Роль иммунных механизмов в поражении почек при геморрагической лихорадке с почечным синдромом
Автор: Иванов М.Ф., Константинов Д.Ю., Балмасова И.П., Улитина А.Ю.
Журнал: Вестник медицинского института "РЕАВИЗ": реабилитация, врач и здоровье @vestnik-reaviz
Рубрика: Клиническая медицина
Статья в выпуске: 3 т.13, 2023 года.
Бесплатный доступ
Исследование посвящено оценке роли иммунных механизмов в развитии острой почечной недостаточности при геморрагической лихорадке с почечным синдромом. Материалом для исследования служила кровь 65 пациентов с геморрагической лихорадкой с почечным синдромом и 17 пациентов с острой почечной недостаточностью токсической природы из группы сопоставления как моделей повреждения почек хантавирусного и неинфекционного генеза и 15 клинически здоровых лиц контрольной группы. Были получены данные, которые позволяют рассматривать в качестве факторов повреждения, в том числе и почечной ткани, цитолитические эффекты натуральных киллеров и активированных NKG2D-зависимым способом цитотоксических Т-лимфоцитов, а в качестве протективных механизмов - значительный рост содержания в крови регуляторных Т-клеток.
Геморрагическая лихорадка с почечным синдромом, острая почечная недостаточность, иммунная система, фенотипы лимфоциты
Короткий адрес: https://sciup.org/143180693
IDR: 143180693 | УДК: 616.61-002.151+613-083 | DOI: 10.20340/vmi-rvz.2023.3.CLIN.11
Текст научной статьи Роль иммунных механизмов в поражении почек при геморрагической лихорадке с почечным синдромом
Геморрагическая лихорадка с почечным синдромом (ГЛПС) – остро протекающая вирусная инфекция природноочагового характера, довольно широко распространённая в мире, в том числе на территории Российской Федерации [1]. ГЛПС проявляется поражением мелких сосудов, кровоточивостью и поражением почек по типу острого интерстициального нефрита с развитием острой почечной недостаточности (ОПН) [2]. В течении этого заболевания выделяют несколько периодов: инкубационный (2–3 недели), лихорадочный (3–7 дней), олигоурический (6–12 дней), полиурический (6–14 дней), период реконвалесценции (ранний – до 2 месяцев и поздний – до 2–3 лет); при этом наиболее тяжёлые признаки поражения почек в виде явлений острой почечной недостаточности наблюдаются в олигоурический период [3].
Вирусы, вызывающие ГЛПС, содержат одноцепочечную РНК и относятся к семейству Hantaviridae , роду Orthohantavirus [3, 4]. Хантавирусы гетерогенны по серологическим и генетическим признакам, по которым среди них дифференцируют более 38 вариантов [5]. Вариант хантавируса определяет тяжесть течения заболевания у человека с колебаниями летальности от 1 до 40 % [6]. Причиной летальности при ГЛПС в большинстве случаев служит инфекционно-токсический шок или острая почечная недостаточность [3, 7]. Наиболее лёгкое течение ГЛПС при минимальной летальности (0,1 %) этиологически обусловлено вирусом Puumala [8], распространённым на территории Приуралья и Среднего Поволжья, где проводилось данное исследование [9], а основным природным резервуаром является европейская рыжая полёвка [10]. Тем не менее, даже в последнем случае полное восстановление функции почек происходит только у больных легкой формой ГЛПС, а у больных среднетяжёлой и тяжёлой формами заболевания на протяжении 1–4 лет сохраняются нарушения, в первую очередь, со стороны почек [11].
Хантавирусы инфицируют, главным образом, эндотелиальные клетки и реплицируются в них, не оказывая при этом цитопатического эффекта. Преимущественно поражается эндотелий капилляров и мелких сосудов [12]. В то же время отмечено, что хантавирусы политропны и, помимо клеток эндотелия, они способны инфицировать моноциты, клетки лёгких, печени, слюнных желез, а также эпителиальные клетки почечных канальцев [3]. В результате в патологический процесс вовлекается тубулоинтерстициальная ткань почек. Более того, анализ результатов биопсии почек больных ГЛПС показал, что у таких пациентов в значительной степени нарушена экспрессия белка ZO-1, определяющего плотные межклеточные контакты, благодаря чему клетки почечных клубочков максимально приближены и «сшиты» друг с другом. В настоящее время нарушение экспрессия белка ZO-1 признается исследователями как основной механизм повреждения почек при ГЛПС [7].
Эти изменения, помимо свойств самого возбудителя, исследователи часто связывают со сдвигами со стороны иммунного статуса [10]. Однако более конкретная роль иммунных механизмов в патогенезе острой почечной недостаточности при ГЛПС полностью не установлена и на уровне их реализации в системе общего кровотока вошла в предмет изучения в данной работе.
Материал и методы исследования
Материалом для исследования служила кровь 65 пациентов с верифицированным диагнозом геморрагической лихорадки с почечным синдромом (ГЛПС), которые на протяжении всего заболевания наблюдались в Инфекционном отделении № 1 Клиник Самарского государственного медицинского университета и составили основную группу исследования. В группу сравнения вошли 17 пациентов с острой почечной недостаточностью токсической природы вследствие отравления суррогатами алкоголя, поступавшие в разное время в отделение по оказанию помощи больным с острыми отравлениями Самарской областной клинической больницы им. В.Д. Середа-вина. Группа клинически здоровых людей состояла из 15 человек. Все вошедшие в исследование были предупреждены об участии в исследовании и подписали информированное добровольное согласие в соответствии с Хельсинской декларацией Всемирной Медицинской Ассоциации.
В группе пациентов с ГЛПС и контрольной группе на долю женщин приходилось 60 %, а в группе сравнения – 80 %. Средний возраст пациентов составлял в основной группе – 41,9 ± 12,5 года, в группе сравнения – 41,4 ± 10,6 года, в контрольной группе – 45,1 ± 6,1 года. На 2–3 неделе болезни у всех пациентов основной группы и группы сопоставления проводилась серологическая диагностика ГЛПС в реакции непрямой иммунофлуоресценции (РНИФ) с парными образцами сыворотки, забор которых осуществлялся с интервалом в 1 неделю. На основе клиниколабораторных данных устанавливались периоды ГЛПС. В олигоурический период у пациентов с ГЛПС в конце первой недели от момента отравления в группе сопоставления и в произвольный период в контрольной группе проводился забор крови, исследование которой осуществлялось автоматизированным методом проточной цитофлуо-риметрии с использованием цитофлуориметра BD FACSCanto II (Becton Dickinson, США) и моноклональных антител (МкАт) BD Biosciences (США) в соответствии с инструкцией по применению прибора и МкАт. Забор венозной крови проводился утром натощак в количестве 5 мл, исследование выполнялось в течение 2-х часов после забора крови.
Для исследования применялся следующий набор антител: (1) стандартизированный комплекта МкАт BD Multitest 6-Color TBNK Reagent (BD Biosciences, США), содержащий меченые PerCP-Cy5.5 anti-CD45 МкАт, меченые FITC anti-CD3 МкАт, меченые PE-Cy7 anti-CD4 МкАт, меченые APC-Cy7 anti-CD8 МкАт, меченые APC anti-CD19 МкАт, меченые PE anti-CD16/anti-CD56 МкАт; (2) меченые РЕ-Су5 anti-CD3 МкАт; (3) меченые РЕ anti-СD25 МкАт; меченые РЕ-Су5 anti-CD56 МкАт; меченые РЕ anti-CD314 МкАт; меченые FITC anti-FoxP3 МкАт; с пермеабилизирую-щими компонентами.
Cтатистическая обработка данных проводилась на основе пакета статистических программ SPSS (версия 23).
Результаты исследования
Результаты фенотипирования лимфоцитов в крови пациентов с ГЛПС, пациентов из группы сравнения и здоровых лиц контрольной группы представлены в таблице 1 и на рисунке 1. Проводился анализ процентного содержания среди лимфоцитов (CD45+) крови клеток следующих фенотипов: (1) CD19+ (В-лимфоциты); (2) CD3+ (Т-лимфоциты); (3) СD3+CD4+ (Т-хелперы); (4) СD3+CD8+ (цитотоксические Т-лимфоциты, ЦТЛ); (5) СD3+CD4+FoxP3+ (регуляторные СD4+ Т-клетки, Трег); (6) СD3+CD8+FoxP3+ (СD8+ Трег); (7) CD3+CD56+ (натуральные киллерные Т-лимфоциты, НКТ); (8) СD16+CD56+ (натуральные киллеры, НК); (9) CD3+CD25+ (Т-лимфоциты, экспрессирующие рецептор активации CD25); (10) CD3+CD8+CD314+ (ЦТЛ, экспрессирующие рецептор активации NKG2D); (11) CD16+CD56+CD314+ (НК, экспрессирующие рецептор активации NKG2D).
Сравнение геморрагической лихорадки с почечным синдромом в лихорадочный период – начале олигоуриче-ского периода и острой почечной недостаточности токсической природы на первой неделе заболевания выявляло определенное число различий, которые касались, прежде всего, лимфоцитов, задействованных в реакциях врожденного иммунитета, регуляторных Т-клеток, цитотоксических Т-лимфоцитов, экспрессирующих активирующий рецептор NKG2D.
Было отмечено достоверное снижение активности Т-лимфоцитов с участием рецептора для ИЛ-2 (CD25), особенно при ОПН токсической природы. В последнем случае это можно объяснить общетоксическим воздействием на лимфоциты при отсутствии антигенного стимула, а при ГЛПС падение числа активированных Т-лимфоцитов происходило, по всей вероятности, в связи с резким возрастанием долей СD4+ (в 2,6 раза) и CD8+ (в 3,6 раза) регуляторных Т-клеток, не наблюдавшимся на достоверном уровне при токсической ОПН.
Еще один характерный для ГЛПС феномен – в 2,7 раза возрастало число цитотоксических Т-лимфоцитов, экспрессирующих лектиновый активирующий рецептор NKG2D (CD3+CD8+СD314+), чего не зарегистрировано при ОПН токсической природы.
Реакция лимфоцитов врожденного иммунитета проявлялась при ОПН вирусного и токсического генеза несколько иначе: число натуральных киллеров в крови при ГЛПС падало, а при токсической ОПН – возрастало. Эти отклонения от контроля не были достоверными, но разная направленность подобных сдвигов оказалась статистически значимой.
Далее содержание в крови всех клеток, характеризующих особенности ГЛПС, анализировалось с позиций дифференциальной значимости путем определения 95 % доверительных интервалов этих показателей и построения ROC-кривых, как это показано на рисунке 2.
Таблица 1. Процентное содержание в крови лимфоцитов разных фенотипов на ранних этапах ГЛПС и ОПН токсической природы в сравнении с контролем
Table 1. The percentage of lymphocytes of different phenotypes in the blood in the early stages of hemorrhagic fever with renal syndrome and acute renal failure of toxic nature in comparison with the control
|
Фенотипические признаки лимфоцитов |
Медиана [минимум; максимум] |
р 1 р 2 р 3 |
||
|
Больные ГЛПС, n = 65 |
Больные с ОПН токсической природы, n = 17 |
Контрольная группа, n = 15 |
||
|
CD19+ |
13,6 [5; 25] |
11,4 [7,6; 15,2] |
10,5 [2,5; 15,7] |
0,060 0,546 0,514 |
|
CD3+ |
67,8 [50; 85,3] |
76 [30; 80] |
75 [62; 87] |
0,055 0,314 0,867 |
|
CD3+CD25+ |
4,1 [1,1; 8,9] |
3 [1,4; 4,1] |
7,5 [2,6; 7,8] |
0,021* 0,017* 0,032* |
|
CD3+CD4+ |
36,3 [19,5; 51,4] |
32,8 [17,5; 52] |
41 [14; 57] |
0,774 0,089 0,437 |
|
CD3+CD8+ |
27 [19,6; 78] |
26,5 [12,5; 50] |
28 [16; 71] |
0,848 0,638 0,956 |
|
CD3+CD8+CD314+ |
34,2 [16,9; 58,9] |
13,5 [5,5; 49,6] |
12,6 [9,6; 27] |
< 0,001* 0,128 0,045* |
|
CD3+CD4+FoxP3+ |
10,7 [5,2; 18,4] |
4,3 [3,2; 5,4] |
3,05 [2,3; 8,1] |
0,009* 0,410 < 0,001* |
|
CD3+CD8+FoxP3+ |
14,8 [3,5; 23,9] |
0,6 [0,2; 4,5] |
0,45 [0,1; 4,4] |
0,013* 0,534 0,001* |
|
CD3+CD56+ |
4,3 [1,7; 30,6] |
4,8 [10; 27] |
3,4 [2,3; 5] |
0,082 0,064 0,093 |
|
СD16+CD56+ |
16,9 [9; 53] |
10 [3,4; 15] |
12,9 [9,5; 27,7] |
0,072* 0,060 0,048* |
|
CD16+CD56+CD314+ |
7,2 [1; 16,3] |
9,7 [4,1; 18] |
9,6 [7,7; 21,6] |
0,084 0,204 0,780 |
Примечание: р 1 – вероятность различий между показателями в группе ГЛПС и в контрольной группе, р 2 – вероятность различий между показателями в группе ОПН токсической природы и в контрольной группе, р 3 – вероятность различий между показателями в группах
ГЛПС и ОПН токсической природы, * – достоверность различий по критерию Манна – Уитни при р < 0,05.
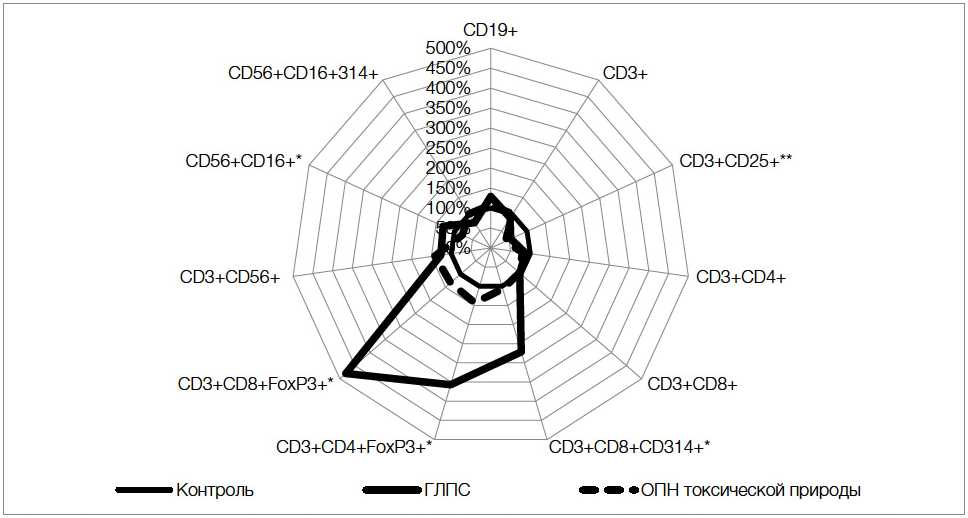
Рисунок 1. Проценты отклонения от контроля лимфоцитов разных фенотипов в крови больных ГЛПС и ОПН токсической природы в начальные периоды заболеваний
Figure 1. Percentages of deviations from the control of lymphocytes of different phenotypes in the blood of patients with hemorrhagic fever with renal syndrome and acute renal failure of toxic nature in the initial periods of diseases
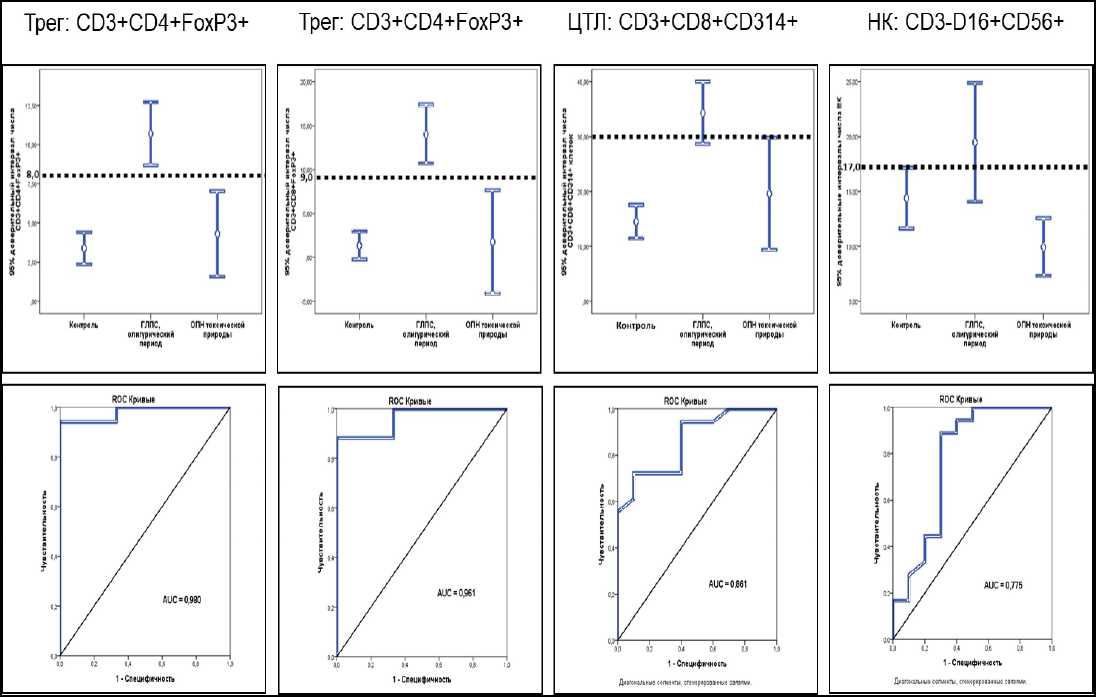
Рисунок 2. 95% доверительные интервалы и ROC-кривые числа лимфоцитов информативных фенотипов в крови пациентов из групп сравнения
Figure 2. 95% confidence intervals and ROC curves of the number of lymphocytes of informative phenotypes in the blood of patients from the comparison groups
Особенно высокой дифференциальной значимостью при ГЛПС в случаях сравнения этих пациентов с пациентами, страдающими ОПН токсической природы, обладало число регуляторных Т-клеток как CD4+, так и CD8+. Процент СD3+CD4+FoxP3+ Трег среди лимфоцитов крови при значениях выше 8 % показывал при ГЛПС почти абсолютную диагностическую значимость (AUC = 0,980). Близкую к этому очень высокую диагностическую значимость (AUC = 0,961) демонстрировал и процент СD3+CD8+FoxP3+ Трег при значениях выше 9 %.
Относительно высокой оказалась дифференциальная значимость числа цитотоксических Т-лимфоцитов, экспрессирующих лектиновый активирующий рецептор NKG2D, в крови. При значениях выше 30 % этот показатель свидетельствовал в пользу ГЛПС в олигоурический период заболевания, в отличие от ОПН токсической природы, при величине AUC = 0,775.
Что касается содержания в крови натуральных киллеров, то относительное число этих клеток выше 17 % с высокой дифференциальной значимостью (AUC = 0,861) подтверждало наличие ГЛПС в олигоурическом периоде заболевания не только по сравнению с ОПН токсической природы, но и по сравнению с контролем.
Обсуждение результатов
Как отмечено в обзоре литературы, механизм поражения почек при ГЛПС имеет, в основном, иммунную природу, но детали этого процесса пока не ясны. В качестве группы сравнения мы использовали пациентов с острой почечной недостаточностью, не ассоциированной с иммунологическими сдвигами, поскольку известно, что интоксикации, связанные с алкоголем, включая метанол и этиленгликоль, имеют метаболическую основу [13]. Например, первым этапом метаболизма этиленгликоля является его превращение в гликолевый альдегид и далее в гликолевую кислоту под действием альдегиддегидрогеназы. Накопление гликолевой кислоты в организме в основном и ответственно за токсичность, при этом хелатирование щавелевой кислоты ионами кальция приводит к образованию нерастворимого оксалата кальция, что может привести к гипокальциемии, нефротоксичности и нейротоксичности [14]. В связи с этим использование данной группы сравнения позволяет выделить иммунные механизмы ОПН, специфичные именно для ГЛПС и прямо не связанные с реакцией почек на деструктивные процессы как таковые.
Что касается роли иммунных механизмов в повреждении почек, то в отсутствии цитопатического эффекта хантавирусов основной механизм элиминации инфицированных клеток связан как с описанным при ГЛПС цитотоксическим воздействием на них таких лимфоцитов врожденного иммунитета как натуральные киллеры [15], так и адаптивного иммунного ответа – цитотоксических Т-лимфоцитов [16].
Обе эти клеточные субпопуляции возрастали при ГЛПС и достоверно отличались по содержанию в крови от случаев ОПН токсической природы. Однако рост доли ЦТЛ среди лимфоцитов крови отмечался только для определённой их категории, экспрессирующей особый активирующий рецептор лектиновой природы – NKG2D (CD134). В наших предыдущих публикациях было показано, что, с одной стороны, NKG2D+ ЦТЛ способствуют раннему формированию CD8+ Т-лимфоцитов памяти, что препятствует развитию хронических форм заболевания [17], а с другой стороны, чем выше было содержание этих клеток среди лимфоцитов крови, тем значительней был риск развития тяжёлого течения ГЛПС [18].
Полученные результаты показали, что патогенетическое значение этих клеток при ГЛПС имело механизм контроля, который тоже был установлен в процессе исследований – это высокое содержание регуляторных Т-клеток как CD4+, так и CD8+ фенотипа. Дело в том, что в литературе (безотносительно к ГЛПС) описана протективная роль Трег при клеточном повреждении и развитии фиброзных изменений в почках [19]. При ГЛПС подобный подход к оценке значения изменений со стороны регуляторных Т-клеток уже на ранних этапах заболевания отмечен нами впервые.
Заключение
Анализ иммунных механизмов на ранних этапах ГЛПС с позиций их значения в повреждении почек с развитием острой почечной недостаточности позволил выявить их уникальную патогенетическую роль. Инфицирование хантавирусами клеток эндотелия (в том числе сосудов почек) и эпителиальных клеток почечных канальцев вызывало цитотоксические реакции их повреждения, которое проявлялось ростом содержания в крови натуральных киллеров и цитотоксических Т-лимфоцитов. Этот повреждающий эффект сопровождался активацией ЦТЛ с участием NKG2D-рецептора, индуцирующего образование CD8+ Т-клеток памяти, способствующего выходу из инфекционного процесса. Подобный защитный механизм поддерживался также довольно значительным ростом CD4+ и CD8+ регуляторных Т-клеток, что нетипично для первой недели заболевания, но может трактоваться с позиций их протек-тивного действия, ограничивающего повреждение почек.
Список литературы Роль иммунных механизмов в поражении почек при геморрагической лихорадке с почечным синдромом
- Tkachenko E.A., Ishmukhametov A.A., Dzagurova T.K., Bernshtein A.D., Morozov V.G., Siniugina A.A. et al. Hemorrhagic fever with renal syndrome, Russia. Emerg Infect Dis. 2019;25(12):2325-2328. https://doi.org/10.3201/eid2512.181649
- Митрофанова Н.Н., Мельников В.Л., Золина Н.Ф., Скороходова Е.Д. Анализ клинико-эпидемиологических и эпизоотических особенностей заболеваемости геморрагической лихорадкой с почечным синдромом на территории Пензенской области. Известия высших учебных заведений. Поволжский регион. Медицинские науки. 2009;3(11):109-116. [Mitrofanova N.N., Mel'nikov V.L., Zolina N.F., Skorokhodova E.D. Analysis of clinical, epidemiological and epizootic features of the incidence of hemorrhagic fever with renal syndrome in the territory of the Penza region. News of higher educational institutions. Volga region. Medical Sciences. 2009;3(11): 109-116. (in Russ)].
- Yashina L.N., Hay J., Smetannikova N.A., Kushnareva T.V., Iunikhina O.V., Kompanets G.G. Hemorrhagic fever with renal syndrome in Vladivostok city, Russia. Front Public Health. 2021 ;9:620279.
- Валишин Д.А., Шестакова И.В., Мурзабаева Р.Т., Иванис В.А., Суздальцев А.А., Фазылов В.Х. Геморрагическая лихорадка с почечным синдромом у взрослых. Клинические рекомендации. Некоммерческое партнерство «Национальное научное общество инфекционистов». 2016:49. [Valishin D.A., Shestakova I.V., Murzabaeva R.T., Ivanis V.A., Suzdaltsev A.A., Fazylov V.Kh. Hemorrhagic fever with renal syndrome in adults. Clinical recommendations. Non-commercial partnership "National Scientific Society of Infectious Diseases". 2016:49. (in Russ)].
- Guterres A., de Oliveira C.R., Fernandes J., de Lemos R.S.E. The mystery of the phylogeographic structural pattern in rodent-borne hantaviruses. Mol Phylogenet Evol. 2019;136:35-43.
- Noack D., Goeijenbier M., Reusken C.B.E.M. et al. Orthohantavirus pathogenesis and cell tropism. Front Cell Infect Microbiol. 2020;10:399.
- Krüger D.H., Figueiredo L.T., Song J.W., Klempa B. Hantaviruses - globally emerging pathogens. J Clin Virol. 2015;64:128-136.
- Klingström J., Ahlm C. Hantavirus protein interactions regulate cellular functions and signaling responses. Expert Rev Anti Infect Ther. 2011 ;9(1):33-47.
- Hjertqvist M., Klein S.L., Ahlm C. et al. Mortality rate patterns for hemorrhagic fever with renal syndrome caused by Puumala virus. Emerg Infect Dis. 2010;16(10):1584-1586.
- Митрофанова Н.Н., Мельников В.Л., Золина Н.Ф., Скороходова Е.Д. Анализ клинико-эпидемиологических и эпизоотических особенностей заболеваемости геморрагической лихорадкой с почечным синдромом на территории Пензенской области. Известия высших учебных заведений. Поволжский регион. Медицинские науки. 2009;3(11):109-116. [Mitrofanova N.N., Melnikov V.L., Zolina N.F., Skorokhodova E.D. Analysis of clinical, epidemiological and epizootic features of the incidence of hemorrhagic fever with renal syndrome in the Penza region. News of higher educational institutions. Volga region. Medical sciences. 2009;3(11):109-116. (in Russ)].
- Алехин Е.К., Камилов Ф.Х., Хунафина Д.Х., Валишин Д.А., Шайхуллина Л.Р., Мурзабаева Р.Т. и др. Геморрагическая лихорадка с почечным синдромом. Медицинский вестник Башкортостана. 2013;5:24-31. [Alekhine E.K., Kamilov F.H., Hunafina D.H., Valishin D.A., Shaikhullina L.R., Murzabaeva R.T., etc. Hemorrhagic fever with renal syndrome. Medical Bulletin of Bashkortostan. 2013;5:24-31. (in Russ)].
- Latus J., Schwab M., Tacconelli E., Pieper F.M., Wegener D., Dippon J. et al. Clinical course and long-term outcome of hantavirus-associated nephropathia epidemica, Germany. Emerg Infect Dis. 2015;21(1):76-83.
- Jiang H., Wang L.M., Wang P.Z., Bai X.F. Hemorrhagic fever with renal syndrome: pathogenesis and clinical picture. Front Cell Infect Microbiol. 2016;6:1-14.
- Kraut J.A., Kurtz I. Toxic alcohol ingestions: clinical features, diagnosis, and management. Clin J Am Soc Nephrol. 2008;3(1):208-225.
- Ukita K., Otomune K., Fujimoto R., Hasegawa K., Izumikawa K., Morimoto N. et al. Anion gap-opening metabolic acidosis and urinary findings in the early diagnosis of ethylene glycol poisoning: A case report. Clin Case Rep. 2022;10(1):e05215.
- Bjorkstrom N.K., Lindgren T., Stoltz M. et al. Rapid expansion and long term persistence of elevated NK cell numbers in humans infected with hantavirus. J Exp Med. 2011 ;208(1):13-21.
- Rouse B.T., Sehrawat S. Immunity and immunopathology to viruses: what decides the outcome? Nat Rev Immunol. 2010;10(7):514-526.
- Иванов М.Ф., Балмасова И.П., Жестков А.В., Константинов Д.Ю., Малова Е.С. Экспрессия NKG2D цитотоксическими Т-лимфоци-тами как возможный механизм иммунопатогенеза геморрагической лихорадки с почечным синдромом. Иммунология. 2023;44(1):93-102. [18 Ivanov M.F., Balmasova I.P., Zhestkov A.V., Konstantinov D.Yu., Maslova E.S. NKG2D expression by cytotoxic T-lymphocytes as a possible mechanism of immunopathogenesis of hemorrhagic fever with renal syndrome. Immunology. 2023;44(1):93-102. (in Russ)].
- Иванов М.Ф., Балмасова И.П., Жестков А.В., Константинов Д.Ю., Малова Е.С. Прогностическое значение фенотипических изменений лимфоцитов при геморрагической лихорадке с почечным синдромом. Иммунология. 2023;44(2):181-190. [19 Ivanov M.F., Balmasova I.P., Zhestkov A.V., Konstantinov D.Yu., Maslova E.S. Prognostic value of phenotypic changes of lymphocytes in hemorrhagic fever with renal syndrome. Immunology. 2023;44(2):181-190. (in Russ)].
- Do Valle Duraes F., Lafont A., Beibel M., Martin K., Darribat K., Cuttat R. et al. Immune cell landscaping reveals a protective role for regulatory T cells during kidney injury and fibrosis. JCI Insight. 2020;5(3):e130651.


