Роль изменений жирно-кислотного состава клеток в процессе повышения морозоустойчивости суспензионной культуры озимой пшеницы
Автор: Любушкина И.В., Кириченко К.А., Грабельных О.И., Побежимова Т.П., Федяева А.В., Степанов А.В., Войников В.К.
Журнал: Журнал стресс-физиологии и биохимии @jspb
Статья в выпуске: 4 т.9, 2013 года.
Бесплатный доступ
Изучено влияние низких положительных температур (4 и 8 °С) на морозоустойчивость и жирнокислотный состав клеток суспензионной культуры озимой пшеницы. Выявлено, что обработка культуры температурой 4 °С (7 суток) не защищала клетки от последующего действия отрицательной температуры (-8 °С, 6 ч) и не сопровождалась значимыми изменениями жирнокислотного состава клеток. Напротив, обработка культуры температурой 8 °С (7 суток) предотвращала гибель, вызываемую отрицательной температурой, при этом снижалось содержание насыщенных жирных кислот: пентадециловой (на 35,0%), пальмитиновой (на 19,9%) и стеариновой (на 65,4%) и увеличивалось содержание α-линоленовой кислоты (на 94%), что обусловливало повышение индекса двойной связи на 16%. Обсуждается роль изменений жирнокислотного состава клеток в процессе повышения морозоустойчивости растений.
Короткий адрес: https://sciup.org/14323803
IDR: 14323803
Текст научной статьи Роль изменений жирно-кислотного состава клеток в процессе повышения морозоустойчивости суспензионной культуры озимой пшеницы
Устойчивость растений к холодовому воздействию в большой степени определяется их способностью восстанавливать исходную структуру мембран, которые являются наиболее чувствительными компонентами клеток. Важнейшую роль в этом процессе играют изменения в составе липидов (Верещагин, 2007; Трунова, 2007; Heidarvand and Maali-Amiri, 2010). При адаптации к низким температурам в мембранах увеличивается содержание фосфатидилхолинов, участвующих в образовании ламеллярной структуры (Uoshida and Sakai, 1973; Иошида, 1983), снижается доля цереброзидов (Uemura et al., 2006; Heidarvand and Maali-Amiri, 2010) и повышается соотношение полярных липидов к белкам, позволяющее поддерживать функциональную активность белков-ферментов, рецепторов и переносчиков (Новицкая и др., 2000).Снижение температуры окружающей среды способствует повышению вязкости мембран, что приводит к их переходу из жидкокристаллического состояния в гель и нарушению избирательной проницаемости, поэтому во время адаптации растений к холоду и морозу в первую очередь формируются защитные механизмы, предотвращающие эти изменения и направленные на увеличение текучести мембран (Новицкая, 2000; Герасименко и др., 2010). Так, в плазмалемме, считающейся наиболее чувствительной к пониженным температурам, возрастает количественное соотношение фосфолипидов и стеринов (Трунова, 2007), а удлинение углеродных цепей жирных кислот и их изомеризация (увеличение доли ненасыщенных жирных кислот в цисконфигурации) наблюдаются не только в плазматической мембране, но и в других мембранных системах клетки (Heidarvand and Maali-Amiri, 2010). Все эти модификации направлены на снижение температуры фазовых переходов клеточных мембран, что способствует поддержанию их функциональной активности.
Наиболее важным механизмом низкотемпературной адаптации является повышение содержания ненасыщенных жирных кислот в составе мембранных липидов (Сущик и др., 2003; Верещагин, 2007), при этом существенное влияние на жидкостные свойства мембран оказывает первая двойная связь в ∆9-положении жирной кислоты (Трунова, 2007). В составе плазматической мембраны увеличивается, в основном, ненасыщенность двух классов фосфолипидов: фосфатидилхолина и фосфатидилэтаноламина (Heidarvand and Maali-Amiri, 2010). Повышение степени ненасыщенности осуществляется двумя путями: за счет синтеза ненасыщенных жирных кислот de novo (Vereshagin et al., 1990) и десатурации уже существующих в клетке насыщенных жирных кислот (Sayanova et al., 1999; Сущик и др., 2003).
Изучение формирования механизмов низкотемпературного закаливания, в том числе и жирнокислотного состава клеток, обычно проводится на интактных растениях, однако значительный интерес представляет исследование подобных изменений на модельной системе, каковой является, например, суспензионная культура клеток. В отличие от целого растения, образованного широким спектром тканей и, соответственно, имеющего большую вариабельность реакций клеток, суспензионная культура представляет собой однородную систему и характеризуется более синхронной и выраженной реакцией на действие внешних факторов. С другой стороны, физиологические и биохимические изменения, происходящие в гетеротрофной культуре клеток, могут значительно отличаться от изменений, наблюдающихся в клетках растительного организма. В связи с этим в данной работе были изучены изменения жирнокислотного состава клеток при действии двух низких положительных температур, различающихся по их влиянию на морозоустойчивость суспензионной культуры озимой пшеницы.
МАТЕРИАЛЫ И МЕТОДЫ
Объект исследования
В работе использовали суспензионную культуру клеток озимой пшеницы Triticum aestivum (L.), полученную из зрелых зародышей. Культура выращивалась при 26 °С на МС-среде (Murashige and Scoog, 1962), содержащей сахарозу (3%), тиамин (1,0 мг/л), пиридоксин (0,5 мг/л), никотиновую кислоту (0,5 мг/л), 2,4-Д (2,5 мг/л), инозитол (0,01 %) и дитиокарбамат натрия (0,0005 %). Культуру пересевали каждые 14 дней с разведением свежей средой в 6 раз. Культуру подвергали длительному холодовому воздействию при 4 °С или 8 °С в течение 7 суток, затем переносили для восстановления в контрольные условия (26 °С) на 3, 6 и 10 суток или подвергали более жесткому холодовому воздействию: -8 °С в течение 6 ч (холодовой шок, ХШ), по окончании действия которого культуру также помещали в контрольные условия на 3, 6 или 10 суток.
Определение выживаемости клеток
Выживаемость клеток суспензионной культуры озимой пшеницы определяли с помощью летального красителя Эванса голубого (0,25% водный раствор) по модифицированной методике C.J. Baker и N.M. Mock (1994) сразу и через 3, 6 или 10 суток после воздействия. Окрашивание проводили в течение 15 мин, после чего клетки отмывали 10 раз деионизированной водой для удаления излишков красителя. Количество окрашенных клеток и клеток с конденсированным протопластом подсчитывалось в 5 полях, содержащих, по меньшей мере, 50 клеток в 3-х повторностях, с использованием светового микроскопа Axiostar plus («CarlZeiss», Германия).
Экстракция и метилирование жирных кислот
Навеску растительного материала 1 г фиксировали жидким азотом и растирали в фарфоровой ступке с добавлением кварцевого песка до получения гомогенной массы. Липиды экстрагировали смесью хлороформ:метанол (2:1) (Bligh and Dyer, 1959). Для предотвращения окисления липидов при экстракции в систему растворителей добавляли 0,001% ионол (2,6-ди-трет-бутил-4-метилфенол). Хлороформ из липидного экстракта удаляли под вакуумом с помощью роторного испарителя ИР-1ЛТ («Labtex», Россия). До стадии переэтерификации липидов их хлороформные экстракты хранили при -20 °С с добавлением ионола до концентрации 0,05% (Кейтс, 1975).
Для получения метиловых эфиров жирных кислот к экстракту суммарных липидов после удаления растворителя добавляли 5% метанольный раствор Н 2 SO 4 и нагревали на водяной бане при 55-60°С в течение 30 минут. Метиловые эфиры жирных кислот после охлаждения трижды экстрагировались гексаном (Christie, 1993). Дополнительную очистку метиловых эфиров жирных кислот проводили методом ТСХ на алюминиевых пластинках с силикагелем Sorbfil ПТСХ-АФ-В (Россия) в камере с бензолом.
Анализ метиловых эфиров жирных кислот проводили методом газожидкостной хроматографии с использованием хромато-масс-спектрометра 5973N/6890N MSD/DS («AgilentTechnologies», США). Детектор – масс-спектрометра – квадруполь, способ ионизации электронный удар (EI), энергия ионизации 70 эВ, для анализа использовали режим регистрации полного ионного тока. Для разделения использовали капиллярную колонку HP-INNOWAX, (30м × 250 мкм × 0,50 мкм). Неподвижная фаза – полиэтиленгликоль. Подвижная фаза: гелий, скорость потока газа 1
мл/мин. Температура испарителя 250 °С, источника ионов 230 °С, детектора 150 °С, температура линии, соединяющей хроматограф с масс-спектрометром, 280 °С. Диапазон сканирования 41-450 а.е.м. Объем вводимой пробы – 1 мкл, разделение потоков 5:1. Хроматографирование выполняли в изократическом режиме при 200 °С.
Идентификацию метиловых эфиров жирных кислот проводили с помощью расчета эквивалентной длины алифатической цепи (ECL). Кроме этого использовали библиотеки масс-спектров NIST 05, Christie, а также сравнение времени удерживания со временами удерживания стандартных соединений. Относительное содержание жирных кислот определяли в весовых процентах от общего их содержания в исследуемом образце. Для оценки степени ненасыщенности жирных кислот рассчитывали индекс двойной связи (ИДС) по формуле, предложенной Lyons с соавт. (Lyons et al ., 1964):
ИДС = Σ P j n /100,где P j – содержание жирных кислот (вес, %) и n – количество двойных связей в каждой кислоте.
Статистическая обработка данных
Данные обработаны статистически. Приведены средние арифметические и стандартные отклонения. Поскольку в ряде случаев не было возможно определить тип распределения, доказать его близость к нормальному, а некоторые из оцениваемых параметров выражались в виде долей, поэтому для оценки статистической достоверности отличий использовали непараметрический Т-критерий Манна-Уитни (Гланц, 1998).
РЕЗУЛЬТАТЫ
Влияние предварительной обработки низкими положительными температурами на морозостойкость клеток суспензионной культуры озимой пшеницы
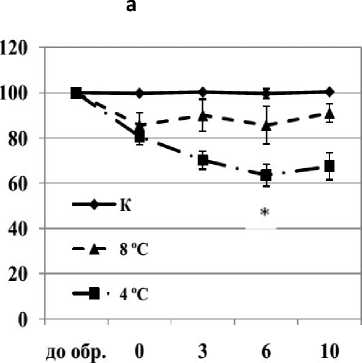
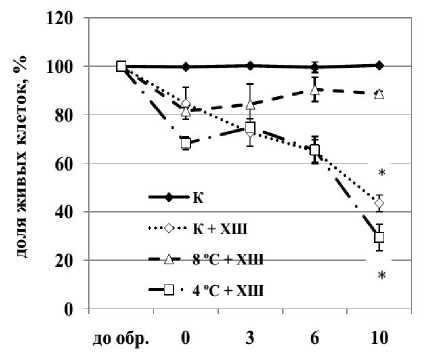
В работе было показано, что обработка суспензионной культуры озимой пшеницы температурой 4 °С не предотвращала гибель клеток, вызываемую действием отрицательной температуры (-8 °С, 6 ч) (рис. 1 а, б ). Так, ХШ вызывал гибель 60% клеток в контрольной культуре на протяжение 10 суток после действия (рис. 1 б ). Во время обработки культуры низкой положительной температурой 4 °С погибало около 20% клеток, а после перемещения ее в контрольные условия - еще 20% (рис. 1 а ), при этом последующий ХШ усиливал гибель клеток, и в течение 10 суток после обработки погибало до 70% клеток культуры (рис. 1 б ). Дальнейшие эксперименты выявили, что гибель клеток, вызванная отрицательной температурой, предотвращалась с помощью предварительной обработки температурой 8 °С (рис. 1 б ). Во время экспонирования культуры при данной температуре погибало около 15% клеток, но после перемещения ее в контрольные условия дальнейшей гибели клеток не происходило (рис. 1 а ). Это свидетельствует об эффективности закаливания культуры при температуре 8 °С и повышении морозостойкости клеток.
Изменение жирнокислотного состава клеток суспензионной культуры озимой пшеницы, подвергнутых длительному воздействию низких положительных температур
Наиболее чувствительными к действию пониженных температур являются липидные компоненты мембран, которые в первую очередь претерпевают изменения при низкотемпературной адаптации. В связи с этим были изучены изменения жирнокислотного состава общих липидов в клетках суспензионной культуры озимой пшеницы при длительном действии низких положительных температур 4 и 8 °С.
Исследования показали, что жирные кислоты, входящие в состав общих липидов клеток суспензионной культуры озимой пшеницы, содержали от 14 до 22 углеродных атомов. Насыщенные жирные кислоты были представлены, главным образом, пальмитиновой (16:0) и стеариновой (18:0) кислотами. Содержание миристиновой (14:0), пентадециловой (15:0), маргариновой (17:0), арахиновой (20:0) и бегеновой (22:0) кислот было, напротив, незначительным (≤ 1%), причем миристиновая кислота была обнаружена лишь в клетках контрольной культуры (таблица). Из ненасыщенных жирных кислот в состав общих липидов суспензионной культуры озимой пшеницы входили С 16 и С 18 кислоты. Доминирующими являлись линолевая (18:2∆9,12) и линоленовая (18:3∆9,12,15) кислоты, содержание остальных - пальмитоолеиновой (16:1∆9), олеиновой (18:1∆9) и цис -вакценовой (18:1∆7) -не превышало 2% (табл. 1). Следует обратить внимание на то, что даже в контрольной культуре доля ненасыщенных жирных кислот была значительной и почти в два раза превышала долю насыщенных жирных кислот -63,2 по сравнению с 36,8%, соответственно (таблица).
Обработка суспензионной культуры низкими положительными температурами вызывала изменения не только в содержании отдельных жирных кислот, но и в их составе. Как было указано выше, низкие положительные температуры приводили к исчезновению миристиновой кислоты в клетках культуры, обработанной как при 8 °С, так и при 4 °С, однако остальные различия в содержании кислот были достоверными только в отношении культуры, обработанной температурой 8 °С.
Так, закаливание при 8 °С приводило к снижению содержания насыщенных жирных кислот: пентадециловой - на 35,0%, пальмитиновой - на 19,9%, стеариновой - на 65,4% (таблица). Из ненасыщенных жирных кислот достоверные изменения наблюдали только для линоленовой кислоты: ее содержание увеличивалось на 94%, т.е. практически в два раза по сравнению с контролем (таблица).
Поскольку в результате закаливания при температуре 8 °С происходило снижение содержания насыщенных жирных кислот и увеличение содержания ненасыщенных, то эти изменения отразились на таких показателях жирнокислотного состава, как индекс двойной связи (ИДС) и отношение содержания ненасыщенных жирных кислот к насыщенным (ΣUSFA/ΣSFA) (таблица). Увеличение ИДС при данной температуре закаливания составило 16%, а показателя ΣUSFA/ΣSFA- 35%. Следует отметить, что изменение данных параметров было обусловлено, главным образом, увеличением содержания ненасыщенных жирных кислот С18 ряда: суммарное содержание этих кислот увеличилось после обработки культуры температурой 4 °С на 11% по сравнению с контролем, а отношение ΣU-C18/ΣS-C18 – больше, чем в 2 раза (таблица).
Таблица 1. Влияние температуры закаливания на изменения жирнокислотного состава в клетках суспензионной культуры озимой пшеницы
|
К, вес. % |
8°С, вес. % |
4°С, вес. % |
|
|
С14:0 (миристиновая) |
0,25 ± 0,44 |
- |
- |
|
С15:0 (пентадециловая) |
0,80 ± 0,22 |
0,52 ± 0,07* |
0,66 ± 0,16 |
|
С16:0 (пальмитиновая) |
29,20 ± 2,00 |
23,38 ± 0,65* |
27,17 ±1,84 |
|
С16:1∆9 (пальмитоолеиновая) |
0,48 ± 0,75 |
0,65 ± 0,47 |
1,65 ± 0,41 |
|
С17:0 (маргариновая) |
0,18 ± 0,15 |
0,13 ± 0,09 |
0,26 ±0,07 |
|
С18:0 (стеариновая) |
5,67 ± 1,65 |
1,96 ± 0,68* |
3,21 ± 0,96 |
|
C18:1∆9 (олеиновая) |
1,62 ± 1,12 |
1,22 ± 0,12 |
2,12 ± 0,83 |
|
C18:1∆7 ( цис -вакценовая) |
0,99 ± 0,39 |
1,60 ± 0,39 |
1,06 ± 0,22 |
|
C18:2∆9, 12 (линолевая) |
52,73 ± 3,26 |
52,48 ±1,22 |
53,77 ± 2,24 |
|
C18:3∆9, 12, 15 (линоленовая) |
7,41 ± 1,02 |
14,38 ± 1,53* |
9,72 ± 1,92 |
|
C20:0 (арахиновая) |
0,72 ±0,37 |
0,53 ± 0,04 |
0,55 ± 0,22 |
|
C22:0 (бегеновая) |
1,03 ± 0,46 |
0,83 ± 0,10 |
0,76 ± 0,17 |
|
ИДС |
1,31 ± 0,09 |
1,52 ± 0,04* |
1,41 ± 0,08 |
|
Σ SFA |
36,77 ±4,86 |
29,69 ± 1,60* |
32,51 ± 3,02 |
|
Σ USFA |
63,24 ± 4,86 |
70,32 ± 1,60* |
67,51 ± 3,01 |
|
Σ USFA / Σ SFA |
1,76 ± 0,34 |
2,38 ± 0,19* |
2,09 ± 0,29 |
|
Σ U-C18 |
62,76 ± 4,36 |
69,68 ± 1,65* |
66,68 ± 2,72 |
|
Σ U-C18 / Σ S-C18 |
17,15 ± 9,04 |
38,84 ± 7,04* |
22,84 ± 8,48 |
Обозначения: К - контрольная культура клеток, выращенная при температуре 26 °С; 8 °С - культура клеток, обработанная при 8 °С в течение 7 суток; 4 °С - культура клеток, обработанная при 4 °С в течение 7 суток; ИДС - индекс двойной связи; Σ SFA - сумма насыщенных жирных кислот; Σ USFA - сумма ненасыщенных жирных кислот; Σ USFA /Σ SFA - отношение суммы ненасыщенных жирных кислот к сумме насыщенных жирных кислот; Σ U-C18 -сумма ненасыщенных жирных кислот с длиной цепи 18 атомов углерода;
Σ U-C18 / Σ S-C18 - отношение суммы ненасыщенных жирных кислот с длиной цепи 18 атомов углерода к насыщенным жирным кислотам с такой же длиной цепи. n = 4-6. M±S.D. * - различия достоверны при уровне значимости p≤0,05.
время после воздействия, сут.
время после воздействия, сут.
Рисунок 1. Влияние низких положительных и отрицательной температур на жизнеспособность клеток суспензионной культуры озимой пшеницы.
Обозначения: К - контрольная культура клеток, выращенная при температуре 26 °С; 8 °С -культура клеток, обработанная температурой 8 °С в течение 7 суток; 4 °С - культура клеток, обработанная температурой 4 °С в течение 7 суток, ХШ – холодовой шок, -8°С, 6 ч. M±S.D. n=3-10. * - различия достоверны при уровне значимости p≤0,05.
ОБСУЖДЕНИЕ
Теоретической базой закаливания является гипотеза зонового влияния температуры на терморезистентность растений, согласно которой действие температур из зоны холодового закаливания повышает холодоустойчивость растений. Эффект закаливания возрастает по мере отклонения температур от границ фоновой зоны почти до начала зоны повреждения (Дроздов и др., 1977). Границы данных температурных зон определены для растений с разной чувствительностью к изменениям температуры окружающей среды, на основании чего закаливание интактных растений осуществляют у морозостойких видов при околонулевых температурах, у холодостойких - при температурах от 3 до 5 °С, а у теплолюбивых - выше 5 °С (Трунова, 2007).
В данной работе проводилось закаливание суспензионной культуры, клетки которой находятся в условиях, отличных от таковых в интактном организме, и подвергаются in vitro различным химическим и физическим воздействиям. Эти воздействия и условия часто превышают пределы нормы реакции исходного генотипа (Кунах, 1999). Вероятно, этим объясняется тот факт, что температура 4 °С, обычно использующаяся для закаливания проростков озимой пшеницы и повышающая их устойчивость к действию отрицательной температуры, оказалась не эффективной для закаливания суспензионной культуры, и вызывала гибель клеток (рис. 1а, б).
В основе низкотемпературного закаливания лежит адаптация растений, сопровождающаяся возникновением специфических структурных и функциональных перестроек (Туманов, 1979; Дорофеев и др., 2004; Трунова, 2007). В этом процессе принимают участие белок-синтезирующая и гормональная системы (Лукаткин, 2002), а также важную роль играет синтез низкомолекулярных и ферментативных антиоксидантов (Wang, 1995).
Наиболее чувствительными к действию пониженных температур являются липидные компоненты мембран, которые в первую очередь претерпевают изменения при низкотемпературной адаптации (Трунова, 2007; Iba, 2002; Yu et al ., 2009). При этом липиды, содержащие α-линоленовую кислоту, играют решающую роль в развитии криоадаптации растений (Murakami et al ., 2000; Верещагин, 2007). Увеличение относительного содержания данной кислоты в составе общих липидов происходило только при обработке суспензионной культуры клеток озимой пшеницы температурой 8 °С, в то время как обработка культуры температурой 4 °С не вызывала таких изменений (таблица). Эти результаты согласуются с данными, полученными А.Г. Верещагиным с соавт., которые показали, что рост уровня линолената всегда сопровождал закаливание и отсутствовал при инкубации ткани на холоду без достижения морозостойкости (цит. по Верещагину, 2007).
Кроме того, в ходе экспериментов было установлено, что повышение ИДС осуществляется не только за счет увеличения содержания линоленовой кислоты, но и за счет понижения относительного содержания насыщенных жирных кислот, таких как пентадециловая, пальмитиновая и, в особенности, стеариновая (таблица). Можно предположить, что основным способом повышения степени ненасыщенности липидов в клетках суспензионной культуры озимой пшеницы является не их синтез de novo , а десатурация уже существующих в клетке насыщенных жирных кислот (Shanklin and Cahoon, 1998; Sayanova et al ., 1999; Yu et al .,
2009; Shi et al ., 2011). Таким образом, изменения жирнокислотного состава клеток суспензионной культуры озимой пшеницы, соответствующие структурным и функциональным перестройкам, происходящим в процессе низкотемпературного закаливания, имели место только при обработке культуры температурой 8 °С, что указывает на данную температуру как на закаливающую для изучаемой суспензионной культуры клеток озимой пшеницы. На основании полученных результатов можно сделать вывод, что закаливание суспензионной культуры озимой пшеницы происходит при температуре более высокой, чем закаливание интактных растений, что может быть связано со спецификой метаболизма клеток в условиях гетеротрофного выращивания.
Работа выполнена при поддержке Министерства образования и науки Российской Федерации, соглашение 8266.
Список литературы Роль изменений жирно-кислотного состава клеток в процессе повышения морозоустойчивости суспензионной культуры озимой пшеницы
- Верещагин, А.Г. (2007) Липиды в жизни растений. М.: Наука, 78 с
- Герасименко, Н.И.,Бусарова, Н.Г., Моисеенко, О.П. (2010) Сезонные изменения в содержании липидов, жирных кислот и пигментов бурой водоросли Costaria costata. Физиология растений,57, 217-223
- Гланц, С. (1998) Медико-биологическая статистика. М.: Практика, 459 c
- Дорофеев, Н.В., Пешкова, А.А., Войников, В.К. (2003) Озимая пшеница в Иркутской области. Иркутск: Арт-Пресс, 175 с
- Дроздов, С.Н., Сычева, З.Ф., Будыкина, Н.П., Курец, В.К. (1977) Эколого-физиологические аспекты устойчивости растений к заморозкам. Л.: Наука, 228 с
- Иошида, С. (1983) Распад фосфолипидов при замерзании растительных клеток. Холодостойкость растений. М.: Колос, 97-111
- Кейтс, М. (1975) Техника липидологии. Выделение, анализ и идентификация липидов. М.: Мир, 233 с
- Кунах, В.А. (1999) Изменчивость растительного генома в процессе дифференцировки и каллусообразования in vitro. Физиология растений, 46, 919-930
- Лукаткин, А.С. (2002) Холодовое повреждение теплолюбивых растений и окислительный стресс. Саранск: Изд-во Мордовского университета, 208 с
- Новицкая, Г.В., Суворова, Т.А., Трунова, Т.И. (2000) Липидный состав листьев в связи с холодостойкостью растений томатов. Физиология растений, 47, 829-835
- Сущик, Н.Н., Калачева, Г.С., Жила, Н.О., Гладышев, М.И., Волова, Т.Г. (2003) Влияние температуры на состав внутри-и внеклеточных жирных кислот зеленых водорослей и цианобактерий. Физиология растений, 50, 420-427
- Трунова, Т.И. (2007) Растение и низкотемпературный стресс. М.: Наука, 54 с
- Туманов, И.И., Красавцев, О.А. (1959) Закаливание северных древесных растений отрицательными температурами. Физиология растений, 6, 654-667
- Baker, C.J., Mock, N.M. (1994) An improved method for monitoring cell death in cell suspension and leaf disk assay using evans blue. Plant Cell, Tissue and Organ Culture, 39, 7-12
- Bligh, E.G., Dyer, W.J. (1959) A rapid method of total lipid extraction and purification. Canad. J. Biochem. Physiol., 37, 911-919
- Christie, W.W. (1993) Preparation of ester derivatives of fatty acids for chromatographic analysis. Advances in lipid methodology. Oily Press, 69-111
- Guy, C. (1999) Molecular responses of plants to cold shock and cold acclimation. J. Mol. Microbiol. Biotechnol., 1, 231-242
- Heidarvand, L., Maali-Amiri, R. (2010) What happens in plant molecular responses to cold stress? Acta Physiol. Plant., 32, 419-431
- Iba, K. (2002) Acclimative response to temperature stress in higher plants: approaches of gene engineering to temperature tolerance. Annu. Rev. Plant Biol., 53, 225-245
- Lyons, J.M., Wheaton, T.A., Pratt, H.K. (1964) Relationship between the physical nature of mitochondrial membranes and chilling sensitivity in plant. Plant Physiol., 39, 262-268
- Murakami, Y., Tsuyama, M., Kobayashi, Y., Kodama, H., Iba, K. (2000) Trienoic fatty acids and plant tolerance of high temperature. Science, 287, 476-479
- Murashige, T.,Scoog, F. (1962) A revised medium for rapid growth and bioassays with tobacco tissue cultures. Physiol. Plant., 15, 473-497
- Sayanova, O., Davies, G.M., Smith, M.A., Griffiths, G., Stobart, A.K., Shewry, P.R., Napier, J.A. (1999) Accumulation of ∆6-unsaturated fatty acids in transgenic tobacco plants expressing a ∆6-desaturase from Borago officinalis. J. Exp. Bot., 50, 1647-1652
- Shanklin, J., Cahoon, E.B. (1998) Desaturation and related modification of fatty acids. Annu. Rev. Plant Physiol. Plant Mol. Biol., 49, 611-641
- Shi, Y., An, L., Li, X., Huang, C., Chen, G. (2011) The octadecanoid signaling pathway participates in the chilling-induced transcription of ω-3 fatty acid desaturases in Arabidopsis. Plant Physiol. Biochem., 49, 208-215
- Uemura, M., Tominaga, Y., Nakagawara, C., Shigematsu, S., Minami, A., Kawamura, Y. (2006) Responses of the plasma membrane to low temperatures. Physiol. Plant., 126, 81-89
- Uoshida, S., Sakai, A. (1973) Phospholipid changes associated with the cold hardiness of cortical cells from poplar stem. Plant Cell Physiol., 14, 353
- Vereshchagin, A.G., Trunova, T.I., Shayakhmetova, I.S., Tsydendambaev, V.D. (1990) On the role of cell membrane lipids in cold hardening of winter wheat leaves and crowns. Plant Physiol. Biochem., 28, 623-630
- Wang, C.Y. (1995) Temperature preconditioning affects glutatione content and glutationereductase activity in chilled zucchini squash. J. Plant Physiol., 145, 148-152
- Yu, J.W., Jeffrey, P.D., Shi, Y. Mechanism of procaspase-8 activation by c-FLIPL. Proc. Natl. Acad. Sci. USA, 106, 8169-8174


