Роль эпителиально-мезенхимального перехода и аутофагии в противоопухолевом ответе клеточных линий меланомы на таргетное ингибирование MEK и MTOR киназ
Автор: Рябая Оксана Олеговна, Прокофьева Анастасия Алексеевна, Хоченков Дмитрий Александрович, Акасов Роман Александрович, Буров Сергей Владимирович, Марквичева Елена Арнольдовна, Степанова Евгения Владиславовна
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 3 т.18, 2019 года.
Бесплатный доступ
Введение. Возникновение резистентности и дальнейшая опухолевая прогрессия остаются актуальной проблемой в лечении меланомы кожи. Процесс аутофагии и эпителиально-мезенхимальный переход (ЭМП) тесно связаны между собой и играют ключевую роль в опухолевой прогрессии. Таргетное ко-ингибирование МЕК и mTOR киназ является потенциальной мишенью для терапии меланомы, нацеленной на блокирование ЭМП. Цель работы - изучение влияния ко-ингибирования МЕК и mTOR киназ на выживаемость, возможность формирования 30-сфероидов и миграционные способности клеточных линий меланомы, а также взаимосвязь этих изменений с маркерами ЭМП и аутофагии. Материал и методы. Работа проведена на клеточных линиях меланомы Mel Z и Mel MTP, полученных от пациентов, проходивших лечение в НМИЦ онкологии им. Н.Н. Блохина. Оценку антипролиферативной активности биниметиниба и/или рапамицина исследовали МТТ-тестом. 30-сфероиды получали на основе RG0-пептидов, миграционную способность и инвазивность оценивали к камере Бойдена и базальном матриксе. Изменения экспрессии маркеров аутофагии и ЭМП исследованы иммуноцитохимически или иммуноблоттингом. Результаты. Рапамицин усиливал цитотоксичность биниметиниба как в 20-, так и в 30-культурах клеточных линий меланомы. При этом биниметиниб и рапамицин снижали инвазию, но не миграцию клеток меланомы in vitro. Эффективность комбинации связана со снижением маркеров ЭМП N-кадхерина и р-катенина и аутофагии в клетках меланомы - Беклин 1, р62/SQSTM1 и LC3BII. Заключение. Инактивация аутофагии и ЭМП позволяет преодолевать резистентность к существующей терапии и может быть рассмотрена как перспективная мишень для терапии меланомы.
Меланома, аутофагия, эпителиально-мезенхимальный переход, зd-сфероиды, экспериментальная терапия, рапамицин
Короткий адрес: https://sciup.org/140254439
IDR: 140254439 | УДК: 616.5-006.81-091.811:576.3:577.2 | DOI: 10.21294/1814-4861-2019-18-3-54-63
Текст научной статьи Роль эпителиально-мезенхимального перехода и аутофагии в противоопухолевом ответе клеточных линий меланомы на таргетное ингибирование MEK и MTOR киназ
Несмотря на достигнутые успехи в лечении меланомы, проблема возникновения резистентности и дальнейшей опухолевой прогрессии остается актуальной. Опухолевая прогрессия может быть рассмотрена как многоступенчатый эволюционный процесс, который позволяет опухолевым клеткам на разных этапах преодолевать неблагоприятные условия и физиологические барьеры, сдерживающие рост, за счет приобретения новых функций. Этот процесс адаптации включает в себя изменение клеточных функций и взаимодействие между несколькими клеточными путями. Предполагается, что аутофагия и эпителиально-мезенхимальный переход (ЭМП) тесно связаны между собой и играют ключевую роль в опухолевой прогрессии, являясь основными биологическими процессами в опухоли. Аутофагия – эволюционно сложившийся процесс лизосомальной утилизации белков и органелл для поддержания своего гомеостаза и жизнедеятельности при неблагоприятных условиях окружающей среды или нехватке питательных веществ и энергии в клетках, предотвращая накопление токсинов внутри клетки [1]. В последнее время участие ЭМП и аутофагии и их взаимосвязь в опухолевой прогрессии активно изучаются [2]. ЭМП является ведущим механизмом инвазии и метастазирования опухолей, в результате которого эпителиальные клетки теряют апикальнобазальную полярность и межклеточные контакты с последующей реорганизацией цитоскелета [3]. Ключевым событием в процессе ЭМП является утрата центральной молекулы межклеточных адгезионных контактов – Е-кадхерина. При ЭМП также происходит так называемое переключение кадхе-ринов, «cadherin switch» – снижение экспрессии Е-кадхерина и повышение уровня N-кадхерина, характерного для мезенхимальных клеток, вименти-на, фибронектина, матриксных металлопротеиназ, а также высвобождение β-катенина, его ядерная транслокация, что, собственно, способствует эпителиально-мезенхимальной трансформации [3–5].
Белок RAS представляет собой небольшую ГТФазу, которая регулирует последующую активацию сигнальных путей, включая MAPK и PI3K и, следовательно, вовлечена в прогрессирование меланомы [6, 7]. Изоформа NRAS мутирована примерно у 15–25 % пациентов с меланомой [6]. Наиболее распространенными мутациями являются замены лизина или аргинина на глютамин [8]. Нижестоящий белок BRAF представлен мутантной формой в 50–70 % случаев меланомы. BRAF-активация может индуцировать подвижность клеток меланомы, его активация связана с увеличением экспрессии Twist1 и Zeb1, что приводит к большей инвазии меланомных клеток [5]. Кроме того, мутация BRAF потенцирует путь NFκB, который, в свою очередь, стимулирует экспрессию MMP, увеличивая миграционную способность, и индуцирует экспрессию SNAIL, известного драйвера метастазирования [9, 10].
Митоген-активированная протеинкиназа (MEK) является нисходящим эффектором BRAF и потенциальной мишенью для терапии меланомы [11]. Однако недавние данные свидетельствуют о том, что ингибирование МЕК может фактически увеличить инвазивный потенциал в меланоме [12]. Известно, что PI3K/AKT/mTOR-сигнальный путь играет значительную роль в ЭМП при меланоме. Структурная активация PI3K/AKT приводит к последующей экспрессии мезенхимальных белков, репрессии E-кадхерина и усиленной миграции клеток меланомы [13, 14]. Активация PI3K/AKT-пути регулируется белком PTEN. Стоит отметить, что PTEN часто мутирован при меланоме, и потеря его функций ведет к резистентности к лекарственной терапии и плохому прогнозу [15]. Дальнейшая активация комплекса mTOR-mTORC1 индуцирует ЭМП путем активации p7026 киназы 1 (S6K1). Таким образом, mTOR-путь является потенциальной мишенью для терапии меланомы, нацеленной на блокирование ЭМП.
Целью исследования явилось изучение влияния ко-ингибирования МЕК и mTOR на выживаемость, возможность формирования 3D-сфероидов и миграционные способности клеточных линий меланомы, а также взаимосвязь этих изменений с маркерами ЭМП и аутофагии.
Материал и методы
Клеточные линии
Клетки метастатической меланомы Mel MTP и Mel Z были получены из опухолевого материала пациентов, проходивших лечение в НМИЦ онкологии им. Н.Н. Блохина [16]. Клеточные линии культивировали в RPMI-1640 (Gibco, США) с добавлением 10 % телячьей эмбриональной сыворотки (ТЭС, HyClone, США), 2 мМ L-глутамина (Sigma, США), 10 МЕ/мл пенициллин-стрептомицина (ПанЭко, Россия) при 37 °C в атмосфере с 5 % CO2. Клетки поддерживали в логарифмической фазе роста постоянным пересевом культуры через 3–4 дня.
Оценка цитотоксичности
Клеточные линии (8×104 кл/лунка) вносили в 96-луночный планшет. Через 24 ч заменяли среду и добавляли рамамицин и/или биниметиниб и инкубировали в течение 48 ч при 37 °С и 5 % СО2. Затем вносили раствор МТТ (3- [4,5-диметилтриазол-2-ил] -2,5-дифенилтетразолийбромид, Sigma-Aldrich, США) в конечной концентрации 0,5 мг/мл. Образовавшиеся кристаллы диформазана элиюриовали с клеточных мембран ДМСО (200 мкл/лунка). Результат оценивался спектрофотометрически при длине волны 570 нм на анализаторе Multiscan FC (Thermo Scientific, США). Выживаемость клеток рассчитывали по фомруле: (OD экспериментальной группы – OD контрольной группы) / OD контрольной группы × 100 %.
Иммуноблоттинг
Клетки (2×106) лизировали в буфере, содержащем 50 мМ Трис-HCl, 1 мМ ЭДТА, 0,5 % дезоксихолата натрия, 0,1 % SDS, 10 мкл/мл ингибирующего коктейля, 1 мМ PMSF, 100 мкмоль/л ДТТ (рН 7,5) в течение 40 мин при +4 оС, центрифугировали при 13 400 об/мин 15 мин при +4 ºС. Концентрацию белка определяли методом Брэдфорда (Sigma-Aldrich, США) на спектро-флуориметре Multiscan FC (595 нм). Электрофорез образцов, содержавших по 40–60 мкг белка, проводили в 10 % SDS-полиакриламидном геле, белки переносили на нитроцеллюлозные мембраны (BioRad, США) методом полусухого электропереноса в системе Trans-Blot Turbo (Bio-Rad, США) при 1А и 25В в течение 30 мин. Для предотвращения неспецифической сорбции нитроцеллюлозную мембрану обрабатывали 5 % раствором сухого молока («Applichem», Германия) в TBS-T Мембрану инкубировали с первичными антителами LC3B (Novus Biologicals, Великобритания), р62/ SQSTM1 (Cell Signaling, США), Беклин 1 (Cell Signaling, США), E-кадхерин (Dako, Дания), N-кадхерин (Dako, Дания), β-катенин (NeoMarkers, Великобритания), Виментин (Dako, Дания) и β-актином (Sigma, США) в течение ночи при +4 оС, отмывали раствором ТBS-T при комнатной температуре, инкубировали 1,5 ч с вторичными антивидовыми антителами, конъюгированными пероксидазой хрена (Amersham, США). Затем добавляли хемилюминесцентный субстрат Clarity ECL (Bio-Rad, США). Хемилюминесцентную реакцию регистрировали на ChemiDoc Touch (Bio-Rad, США). Денситометрический анализ проводился с помощью программы ImageJ (NIH, США).
Иммуноцитохимическое исследование
Клетки наращивали на стеклах до 80 % монослоя, далее фиксировали в спирте и ацетоне, инкубировали с первичными антителами к E-кадхерину (Dako, Дания), N-кадхерину (Dako, Дания), β-катенину (NeoMarkers, Великобритания), Виментину (Dako, Дания), матриксным металлопротеиназам 2 (Abcam, Великобритания) и 9 (Santa Cruz, США) при 4 ºС в течение 18 ч. Клетки промывали и инкубировали с вторичными антивидовыми антителами, меченными флуорохромом AlexaFluor®488 (Life Technologies, США), а затем с Хекстом 33258 (ПанЭко, США). Клетки заключали под покровные стекла с использованием полимерной среды Fluorescent mounting medium (Dako, Дания). Интенсивность окрашивания оценивали на клеточном анализаторе InCell Analyzer 6000 с использованием программного обеспечения InCell Investagator.
Формирование сфероидовс использованием RGD-пептида
Формирование сфероидов проводили, как описано ранее [17]. Стоковый раствор cyclo-RGDfK(TPP) пептида (400 мкМ) готовили растворением лиофилизированного порошка в питательной среде RPMI-1640 без сыворотки и последующей стерилизацией через одноразовый фильтр (Millipore, 0,22 мкм), стоковый раствор хранили в морозильной камере при -20 оС не более трех месяцев. Клетки рассеивали на 96-луночные планшеты в концентрации 2×104 клеток на лунку в 100 мкл питательной среды RPMI-1640 + 10 % ТЭС и помещали в CO2-инкубатор. Через 2–4 ч из лунок удаляли старую питательную среду и вносили 100 мкл полной среды, содержащей 10–100 мкМ пептида, и вновь помещали в CO2-инкубатор. За изменениями в характере роста и морфологии клеток наблюдали с помощью оптического микроскопа.
Оценка инвазии сфероидов в Матригель
Сфероиды клеточной линии Mel Z, полученные на основе RGD-пептидов, собирали в 15 мл пробирку и откручивали в течение 10 мин при 1500 об/мин. Далее отбирали супернатант, к осадку клеток добавляли 1 мл Матригеля (BD Bioscience, Бельгия), аккуратно ресуспендировали и добавляли по 50 мкл в охлажденный 96-лучный планшет. Планшет инкубировали при 37 °C 10 мин для полимеризации Матригеля, а затем добавляли 100 мкл полной питательной среды, содержащей рапамицин (250 нM) и/или биниметиниб (2,5 µM) или оставляли интактными. Инвазия клеток в Матригель оценивалась через 2–3 дня с помощью светового микроскопа.
Оценка миграционной способностиклеток в камере Бойдена
Клетки меланомы (2,5×105/мл) прединкубирова-ли с рамамицином (250 нМ) и/или биниметинибом (2 µM) в течение 4 ч, затем переносили в камеру Бойдена в 300 мкл бессывороточной среды, содержащей химиопрепараты, помещали в 24-луночный планшет, содержащий 750 мкл среды с 10 % ТЭС для создания условий для миграции клеток через поры камеры Бойдена, и оставляли на 24 ч при 37 °C в атмосфере с 5 % CO2. Затем мембрану фиксировали 3 % формальдегидом в течение 5 мин с последующей фиксацией в метаноле, после чего клетки окрашивали 0,5 % раствором кристаллического фиолетового в течение 30 мин. Количество мигрировавших клеток с нижней стороны мембраны камеры Бойдена считали в 5 различных полях (×40) под световым микроскопом Nikon 80i.
Статистический анализ
Все эксперименты были выполнены в трех повторах. Статистический анализ и графический интерфейс представлены с использованием программного обеспечения GraphPad Prizm v.5.0. (GraphPad, США). Для достоверности различий использовали t-критерий Стьюдента. Значение р≤0,05 считалось статистически достоверным.
Результаты
Изучение экспрессии маркеров ЭМП на клеточных линиях меланомы
Mel Z и Mel MTP
Изначально мы изучили базальную экспрессию E-кадхерина, N-кадхерина, β-катенина, виментина, MMP2 и ММР9 на 2 клеточных линиях метастатической меланомы Mel Z, несущей мутацию в гене BRAF , и линии c мутантным NRAS – Mel MTP. Установлено, что обе клеточные линии отличаются более высоким базальным уровнем маркеров мезенхимальности: виментина, N-кадхерина и ММР2 по сравнению с эпителиальным маркером Е-кадхерином. Уровень экспрессии β-катенина и ММР9 был заметно ниже (рис. 1).
Ранее нами был изучен уровень базальной аутофагии по уровню экспрессии Беклин 1 в исследованных клеточных линиях [18]. Было показано, что клеточная линия Mel Z имела низкий уровень базальной аутофагии, а Mel MTP – высокий. Таким образом, на уровне базальной экспрессии корреляции между уровнем аутофагии и ЭМП не отмечено.
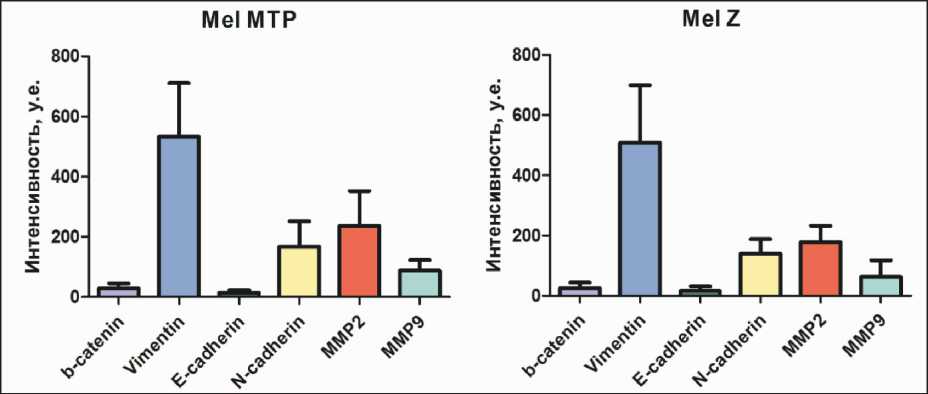
Рис. 1. Иммуноцитохимическое исследование экспрессии маркеров ЭМП на клеточных линиях меланомы Mel MTP и Mel Z
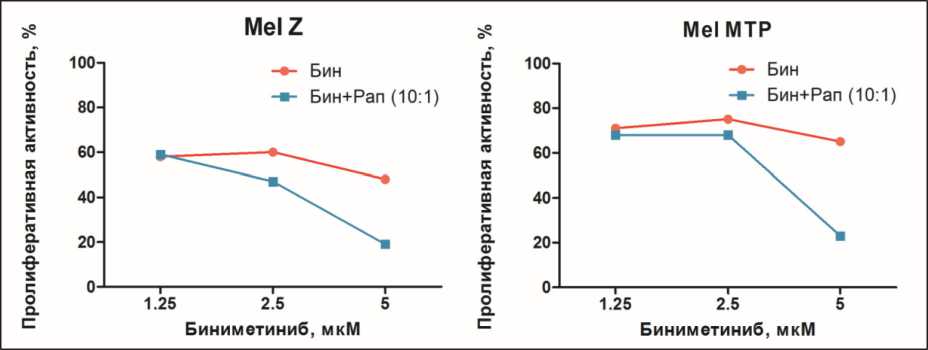
Рис. 2. Изменение цитотоксичности биниметиниба в присутствии или отсутствии рапамицина на клеточных линиях меланомы Mel Z и Mel MTP определено методом МТТ после 48-часовой инкубации с препаратами (p<0,05)
Цитотоксичность комбинации биниметиниба и рапамицина
Далее мы изучили действие биниметиниба и/или рапамицина на выживаемость клеточных линий меланомы. Величина IC50 биниметиниба составила 3,8 ± 0,2 µМ для линии Mel Z и 10,2 ± 0,4 µМ – для Mel MTP (p<0,05), величина IC50 рапамицина составила 300 ± 15 нM для обеих клеточных линий (p<0,05). Для изучения действия комбинации препаратов на выживаемость клеток меланомы биниметиниб и рапамицин брали в соотношении 10:1. Все комбинации демонстрировали усиленный антипролиферативный эффект по сравнению с монорежимами рапамицина и биниметиниба, однако синергизм действия 2 препаратов, определяемый по комбинационному индексу (КИ) методом Chou-Talalay [19], отмечался только при концентрациях 5 µМ биниметиниба и 0,5 µМ рапамицина и 2,5 µМ биниметиниба и
0,25 µМ рамамицина (таблица, рис. 2). При более низких концентрациях отмечалась незначительная аддитивность взаимодействия препаратов (данные не представлены). Для дальнейших исследований брали биниметиниб и рамамицин в концентрациях 2,5 µМ и 250 нМ, которые приводили к 10–15 % ингибированию роста по сравнению с бинимети-нибом в монорежиме.
Цитотоксичность комбинации биниметиниба и рапамицина в 3D-сфероидах
Опираясь на данные о цитотоксичности препаратов в монослойной культуре (2D-культуре), мы исследовали эффективность комбинации в 3D-сфероидах, которые представляют собой более близкую к in vivo клеточную модель. Клетки Mel Z формировали плотные сфероиды с диаметром в среднем 100 µм, клетки Mel MTP имели
Таблица
Антипролиферативная активность (% от контроля) биниметиниба, рапамицина или их комбинации в соотношении 10:1, КИ – комбинационный индекс, посчитанный по методу Chou-talalay
(КИ<1 – антагонизм, >1 – антагонизм, =1 – аддитивность)
|
Mel Z |
Mel MTP |
||||
|
Биниметиниб |
Рапамицин |
Биниметиниб + |
Биниметиниб |
Рапамицин |
Биниметиниб + |
|
рапамицин |
рапамицин |
||||
|
Концен- |
Выжива- |
Концен- |
Выжива- |
Выжива- |
КИ |
Концен- |
Выжива- |
Концен- |
Выжива- |
Выжива- |
КИ |
|
трация, |
емость |
трация, |
емость |
емость |
трация, |
емость |
трация, |
емость |
емость |
||
|
мкМ |
нМ |
мкМ |
нМ |
||||||||
|
5 |
48 % |
500 |
16 % |
19 % |
0,95 |
5 |
67 % |
500 |
28 % |
23 % |
0,99 |
|
2,5 |
60 % |
250 |
80 % |
47 % |
0,45 |
2,5 |
75 % |
250 |
77 % |
68 % |
0,8 |
|
1,25 |
58 % |
125 |
95 % |
59 % |
0,97 |
1,25 |
71 % |
125 |
98 % |
68 % |
1,25 |
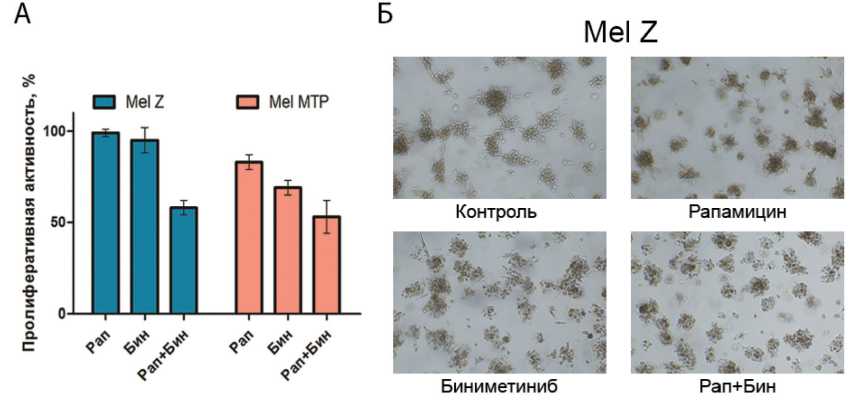
Рис. 3. Влияние комбинации биниметиниба и/или рапамицина на 3D-клеточные линии меланомы: А – антипролифератив-ная активность биниметиниба, рапамицина или их комбинации в 3D-сфероидах клеточных линий Mel MTP и Mel Z методом МТТ после 48 ч инкубации с препаратами; Б – изучение инвазивности 3D-сфероидов клеток Mel Z, имплантированных в Матригель, через 48 ч после воздействия биниметиниба и/или рапамицина
гроздевидную форму. Минимальное количество cyclo-RGDfK(TPP) пептида для формирования сфероидов составило 100 µМ для Mel Z и 50 µМ для Mel MTP. Неожиданным оказался тот факт, что биниметиниб в монорежиме был нетоксичным для клеток линии Mel Z по сравнению с монослойной культурой (95 % выживаемость в 3D-сфероидах против 60 % в 2D-культуре), при этом в Mel MTP токсичность биниметиниба была сопоставима с 2D-культурой (75 и 69 % соответственно). При комбинации с рапамицином в клеточной линии Mel Z сохранялся усиленный антипролифератив-ный эффект по сравнению с биниметинибом, а в линии Mel MTP отмечалось усиление токсичности на 20 % (рис. 3А).
Биниметиниб и рапамицин снижают инвазию, но не миграцию клеток меланомы in vitro
Мы изучили способность биниметиниба и/или рапамицина к уменьшению инвазии клеток на 3D-сфероидах, имплантированных в Матригель, для чего клетки линии Mel Z были преинкубированы с биниметинибом (2,5 мкМ) и/или рапамицином (250 нМ) в течение 48 ч. Рапамицин и биниме-тиниб в монорежиме снижали инвазию Mel Z в Матригель. Более того, комбинированное действие препаратов приводило к более значительному ингибированию инвазии по сравнению с биниме-тинибом и рапамицином отдельно (рис. 3Б).
Влияние комбинации биниметиниба и рапа-мицина на миграционную способность клеток меланомы было изучено по способности клеток проходить 8 мкМ мембрану камеры Бойдена. Клетки преинкубировали с препаратами в течение 4 ч, после чего их вносили в камеру Бойдена в бес-сывороточной среде с 2,5 мкМ биниметинибом и/ или 250 нМ рапамицином. Через 24 ч получали изображения мигрировавших через камеру Бойдена клеток и подсчитывали количество проми-грировавших клеток в присутствии препаратов под световым микроскопом в 5 полях (рис. 4). Снижение миграционной активности под действием препаратов относительно контроля было более значительным в клетках линии Mel Z по сравнению с Mel MTP. Однако не выявлено различий в миграционной способности под действием биниметиниба, рамамицина и их комбинации ни в одной из двух клеточных линий. Более того, ко-инкубация с биниметинибом и рапамицином в клеточной линии Mel Z приводила к усиленной миграции клеток, что может быть объяснено более агрессивным фенотипом этих клеток и как следствие повышенной подвижностью.
Изучение экспрессии маркеров ЭМП и аутофагии под действием комбинации рапамицина и биниметиниба
Для оценки степени участия маркеров ЭМП и аутофагии в снижении опухолевой пролиферации
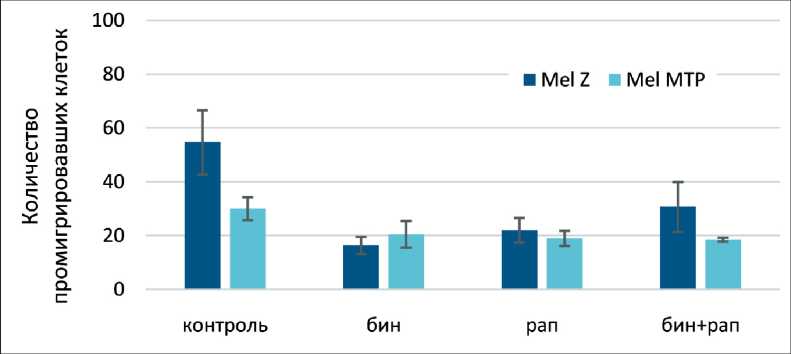
Рис. 4. Миграционная способность клеточных линий Mel MTP и Mel Z в камере Бойдена после 24-часовой инкубации c биниметинибом (2,5 мкМ) и/ или рапамицином (250 нМ). Количество мигрировавших клеток в камере Бойдена подсчитывали в 5 различных полях (×40) под световым микроскопом
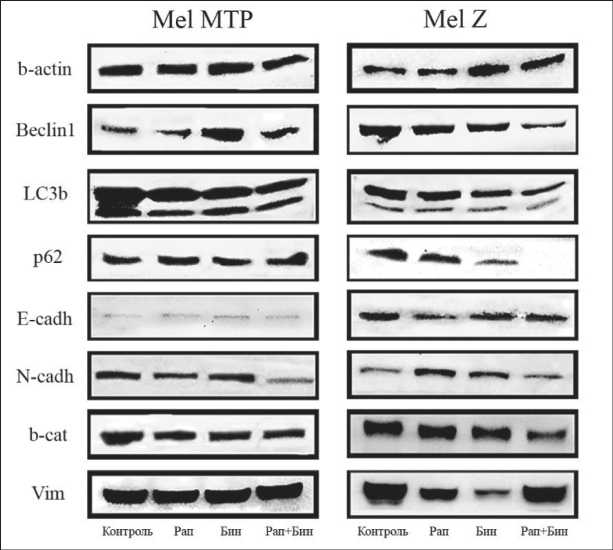
Рис. 5. Иммуноблоттинг экспрессии Беклина 1, LC3B, p62, Е-кадхерина, Ν-кадхерина, β-катенина и виментина после воздействия биниметиниба и/или рапамицина на клеточных линиях меланомы Mel MTP и Мel Z под действием рамамицина и/или биниметини-ба мы исследовали экспрессию E-кадхерина, N-кадхерина, β-катенина, виментина, LC3BI/II, р62/SQSTM1 и Беклин 1. Активность каждого рецептора определяли методом вестерн-блотинга с использованием соответствующих антител. Как показано на рис. 5, в клетках Mel Z комбинация препаратов снижала экспрессию маркеров аутофагии Беклин 1, р62/SQSTM1, LC3BII и маркеров мезенхимальности N-кадхерина и β-катенина, препараты в монорежиме не влияли на степень активации белков. При этом уровень виментина оставался неизменным. Схожая картина наблюдалась и в другой линии меланомы Mel MTP, где комбинация препаратов также подавляла активацию N-кадхерина, β-катенина и LC3BII. Однако не происходило сколько-нибудь значимой блокировки р62/SQSTM1 и виментина по сравнению с контролем. При исследовании обеих клеточных линий не отмечено значимых различий в экспрессии Е-кадхерина.
Обсуждение
Основной причиной, ограничивающей эффективность таргетной терапии при меланоме, являются возникающая резистентность и дальнейшая опухолевая прогрессия. Чаще всего резистентность приобретается за счет реактивации МАРК-сигнального пути или активации альтернативных каскадов, включая PI3K/AKT/mTOR [20]. Оба сигнальных пути PI3K/AKT/mTOR и МАРK могут регулироваться посредством рецепторных тиро-зинкиназ [21].
В данном исследовании мы показали, что комбинация МЕК-ингибитора биниметиниба и mTOR-ингибитора рапамицина имеет большую терапевтическую эффективность по сравнению с препаратами в монорежиме в экспериментах in vitro. Биниметиниб и рапамицин синергично снижали пролиферативную активность как BRAF-мутированной меланомы Mel Z, так и NRAS-мутированной Mel MTP. Более того, данный эффект сохранялся и при изучении эффективности данной комбинации в 3D-сфероидах, которые представляют собой более близкую к in vivo экспериментальную модель. Недавние данные показали, что инактивация PI3K/AKT/mTOR-сигнального пути уменьшает прогрессию меланомы. Предварительные исследования показывают, что ингибитор PI3K, LY-294.002 может уменьшить инвазию и миграцию меланомы за счет снижения фосфорилирования АКТ и увеличения экспрессии MITF [22]. Схожие данные были получены и при других типах опухолей [23].
Нами показано, что частично эффективность комбинации связана со снижением маркеров ЭМП N-кадхерина и β-катенина и снижением аутофагии в клетках меланомы – Беклин 1, р62/SQSTM1 и LC3BII.
Известно, что PI3K/AKT/mTOR играет значительную роль в меланоме ЭМП. Структурная активация PI3K/AKT приводит к последующей экспрессии мезенхимальных белков, репрессии E-кадхерина и усиленной миграции клеток меланомы [13, 14]. mTOR является нисходящим эффектором пути PI3K/AKT. mTOR функционирует как каталитическая единица двух важных белковых комплексов mTORC1 и mTORC2 [25]. Активация mTORC1 индуцирует ЭМП путем активации p7026 киназы 1. Это изменение стимулирует реорганизацию F-актина, фокальную адгезию и экспрессию MMP. Через фосфорилирование AKT, сигнализация TGFβ стимулирует mTORC2, чтобы индуцировать цитоскелетную реорганизацию и миграцию.
Хотя ряд ученых показали, что ингибирование MEK при меланоме может увеличивать инвазию и индуцировать клеточную подвижность, особенно в клеточных линиях, мутантных по BRAF и KRAS [12, 26–28], в нашем исследовании комбинация биниметиниба и рапамицина снижала инвазию клеток, но не миграцию. Стоит отметить, что не все МЕК-ингибиторы индуцируют повышенную инвазию клеток. Так, МЕК-ингибитор траметиниб уменьшал фосфорилирование ERK1/2, но увеличивал активацию AKT и нисходящих эффекторов в NRAS-мутированных клетках SK-MEL-2 посредством EGF-сигналинга [29]. Другой МЕК-ингибитор селуметиниб индуцировал инвазию в клеточной линии A375 по сравнению с контролем за счет усиления экспрессии MMP-2 и MMP-9 и промезенхимальных транскрипционных факторов, таких как Zeb1, Twist, Snail [12, 30]. C другой стороны, U0126 – потенциальный ингибитор МЕК – ингибировал инвазию клеток A375 в клеточных моделях в матригеле за счет снижения экспрессии урокиназы плазминогена и MMP-9 [31].
Недавние исследования показывают, что аутофагия и ЭМП находятся в сложной взаимосвязи в опухолях [2]. Оба процесса регулируются общими молекулярными медиаторами и сигнальными путями, включая TGF, STAT3 и PI3K/AKT/mTOR сигнальный каскад. С одной стороны, аберрантная активация ЭМП требует повышенного уровня аутофагии для поддержания жизнеспособности опухолевых клеток при метастатическом распространении. С другой стороны, аутофагия на ранних стадиях может подавлять рост опухоли, дестабилизируя важнейшие медиаторы ЭМП [2]. Qiang and He показали, что функциональное снижение аутофагии активировало ЭМП посредством
Список литературы Роль эпителиально-мезенхимального перехода и аутофагии в противоопухолевом ответе клеточных линий меланомы на таргетное ингибирование MEK и MTOR киназ
- Yang X., Yu D.D., Yan F., Jing Y.Y., Han Z.P., Sun K., Liang L., Hou J., Wei L.X. The role of autophagy induced by tumor microenvironment in different cells and stages of cancer. Cell Biosci. 2015 Mar 28; 5: 14. DOI: 10.1186/s13578-015-0005-2
- Gugnoni M., Sancisi V, Manzotti G., Gandolfi G., Ciarrocchi A. Autophagy and epithelial-mesenchymal transition: an intricate interplay in cancer. Cell Death Dis. 2016 Dec 8; 7(12): e2520. 10.1038/ cddis.2016.415. DOI: 10.1038/cddis.2016.415
- Kalluri R., Weinberg R.A. The basics of epithelial-mesenchymal transition. J Clin Invest. 2009 Jun; 119(6): 1420-8. 10.1172/ JCI39104. DOI: 10.1172/JCI39104
- Alonso S.R., Tracey L., Ortiz P., Perez-Gomez B., Palacios J., Pollan M., Linares J., Serrano S., Saez-Castillo A.I., Sanchez L., Pajares R., Sanchez-Aguilera A., Artiga M.J., Piris M.A., Rodriguez-Peralto J.L. A High-Throughput Study in Melanoma Identifies Epithelial-Mesenchymal Transition as a Major Determinant of Metastasis. Cancer Res. 2007 Apr 1; 67(7): 3450-60. DOI: 10.1158/0008-5472.CAN-06-3481
- Caramel J., Papadogeorgakis E., Hill L., Browne G.J., Richard G., Wierinckx A., Saldanha G., Osborne J., Hutchinson P., Tse G., Lachuer J., Puisieux A., Pringle J.H., Ansieau S., Tulchinsky E. A switch in the expression of embryonic EMT-inducers drives the development of malignant melanoma. Cancer Cell. 2013 Oct 14; 24(4): 466-80. 10.1016/j. ccr.2013.08.018. DOI: 10.1016/j.ccr.2013.08.018


