Роль магнитно-резонансной томографии и двухэнергетической компьютерной томографии в диагностике рабдомиомы сердца у взрослого пациента: клинический случай
Автор: Мершина Е.А., Филатова Д.А., Синицын В.Е., Лисицкая М.В., Дземешкевич С.Л., Заклязьминская Е.В., Нечаенко М.А.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические случаи
Статья в выпуске: 1 т.37, 2022 года.
Бесплатный доступ
В настоящей статье описан клинический случай взрослого пациента с рабдомиомой сердца, диагностированной в раннем детском возрасте. Результатом продолженного роста опухоли явились нарушения ритма сердца в виде желудочковой экстрасистолии с пробежками желудочковой тахикардии. Также приведен обзор литературы о частоте встречаемости, морфологии, клинических проявлениях и диагностике данного типа опухолей сердца, в том числе с помощью двухэнергетической компьютерной томографии (КТ) и магнитно-резонансной томографии (МРТ) сердца с контрастированием.
Рабдомиома, сердце, двухэнергетическая компьютерная томография, магнитно-резонансная томография, нарушение ритма сердца
Короткий адрес: https://sciup.org/149140013
IDR: 149140013 | УДК: 616.12-006.364.03-073.86-073.756.8-053.8
Текст научной статьи Роль магнитно-резонансной томографии и двухэнергетической компьютерной томографии в диагностике рабдомиомы сердца у взрослого пациента: клинический случай
Рабдомиома является наиболее часто встречающейся фетальной опухолью сердца: по разным оценкам, она составляет от 60 до 86% первичных опухолей сердца в этот период жизни [1]; встречаемость данного типа опухолей в постнатальном периоде составляет порядка 1 на 40 000 [2]. В частности, у новорожденных рабдоми-омы составляют порядка 58,6% опухолей сердца, у детей от 1 мес. жизни до 18 лет – 39,3% [3]. Рабдомиомы обычно представляют собой гомогенные опухоли вариабельных размеров, чаще всего расположенные в желудочках; реже они встречаются в полости перикарда, могут также исходить из межжелудочковой перегородки и распространяться в полость предсердий. Направление роста рабдомиомы может быть как экстра-, так и интрамуральным.
Среди первичных опухолей сердца большинство являются доброкачественными, но возможности лечения в период беременности матери сильно ограничены, и основные мероприятия выполняются уже после родов. Тем не менее, прогноз после подобных вмешательств обычно благоприятный. Однако часто рабдомиома ассоциирована с туберозным склерозом – аутосомно-доминантным генетическим заболеванием, вовлекающим множество систем органов, включая кожу, центральную нервную систему, органы слуха, почки и легкие [4]. Доказана корреляция между рабдомиомами сердца и туберозным склерозом: у 96% новорожденных и детей с рабдоми-омами сердца диагностируют туберозный склероз [5]. Данное заболевание отличается многообразием проявлений: общей чертой является образование доброкачественных новообразований в разных системах органов. Некоторые из них, такие как ангиомиолипомы в почках, развиваются только при достижении взрослого возраста; рабдомиомы в сердце, напротив, возникают уже в фетальном периоде и нередко спонтанно регрессируют в детском возрасте [6, 7]. Имеются данные о спонтанной регрессии рабдомиомы у 36% детей; после 6-летнего возраста опухоль исчезает реже, но может уменьшаться в размере [8]. В целом, учитывая то, что у 90% пациентов с туберозным склерозом развиваются неврологические осложнения (эпилепсия, аутизм и снижение когнитивных способностей), прогноз данного заболевания обычно не- благоприятный [4, 9]; в настоящее время возможно лишь симптоматическое лечение.
Диагностика рабдомиом сердца основывается на визуализирующих методиках (эхокардиография (ЭхоКГ), компьютерная томография (КТ), магнитно-резонансная томография (МРТ)). Данные методы позволяют определить форму, размеры, локализацию и характер опухоли, уточнить ее взаимоотношения с клапанными структурами сердца, коронарными сосудами, структурами средостения. В последнее время по мере совершенствования технологических и программных аспектов диагностики расширяются возможности по выявлению ряда важных признаков образования, в том числе его предположительной природы.
Цель данной статьи: описание клинического случая пациента с рабдомиомой сердца и анализ возможностей различных методов для диагностики подобных образований.
Клинический случай
Был обследован пациент Г., 42 лет. Из анамнеза известно, что впервые кардиологически обследован был в 3-месячном возрасте в связи с наличием одышки, сердцебиения, слабости; был выставлен диагноз «опухоль сердца». В возрасте 2 лет пациенту было проведено оперативное вмешательство, которое из-за особенностей локализации опухоли было вынужденно ограничено эксплоративной перикардэктомией: в области межжелудочковой перегородки с переходом на правый и левый желудочки определялось внутримышечное новообразование плотноэластической консистенции белесоватой окраски без четких границ, был взят материал для гистологического исследования; объемное образование признано неоперабельным. По результатам биопсии новообразования выявлена рабдомиома. В процессе динамического наблюдения с возраста 15 лет при ультразвуковом исследовании (УЗИ) сердца отмечался спонтанный регресс опухоли до размеров 20 х 25 мм (последнее УЗИ сердца было в возрасте 41 года), однако исследований с высокой разрешающей способностью (мультиспиральная компьютерная томография (МСКТ), МРТ с контрастированием) не проводилось. Положительная ультразвуковая динамика не сопровождалась исчезновением нарушений ритма или свободой от приема противоаритмических препаратов. На протяжении всего времени наблюдения отмечаются нарушения ритма сердца, которые контролируются медикаментозно. При мониторировании ЭКГ выявлены склонность к тахикардии, множественные желудочковые экстрасистолы, в том числе эпизоды бигеминии и тригеминии.
В возрасте 40 лет пациент был направлен на консультацию врача-генетика. При осмотре кожных нарушений пигментации, ангиофибром, макулярной дегенерации, новообразований со стороны других внутренних органов, очаговой или диффузной неврологической симптоматики выявлено не было. Данных в пользу диагноза туберозного склероза или другого заболевания из группы факома-тозов недостаточно.
На момент обследования рентгенологически определяется необычная конфигурация сердца; на ЭКГ: синусовый ритм, вертикальное положение электрической оси сердца, очаговые изменения в переднебоковой и верху- шечной зонах сердца. Данные ЭхоКГ: левый желудочек 36 х 27 мм, левое предсердие 25 мм, объемное образование по передней поверхности сердца, распространяющееся на левые и правые отделы сердца. КТ: округлое образование размером 70 мм неравномерной плотности, деформирующее левые отделы сердца.
В возрасте 42 лет на фоне сохраняющихся жалоб на нарушения ритма сердца на базе МНОЦ МГУ имени М.В. Ломоносова проведены двухэнергетическая КТ и МРТ сердца с внутривенным контрастированием. Полость правого желудочка деформирована за счет большого объемного образования, имеющего промежуточную интенсивность сигнала, исходящего из миокарда верхней части межжелудочковой перегородки, передней стенки левого желудочка и свободной стенки правого желудочка (рис. 1). При проведении двухэнергетического сканирования был уточнен вид образования и степень вовлечения структур сердца (рис. 2).
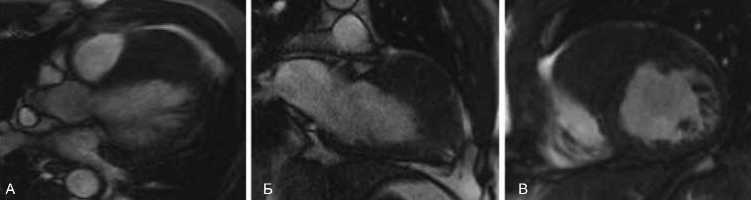
Рис. 1. МР-картина рабдомиомы сердца в кино-режиме (SSFP). А – срез по длинной оси сердца, четырехкамерная проекция; Б – срез по длинной оси сердца, двухкамерная проекция; В – срез по короткой оси сердца
Fig. 1. CMR cine images of heart rhabdomyoma (SSFP). A – heart long axis, 4-chamber view; Б – heart long axis, 2-chamber view; В – heart short axis
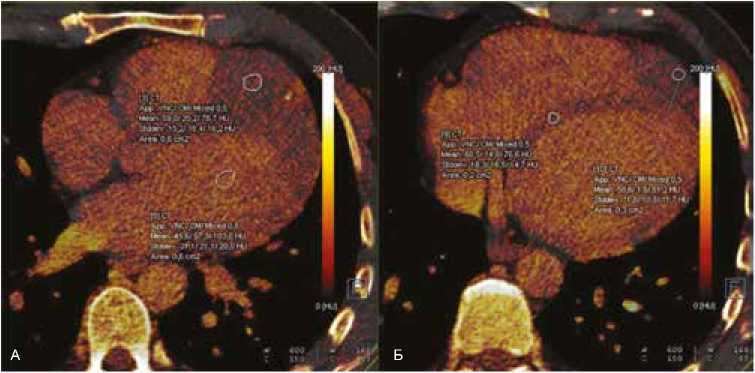
Рис. 2. Картина рабдомиомы сердца при проведении двухэнергетической компьютерной томографии. Показаны значения плотности ткани опухоли и нормальных структур сердца (межжелудочковой перегородки и полости левого желудочка). А, Б – срезы в аксиальной проекции
Fig. 2. Dual-energy CT images of heart rhabdomyoma. The density of tumor tissue and normal heart structures (interventricular septum and left ventricular cavity) are shown. А, Б – axial view
Сужение выносящего тракта правого желудочка не отмечается, его фракция выброса снижена до 35%. При до-контрастном исследовании образование изоденсно миокарду, внутри имеются мелкие высокоплотные структуры, по-видимому, хирургические скобки. При МРТ в кино-режиме образование также изоинтенсивно миокарду, однако в режиме STIR структура образования неоднородна за счет наличия участков пониженной плотности. При проведении МРТ образование активно негомогенно накапливает гадолиний-содержащий контрастный препарат в раннюю и отсроченную фазы (рис. 3). Размеры образования 84 х 70 х 47 мм. Отмечается участок инфильтративного роста образования в миокарде межжелудочковой перегородки со стороны правого желудочка на протяжении 40 мм в области базального и среднего передне-перегородочных сегментов. В толще образования проходит крупная ветвь септальной артерии (рис. 4). Глобальная сократимость левого желудочка не снижена, фракция выброса 52%. Правый тип коронарного кровоснабжения, коронарные артерии без кальцинатов и стенозов. Камеры сердца не расширены, гипертрофии миокарда нет. Отмечается асинхронное движение межжелудочковой перегородки, вероятно, за счет нарушения проводимости. По всей видимости, настоящие диагностические находки представляют собой результат продолженного роста опухоли, выявленной у пациента в раннем детстве.
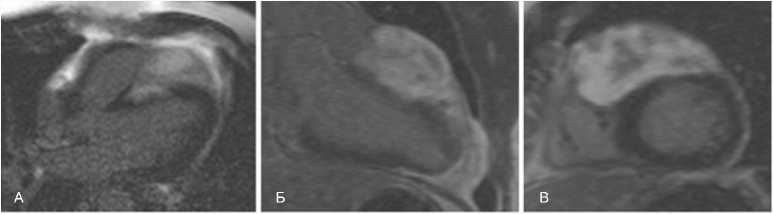
Рис. 3. МР-картина рабдомиомы сердца в отсроченную фазу через 10 мин после внутривенного введения гадолиний-содержащего контрастного препарата. А – срез по длинной оси сердца, четырехкамерная проекция; Б – срез по длинной оси сердца, двухкамерная проекция; В – срез по короткой оси сердца
Fig. 3. CMR images of delayed contrast enhancement of heart rhabdomyoma after 10 minutes since intravenous administration of gadolinium-containing contrast agent. A – heart long axis, 4-chamber view; Б – heart long axis, 2-chamber view; В – heart short axis
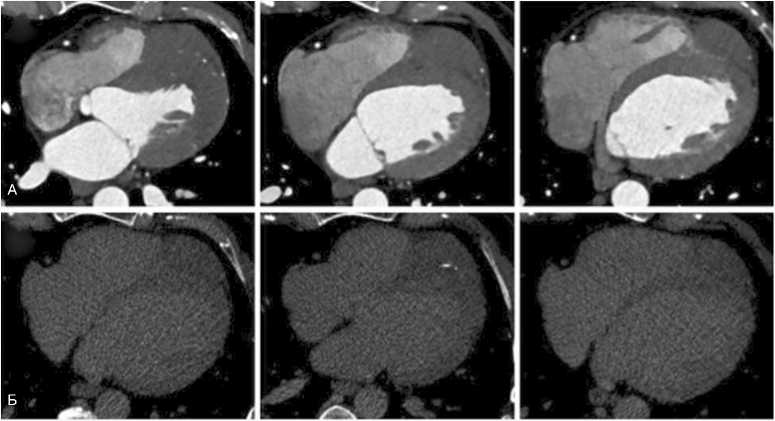
Рис. 4. КТ-картина рабдомиомы сердца в двухэнергетическом режиме, срезы в аксиальной проекции на трех разных уровнях. А – изображения в артериальную фазу; Б – изображения в венозную фазу
Fig. 4. Dual-energy CT images of heart rhabdomyoma, axial views at three different levels. А – arterial phase; Б – venous phase
Результаты и обсуждение
Рабдомиома сердца является наиболее частой опухолью данной локализации в фетальном периоде. В литературе отмечается преимущественно доброкачественное клиническое течение этих опухолей с незначительным эффектом на функцию сердца. Тем не менее, клинические проявления могут появиться уже в фетальном периоде в виде нарушений ритма сердца, неиммунной водянки или смерти. У пациентов с рабдомиомами, локализованными в перегородочной области, возможно развитие суправентрикулярной тахикардии, вторичной по отношению к синдрому предвозбуждения желудочков, например, Вольфа – Паркинсона – Уайта. Существует гипотеза, что данный синдром возникает у таких пациентов вследствие наличия дополнительного проводящего пучка, являющегося частью опухоли или тесно связанного с ней, а не пучка Кента, как в случае первичного синдрома Вольфа – Паркинсона – Уайта [10]. Также среди возможных осложнений отмечается механическая обструкция камеры сердца опухолью [4]. Сдавление опухолью коронарных сосудов может приводить к ишемической болезни сердца. В случаях, когда опухоль вызывает обструкцию выносящих трактов желудочков или создает условия для жизнеугрожающих нарушений ритма сердца, пациенту показано хирургическое лечение [11].
Диагностика рабдомиом осуществляется с использованием диапазона визуализирующих методик. ЭхоКГ обладает высокой разрешающей способностью и позволяет определить размеры и форму новообразований, место их прикрепления, подвижность, соотношение с клапанным аппаратом, степень нарушения гемодинамики. Тем не менее недостатками метода являются оператор-зависимость, плохое качество изображения у пациентов с узкими акустическими окнами, неспособность выявления экстра- и интракардиального распространения экстракардиальных объемных образований, не всегда точная визуализация интрамуральных образований, а главное, – невозможность описать тканевую структуру опухоли. В приведенном случае размеры опухоли на ЭхоКГ отличались от данных, по- лученных при МРТ сердца, что указывает на порой недостаточную диагностическую точность ЭхоКГ.
МРТ является «золотым стандартом» диагностики мягкотканных образований, позволяя детально охарактеризовать их, выяснить взаимоотношения с окружающими тканями и структурами; отсроченное гадолиниевое усиление дает дополнительную информацию о жизнеспособности ткани и наличии фиброза. Тем не менее, нередко выполнение МРТ затруднено или невозможно по причинам высокой стоимости, длительности, наличия у пациента имплантированных металлических устройств или клаустрофобии [12]. КТ позволяет получить информацию о размерах, локализации, структуре, глубине инвазии в окружающие ткани, а также степени васкуляризации опухоли. Режим двухэнергетической КТ дает возможность получить дополнительную информацию о дифференцировке тканей на основе специфического поглощения излучения от йода на высоко- и низкоэнергетических уровнях с построением карт распределения йода. Для выполнения исследования используются одно- или двухтрубочные системы с разными источниками излучения либо двухслойные детекторы. Фотоны с более низкой энергией легче поглощаются веществами высокой плотности, например, контрастированными структурами, что позволяет лучше их дифференцировать. Так, в литературе описан алгоритм дифференциальной диагностики миксом и тромбов: при моноэнергетических режимах
Список литературы Роль магнитно-резонансной томографии и двухэнергетической компьютерной томографии в диагностике рабдомиомы сердца у взрослого пациента: клинический случай
- Chen J., Wang J., Sun H., Gu X., Hao X., Fu Y. et al. Fetal cardiac tumor: Echocardiography, clinical outcome and genetic analysis in 53 cases. UltrasoundObstet. Gynecol. 2019;54(1):103-109. DOI: 10.1002/ uog.19108.
- Ekmekci E., Ozkan B.O., Yildiz M.S., Kocakaya B. Prenatal diagnosis of fetal cardiac rhabdomyoma associated with tuberous sclerosis: A case report. Case Rep. Womens Health. 2018;19:e00070. DOI: 10.1016/j. crwh.2018.e00070.
- Кардиология детского возраста; под ред. А.Д. Царегородцева, Ю.М. Белозерова, Л.В. Брегель. М.: ГЭОТАР-Медиа; 2014:784.
- Curatolo P., Bombardieri R., Jozwiak S. Tuberous sclerosis. Lancet. 2008;372(9639):657-668. DOI: 10.1016/S0140-6736(08)61279-9.
- Bader R.S., Chitayat D., Kelly E., Ryan G., Smallhorn J.F., Toi A. et al. Fetal rhabdomyoma: Prenatal diagnosis, clinical outcome, and incidence of associated tuberous sclerosis complex. J. Pediatr. 2003;143(5):620-624. DOI: 10.1067/S0022-3476(03)00494-3.
- Smythe J.F., Dyck J.D., Smallhorn J.F., Freedom R.M. Natural history of cardiac rhabdomyoma in infancy and childhood. Am. J. Cardiol. 1990;66(17):1247-1249. DOI: 10.1016/0002-9149(90)91109-j.
- Jozwak S., Kotulska K., Kasprzyk-Obara J., Domanska-Pakieta D., To-myn-Drabik M., Roberts P. et al. Clinical and genotype studies of cardiac tumors in 154 patients with tuberous sclerosis complex. Pediatrics. 2006;118(4):e1146-1151. DOI: 10.1542/peds.2006-0504.
- Хмелевская И.Г., Бец О.Г., Матвиенко Е.В., Архипова А.Г. Спонтанный регресс рабдомиомы сердца в неонатальном периоде. Трудный пациент. 2021;19(3):11-14. DOI: 10.224412/2074-1005-2021-311-14.
- Henske E.P., Jozwiak S., Kingswood J.C., Sampson J.R., Thiele E.A. Tuberous sclerosis complex. Nat. Rev. Dis. Primer. 2016;2:16035. DOI: 10.1038/nrdp.2016.35.
- Van Hare G.F., Phoon C.K., Munkenbeck F., Patel C.R., Fink D.L., Silverman N.H. Electrophysiologic study and radiofrequency ablation in patients with intracardiac tumors and accessory pathways: Is the tumor the pathway? J. Cardiovasc. Electrophysiol. 1996;7(12):1204-1210. DOI: 10.1111/j.1540-8167.1996.tb00499.x.
- Бокерия Л.А., Бокерия О.Л., Рубцов П.П., Ахобеков А.А., Алехина М.А. Опыт лечения рабдомиом сердца в сочетании с нарушениями ритма у детей. Анналы аритмологии. 2014;11(4):204-212. DOI: 10.15275/annaritmol.2014.4.3.
- Hong Y.J., Hur J., Han K., Im D.J., Suh Y.J., Lee H.-J. et al. Quantitative analysis of a whole cardiac mass using dual-energy computed tomography: Comparison with conventional computed tomography and magnetic resonance imaging. Sci. Rep. 2018;8(1):15334. DOI: 10.1038/s41598-018-33635-0.
- Hong Y.J., Hur J., Kim Y.J., Lee H.J., Hong S.R., Suh Y.J. et al. Dual-energy cardiac computed tomography for differentiating cardiac myxoma from thrombus. Int. J. Cardiovasc. Imaging. 2014;30(2):121-128. DOI: 10.1007/s10554-014-0490-0.


