Роль микро-РНК при солидных опухолях
Автор: Федянин Михаил Юрьевич, Игнатова Екатерина Олеговна, Тюляндин Сергей Алексеевич
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Фундаментальная онкология и экспериментальная медицина
Статья в выпуске: 1 (5), 2013 года.
Бесплатный доступ
Последнее десятилетие сопровождается появлением большого количества исследований, посвященных роли малых, не кодирующих белок, молекул РНК (микро-РНК) в канцерогенезе и развитии резистентности к проводимой противоопухолевой терапии. Семейство генов микро-РНК составляет немногим более 1% от всего генома человека, но регулирует экспрессию почти трети всех генов на посттранскрипционном уровне. При нарастающем внимании специалистов к персонализированному подходу в лечении онкологических больных, внедрение знаний по ролимикро-РНК в клинику позволит в будущем индивидуализировать подход в лечении этого сложного контингента пациентов.В этом обзоре приводится информация о номенклатуре и механизмах образования микро-РНК, анализируется взаимосвязь между профилем экспрессии микро-РНК и фенотипом опухоли, а также обсуждается возможное применение микро-РНК в клинической практике.
Микро-рнк, факторы прогноза, предикторные факторы
Короткий адрес: https://sciup.org/14045443
IDR: 14045443
Текст научной статьи Роль микро-РНК при солидных опухолях
Последнее десятилетие сопровождается появлением большого количества исследований, посвященных роли малых, не кодирующих белок молекул РНК (микро-РНК) в канцерогенезе. Семейство генов микро-РНК составляет немногим более 1% от всего генома человека, но регулирует экспрессию почти трети всех генов на посттранскрипционном уровне, при этом являясь наиболее консервативным по последовательностям и механизмам экспрессии. Эти 21-нуклеотидные РНК участвуют в большом количестве генетических регуляторных механизмов вирусов, растений, животных и человека. Выявлена ключевая роль микро-РНК в нарушении баланса пролиферации, дифференцировки и программированной клеточной смерти при развитии различных заболеваний, в том числе онкологической патологии. Профиль микро-РНК зачастую различается между клетками различных тканей и опухолей, что в свою очередь может помочь определить органную принадлежность опухолей, предсказать ответ на терапию и определить прогноз течения болезни. В этом обзоре мы анализируем взаимосвязь между профилем экспрессии микро-РНК и фенотипом опухоли, а также обсуждаем возможное применение микро-РНК в клинической практике.
Механизм образования микро-РНК
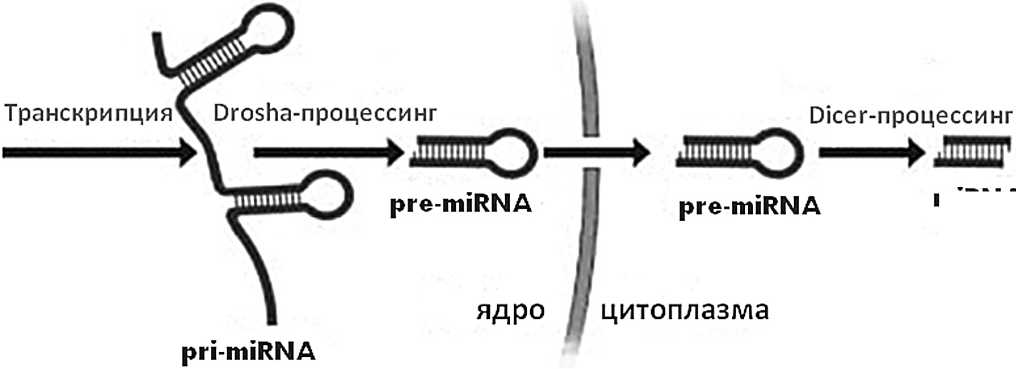
Путь образования микро-РНК (miRNA) начинается с транскрипции кодирующих генов с помощью РНК полимеразы II. Отмечено, что у млекопитающих более 90% микро-РНК кодируются нуклеотидными последовательностями, которые находятся в интронах (участках ДНК, являющихся частью генов, но не содержащих информации о последовательности аминокислот кодируемого им белка). Для сравнения, только 14% микро-РНК червей и мух кодируются генами, локализованными в интронах [2, 3]. Интрон, состоящий из 400 пар нуклеотидов, вырезается из первичного транскрипта и становится первичной микро-РНК (pri-miRNA). На следующем этапе pri-miRNA под действием РНКазы III, названной Drosha, совместно с другими факторами превращается в «шпильку» — последовательности длиной в 70 нуклеотидов, называющиеся pre-miRNA (рис. 1). При помощи экспортина-5 шпилькообразная pre-miRNA попадает в цитоплазму, где под действием другой РНКазы III, названной Dicer, pre-miRNA расщепляется на короткие фрагменты, которые трансформируются в зрелые микро-РНК [4]. В результате образуются двуцепочечные РНК-дуплексы. Эти 21-нуклео-тидные РНК вовлечены в разнообразные биологические процессы большинства форм жизни (вирусов, растений, животных и человека). В настоящее время описано более 4000 микроРНК в 168 видах организмов [5]. Гены этих некодирующих РНК, составляют более чем 1% от всего генома человека и, как считается, регулируют функцию трети всех генов [6].
Номенклатура микро-РНК
Номер микро-РНК присваивается в соответствии с их открытием. На вид организма, из которого выделена микро-РНК, в названии указывает приставка из 3-4 букв, например: hsa-miR-101 обозначает, что данная микро-РНК выделена из клеток Homo sapiens. Сформировавшиеся микро-РНК обозначаются «miR», тогда как их предшественники обозначаются «mir». Также в названии фигурирует информация о структурной взаимосвязи различных микро-РНК. Например, hsa-miR-101 у человека и mmu-miR-101 у мышей являются ортологами, то есть идентичны по структуре. Паралогические микро-РНК отличаются по одной или двум нуклеотидным последовательностям, что обозначается дополнительным суффиксом в названии (например, mmu-miR-10a и mmu-miR-10b у мышей). Один ген может давать начало нескольким предшественникам микро-РНК, которые будут различаться в названии цифровым суффиксом (например, dme-mir-281-1 и dme-mir-281-2 в Drosophila melanogaster). Название усложняется и в случае, если различные участки одного предшественника дают начало различным микро-РНК (miR-17-5p и miR-17-3p) [1].
Механизм действия микро-РНК
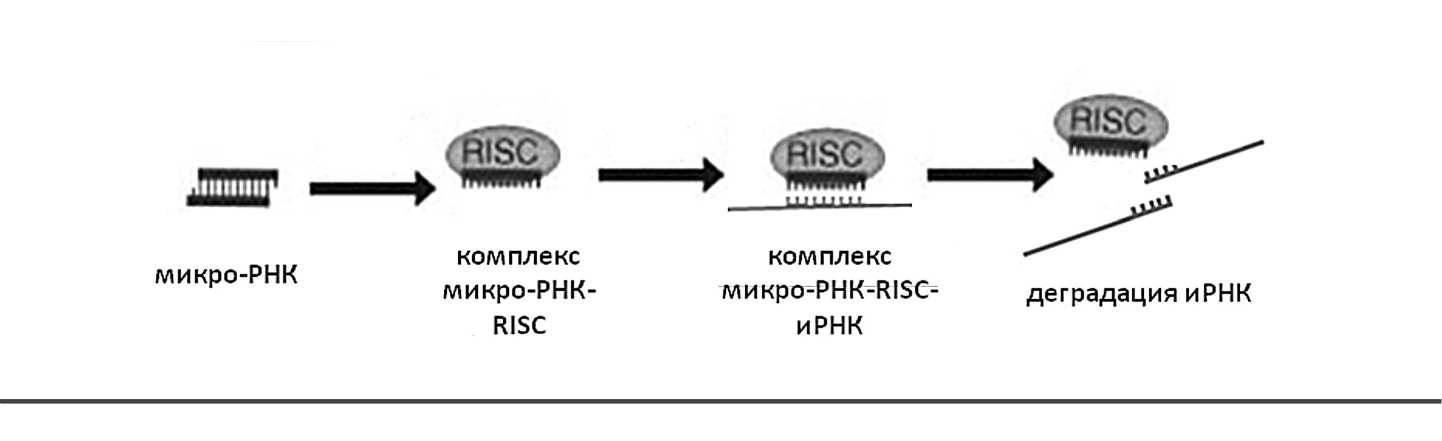
Микро-РНК регулируют экспрессию генов путем ингибирования трансляции или разрушения специфических транскриптов матричной РНК (мРНК). Посттранскрипционное подавле-
Рисунок 1. Образование микро-РНК
miRNA
Роль микро-РНК при солидных опухолях ние экспрессии генов начинается тогда, когда микро-РНК рекрутирует белковый комплекс RISC (RNA-induced silencing complex). Одна из цепей двухцепочечного дуплекса микро-РНК (ведущая цепь) внедряется в белковый комплекс RISC. Данная структура представляет собой комплекс белков, которые способствуют связи микро-РНК с 3’ — нетранслируемым концом соответствующей мРНК-мишени [4]. Микро-РНК приводят к разрушению мРНК или подавлению трансляции с таргетной мРНК (рис. 2). При этом они способны подавлять трансляцию посредством различных механизмов: как на этапе инициации, так и в процессе элонгации. Механизм прекращения трансляции также зависит от степени комплементарности связывающихся областей микро-РНК и мРНК. Деградация мРНК включает такие процессы, как деаденилирование, декапирование и экзонуклеарное расщепление молекулы мРНК [7]. Однако до конца механизм действия микро-РНК еще не изучен.
тации, так и метилирования генов, кодирующих микро-РНК [8]. Большинство этих генов локализуется в хрупких сайтах и участках генома, что и объясняет их частую делецию или амплификацию в клетках злокачественных опухолей. В основополагающем исследовании, проведенном группой Croce, было выявлено, что частая делеция участка хромосомы 13q14 в клетках хронического лимфолейкоза приводит к нарушению работы двух микро-РНК: микро-РНК-15a, микро-РНК-16-1 [9]. Эти микро-РНК представляют собой первые микро-РНК онкосупрессоры, которые были открыты при исследовании функций микро-РНК в канцерогенезе. В дальнейшем исследования показали, что нарушение экспрессии микро-РНК в опухолевых клетках является распространенным явлением по сравнению с клетками нормальных тканей [10]. Это определяет необходимость дальнейших исследований изменений, ведущих к формированию опухолевого фенотипа.
Рисунок 2. Механизм действия микро-РНКК
Роль микро-РНК при онкологической патологии
Микро-РНК в «здоровых» клетках являются одним из основных регуляторов экспрессии генов, принимающих участие практически во всех процессах ее жизнедеятельности, поведении, размножения и развития. Злокачественные опухоли характеризуются неконтролируемым делением клеток, фенотип которых определяется нарушением экспрессии различных генов. Поэтому неудивительно, что образование микро-РНК часто нарушено в клетках различных опухолей. Аберрантная экспрессия микро-РНК может являться результатом как му-
Классификация опухолей по профилю микро-РНК
Около 4% всех опухолей имеют неясную гистопринадлежность. В здоровом организме профиль экспрессии микро-РНК зачастую имеет тканеспецифичный характер, также он специфичен для фазы развития организма и уровня дифференцировки клеток [10]. Ряд исследований показал различия в экспрессии микро-РНК между опухолевыми и неизмененными клетками, при этом в опухоли сохраняется и экспрессия тканеспецифичных микро-РНК [10, 11]. Поэтому микро-РНК могут помочь в определении природы опухолей неясной ги- стопринадлежности. В одном из исследований образцы 336 первичных и метастатических опухолей были классифицированы по экспрессии 48 микро-РНК, что позволило при «слепом» пересмотре образцов опухолей с уже определенным гистологическим подтипом правильно определить тканевую принадлежность опухоли в 86% случаев, включая 76% метастатических опухолей [12].
Недавно предложена к применению новая классификационная система, основанная на анализе данных экспрессии микро-РНК с помощью вычислительных исследований, называемая SFSSClass [Simultaneous Feature (miRNA) and Sample (tissue) Selection] [13]. Авторы создали данную классификационную технику, основываясь на предшествующих исследованиях. Проведя анализ литературы, посвященной изучению микро-РНК в опухолевой ткани, исследователи смогли определить «модули» микро-РНК с наиболее часто измененной экспрессией в различных опухолях. Было идентифицировано около 100 тканеспецифичных микро-РНК. Авторы применили данный набор микро-РНК для определения органопринадлежности низкодифференцированных опухолей, показав ее более высокую точность в сравнении с использованием мРНК [14].
Таким образом, у микро-РНК имеется значительный потенциал для использования с целью выявления органной принадлежности низкодифференцированных опухолей и метастатических опухолей с невыявленным первичным очагом.
Микро-РНК при некоторых солидных опухолях
Принимая во внимание, что профили экспрессии микро-РНК различаются между клетками нормальных и опухолевых тканей, исследователи поставили вопрос о возможности определения различий между подтипами опухолей и их специфическими онкогенными свойствами по профилю экспрессии микроРНК. При проведении исследований отмечено, что профиль экспрессии микро-РНК связан с наличием или отсутствием специфических онкогенных мутаций. Обнаружились связи между нарушениями регуляции микро-РНК и мРНК-мишенями [15]. Все это позволяет распутать некоторые уникальные генные связи.
Рак молочной железы
Рак молочной железы традиционно классифицируется на 4 подтипа: базально-подобный, люминальный А, люминальный В и HER-2 позитивный. Данная классификация основана на различии в экспрессии генов. Выявлено, что ряд микро-РНК неодинаково экспрессируются при базальном и люминальном подтипе рака молочной железы [16]. Эстроген-рецеп-тор положительные опухоли, прогестерон-ре-цептор положительные опухоли и HER-2/neu-положительные опухоли также различаются профилем экспрессии микро-РНК [17-20].
Некоторые микро-РНК, которые ассоциированы с люминальным или базальным подтипом, отражают их эпителиальную и миоэпителиальную природу, соответственно. К примеру, изменения экспрессии микро-РНК-200 ассоциировано с люминальным подтипом [21].
Члены семейства микро-РНК-200 регулируют поддержание клеткой эпителиального фенотипа путем ингибирования цинковых пальцев генов ZEB1 и ZEB2, которые способствуют эпителиально-мезенхимальному переходу (ЭМП) — процессу, который определяет способность опухолевых клеток к метастазированию [21]. Низкие значения микро-РНК-200 при базально-подобном подтипе рака молочной железы могут явиться объяснением высокого метастатического потенциала таких опухолей [22]. Кроме этого, представители семейства микро-РНК-200 участвуют в негативной регуляции клеточной инвазии, которая обусловлена сигналами с рецептора эпидермального фактора роста. Поэтому низкая экспрессия микро-РНК-200 ассоциирована с высоким потенциалом опухолевых клеток к инвазии [23].
Также при тройном негативном раке молочной железы отмечается выраженное снижение экспрессии микро-РНК-145 [24]. Данная молекула преимущественно экспрессируется в нормальных миоэпителиальных клетках. Снижение экспрессии микро-РНК-145 определяется в гиперпластических протоках и является одной из причин структурной пере-
Роль микро-РНК при солидных опухолях стройки миоэпителиальной ткани молочной железы [25].
При введении микро-РНК-145 извне в культуру клеток рака молочной железы отмечается усиление апоптоза опухолевых клеток [26]. Также микро-РНК-145 может подавлять способность клетки к инвазии и метастазированию путем снижения посттранскрипционной экспрессии гена метастазирования — MUC-1 (муцин-1) [27].
Для опухолей молочной железы с метастазами в регионарные лимфоузлы или с высоким пролиферативным индексом характерно повышение экспрессии let-7, что позволяет выделить группу больных с неблагоприятным прогнозом [28]. Ген Let-7 дает начало большому семейству микро-РНК, является одной из первых открытых микро-РНК. Данная молекула участвует в регуляции функций генов ras и c-myc [46].
Таким образом, в будущем станет возможно с помощью небольшого набора микроРНК определять подтип рака молочной железы и, более того, предсказывать биологические свойства опухоли. Нужно отметить, что в настоящее время для этого необходимо знать профиль экспрессии сотен мРНК (матричных РНК), что еще более подчеркивает вероятную значимость предиктивных способностей микро-РНК по сравнению с мРНК.
Рак яичников
При раке яичников разными исследовательскими группами по изучению микроРНК получены отличные друг от друга результаты. В ряде исследований значимая роль при раке яичников отводилась семейству микро-РНК-200. Отмечено, что в клетках рака яичников микро-РНК-200а, микро-РНК-141, микро-РНК-200c и микро-РНК-200b гиперэк-спрессированы, тогда как экспрессия микро-РНК-199а, микро-РНК-140, микро-РНК-145 и микро-РНК-125b1 снижена относительно нормальной ткани яичника [29, 30] (таблица 1). Также выявлено, что вследствие гипометилирования в опухолевой ткани яичников отмечается повышение экспрессии таких микро-РНК, как микро-РНК-203, микро-РНК-205 и микроРНК-21 [29]. Микро-РНК-200а и микро-РНК-200с гиперэкспрессированы в трех гистоло- гических типах: серозном, эндометриоидном и светлоклеточном раке, тогда как повышение уровня микро-РНК200b и микро-РНК-141 характерно только для эндометриоидного и серозного гистотипов. Таким образом, авторы с помощью сигнатур микро-РНК предложили не только отличать рак яичников от нормальной ткани, но и дифференцировать светлоклеточный гистологический тип рака яичников от других подтипов [29]. Этими же авторами показано отсутствие различий профиля микроРНК между опухолями с различной степенью дифференцировки и стадией заболевания. Авторы сделали вывод, что изменение экспрессии микро-РНК играет роль в развитии рака яичников, но не в прогрессировании заболевания.
При раке яичников также отмечена гиперэкспрессия микро-РНК-214, которая, как считают, ассоциирована с резистентностью опухолевых клеток к цисплатину [31]. Более того, механизм действия микро-РНК-214 связан, вероятно, с подавлением трансляции белка PTEN, что приводит к активации Akt сигнального пути. Возможно, с помощью микро-РНК удастся пролить свет на развитие резистентности к препаратам платины у больных раком яичников.
В другом исследовании, проведенном в MSKCC, на архивном материале 62 больных раком яичников определяли сигнатуру микроРНК. В этой работе получены противоположные данные вышеописанным исследованиям. Не было выявлено гиперэкспрессии представителей семейства микро-РНК-200. С другой стороны, выделено 19 микро-РНК с повышенной экспрессией. Из них только 2 обладало значимым влиянием на выживаемость — микроРНК-410 и микро-РНК-645. Данный набор из 2 микро-РНК был валидирован на 123 больных. При многофакторном анализе обе микро-РНК оказывали влияние на продолжительность жизни независимо от стадии болезни, степени дифференцировки опухоли, возраста и объема циторедуктивной операции [32]. Медиана продолжительности жизни при высокой экспрессии данных микро-РНК составила 70 месяцев, при низкой экспрессии — 40 месяцев. При анализе возможных патогенетических мишеней для микро-РНК-410 и микро-РНК-645 наибольшее значение придается мРНК генов транскрипционного фактора NF- κ B и фермен-
Таблица 1. Микро-РНК при раке яичников
|
Микро-РНК |
Мишень — мРНК гена |
Клиническое значение |
Ссылка |
|
микро-РНК-200а микро-РНК-200b микро-РНК-200с микро-РНК-141 |
PTPN12 (для микро-РНК-200b) |
Ассоциирована с гистотипом опухоли |
29, 30 |
|
микро-РНК-214 |
PTEN |
Высокая экспрессия ассоциирована с резистентностью к химиотерапии |
31 |
|
микро-РНК-410 |
NF- κ B, HDAC1 |
Высокая экспрессия ассоциирована с низкой выживаемостью |
32 |
|
микро-РНК-645 |
NF- κ B, HDAC1 |
Высокая экспрессия ассоциирована с низкой выживаемостью |
32 |
та гистон-деацетилазы (HDAC1), участвующего в эпигенетической регуляции. Таким образом, сделано предположение, что микро-РНК семейства 200 участвуют в процессе канцерогенеза, тогда как микро-РНК-410 и микро-РНК-645, по-видимому, уже отражают биологический характер опухоли.
Другое интересное направление в микроРНК — определение сигнатур микро-РНК в эк-зосомах плазмы крови. Экзосомы и эндосомы — органеллы размером 50-100 нм, активно секретирующиеся путем экзоцитоза. Как считается, они играют важную роль в активации Т-лимфоцитов и, вероятно, обладают иммуносупрессивной функцией [33]. Одно из первых исследований, посвященных определению микроРНК в экзосомах, проводилось на образцах крови больных раком яичников. В сыворотке крови пациенток с различными стадиями рака яичников, а также в крови здоровых женщин и женщин с доброкачественными опухолями яичников определяли уровень циркулирующих экзосом. Было показано, что в сыворотке крови больных раком яичников концентрация экзосом была выше, чем у больных с доброкачественными опухолями и в группе здоровых женщин. Также отмечено, что женщины с более распространенными стадиями болезни имели и более высокие уровни циркулирующих в крови экзосом. Главной целью исследования явилось доказательство того, что микро-РНК, которые гиперэкспрессированы в опухоли, определяются и в циркулирующих в крови экзосомах. Исследователям удалось выявить, что из 218 микро-РНК, определяемых в опухолевой ткани 50 больных, уровень 175 микро-РНК достоверно не отличался от уровней микро-РНК в циркулирующих в крови экзосомах. Двенадцать микроРНК определялись в более низких концентрациях в экзосомах, а концентрация 31 микро-РНК была выше в экзосомах по сравнению с опухолевой тканью. Эти микро-РНК не были выявлены в группе контроля и определялись в значительно более низких концентрациях в экзосомах при доброкачественных опухолях яичников. Авторы не уточняют количество больных, у которых отмечалось совпадение по определенным микро-РНК, однако указывают, что наибольшая корреляция между уровнями микро-РНК в опухолевой клетке и в экзосомах была отмечена для 8 микро-РНК: микро-РНК-21, микро-РНК-141, микро-РНК-200a, микро-РНК-200b, микро-РНК-200c, микро-РНК-203, микро-РНК-205, и микроРНК-214 [34].
Авторы предложили использовать профиль экзосомальных микро-РНК для скрининга в выявлении бессимптомного рака яичников и в выявлении рецидива болезни. Несмотря на предварительный характер результатов исследования, данное сообщение дает надежду на выявление нового биомаркера при раке яичников.
Рак толстой кишки
В процессах канцерогенеза опухолей толстой кишки описано как усиление, так и подавление или полное прекращение экспрессии различных микро-РНК [35-38]. Schetter с коллегами выявили, что ряд микро-РНК (микро-РНК-106а, микро-РНК-181b и микро-
Роль микро-РНК при солидных опухолях
РНК-203) имеют более высокие показатели экспрессии в клетках рака толстой кишки в сравнении с неизмененной слизистой оболочки толстой кишки. Но нельзя однозначно утверждать, что данные изменения были ответственны за развитие опухоли, а не были просто ассоциированными с опухолью [39].
В одном из исследований была изучена роль микро-РНК-143 и микро-РНК-21 в 11 образцах аденокарцином толстой кишки и неизмененной слизистой оболочки толстой кишки от одних и тех же больных. Отмечено, что среди пациентов моложе 50 лет безотносительно к стадии заболевания чаще наблюдались более низкие показатели экспрессии микро-РНК-143. Тогда как для пациентов старше 50 лет и с более высокой степенью инвазии опухоли и метастазами в лимфоузлы были характерны более высокие уровни микро-РНК-21 [40]. С этого начались публикации большого количества работ, посвященных микро-РНК-21 при раке толстой кишки.
Ингибирование микро-РНК-21 приводит к снижению пролиферации клеток рака толстой кишки, что сопровождалось подавлением экспрессии антиапоптотического гена Bcl-2. Интересно, что при аденомах также отмечена гиперэкспрессия микро-РНК-21 в сравнении с клетками прилегающей неизмененной слизистой [41, 42]. С помощью ПЦР анализа определялся уровень экспрессии микро-РНК-21 в 60 образцах рака толстой кишки и 40 образцах нормальной ткани. Выявлено, что повышенный уровень экспрессии микро-РНК-21 в опухоли был ассоциирован с более низкими показателями общей выживаемости (р=0,043) [44]. Ранее в предклинических работах сообщалось, что более высокая экспрессия микро-РНК-21 была связана с такими признаками опухоли, как высокий потенциал инвазии, способность к интравазации и метастазированию [45]. Также выявлено, что при воздействии антисмысловых последовательностей микроРНК-21, подавляющих ее функционирование, пролиферация в клеточных линиях рака толстой кишки с подавлением экспрессии р53 и в линиях, клетки которых экспрессируют мутантный тип р53, не изменялась. В клетках с диким типом р53 наблюдалось снижение пролиферации на 20% после трансфекции антисмысловых последовательностей микроРНК-21 [44].
В другом исследовании авторы показали, что уровень экспрессии микро-РНК-21 в строме опухоли повышается с увеличением стадии заболевания. Отмечено, что при высоких значениях микро-РНК-21 в строме опухоли продолжительность жизни больных раком толстой кишки меньше. Исследователям удалось выделить микро-РНК-21 из парафиновых блоков тканей опухоли 187 больных раком толстой кишки 2 стадии (130 — ободочная кишка, 67 — прямая кишка). В течение 5 лет у 63 пациентов было зарегистрировано прогрессирование болезни. Отмечена статистически значимая обратная взаимосвязь между экспрессией микро-РНК-21 и временем до прогрессирования (р<0,01) среди больных раком ободочной кишки, но не раком прямой кишки. По данным многофакторного анализа, данное влияние экспрессии микро-РНК-21 на время до прогрессирования оказалось независимо от других клинических параметров (возраста, пола, общего числа лейкоцитов, статуса гена KRAS и микро-сателлитной нестабильности). Таким образом, авторам с помощью определения экспрессии микро-РНК-21 в строме опухоли удалось выявить подгруппу пациентов со 2 стадией рака ободочной кишки, которые имели неблагоприятный прогноз течения болезни [43].
Таким образом, уровень микро-РНК-21 как в опухолевых клетках, так и в строме опухоли можно рассматривать как потенциальный прогностический биомаркер, позволяющий определить неблагоприятный прогноз у пациентов с диссеминированным раком толстой кишки.
Другой интересной микро-РНК при раке толстой кишки является микро-РНК-106а. Выявлено, что снижение уровня микро-РНК-106а ассоциировано с более низкими показателями времени до прогрессирования и продолжительности жизни больных раком толстой кишки, а также и со стадией заболевания. Микро-РНК-106а действует как опухолевый супрессор, поэтому обратно коррелирует с уровнем экспрессии онкогена E2F1. Снижение уровня микро-РНК-106а ассоциировано с более короткой продолжительностью жиз-ни[45]. Это наблюдение позволяет сделать вывод о возможном использовании определения микро-РНК-106а в качестве прогностического маркера при раке толстой кишки.
Выявлено, что при различных мутациях генов в опухолевых клетках меняется и профиль экспрессии микро-РНК. Так для клеток рака толстой кишки с мутацией генов KRAS и/или BRAF характерно повышение экспрессии таких микро-РНК, как микро-РНК-31, микро-РНК-96, микро-РНК-135 [46]. Роль этих и других микро-РНК при раке толстой кишки представлена в таблице 2.
Большое клиническое значение отводится возможности прогнозирования ответа на специфическое лечение. Ряд микро-РНК коррелируют с негативным ответом на специфическое лечение. В различных опухолях экспрессия микро-РНК-21 является индикатором неблагоприятного прогноза [53, 54] и также ассоциирована с плохим ответом на адъювантную терапию при аденокарциномах [42]. Высокие уровни микро-РНК-125b при раке молочной железы предсказывают отсутствие ответа клеточных линий опухоли при применении так-санов [56]. Аналогичные сообщения представлены и в отношении микро-РНК-21 при раке поджелудочной железы и чувствительностью опухоли к гемцитабину [57].
Эти находки подчеркивают важность этого альтернативного направления в изучении развития резистентности к различным препаратам.
Микро-РНК и лечение
Разработаны различные подходы к применению микро-РНК в терапии опухолей. Первый путь — комбинация стандартной терапии с препаратами, влияющими на экспрессию микро-РНК. К примеру, экспрессия микроРНК-21 в гемцитабин-резистентных клетках рака поджелудочной железы может уменьшаться под действием аналогов куркумина, приводя к реактивации гена PTEN, являющегося опухолевым супрессором [58]. Также авторы отмечают повышение экспрессии микро-РНК-200с при обработке культуры гемцитабин-ре-зистентных клеток аналогами куркумина, что, возможно, приводит к обратной эпителиальномезенхимальной трансформации. Это, по мнению авторов, может сопровождаться возвра-
Таблица 2. Некоторые микро-РНК при раке толстой кишки
|
Ми-РНК |
Экспрессия микро-РНК |
Мишень — мРНК гена |
Биологическое и клиническое значение |
Ссылка |
|
микро-РНК-21 |
Повышена |
Bcl-2, TIMP, PDCD4 |
Ассоциировано с высокой стадией, N+, M1, низкой ОВ, клеточной пролиферацией, васкуляризацией опухоли |
42, 44 |
|
Let-7 |
Снижена |
RAS, c-myc |
Повышение клеточной пролиферации |
46 |
|
Let-7 g* |
Повышена |
TGFR-2, RAS, cyclin-D, cytochrome c |
Повышение клеточной пролиферации и подавление апоптоза |
47, 48 |
|
микро-РНК-125b |
Повышена |
VEFG, VEGFR, IGFR-1 |
Снижение клеточной пролиферации и ангиогенеза, но ассоциирована с резистентностью к терапии |
49 |
|
микро-РНК-137 |
Повышена |
TGF2I |
Поддержание опухолевого фенотипа |
49 |
|
микро-РНК-34а |
Снижена |
E2F, p53 |
Ингибирование клеточного роста |
50 |
|
микро-РНК-106а |
Снижена |
E2F |
Ассоциировано с более высокой стадией, снижением ВДП и ОВ |
45, 51 |
*Let-7 g — представитель семейства микро-РНК let-7, ОВ — общая выживаемость, ВДП- время до прогрессирования.
Роль микро-РНК при солидных опухолях щением чувствительности к гемцитабину [59]. Таким образом, комбинация стандартной терапии с препаратами, влияющими на экспрессию микро-РНК, может быть эффективной стратегией при лечении злокачественных опухолей.
Второе направление — применение антисмысловых последовательностей микро-РНК (анти-микро-РНК). Антисмысловая последовательность — короткая однонитевая последовательность нуклеотидов, комплементарная молекуле микро-РНК. После связывания с нуклеотидной последовательностью микроРНК последняя не может распознавать свою мишень — мРНК, в результате чего возобновляется синтез белка с мРНК-мишени. Первое сообщение о терапевтическом применении антисмысловых микро-РНК появилось в начале 2008 года [60]. Анти-микро-РНК, конъюгированные с холестеролом, обладают способностью ингибировать микро-РНК in vivo в организмах мышей. Введение таких антисмысловых олигонуклеотидов эффективно ингибирует зрелые микро-РНК в печени в течение 23 дней. Ингибирование микро-РНК-21 и микро-РНК-200b привело к увеличению чувствительности клеток холангиоцеллюлярного рака к гемцитабину, а снижение экспрессии микро-РНК-141 — к подавлению клеточного роста [61]. В другом исследовании введение антисмысловых последовательностей микроРНК-16 (часто экспрессирована при различных опухолях) приводит к полному исчезновению микро-РНК-16 во всех тканях у мышей, за исключением головного мозга [62].
Третий путь применения микро-РНК в терапии опухолей — использование самих микро-РНК для подавления опухолевого роста. Scott с соавторами удалось снизить инвазию и миграцию клеток рака молочной железы с помощью микро-РНК-125 [63].
Четвертым путем воздействия на экспрессию микро-РНК может служить применение других эпигенетических механизмов — модификация гистонов или метилирование ДНК. Так, при раке яичников гипометилирование ДНК ответственно за гиперэкспрессию микроРНК-21, микро-РНК-203 и микро-РНК-205 [29]. В будущем такие препараты, как ингибиторы деацетилазы гистонов и деметилирующие агенты, могут быть применены для восстановления экспрессии соответствующих микро-
РНК, что приведет к реверсии опухолевого фенотипа в фенотип нормальной клетки.
Таким образом, перед онкологами открывается большое перспективное направление в терапии онкологических заболеваний.
Перспективы и ограничение применения микро-РНК в онкологии
Доказана возможность первичной идентификации микро-РНК с помощью определения широкого спектра профиля экспрессии генов. Этот подход значительно упростился в результате внедрения таких новых методов, как микрочипирование микро-РНК, высокоэффективное глубокое секвенирование и цитофлуориметри-ческий анализ с сортировкой клеток на бусах [64, 65]. С помощью данных методов расширился спектр микро-РНК, выявляемых в опухолевых клетках. Таким образом, для расшифровки сложной сети взаимосвязей патогенетических путей в опухолевых клетках рекомендуется совместное определение профиля экспрессии генов микро-РНК и мРНК параллельно с изучением модели экспрессии транскрипционных факторов [67]. Тем не менее, среди различных методов генетической диагностики применение методов по определению сигнатур микро-РНК имеет ряд преимуществ над методами по определению профилей экспрессии традиционной мРНК, так как стабильность образцов с микроРНК выше, чем мРНК [66].
Несмотря на все преимущества применения микро-РНК в клинической практике, в настоящий момент имеются следующие ограничения. Так, Blenkiron с соавторами сообщили о низком соответствии результатов своих исследований по взаимоотношению экспрессии микро-РНК и цитоморфологических факторов с результатами предшествующих исследований [17]. Такие различия обычно обусловлены особенностями опухолевого материала или методов подготовки препарата, дизайном эксперимента и/или анализом данных [68]. Кроме этого, использование различных методов для нормализации данных может объяснять некоторую вариабельность в результатах различных исследований [69]. Другим объяснением таких несоответствий между исследовательскими группами может являть- ся возможность быстрого изменения уровня микро-РНК при стрессе и гипоксии [70, 71], так как время взятия и транспортировки материала могут влиять на уровень микро-РНК.
Использование микро-РНК в качестве биомаркера, который способен предсказывать риск развития рака, является еще более значимым, так как в настоящее время таких известных маркеров очень мало. Некоторые исследователи сообщили, что уровень экспрессии некоторых микро-РНК может отличаться между представителями различных этнических групп и при различных опухолях [72]. Поэтому рекомендуется валидировать, полученные данные об экспрессии микро-РНК на больных со сходными характеристиками.
Тем не менее, результаты недавних исследований вселяют оптимизм. И в настоящее время первичной целью является всесторонняя валидация полученных результатов и унификация методов выделения микро-РНК, что позволит внедрить анализ микро-РНК в диагностику и лечение онкологических заболеваний.
Список литературы Роль микро-РНК при солидных опухолях
- Ambros V., Bartel B., Bartel D. P. et al. A uniform system for microRNA annotation. RNA. -2003, 9: 277-279
- Rodriguez A., Griffiths-Jones S., Ashurst J. L. et al. Identification of mammalian microRNA host genes and transcription units. Genome Res. -2004, 14, 1902-1910
- Kim Y. K., Kim V. N. Processing of intronic microRNAs, EMBO J. -2007, 26, 775-783
- Kutter C., Svoboda P. Meeting report: miRNA, siRNA, piRNA. Knowns of the unknown. RNA Biology; October/November/December. -2008, 5:4, 181-188
- http://www.mirbase.org
- Hatfield S., Ruohola-Baker H. MicroRNA and stem cell function. Cell Tissue Res. -2008, 331, 57-66
- Wu L., Fan J., Belasco J. G. MicroRNAs direct rapid deadenylation of mRNA, Proc. Natl. Acad. Sci. USA. -2006, 103, 4034-4039
- Lujambio A., Calin G. A., Villanueva A. et al. A micro RNA DNA methylation signature for human cancer metastasis. Proc. Natl. Acad. Sci. U. S.A. -2008, 105, 13556-13561
- Calin G. A., Dumitru C. D., Shimizu M. et al. Frequent deletions and down-regulation of micro-RNA genes miR15 and miR16 at 13q14 in chronic lymphocytic leukemia. Proc. Natl. Acad. Sci. U. S.A. -2002, 99, 15524-15529
- Lu J., Getz G., Miska E. A. et al. MicroRNA expression profiles classify human cancers. Nature. -2005, 435, 834-838
- Volinia S., Calin G. A., Liu C. G. et al. A micro RNA expression signature of human solid tumors defines cancer gene targets. Proc. Natl. Acad. Sci. U. S.A. -2006, 103, 2257-2261
- Rosenfeld N., Aharonov R., Meiri E. et al. MicroRNAs accurately identify cancer tissue origin. Nat. Biotechnol. -2008, 26, 462-469
- Mitra R., Bandyopadhyay S., Maulik U., Zhang M. Q. et al. SFSS Class: an integrated approach for miRNA based tumor classification. BMC Bioinform. -2010, 11 (Suppl.1), S22
- Bandyopadhyay S., Mitra R., Maulik U., Zhang M. Q. et al. Development of the human cancer microRNA network. Silence. -2010, 1, 6
- O’Day,E.and Lal,A. MicroRNAs and their target gene networks in breast cancer. Breast Cancer Res. -2010, 12, 201
- Sotiriou C.and Pusztai L. Gene-expression signatures in breast cancer. N. Engl. J. Med. -2009, 360, 790-800
- Blenkiron C., Goldstein L. D., Thorne N. P. et al. MicroRNA expression profiling of human breast cancer identifies new markers of tumor subtype. Genome Biol. -2007, 8, R214
- Mattie M. D., Benz C. C., Bowers J. et al. Optimized high-throughput microRNA expression profiling provides novel biomarker assessment of clinical prostate and breast cancer biopsies. Mol. Cancer. -2006, 5, 24
- Lowery A. J., Miller N., Devaney A. et al. MicroRNA signatures predict oestrogen receptor, progesterone receptor and HER2/neu receptor status in breast cancer. Breast Cancer Res. -2009, 11, R27
- Iorio M. V., Ferracin M., Liu C. G. et al. MicroRNA gene expression deregulation in human breast cancer. Cancer Res. -2005, 65, 7065-7070
- Park S. M., Gaur A. B., Lengyelet E. et al. The miR-200 family determines the epithelial phenotype of cancer cells by targeting the E-cadherin repressors ZEB1 and ZEB2. Genes Dev. -2008, 22, 894-907
- Baffa R., Fassan M., Volinia S. et al. MicroRNA expression profiling of human metastatic cancers identifies cancer gene targets. J. Pathol. -2009, 219, 214-221
- Uhlmann S., Zhang J. D., Schw ger A. et al. miR-200bc/429 cluster targets PLC gamma1 and differentially regulates proliferation and EGF-driven invasion than miR-200a/141 in breast cancer. Oncogene. -2010, 29, 4297-4306
- Sachdeva M. and Mo Y. Y. miR-145-mediated suppression of cell growth, invasion and metastasis. Am. J. Transl. Res. -2010, 2, 170-180
- Sempere L. F., Christensen M., Silahtaroglu A. et al. Altered microRNA expression confined to specific epithelial cell Роль микро-РНК при солидных опухолях subpopulations in breast cancer. Cancer Res. -2007, 67, 11612-11620
- Spizzo R., Nicoloso M. S., Lupini L. et al. miR-145 participates with TP53 in a death-promoting regulatory loop and targets estrogen receptor-alpha in human breast cancer cells. Cell Death Differ. -2010, 17, 246-254
- Sachdeva M. and Mo Y. Y. MicroRNA-145 suppresses cell invasion and metastasis by directly targeting mucin 1. Cancer Res. -2010, 70, 378-387
- Yu F., Yao H., Zhu P. et al. Let-7 regulates self renewal and tumorigenicity of breast cancer cells. Cell. -2007, 131, 1109-1123
- Iorio M. V., Visone R., Di Leva G. et al. MicroRNA signatures in human ovarian cancer. Cancer Res Sep, 15. -2007; 67 (18): 8699-707
- Hu X., Macdonald D. M., Huettner P. C. et al. A miR-200 microRNA cluster as prognostic marker in advanced ovarian cancer. Gynecol Oncol Sep. -2009;114 (3):457-64
- Yang H., KongW., He L. et al. MicroRNA expression profiling in human ovarian cancer: miR-214 induces cell survival and cisplatin resistance by targeting PTEN. Cancer Res. -2008; 68: 425-33
- Shih K. K., Qin L. X., Tanner E. J. et al. A microRNA survival signature (MiSS) for advanced ovarian cancer, Gynecol Oncol. 121 (2011) 444-450
- Mathivanan S., Ji H., Simpson.R. J. et al. Exosomes: Extracellular organelles important in intercellular communication. Journal of Proteomics. 73 (2010), 1907-1920
- Taylor D. D., Gercel-Taylor C. MicroRNA signatures of tumor-derived exosomes as diagnostic biomarkers of ovarian cancer. Gyn Oncol. -2008; 110: 13-21
- Aslam M. I., Taylor K., Pringle J. H., Jameson J. S. MicroRNAs are novel biomarkers of colorectal cancer. Br J Surg. -2009; 96: 702-10
- Slaby O., Svoboda M., Fabian P. et al. Altered expression of miR-21, miR-31, miR-143 and miR-145 is related to clinicopathologic features of colorectal cancer. Oncology. -2007; 72: 397-402
- Faber C., Kirchner T., Hlubek F. The impact of microRNAs on colorectal cancer. Virchows Arch. -2009; 454: 359-67
- Tang J. T., Fang J. Y. MicroRNA regulatory network in human colorectal cancer. Mini Rev Med Chem. -2009; 9: 921-6
- Schetter A. J., Harris C. C. Plasma microRNAs: a potential biomarker for colorectal cancer? Gut. -2009; 58: 1318-9
- Biscaglia G., Panza A., Gentile A. M. et al. Role of microRNA in the pathogenesis of colorectal cancer: possible involvement of miRNA-143 and miRNA-21. Abstracts/Digestive and Liver Disease 41S (2009), S1 -S167
- Rossi S., Kopetz S., Davuluri R. et al. MicroRNAs, ultraconserved genes and colorectal cancers. Int J Biochem Cell Biol. -2010 Aug;42 (8):1291-7
- Schetter A. J., Leung S. Y., Sohn J. J. et al. MicroRNA expression profiles associated with prognosis and therapeutic outcome in colon adenocarcinoma. Jama. -2008; 299: 425-36
- Nielsen B. S., Jorgensen S., Fog J. et al. MicroRNA-21 is expressed in stroma of colorectal cancers and high levels identified by image analysis predict short disease-free survival in stage II colon cancer patients. EJC supplements 8, no. 5 (2010) 5-81
- Slaby O., Hrstka R., Sobkova K. et al. Knockdown of oncogenic microRNA-21 displays cytotoxicity in p53 wild-type colon cancer cells. 07 July 2008 abs. 306, p.78
- Slaby O., Svoboda M., Fabian P. et al. Altered expression of miR-21, miR-31, miR-143 and miR-145 is related to clinicopathologic features of colorectal cancer. Oncology. -2007; 72: 397-402
- Akao Y., Nakagawa Y., Naoe T. let-7 microRNA functions as a potential growth suppressor in human colon cancer cells. Biol Pharm Bull. -2006; 29: 903-6
- Xi Y., Shalgi R., Fodstad O., Pilpel Y., Ju J. Differentially regulated micro-RNAs and actively translated messenger RNA transcripts by tumor suppressor p53 in colon cancer. Clin Cancer Res. -2006; 12: 2014-24
- Nakajima G., Hayashi K., Xi Y. et al. Non-coding MicroRNAs hsa-let-7 g and hsa-miR-181b are associated with chemoresponse to S-1 in colon cancer. Cancer Genomics Proteomics. -2006; 3: 317-24
- Svoboda M., Izakovicova Holla L., Sefr R. et al. Micro-RNAs miR125b and miR137 are frequently upregulated in response to capecitabine chemoradiotherapy of rectal cancer. Int J Oncol. -2008; 33: 541-7
- Tazawa H., Tsuchiya N., Izumiya M., Nakagama H. Tumor-suppressive miR-34a induces senescence-like growth arrest through modulation of the E2F pathway in human colon cancer cells. Proc Natl Acad Sci USA. -2007; 104: 15472-7
- Diaz R., Silva J., Garcia J. M. et al. Deregulated expression of miR-106a predicts survival in human colon cancer patients. Genes Chromosomes Cancer. -2008; 47: 794-802
- Li X., Zhang Y., Zhang Y. et al. Survival prediction of gastric cancer by a seven-microRNA signature. Gut. -2010, 59, 579-585
- Caramuta S., Egyhzi S., Rodolfo M. et al. MicroRNA expression profiles associated with mutational status and survival in malignant melanoma. J. Invest. Dermatol. -2010, 130, 2062-2070
- Rossi S., Shimizu M., Barbarotto E. et al. microRNA fingerprinting of CLL patients with chromosome 17p deletion identify a miR-21 score that stratifies early survival. Blood. -2010, 116, 945-952
- Dillhoff M., Liu J., Frankel W., Croce C. et al. MicroRNA-21 is overexpressed in pancreatic cancer and a potential predictor of survival. J. Gastrointest. Surg. -2008, 12, 2171-2176
- Zhou M., Liu Z., Zhao Y. et al. MicroRNA-125b confers the resistance of breast cancer cells to paclitaxel through suppression of pro-apoptotic Bcl-2 antagonist killer1 (Bak1) expression. J. Biol. Chem. -2010, 285, 21496-21507
- Giovannetti E., Funel N., Peters G. J. et al. MicroRNA-21 in pancreatic cancer: correlation with clinical outcome and pharmacologic aspects underlying its role in the modulation of gemcitabine activity. Cancer Res. -2010. 70, 4528-4538
- Ali A., Ahmad A., Banerjee S. et al. Gemcitabine sensitivity can be induced in pancreatic cancer cells through modulation of miR-200 and miR-21 expression by curcumin or its analogue CDF. Cancer Res. -2010, 70, 3606
- Yu J., Ohuchida K., Mizumoto K. et al. MicroRNA, hsa-miR-200c, is an independent prognostic factor in pancreatic cancer and its upregulation inhibits pancreatic cancer invasion but increases cell proliferation. Mol. Cancer. -2010, 9, 169
- Elm n J., Lindow M., Schtz S., et al. LNA mediated microRNA silencing in non-human primates. Nature. -2008; 452: 896-9
- Meng F., Henson R., Lang M. et al. Involvement of human microRNA in growth and response to chemotherapy in human cholangiocarcinoma cell lines. Gastroenterolgoy. -2006; 130: 2113
- Krutzfeldt J., Rajewsky N., Braich R. et al. Silencing of microRNAs in vivo with ‘antagomirs’. Nature. -2005, 438: 685-689
- Scott G. K., Goga A., Bhaumik D. et al. Coordinate suppression of ERBB2 and ERBB3 by enforced expression of micro-RNA miR-125 or miR-125b. J Biol Chem. -2007; 282: 1479
- Liu C. G., Calin G. A., Meloon B. et al. An oligonucleotide microchip for genome-wide microRNA profiling in human and mouse tissues. Proc. Natl.Acad. Sci. U. S.A. -2004, 101, 9740-9744
- Margulies M., Egholm M., Altman W. E. et al. Genome sequencing in microfabricated high-density picolitre reactors. Nature. -2005, 437, 376-380
- Jung M., Schaefer A., Steiner I. et al. Robust microRNA stability in degraded RNA preparations from human tissue and cell samples. Clin. Chem. -2010, 56, 998-1006
- Chan E., Vez Prado D. E. and Weidhaas J. B. Cancer microRNAs: From subtype profiling to predictors of response to therapy. Trends in Molecular Medicine. Volume 17, Issue 5, 235-243, 28 February. -2011
- Xu J. Z. and Wong C. W. Hunting for robust gene signature from cancer profiling data: sources of variability, different interpretations, and recent methodological developments. Cancer Lett. -2010, 296, 9-16
- Peltier H. J. and Latham G. J. Normalization of microRNA expression levels in quantitative RT-PCR assays: identification of suitable reference RNA targets in normal and cancerous human solid tissues. RNA. -2008, 14, 844-852
- Marsit C. J., Eddy K. and Kelsey K. T. MicroRNA responses to cellular stress. Cancer Res. -2006, 66, 10843-10848
- Kulshreshtha R., Ferracin M., Wojcik S. E. et al. A microRNA signature of hypoxia. Mol. Cell. Biol. -2007, 27, 1859-1867
- Yazici H., Terry M. B., Cho Y. H. et al. Investigation of the miR16-1 (C > T) +7 substitutionins even different types of cancer from three ethnic groups. Journal of Oncology. Volume 2009, Article ID 827532, 4 p


