Роль митохондрий в патогенезе "сложного" раневого процесса
Автор: Супильников А.А., Ледовских Е.А., Джамалова Н.М., Трусова Л.А., Старостина А.А., Юнусов Р.Р., Яремин Б.И.
Журнал: Вестник медицинского института "РЕАВИЗ": реабилитация, врач и здоровье @vestnik-reaviz
Рубрика: Клиническая медицина
Статья в выпуске: 5 (59), 2022 года.
Бесплатный доступ
Заживление ран - это сложный биологический процесс, в который входят различные клетки, медиаторы и компоненты внеклеточного матрикса, участвующие в процессах коагуляции, воспаления, ангиогенеза, реэпителизации, и фиброплазии. Заживление ран описывается четырьмя взаимосвязанными фазами: гемостаз, воспаление, пролиферация и ремоделирование. Каждая из фаз имеет свою роль на молекулярном и тканевом уровнях, и при возникновении дефекта в цепи одной из фаз раневого процесса нарушается процесс заживления, и возникает состояние хронической раны. Происходит это под влиянием различных факторов, таких как инфекции, нарушение артериального и венозного кровообращения, диабет 2 типа и хроническое воспаление. Длительно незаживающие раны представляют актуальную проблему современной медицины. В патогенезе хронических ран важнейшую роль играет окислительный стресс. В данном обзоре рассматривается патогенез хронических ран и участия в нём активных форм кислорода (АФК), окислительного стресса, роли митохондрий в генерации АФК, а также перспективы применения митохондриально-направленных антиоксидантов в лечении хронических ран.
Митохондрия, раневой процесс, антиоксиданты, лечение ран
Короткий адрес: https://sciup.org/143179580
IDR: 143179580 | УДК: 576.311.347: | DOI: 10.20340/vmi-rvz.2022.5.CLIN.2
Текст научной статьи Роль митохондрий в патогенезе "сложного" раневого процесса
УДК 576.311.347: 617-001.4(035)
Cite as: Supilnikov A.A., Ledovskikh E.A., Dzhamalova N.M., Trusova L.A., Starostina A.A., Yunusov R.R., Yaremin B.I. The role of mitochondria in the pathogenesis of the "complex" wound process. Bulletin of the Medical Institute “REAVIZ”. Rehabilitation, Doctor and Health. 2022;12(5):28-36.

Заживление ран происходит в четыре перекрывающихся фазы: гемостаз, воспаление, пролиферация и ремоделирование.
Фаза гемостаза начинается сразу после травмы и разделяется на первичную – тромбоцитарно-сосудистую реакцию, реализующуюся за счёт сокращения стенок кровеносных сосудов и образования первичного тромбоцитарного тромба, и вторичную – свёртывание крови, которая происходит за счёт клеток крови, а также плазменных ферментных систем (свёртывающей, фибринолитической, калликреин-кининовой и др.). Повреждение эндотелия обнажает белки субэндотелиального матрикса, а также способствует выделению из сосудистой стенки АДФ, катехоламинов (адреналин, норадреналин), серотонина, тромбоксана А2, ФАТ, которые в свою очередь стимулируют адгезию и агрегацию тромбоцитов к участку повреждения. Впоследствии тромбин запускает активацию тромбоцитов, и под действием сократительных белков происходит их дегрануляция, в итоге стимуляторы агрегации выделяют уже сами тромбоциты. В процессе дегрануляции происходит высвобождение a-гранул, из которых секретируются b-тромбоглобулин, тромбоцитарный фактор 4, фактор Виллебранда и фактор роста тромбоцитов (PDGF), плотных гранул, из которых образуется адреналин, серотонин и АДФ, и пероксисом и лизосом, из которых образуются ферменты протеазы и кислые гидролазы. Под действием хемотаксических факторов, таких как фактор роста тромбоцитов (PDGF), фактор роста сосудистого эндотелия (VEGF), фактор роста кератиноцитов (KGF), основного фактора роста фибробластов (bFGF) и трансформирующий фактор роста-b (TGF-b), которые продуцируют тромбоциты, происходит миграция нейтрофилов, макрофагов, фибробластов, керати-ноцитов и гладкомышечных клеток, которые необходимы для последующих фаз нормального заживления раны. В ходе агрегации новых тромбоцитов, под действием плазменной системы свертывания крови, формируется фибриновый тромб, в состав которого входят фибрин, фибронектин, витронектин, тромбоспондин и фактор Виллебранда. Фибриновый тромб служит не только для предотвращения кровотечения и защиты от инфицирования раны, но также действует как матрица для поступающих иммунных клеток, цитокинов и факторов роста [1, 29].
Воспалительная фаза начинается с инфильтрации раны полиморфноядерными лейкоцитами, в основном нейтрофилами. Эти клетки мигрируют в область раны благодаря тромбоцитам, хемотаксическим факторам (трансформирующий фактор роста TGF-b), белку системы комплемента C5a, формилметионилу. Гранулоциты используют протеолитические ферменты, такие как металлопротеиназы (ММП) (эластазу и коллагеназу) и сериновые протеазы для расщепления белков матрикса и миграции во внеклеточное пространство, где они фагоцитируют бактерии и генерируют активные формы кислорода АФК. После исполнения основной функции нейтрофилов – предотвращения инфицирования, в рану мигрируют моноцины, которые впоследствии дифференцируются в макрофаги. В позднюю фазу воспаления макрофаги имеют наиболее важное значение, поскольку помимо фагоцитоза они способны высвобождать АФК, продуцировать цитокины и факторы роста, стимулируя образование грануляционной ткани и ангиогенез, необходимые для пролиферативной фазы заживления ран. Факторы роста макрофагов включают: фактор роста тромбоцитов (PDGF), трансформирующий фактор роста-b (TGF-b), фактор роста сосудистого эндотелия (VEGF), цитокины: интерлейкин-1, интерлейкин-6 и фактор некроза опухоли α (TNF α ). Завершающий этап воспаления характеризуется появлением лимфоцитов, которые могут быть привлечены интерлейкином-1 и IgG, и которые также участвуют в ремоделирование коллагена и внеклеточного матрикса [1].
Пролиферативная фаза включает в себя: фиброплазию, грануляцию, эпителизацию и ангиогенез. В эту фазу происходит регенерация клеточных структур внутри раны, идет пролиферация фибробластов с замещением фибринового матрикса на грануляционную ткань, активация керати-ноцитов под действием фактора роста кератиноци-тов (KGF) и эпидермального фактора роста (EGF), которые обеспечивают процесс эпителизации. Фибробласты синтезируют компоненты внеклеточного матрикса: белки внеклеточного матрикса, коллаген I и III типов, эластин, матриксные металлопротеиназы (ММП), которые, разрушая фибриновый тромб, обеспечивают движение фибробластов к месту регенерации, и гликозаминогликаны (хондроитин сульфат, гиалуроновая кислота и дерматансульфат и протеогликаны). Фибробласты также выделяют цитокины и факторы роста (трансформирующий фактор роста-b (TGF-b)), стимулирующие кератиноциты к синтезу компонентов базальной мембраны: коллагена IV и VII типов, ламинина-5, перликана. Ангиогенез запускается гипоксией и происходит на всех этапах заживления ран, трансформирующий фактор роста-b (TGF-b) и фактор роста тромбоцитов (PDGF) секретируемыми тромбоцитами во время фазы гемостаза и макрофагами во время воспаления, привлекают гранулоциты и макрофаги, которые в свою очередь продуцируют фактор некроза опухоли α (TNF α), стимулируя ангиогенез. Также ангиогенезу способствует сосудистый эндотелиальный фактор роста (VEGF), который индуцирует гладкомышечные и эндотелиальные клетки к месту пролиферации [1, 4, 29].
С началом развития грануляционной ткани начинается фаза ремоделирования : переход от грануляционной к рубцовой ткани. Эта фаза характеризуется появлением фибронектина и гиалуронана, снижением клеточности, утолщением пучков коллагеновых волокон, замещением коллагена III типа коллагеном I типа, что увеличивает прочность соединение краев раны и обеспечивает образование более прочного рубца. Процесс ремоделирования почти полностью контролируется активностью матриксных металлопротеиназ (ММП) и их ингибиторов (тканевые ингибиторы металлопротеиназ, ТИМП). Основным типом клеток, ответственным за ремоделирование раны, являются фибробласты, которые заменяют фибриновый матрикс гиалуроновой кислотой, фибронектином и протеогликанами. В последующем в ответ на цитокины, фибробласты увеличивают экспрессию α -гладкомышечного актина и дифференцируются в миофибробласты, сближая края раны друг с другом. В этот момент синтез ВКМ снижается, а ранее синтезированные компоненты изменяются по мере ремоделирования матрикса. В завершении ремодлирования появляется эластин, реформирующий эластичные волокна, а клеточность резко снижается за счет апоптоза макрофагов, эндотелиальных клеток, фибробластов и миофибробластов [3–6, 32].
Регуляция окислительно-восстановительных процессов при нормальном заживлении ран Молекулярный кислород (O2) необходим для аэробного энергетического метаболизма, основан- ного на окислительном фосфорилировании, посредством которого окислительно-восстановительная энергия митохондриального электронного транспорта преобразуется в аденозинтрифосфат (АТФ), его большое количество необходимого для восстановления тканей в процессе заживления ран.
Вместе с процессом окислительного фосфорилирования, происходят реакции восстановления кислорода, которые образовывают его активные формы (АФК). К активным формам кислорода (АФК) относят супероксиданион (O 2 - ), перекись (O 22 ), перекись водорода (H 2 О 2 ), гидроксильные радикалы (ОН), гидроксильные (ОН - ) ионы т.д. На физиологических уровнях АФК, генерируемые нейтрофилами, мононуклеарными фагоцитами, выполняют ряд функций: защита организма от инфекционных агентов, диапедез лейкоцитов, участие в сужении сосудов и образовании тромбов, действуют как вторичные молекулы, высвобождают TNF- α и PDGF, которые передают сигналы, вызывающих активацию и миграцию лейкоцитов в очаг воспаления. АФК вовлечены как в катаболические (процессы, связанные с окислением молекул, АФК забирают электроны у последних, повреждая их структуру; например, в дыхательной цепи митохондрий, электронно-транспортной цепи микросом, при окислении катехоламинов и т.д.), так и в анаболические (синтез лейкотриенов, тромбоксанов, простагландинов) процессы.
В физиологических условиях выработка АФК и RNS достаточно низкая, и окислительное повреждение сводится к минимуму благодаря антиоксидантной защите. Для поддержания окислительновосстановительного гомеостаза аэробные организмы имеют эффективные антиоксидантные системы. Антиоксидантная система включает в себя антиоксидантные ферменты: каталазу, изоформы глутатионпероксидазы (GPX) и супероксиддисму-тазы (SOD), глутатионредуктазу. Изоформы каталазы и глутатионпероксидазы (GPX) устраняют H2O2, а также других органических гидропероксидов, изоформы супероксиддисмутазы (SOD) преобразуют O2- в H2O2. Одновременно с этим в защите от АФК участвуют тиолы (глутатион, липоевая кислота и N-ацетилцистеин), убихинон (коэнзим Q10), мелатонин, и металлосвязывающие белки (ферритин, трансферрин, церулоплазмин, металлотио-неин и лактоферрин), которые связывают окисли- тельно-активные ионы металлов. Экзогенные антиоксиданты могут дополнять действие эндогенных антиоксидантов или напрямую уничтожать АФК. К экзогенным антиоксидантам относятся некоторые витамины и минералы, каротиноиды, полифенолы, флавоноиды, жирные кислоты, омега-3 и омега-6 [8, 9, 31].
На рисунке 1 показаны роли АФК во время заживления ран (относится к нормальным, а не избыточным уровням АФК).
-
(1) АФК играют важную роль на начальном этапе раневого процесса, уменьшая кровоток и локальную передачу клетками сигналов о тромбооб-разовании;
-
(2) локальное высвобождение АФК привлекает связанные с кровеносными сосудами местные нейтрофилы к месту раны для защиты от бактерий;
-
(3) в процессе фагоцитоза высвобождается АФК, чтобы остановить рост бактерий;
-
(4) другие иммуноциты, включая моноциты, мигрируют к месту раны, помогая атаковать вторгающиеся патогенные микроорганизмы;
-
(5) высвобождение АФК стимулируют деление и миграцию эндотелиальных клеток для перестройки кровеносных сосудов, деление и миграцию фибробластов для образования компонентов нового внеклеточного матрикса (включая синтез коллагена) и способствуют пролиферации и миграции кератиноцитов [7, 30].
Заживление хронических рани окислительный стресс
Хронические раны – это раны, которые не заживают в течение определенного периода времени несмотря на соответствующее лечение, из - за нарушения фаз заживления ран и стойких сопутствующих патологий, таких как инфекции, локальная ишемия, нарушение артериального и венозного кровообращения, диабет 2 типа и хроническое воспаление. Несмотря на различные причины возникновения хронических ран, патогенез происходит по общему сценарию [10, 11].
Хроническая рана характеризуется обилием иммунных клеток, выделяющих избыточное количество провоспалительных цитокинов, протеолитических ферментов и активных форм кислорода (АФК). Нарушается баланс между провоспалитель-ными цитокинами, хемокинами, протеазами и их ингибиторами, присущий острым ранам.
Особую роль в патогенезе хронических ран играет повышенная активность таких протеаз как се-ринпротеазы и матриксные металлопротеазы (ММП) (коллагиназы, эластазы, гелатиназы А и В) наряду со сниженным уровнем ингибиторов протеаз (тканевые ингибиторы ММП (ТИМП)) [12]. Высокий уровень протеаз способствует разрушению компонентов ВКМ и основных факторов роста: фактор роста фибробластов (bFGF), эпидермальный фактор роста (EGF), трансформирующий фактор роста-b (TGF-b), а серинпротеазы способствуют деградации фибронектина – основного белка, участвующего в фазе ремоделирования [29].
Среди этих факторов ключевую роль в хронических ранах играет ксантиноксидоредуктаза (XOR), усиливая процессы свободнорадикального окисления, предотвращает пролиферацию, васкуляризацию и реэпителизацию, тем самым поддерживая хроническое воспаление в ране. XOR существует в двух формах: ксантиндегидрогеназа (XDH) и ксантиноксидаза (XO), они потребляют молекулярный кислород, чтобы катализировать превращение гипоксантина в ксантин и, наконец, в мочевую кислоту с сопутствующим образованием супероксида (О 2 ) и перекиси водорода (H 2 О 2 ).
АФК, полученные из XO, могут также опосредовать высвобождение интерлейкина-1 β (IL-1 β ), мощного провоспалительного цитокина, повышенный уровень IL-1 β увеличивает привлечение иммунных клеток к месту повреждения, что только усиливает воспаление. Сочетание вышеописанных явлений вызывает истощение внеклеточного матрикса, ингибирование фазы пролиферации, сохранение воспаления, препятствуя заживлению раны [13].
Окислительный стресспри хронической ране
Основная причина возникновения трудноза-живающих ран – хронический окислительный стресс, при котором в течение продолжительного времени уровень АФК поднимается, а антиоксидантная система ингибируется. Несбалансированные уровни АФК вызывают окисление различных биомолекул, происходит усиленное окисление белка и перекисное окисление липидов, вызывающее окислительное повреждение.
Моноциты
5. Восстановление тканей. Стимулированное свободными радикалами деление клеток и миграция кератиноци-тов, эндотелиальных клеток (ангиогенез) и фибробластов, синтез коллагена
4. Привлечение лимфоцитов. Миграция лимфоцитов в зону раны, стимулированная свободными радикалами
2. Привлечение нейтрофилов.
Быстрая миграция нейтрофилов из локальных кровеносных сосудов в зону повреждения, стимулированная свободными радикалами ^)
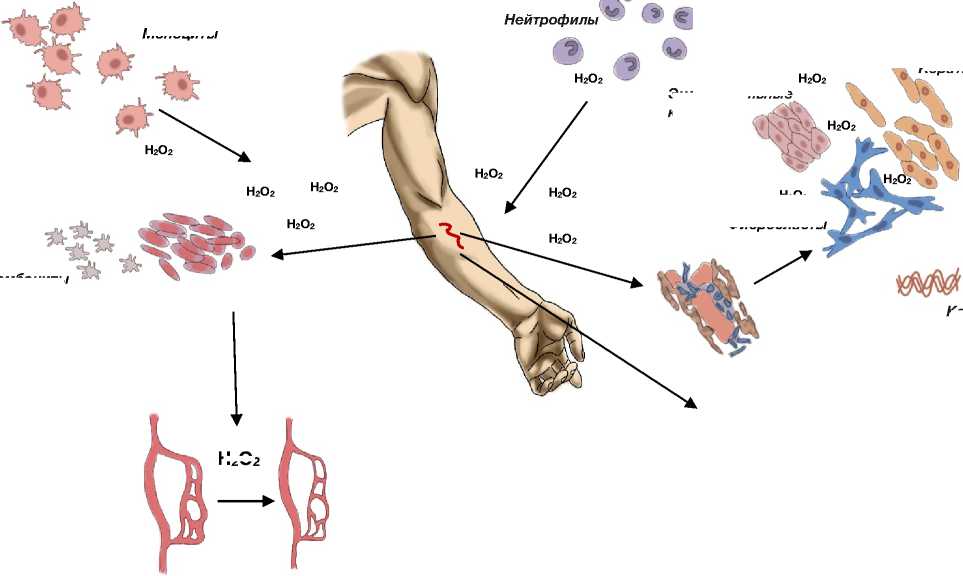
Н 2 О 2
Коллаген
Тромбоциты
Н 2 О 2
Бактерии
Кровеносный сосуд
3. Защита от патогенов. Уничтожение бактерий и грибов при помощи свободнорадикально опосредованного фагоцитоза и выделения бактериостатической Н 2 О 2 тромбоцитами и нейтрофилами
1. Гемостаз. Ранняя вазоконстрикция, опосредованная свободными радикалами после контакта тромбоцитов с экстрацеллюлярным матриксом и коллагеном, активация тромбоцитов и тромбина для индукции тромбообразования
Н 2 О 2 ^ Нейтрофилы Н 2 О 2 <&э
Рисунок 1. Роли АФК в заживлении ран
Эндотелиальные клетки
Н 2 О 2
Фибробласты
Кератиноциты
-
Figure 1. Roles of ROS in wound healing
Неконтролируемая продукция АФК не только вызывает окислительное повреждение, но также стимулирует пути передачи сигналов, приводящие к усиленной экспрессии сериновых протеаз, ММП и воспалительных цитокинов. Нарушается баланс между протеазами и их ингибиторами, усиливая воспаление.
Основную сложность при окислительном стрессе представляет то, что перекисное окисление липидов начинается с внедрения свободного радикала в липидный слой (инициация), который окисляет жирные кислоты с образованием липидного радикала, который, в свою очередь, вступает в реакцию с молекулярным кислородом, растворенным в среде. Таким образом, образуется новый свободный радикал. Этот радикал атакует следующий липид с образованием гидроперекиси липида и нового радикала. Процесс продолжается до тех пор, пока не произойдет обрыв цепи, результатом которого могут стать повреждения клеточных мембран, это ограничивает подвижность полипептид-ной цепи и снижает активность ферментов, белков, встроенных в клеточные мембраны и рецепторов, что в итоге приводит к нарушению свойств и функций, таких как ионный транспорт, ферментативная и рецепторная активности, окисление белков с изменением их третичной структуры (аминокислоты, как аргинин, лизин, пролин), как следствие происходит ингибирование различных ферментов, разрыв нитей ДНК.
Помимо этого, активные формы кислорода (АФК), реагируют с оксидом азота (NO), образуя активные формы азота (RNS). Оксид азота и его метаболиты играют важную роль в ряде физиологических процессов, таких как регуляция кровяного давления и образование тромбов. Действие NO опосредованно его метаболитами (S-нитрозотиол). S-нитрозотиолы действуют как эндотелиальный фактор релаксации, активируют гемсодержашую гуанилатциклазу и ингибируют агрегацию тромбоцитов. Оксид азота (NO), вырабатываемый изоформами NO-синтазы (NOS), самопроизвольно вступает в реакцию с супероксидом (O2), продуцируемым в реакциях с НАДФН-оксидазой, образуя пероксинитрит (ONOO-). Пероксинитрит (ONOO-) реагирует с такими веществами как коэнзим Q, белки, в том числе белки дыхательной цепи митохондрий, липиды (перекисное окисление липидов) и нуклеиновые кислоты (окислительные модификации в нуклеиновых основаниях). Эти реакции влияют на структуру и функцию белка и могут вызывать изменения каталитической активности ферментов, изменения цитоскелета, нарушение передачи клеточного сигнала и усиление апоптоза клеток.
Лечение хронических ран. Митохондриальнонаправленные антиоксиданты
Для классических антиоксидантов есть много ограничений, главное из которых то, что они нейтрализуют свободные радикалы только in vitro и не попадают туда, где образуются супероксид-ра-дикалы.
Митохондриально-направленный антиоксидант SkQ1:
-
- 10 - (6t - пластохинонил). Пластохинон очень эффективный переносчик электронов и антиоксидант хлоропластов, конъюгировали с децилтрифе-нилфосфонием для получения катиона, легко проникающего через мембраны. Этот катион, называемый SkQ1, специфически воздействует на митохондрии с помощью электрофореза в электрическом поле, образованном дыхательной цепью митохондрий. Дыхательная цепь также восстанавливает восстановленный SkQ1H(2) из его окисленной формы, которая появляется в результате антиоксидантной активности SkQ1 H(2). SkQ1 H(2) предотвращает окисление кардиолипина, митохондриального фосфолипида, который особенно чувствителен к воздействию активных форм кислорода (АФК). В клеточных культурах SkQ1 и его аналог пластохинонилдецилродамин 19 (SkQR1) останавливают H 2 O 2 -индуцированный апоптоз [26].
Высокоэффективный митохондриальнонаправленный антиоксидант SkQ1 стимулирует заживление кожных ран, действуя на воспалительную и пролиферативную фазы ранозаживления в различных экспериментальных моделях in vivo и in vitro. Имеются основания полагать, что препараты для локальной терапии труднозаживающих ран на основе SkQ1 послужат эффективным средством борьбы с длительно незаживающими ранами у разных категорий пациентов, в том числе при сахарном диабете, а также у пациентов с хроническими критическими состояниями и рецидивирующими инфекциями [27].
Производные пластохинона, ковалентно конъюгированные с липофильными катионами (SkQ), являются одной из наиболее интенсивно изучаемых групп митохондриально-направленных антиоксидантов. Было показано, что введение SkQ1 мышам с ожирением, содержавшимся на диете с высоким содержанием жиров и сахарозы, нормализовало уровни H 2 O 2 и белковых карбонилов в мышцах. Интересно, что SkQ1 предотвращает увеличение митохондриального биогенеза, вызванное диетой с высоким содержанием жиров, вероятно, опосредованное активацией Ca2+/кальмодулин-зависимой протеинкиназы CaMKII [28]. Другие липофильные антиоксиданты, например, коэнзим Q10, также хорошо проникают в мембраны, но при этом они практически полностью остаются в тех мембранах, в которые попали первыми. Т.е. в мембране клетки или, в крайнем случае, во внешней мембране митохондрий. SkQ1 за счет заряженного компонента может перемещаться из мембраны в воду.
Антиоксиданты, направленные на митохондрии, включают молекулы на основе липофильных катионов трифенилфосфония, такие как:
-
- мито -а -липоевая кислота. MitoQ представляет собой перорально доступное митохондриально-направленное производное антиоксиданта убихинона. MitoQ содержит липофильный катион трифенилфосфония (TPP), который обеспечивает быстрое проникновение в двойные слои фосфолипидов и приводит к накоплению в митохондриях. В митохондриальном матриксе MitoQ постоянно восстанавливается дыхательной цепью до своей активной формы и защищает митохондрии от окислительного повреждения. Из-за характеристики избирательного накопления и непрерывной рециркуляции в митохондриях было продемонстрировано, что MitoQ защищает in vitro и in vivo от многих патологий, связанных с окислительным повреждением, включая ишемически-реперфузионное повреждение, сердечно-сосудистые заболевания, этанолзависимый гепатостеатоз и сепсис. MitoQ
успешно прошел клинические испытания фазы I и фазы II и показал свою эффективность против повреждения печени у пациентов с инфекцией гепатита С. Важно отметить, что эти клинические испытания показали, что MitoQ не имеет серьезных побочных эффектов. В клинических испытаниях MitoQ было показано, что препарат улучшает острую травму толстой кишки в мышиной модели колита не только благодаря своим антиоксидантным эффектам, но и благодаря противовоспалительным эффектам, которые подавляют созревание провоспалительных цитокинов IL-1 бета и IL-18. Учитывая мощную защитную роль MitoQ в экспериментальной модели колита и его доказанную безопасность в клинических испытаниях на людях, MitoQ является возможным препаратом для лечения хронических ран [25].
индукция АФК повреждает комплексы дыхательной цепи митохондрий, индуцируя апоптоз. Чрезмерный и неконтролируемый окислительный стресс способствует поддержанию и дерегулированию процессов воспаления, которые являются ключевыми факторами патогенеза труднозажива-ющих ран. В свою очередь, терапия с применением митохондриально-направленных антиоксидантов на основе производных антиоксиданта убихинона и пластохинона оказалась полезной для улучшения состояния хронических ран. Учитывая доказанную безопасность и эффективность препаратов, подтвержденную клиническими испытаниями на людях, митохондриально-направленные антиоксиданты являются возможным препаратом для лечения хронических ран.
Выводы
Окислительный стресс играет важнейшую роль в патогенезе хронических ран, повышенная
Список литературы Роль митохондрий в патогенезе "сложного" раневого процесса
- Morton LM, Phillips TJ. Wound healing and treating wounds: Differential diagnosis and evaluation of chronic wounds. J Am Acad Dermatol. 2016 Apr;74(4):589-605; quiz 605-6. https://doi.org/10.1016Xj.jaad.2015.08.068. PMID: 26979352.
- Guo S, Dipietro LA. Factors affecting wound healing. J Dent Res. 2010 Mar;89(3):219-29. https://doi.org/10.1177/0022034509359125. Epub 2010 Feb 5. PMID: 20139336; PMCID: PMC2903966.
- Kasuya A, Tokura Y. Attempts to accelerate wound healing. J Dermatol Sci. 2014 Dec;76(3):169-72. https://doi.org/10.1016/j.jderm-sci.2014.11.001. Epub 2014 Nov 11. PMID: 25468357.
- Landen NX, Li D, Stahle M. Transition from inflammation to proliferation: a critical step during wound healing. Cell Mol Life Sci. 2016 0ct;73(20):3861-85. https://doi.org/10.1007/s00018-016-2268-0. Epub 2016 May 14. PMID: 27180275; PMCID: PMC5021733.
- Tracy LE, Minasian RA, Caterson EJ. Extracellular Matrix and Dermal Fibroblast Function in the Healing Wound. Adv Wound Care (New Rochelle). 2016 Mar 1;5(3):119-136. https://doi.org/10.1089/wound.2014.0561. PMID: 26989578; PMCID: PMC4779293.
- Bainbridge P. Wound healing and the role of fibroblasts. J Wound Care. 2013 Aug;22(8):407-8, 410-12. https://doi.org/10.12968/jowc.2013.22.8.407. PMID: 23924840.
- Dunnill C, Patton T, Brennan J, Barrett J, Dryden M, Cooke J, Leaper D, Georgopoulos NT. Reactive oxygen species (ROS) and wound healing: the functional role of ROS and emerging ROS-modulating technologies for augmentation of the healing process. Int Wound J. 2017 Feb;14(1):89-96. https://doi.org/10.1111/iwj.12557. Epub 2015 Dec 21. PMID: 26688157; PMCID: PMC7950185.
- Kim HK, Nilius B, Kim N, Ko KS, Rhee BD, Han J. Cardiac Response to Oxidative Stress Induced by Mitochondrial Dysfunction. Rev Physiol Biochem Pharmacol. 2016;170:101-27. https://doi.org/10.1007/112_2015_5004. PMID: 26744346.
- Xie W, Santulli G, Reiken SR, Yuan Q, Osborne BW, Chen BX, Marks AR. Mitochondrial oxidative stress promotes atrial fibrillation. Sci Rep. 2015 Jul 14;5:11427. https://doi.org/10.1038/srep11427. PMID: 26169582; PMCID: PMC4501003.
- Dunnill C, Patton T, Brennan J, Barrett J, Dryden M, Cooke J, Leaper D, Georgopoulos NT. Reactive oxygen species (ROS) and wound healing: the functional role of ROS and emerging ROS-modulating technologies for augmentation of the healing process. Int Wound J. 2017 Feb;14(1):89-96. https://doi.org/10.1111/iwj.12557. Epub 2015 Dec 21. PMID: 26688157; PMCID: PMC7950185.
- Schäfer M, Werner S. Oxidative stress in normal and impaired wound repair. Pharmacol Res. 2008 Aug;58(2):165-71. https://doi.org/10.1016Zj.phrs.2008.06.004. Epub 2008 Jun 19. PMID: 18617006.
- Patel S, Maheshwari A, Chandra A. Biomarkers for wound healing and their evaluation. J Wound Care. 2016 Jan;25(1):46-55. https://doi.org/10.12968/jowc.2016.25.1.46. PMID: 26762498.
- Fernandez ML, Stupar D, Croll T, Leavesley D, Upton Z. Xanthine Oxidoreductase: A Novel Therapeutic Target for the Treatment of Chronic Wounds? Adv Wound Care (New Rochelle). 2018 Mar 1;7(3):95-104. https://doi.org/10.1089/wound.2016.0724. PMID: 29644146; PMCID: PMC5833883.
- Sen CK. Wound healing essentials: let there be oxygen. Wound Repair Regen. 2009 Jan-Feb;17(1):1-18. https://doi.org/10.1111/j.1524-475X.2008.00436.x. PMID: 19152646; PMCID: PMC2704021.
- Sen CK, Khanna S, Babior BM, Hunt TK, Ellison EC, Roy S. Oxidant-induced vascular endothelial growth factor expression in human keratinocytes and cutaneous wound healing. J Biol Chem. 2002 Sep 6;277(36):33284-90. https://doi.org/10.1074/jbc.M203391200. Epub 2002 Jun 14. PMID: 12068011.
- Bishop A. Role of oxygen in wound healing. J Wound Care. 2008 Sep;17(9):399-402. https://doi.org/10.12968/jowc.2008.17.9.30937. PMID: 18833899.
- Toledo-Pereyra LH, Lopez-Neblina F, Toledo AH. Reactive oxygen species and molecular biology of ischemia/reperfusion. Ann Transplant. 2004;9(1):81-3. PMID: 15478900.
- Willam C, Schindler R, Frei U, Eckardt KU. Increases in oxygen tension stimulate expression of ICAM-1 and VCAM-1 on human endothelial cells. Am J Physiol. 1999 Jun;276(6):H2044-52. https://doi.org/10.1152/ajpheart.1999.276.6.H2044. PMID: 10362686.
- Herrick SE, Sloan P, McGurk M, Freak L, McCollum CN, Ferguson MW. Sequential changes in histologic pattern and extracellular matrix deposition during the healing of chronic venous ulcers. Am J Pathol. 1992 Nov;141(5):1085-95. PMID: 1279979; PMCID: PMC1886678.
- Oskeritzian CA. Mast Cells and Wound Healing. Adv Wound Care (New Rochelle). 2012 Feb;1(1):23-28. https://doi.org/10.1089/wound.2011.0357. PMID: 24527274; PMCID: PMC3623594.
- Wulff BC, Wilgus TA. Mast cell activity in the healing wound: more than meets the eye? Exp Dermatol. 2013 Aug;22(8):507-10. https://doi.org/10.1111/exd.12169. Epub 2013 Jun 27. PMID: 23802591; PMCID: PMC3723719.
- Zinovkin RA, Zamyatnin AA. Mitochondria-Targeted Drugs. Curr Mol Pharmacol. 2019;12(3):202-214. https://doi.org/10.2174/1874467212666181127151059. PMID: 30479224; PMCID: PMC6875871.
- Kim HK, Han J. Mitochondria-Targeted Antioxidants for the Treatment of Cardiovascular Disorders. Adv Exp Med Biol. 2017;982:621-646. https://doi.org/10.1007/978-3-319-55330-6_32. PMID: 28551810.
- Reddy AP, Reddy PH. Mitochondria-Targeted Molecules as Potential Drugs to Treat Patients With Alzheimer's Disease. Prog Mol Biol Transl Sci. 2017;146:173-201. https://doi.org/10.1016/bs.pmbts.2016.12.010. Epub 2017 Feb 11. PMID: 28253985.
- Dashdorj A, Jyothi KR, Lim S, Jo A, Nguyen MN, Ha J, Yoon KS, Kim HJ, Park JH, Murphy MP, Kim SS. Mitochondria-targeted antioxidant MitoQ ameliorates experimental mouse colitis by suppressing NLRP3 inflammasome-mediated inflammatory cytokines. BMC Med. 2013 Aug 6;11:178. https://doi.org/10.1186/1741-7015-11-178. PMID: 23915129; PMCID: PMC3750576.
- Skulachev MV, Antonenko YN, Anisimov VN, Chernyak BV, Cherepanov DA, Chistyakov VA, Egorov MV, Kolosova NG, Korshunova GA, Lyamzaev KG, Plotnikov EY, Roginsky VA, Savchenko AY, Severina II, Severin FF, Shkurat TP, Tashlitsky VN, Shidlovsky KM, Vyssokikh MY, Zamyatnin AA Jr, Zorov DB, Skulachev VP. Mitochondrial-targeted plastoquinone derivatives. Effect on senescence and acute age-related pathologies. Curr Drug Targets. 2011 Jun;12(6):800-26. https://doi.org/10.2174/138945011795528859. PMID: 21269268.
- Zinovkin R.A., Popova E.N., Pletjushkina O.Yu., Ilyinskaya O.P., Pisarev V.M., Chernyak B.V. Prospects for Drugs Based on the Mitochondria-Targeting Antioxidant SkQ1 in Treatment of Wounds with Impaired Healing. General Reanimatology. 2018;14(2):69-86. (In Russ.) https://doi.org/10.15360/1813-9779-2018-2-69-86
- Demyanenko IA, Zakharova VV, Ilyinskaya OP, Vasilieva TV, Fedorov AV, Manskikh VN, Zinovkin RA, Pletjushkina OY, Chernyak BV, Skulachev VP, Popova EN. Mitochondria-Targeted Antioxidant SkQ1 Improves Dermal Wound Healing in Genetically Diabetic Mice. Oxid Med Cell Longev. 2017;2017:6408278. https://doi.org/10.1155/2017/6408278. Epub 2017 Jul 6. PMID: 28761623; PMCID: PMC5518517.
- Wilkinson HN, Hardman MJ. Wound healing: cellular mechanisms and pathological outcomes. Open Biol. 2020 Sep;10(9):200223. https://doi.org/10.1098/rsob.200223. Epub 2020 Sep 30. PMID: 32993416; PMCID: PMC7536089.
- Novo E. Parola M. Redox mechanisms in chronic wound healing and fibrogenesis in the liver. Tissue repair in fibrogenesis. 2008;5. https://doi .org/10.1186/1755-1536-1 -5
- Рязанцева Л.Т. Ферменты-антиоксиданты: структурно-функциональные свойства и роль в регулировании метаболических процессов. Вестник Воронежского государственного технического университета. 2011;7(2):126-129. [Ryazantseva L.T. Antioxidant enzymes: structural and functional properties and role in the regulation of metabolic processes. Vestnik of Voronezh State Technical University. 2011;7(2):126-129. (In Russ)].
- Zhao R, Liang H, Clarke E, Jackson C, Xue M. Inflammation in Chronic Wounds. Int J Mol Sci. 2016 Dec 11; 17(12):2085. https://doi.org/10.3390/ijms17122085. PMID: 27973441; PMCID: PMC5187885.


