Роль MTOR в репрограммировании опухоль-ассоциированных макрофагов и в канцерогенезе (обзор)
Автор: Мартынова Т.Н., Малышев И.Ю.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Патологическая физиология
Статья в выпуске: 1 т.16, 2020 года.
Бесплатный доступ
Макрофаги - гетерогенная популяция клеток, которые дифференцируются в различные функциональные группы в зависимости от полученных сигналов. Агонисты toll-like рецепторов и цитокины воздействуют на соответствующие рецепторы, вызывая изменения метаболизма и экспрессии генов в миелоидных клетках системы врожденного иммунитета. Данные изменения в фагоцитах происходят в процессе их активации, в результате они становятся поляризованными в том или ином направлении, приобретая определенный фенотип. Данные изменения экспрессии генов реализуются в опухолевом микроокружении. mTOR (mammalian target of rapamycin) - серин/треониновая протеинкиназа, которая реагирует на различные стимулы окружения клетки изменением ее метаболизма. mTOR также принимает участие в процессе активации макрофагов. Тема представленного обзора литературы: роль mTOR в репрограммировании макрофагов, в том числе опухоль-ассоциированных. Для поиска информации использовалась база данных PubMed.
Макрофаги, опухоль, репрограммирование
Короткий адрес: https://sciup.org/149135498
IDR: 149135498 | УДК: 616.092
Текст научной статьи Роль MTOR в репрограммировании опухоль-ассоциированных макрофагов и в канцерогенезе (обзор)
а также принимают участие в поддержании механизмов гомеостаза, таких как тканевое ремоделирование и заживление раны [1].
Клетки системы врожденного иммунитета обеспечивают иммунологическую память через эпигенетическое репрограммирование после стимуляции с микробными лигандами. Данная функция позволяет усиливать неспецифический воспалительный ответ после вторичной стимуляции — процесс, называемый «обучением иммунитета». Были идентифицированы эпигеномные копии «обученных» моноцитов, что выявило несколько важных иммунологических и метаболических механизмов, которые лежат в основе этих изменений. Интересно, что подобное долговременное репрограммирование, приводящее к продукции цитокинов, индуцировано эндогенными DAMPs (молекулярными образами, ассоциированными с повреждениями). Обнаружено, что эндогенные сигналы, ассоциированные с тканевым повреждением и асептическим воспалением, могут индуцировать «тренированный» («обученный») иммунитет через эпигенетическую регуляцию транскрипционных программ и что постоянно воздействующие DAMPs влияют на ход воспалительного процесса, а сигналы тканевого происхождения являются критичными для регуляции выраженности и типа иммунного ответа, производимого организмом [2]. В обученных макрофагах промоторы генов, кодирующих компоненты путей иммунного сигналинга, активированы.
То же самое происходит в опухоли: сигналы, полученные в ее микроокружении, начинают программировать макрофаги, мигрировавшие в опухоль для борьбы с ней. Так появляется множество популяций макрофагов: супрессорные клетки миелоидного происхождения, регуляторные Т-клетки и опухоль-ассоциированные макрофаги (ОАМ), которые существуют в опухолевом микроокружении и поддерживают рост опухоли и напрямую, и опосредованно [3].
mTOR (первично «TOR млекопитающих», в настоящее время –«механистический TOR») — ключевой регулятор клеточного метаболизма, который функционирует как питательный/энергетический сенсор и регулирует метаболические процессы синтеза белка, гликолиза и липогенеза в зависимости от доступности питательных веществ [4]. Выявлено нарушение регуляции mTOR-сигналинга в таких заболеваниях, как рак, ожирение, диабет 2-го типа, нейродегенеративные заболеваниях, что говорит об актуальности исследования данного вопроса.
mTOR принимает участие в процессах актива-ции/поляризации макрофагов в зависимости от получаемых стимулов [5], тем самым играя заметную роль в модуляции иммунного ответа.
Роль макрофагов в иммунном ответе: концепция поляризации. Опухоли развиваются как экосистемы, состоящие из опухолевых, стромальных и инфильтрирующих строму иммунных клеток. Макрофаги являются главными компонентами этой системы [6]. Однако популяция этой системы неоднородна.
Моноциты, макрофаги и дендритные клетки в совокупности образуют систему мононуклеарных фагоцитирующих клеток — гетерогенную популяцию клеток, которые могут дифференцироваться в отдельные функциональные подгруппы, формирующиеся при помощи сигналов, полученных от микроокружения [7]. Термин «активация» означает преобразование макрофагов под воздействием экзогенных агентов (цитокинов или агонистов рецепторов (TLR)), что приводит к определенным образам экспрессии генов; многие используют в том же контексте обозначение «поляризация».
Чтобы выполнять различные функции, макрофаги приобретают специфические фенотипы, которые могут быть охарактеризованы определенным видом экспрессии генов, образом поверхностных молекул и продукцией биологических медиаторов и метаболитов [8]. На границах данного континуума поляризационного статуса макрофагов находятся два фенотипа, которые могут быть определены как М1-провоспалительный/противоопухолевый против М2-противовоспалительного/проопухолевого.
Данные разновидности макрофагов принимают соответствующий образ экспрессии генов в зависимости от стимулов, полученных в условиях микроокружения.
Например, в 2011 г. Krausgruber и коллеги показали, что IRF5 является критическим белком для M1 макрофагальной поляризации. И GM–CSF, и IFN-γ стимулы индуцируют IRF5-экспрессию, которая напрямую активирует 20 M1-специфичных генов и ингибирует 19 M2-специфичных генов, кодирующих цитокины [9]. IRF5 вовлечен в М1-поляризацию, индуцируя транскрипцию p40 субъединицы интерлейкина 12 (IL-12p40), IL-12p35 и IL-23p19, а также снижая транскрипцию IL-10 [9].
Таким образом, M1-макрофаги под специфическими условиями усиливают воспалительный процесс, что может стать угрожающим для состояния здоровья. Но в опухоли, особенно на поздних стадиях развития, складывается обратная ситуация, когда к опухолевым клеткам формируется толерантность. В данном случае немаловажную роль играют ОАМ.
Макрофаги, активированные через путь, противоположный классическому, относятся к M2, или альтернативному пути. Было выявлено, что такие стимулы, как CSF-1, IL-4, IL-10, TGF-β и IL-13, грибковая и гельминтная инфекция управляют M2-субпопуляцией поляризации, индуцируя IL-10 в высокой концентрации и IL-12 в низкой [10].
Транскрипционные факторы PPARγ и PPARδ активируются при помощи STAT6 и необходимы для M2-поляризации [11].
Экспериментально доказано, что среди ОAM M2-подобные макрофаги поддерживают в опухоли инициацию, прогрессию и выживаемость; они ингибируют иммуностимулирующие сигналы и не имеют цитотоксической активности. ОAM-инфильтрация в опухоли коррелирует с неблагоприятным прогнозом [12]. Более того, многочисленные исследования показали, что ОАМ главным образом ответственны за резистентность к классической противоопухолевой терапии (лучевой и химиотерапии), а также ограничивают эффективность методов иммунотерапии (например, анти-PD1) [13].
ОАМ собираются в гипоксических областях; они являются MHClow, имеют проангиогенные свойства и плохую антигенпрезентирующую способность; с другой стороны, макрофаги, локализованные в областях нормоксии, могут быть более гетерогенными, и некоторые из них имеют М1-фенотип с MHChigh-экспрессией [14].
Многочисленные свидетельства подтверждают, что в опухолях мыши и человека ОАМ главным образом проявляют альтернативно активированный фенотип, который ассоциирован с поддержкой роста опухоли, ремоделированием внеклеточного матрикса, ангиогенезом и супрессией адаптивного иммунитета [15].
M2-представительство в опухолевом микроокружении также поддерживает выживаемость, рост опухоли и метастазирование [16].
Опухолевые и иммунные клетки в соответствующем микроокружении продуцируют цитокины, факторы роста и метаболиты, которые поддерживают про-опухолевую поляризацию ОАМ. Медиаторы, такие как CSF-1, CCL2 и VEGF, поддерживают вовлечение ОАМ в микроокружение опухоли [8]. Th2-цитокины IL-4, IL-13, IL-10 и TGFβ, продуцируемые Treg и ТАМ, являются ключевыми направляющими иммуносупрессии.
Далее будет рассмотрена роль mTOR в модуляции сигналов в ответ на Th1- и Th2-цитокины, а следовательно, и в репрограммировании макрофагов. Фосфатидилинозитол-3-киназный (PI3K) сигнальный путь, который активирует множественные сигнальные каскады через продукцию вторичного посредника PIP3, регулирует выживаемость макрофагов и экспрессию генов через активацию семейства Akt серин/треонинпротеинкиназ. PI3K/Akt-сигнальный путь контролирует активацию mTOR [17].
Что такое mTOR? mTOR (mammalian target of rapamycin) — атипичная серин/треонинпротеинки-наза, принадлежащая к PIKK (PI3K) семейству киназ с молекулярным весом около 290 kDa.
mTOR — ключевой каталитический компонент, локализующийся в отдельных субклеточных компар-тментах (лизосомах, митохондриях, цитоплазматической мембране, эндоплазматическом ретикулуме, ядре) и состоящий из двух структурно и функционально отдельных комплексов mTORC1 и mTORC2 [4] (рис. 1).
mTORC1-путь объединяет входы, как минимум, от пяти главных внутриклеточных и внеклеточных стимулов: факторов роста, стресса, энергетического состояния, кислорода и аминокислот, опосредуя многие базовые процессы, включая синтез белка и липидов и аутофагию. mTORC1 отвечает на различные стимулы микроокружения, контролируя многие процессы по производству/использованию энергии и питательных веществ. mTOR-сигналинг влияет на главнейшие функции клетки, регулируя основные виды поведения клетки: рост (увеличение массы) и пролиферацию [4].
Немало известно о том, как данные стимулы регулируют mTORC1-сигналинг, хотя присутствуют сведения о связи тех же стимулов с mTORC2 [18].
PI3K-mTOR-путь. Различные рецепторные тиро-зинкиназы активируют PI3K через отдельные стыковочные белки, такие как FRS (FGF Receptor Substrate) или GAB (c-Met or EGFR), или через прямое связывание PI3K (Platelet-derived Growth Factor Receptor).
Инсулин и IGF1 присоединяется к своим распознающим рецепторным тирозинкиназам (RTKs), после активации которых происходит вовлечение в процесс PI3-киназы, а затем ее регуляторной (p85) и каталитической (p110) субъединиц, что приводит к фосфорилированию фосфатидил-4,5-бифосфата (PIP2) и превращению его в фосфатидил-3,4,5-трифосфат (PIP3). PTEN (Phosphataseandtensinhomologuedelete donchromosome 10) катализирует обратную реакцию, обеспечивая инактивацию Akt в покоящихся клетках. PIP3 привлекает киназу PDK1 (phosphoinositide-dependentkinase 1) к плазматической мембране и активирует ее фосфорилированием. Активированная PDK1 затем фосфорилирует Akt и PKCθ. Akt фосфорилирует TSC2 в многочисленных сайтах, напрямую связывая PI3K-Akt с TSC-mTORC1 [18].
TSC2 млекопитающих увеличивает внутреннюю скорость GTP гидролиза Rheb, превращая Rheb из GTP-связанной (активной) в GDP-связанную (неактивную) форму, которая напрямую взаимодействует с mTORC1 и мощно стимулирует его киназную активность.
ФосфорилированиеTSC2 при помощи Akt снижает TSC2 GAP активность в отношении Rheb, что ин-
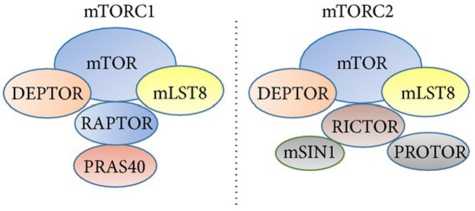
Рис. 1. mTORC1 и mTORC2:
mTORC1 включает в себя собственно mTOR (каталитическая субъединица), RAPTOR, DEPTOR, PRAS40, mLST8; mTORC2 состоит из mTOR, RICTOR, DEPTOR, PROTOR1 /2, mSIN1 и mLST8
дуцирует прямую активацию mTORC1 [18]. mTORC1 фосфорилирует 4E-BP (eukaryoticinitiationfactor 4E (eIF4E) — bindingprotein) и S6K (p70 ribosomalS6 Kinase), что приводит к изменению биогенеза рибосом и трансляции белков [18] (рис. 2).
Инсулин и IGF1 присоединяется к рецепторным тирозинкиназам (RTKs), что приводит к аутофосфорилированию рецептора. После активации рецепторной тирозинкиназы происходит вовлечение в процесс PI3-киназы, а затем ее регуляторной (p85) и каталитической (p110) субъединиц, что приводит к фосфорилирилированию фосфатидил-4,5-бифосфата (PIP2) и превращению его
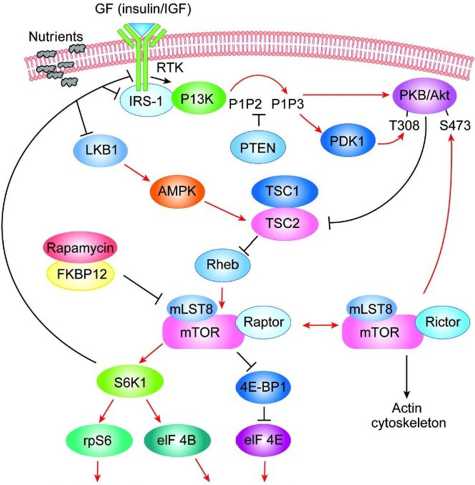
Биогенез рибосом Кэп-зависимая трансляция (циклин D1, с-Myc, HIF-1α, EGF)
Рис. 2. PI3K-mTOR-сигналинг:
GF (факторы роста) — инсулин, инсулиноподобный фактор роста; RTK — рецепторная тирозинкиназа; IRS-1 — инсу-линрецепторный субстрат-1; PI3K — фосфатидилинозитол-3киназа; PKB (AKT) — протеинкиназа В; PDK1 — фосфои-нозитид-зависимая киназа; LKB1 — печеночная киназа 1; PTEN — фосфатаза и тензин-гомолог, удаленный на 10-й хромосоме; AMPK — AMФ-активируемая протеинкиназа;
TSC1 /2 — комплекс Tuberoussclerosis; Rheb — Ras-гомолог, питающий головной мозг; FKBP12 — FK506-связывающий белок; mTORC1: mTOR, Raptor, DEPTOR, PRAS40, mLST8; mTORC2: mTOR, Rictor, DEPTOR, protor1/2, mSinl, mLST8;
S6K1 — S6-киназа 1; rpS6 — рибосомальный белок S6; eIF4B — эукариотический фактор инициации трансляции 4В; 4E-BP1 — eIF4E-связывающий белок; eIF4E — эукариотический фактор инициации трансляции 4Е в фосфатидил-3,4,5-трифосфат (PIP3). PIP3 привлекает киназу PDK1 (phosphoinositide-dependent kinase 1) к плазматической мембране и фосфорилирует ее, которая, в свою очередь, активирует Akt и PKCθ. Akt фосфорилирует TSC2. ИнактивированныйTSC2 аналогичным образом действует на Rheb, в результате чего активируется mTORC1, 4E-BP (eukaryotic initiation factor 4E (eIF4E) — binding protein) и S6K (p70 ribosomal S6 Kinase).
mTOR-активация в макрофагах:
-
1. Роль mTOR в TLR4-сигналинге. Как известно, TLR4-сигналинг—один из наиболее часто задействованных путей в воспалительном процессе, а хроническое воспаление в ряде случаев выступает пусковым моментом в канцерогенезе. По данным Schmitz, ингибирование mTOR снижает TLR-индуцированное высвобождение IL-10, TNF-a, IL-6 и оксида азота макрофагами и дендритными клетками, а также усиливает процессинг каспазы-1 и таким образом повышает продукцию биоактивного IL-1β [19].
-
2. Активация Nod2-рецепторов. Nod2-стимуляция при помощи мурамилдипептида (MDP) приводит к фосфорилированию p70 S6 (субстрата mTOR) [20] и Akt, вышестоящего активатора mTOR. Активация mTOR необходима для последующей секреции IL-10, TGF-β и IL-1Ra, которая лежит в основе Nod2-опосредованной толерантности [21].
-
3. IFN-γ-сигналинг. Под воздействием IFN-γ mTOR снижает экспрессию с/ЕВРв и MARCO, ингибируя таким образом неопсонизированный фагоцитоз. IFN-γ индуцировал повышенную активность mTOR и снижал экспрессию с/ЕВРв (CCAAT enhancer-binding protein β) в макрофагах. А рапамицин значительно отменял ингибиторный эффект IFN-y на неопсонизи-рованный фагоцитоз в макрофагах и восстанавливал экспрессию с/ЕВРв и MARCO [22].
-
4. IL-27. Экзогенный IL-27 индуцирует активацию mTOR через JAK/PI3K-путь и ингибирует IFN-y- стимулированную аутофагию. IL-27 также повышает экспрессию Mcl-1 через PI3k-путь [23] посредством конкурентной активации JAK/PI3 K/Akt/mTOR-каскада, так же как и увеличения Mcl-1, ингибирует IFN-γ-индуцированную аутофагию и элиминацию внутриклеточных бактерий в макрофагах [6].
-
5. Под воздействием минимально модифицированных LDL (mmLDL) активность mTORC1 усиливает индукцию хемокинов, усиливая IL6-сигналинг [25].
В то же время активация Pl3к/Akt-пути снижает продукцию IL27, так как фармакологическая блокада фосфорилирования Akt приводит к усиленной продукции IL-27 (p28) в LPS-стимулированных макрофагах [24].
В классическом IL6-сигналинге соединение цитокина с его рецептором IL6Ra на клеточной поверхности приводит к вовлечению сигнального передатчика gp130 и активации JAK1, которая фосфорилирует STAT3. Фосфорилированный STAT3 димеризуется и идет в ядро, где он начинает свою транскрипционную программу [26].
Несколько исследований подтвердили, что mTORC1 ответствен за фосфорилирование STAT3 в Ser [27]. Ding A. и коллеги обнаружили, что фосфорилирование STAT3 Ser727 в ответ на mmLDL было снижено в Mac-RapKO-макрофагах, и предварительное воздействие рапамицина отменяло фосфорилирование S6 и STAT3 Ser727. Фосфорилирование в Ser727 STAT3 усиливало его способность противодействовать эффекту BCL-6 в Ccl2-промоторе [25].
Стимуляция макрофагов с mmLDL индуцировала экспрессию хемокиновых генов Ccl2, Ccl3 и Ccl7 [28].
mTORCI усиливал эффект IL6/STAT3 на Ccl2-экспрессию генов, что обнаруживает новый перекрест сигналов между воспалительными путями, индуцированными mmLDL, и активацией mTORC1, индуцирующей хемотаксис моноцитов в очаг опухоли.
Много работ выполнено по определению роли растворимых факторов, таких как хемокины и факторы роста, в поляризационной функции макрофагов на протяжении опухолевой прогрессии. Например, хемокин CCL2 и макрофагальный колониестимулирующий фактор вовлекают моноциты в ткань опухоли, а затем IL-10 (при участии mTOR), IL-4, IL-13 и другие цитокины в микроокружении стимулируют моноциты к дифференцировке в M2 ОАМ [29].
mTOR в ОАМ. Для начала проясним роль mTOR в репрограммировании макрофагов в сторону М2-поляризации.
Под действием LPS в макрофагах mTORC1 активирует транскрипцию и трансляцию HIF1α [30], который, в свою очередь: а) связывается с TLR4-промотором, так же как с VEGF-промотором [31]; б) индуцирует гипоксия-ответственные гены, вовлеченные в ангиогенез и метаболизм глюкозы (например, фактор роста эндотелия (VEGF), глюкозные транспортеры (GLUT1 и GLUT3) и гексокиназы (HK1 и HK2), PAI-1, а также iNOS и многие другие, кодирующие ферменты гликолиза [32]; MMP-2 (матриксную металлопротеиназу-2) [33].
Более того, mTORCI связан с глутаминовым метаболизмом через контроль гидролиза глутамина до глутамата (критический момент в утилизации глутамина) [5]. Даже М1-макрофаги совмещают потребление глутамина с анаплеротическим пополнением цикла Кребса, который поддерживает продукцию цитрата и стабилизацию HIF1α [5].
Таким образом, mTOR обеспечивает не только трансляцию HlF-1a, но и ряда ферментов, поддерживающих активность гликолиза в опухоли и феномен Warburg, а усиленный гликолиз управляет потоком через ПФП, что приводит к повышению образования НАДФ, необходимого для синтеза АФК.
c-Myc усиливал IL-4-опосредованную STAT6-активацию и повышенную экспрессию 45% генов, коррелирующих с альтернативной активацией макрофагов. mTOR (S6K) поддерживает активацию c-Myc путем фосфорилирования в Ser145 Mad1, ингибитора c-Myc [35].
-
IL -4 и IL-13 сигнализируют через IRF/STAT, активируя STAT6 в М2-макрофагах. STAT6 индуцирует экспрессию регуляторов транскрипции, таких как PPAR-Y [36]. mTORCI поддерживает экспрессию и активность фактора PPAR-γ (peroxisome proliferator-activated receptor γ), который необходим для поддержания метаболического сдвига в сторону окислительного фосфорилирования, и поддерживает М2-экспрессию генов (Arg1), усиливая эффекторный фенотип M2-макрофагов (синтез коллагена) [37], а также Chi3l3, Mrc1 и Jag1).
-
IL-4 индуцирует также экспрессию PGC-1β мРНК и белка в покоящихся и в активированных макрофагах [11].
Из вышеизложенного следует, что mTOR необходим для осуществления метаболического сдвига и формирования М2-фенотипа макрофагов.
Стимуляция при помощи факторов роста (инсулина, GM–CSF и IL-3) приводит к STAT3-фосфорилированию в Ser727. Активированный STAT3 незаменим для поддержания клеточной выживаемости через регуляцию экспрессии Mcl-1 [38].
Известно, что многие целевые гены STAT3 вовлечены в развитие раковой опухоли, например HIF-1α, который играет ведущую роль в ангиогенезе [39], и TGFβ1, который поддерживает рост опухолевых клеток и метастазирование [40].
По данным Wei Chen и коллег, mTOR регулирует способность макрофагов индуцировать ангиогенез под действием IL10 : в клетках иммунной системы и в опухолевых клетках mTOR увеличивает секрецию IL-10, который поддерживает продукцию VEGF (а ра-памицин оказывает обратный эффект на секрецию IL-10 и VEGF) [41] .
Активированный mTOR поддерживает ангиогенез, индуцированный макрофагами, также через STAT3 (т. к. STAT3 является нижестоящей целью mTOR в макрофагах и других клеточных типах) [42].
Сведения, полученные Dru S. Dace и коллегами, также подтверждают роль IL10/STAT3-сигналинга в экспрессии VEGF: макрофаги, стимулированные с IL-10 в течение 10 минут или гипоксией в течение 24 часов, демонстрировали повышенное фосфорилирование STAT3 по сравнению с исходным нормоксиче-ским уровнем. Было показано, что STAT3-активация и сигналинг может приводить к экспрессии VEGF [43].
STAT3 может быть активирован через JAK/STAT3 (pY705) — путь, который индуцирует экспрессию HIF-1а и vEgF MEK/ERKMAPK-путь управляет активацией STAT3 (pS727), и c-KIT/PI3K/AKT/mTOR-путь также управляет фосфорилированием STAT3 (pS727), которое приводит к экспрессии IDO и HIF-1α [44].
Как упоминалось выше, активация mTOR под воздействием LPS увеличивает экспрессию IL10 [19].
IL10, в свою очередь, активирует STAT3 [45].
Активация сигнального передатчика и активатора транскрипции 3 (STAT3) опосредует роль ОAM в ангиогенезе при помощи повышения экспрессии нескольких проангиогенных факторов, например bVEGF и bFGF [46].
Доказано, что MMP-2 (один из целевых генов HIF1α, а следовательно, результат активации mTOR) и MMP-9 стимулируют продукцию TGFβ, VEGF, PDGF и FGF, а их экспрессия коррелирует с повышенной инвазивностью опухоли и плохим прогнозом [12]. Таким образом, проявляется роль mTOR в индукции перечисленных выше факторов роста в опухолевой прогрессии.
Сходный механизм описан для урокиназа-подоб-ного активатора плазминогена (uPA), который после соединения со своим рецептором (uPAR) на ОAM индуцирует расщепление плазминогена в плазмин, что приводит к деградации внеклеточного матрикса с последующим выделением факторов роста и неблагоприятным исходом [47].
Под воздействием PSGL-1 активация mTOR-сигналинга приводит к повышению трансляции рецептора uPAR (урокиназного активатора плазминогена), поддерживающего адгезию, миграцию и хемотаксис макрофагов в очаг повреждения.
Ключевым игроком в метастазировании является TGFβ, который продуцируется ОАМ; TGFβ запускает эпителиально-мезенхимальный переход, сдвигающий эпителиальные раковые клетки в сторону мезенхимального фенотипа, более склонного к миграции [48]. Иммуносупрессивная функция ОАМ также опосредуется при помощи секреции TGFβ вместе с IL-10, который снижает CD8+ T-клеточные функции не только прямой транскрипционной репрессией генов, кодирующих такие субстанции, как перфорины, гранзимы и цитотоксины, но и опосредованно, путем стимуляции пролиферации Treg-клеток или путем супрессии противоопухолевых функций дендритных клеток [49]. Более того, ОАМ индуцируют старвацию аминокислот в Т-клетках через продукцию аргиназы и индоламин-2,3-диоксигеназы (IDO) [50].
Заключение. Макрофаги представляют собой гетерогенную популяцию клеток, которые обладают удивительной пластичностью и живо реагируют на изменения в системе микроокружения. IFN-γ, LPS и GM–CSF индуцируют приобретение макрофагом свойств и метаболизма, характерных для М1-фенотипа (в том числе секреции провоспа-лительных цитокинов), а CSF-1, IL-4, IL-10, TGF-β и IL-13 индуцируют приобретение макрофагом М2-характеристик. В опухоли присутствуют и М1-, и М2-подобные макрофаги. Однако по мере опухолевой прогрессии ОАМ начинают приобретать все больше М2-характеристик, что в дальнейшем обусловливает неблагоприятный прогноз.
mTOR активно включается в процесс репрограммирования макрофагов в зависимости от вида стимула: под воздействием LPS киназа обеспечивает переход к гликолитическому окислению, которое лежит в основе метаболического сдвига, в том числе за счет повышения экспрессии и активации Hif-1α. Hif-1α, в свою очередь соединяясь с целевыми генами, принимает участие в поддержании процесса хронического воспаления и в канцерогенезе. Под воздействием IL4,13 mTOR-сигналинг обеспечивает экспрессию и активность PPAR-γ и PGC-1β, факторов транскрипции, необходимых для поддержания окислительного метаболизма в М2-макрофагах, экспрессии их маркеров, а также секрецию противовоспалительного цитокина IL-10, который также незаменим в процессе канцерогенеза.
mTORC1 вступает во взаимодействие с другими сигнальными путями в макрофагах:
-
- в TLR4-сигналинге активация mTOR способствует продукции IL-10, TNF-α, IL-6;
-
- в Nod2-сигналинге — продукции IL-10, TGF-β и IL-1Ra;
-
- под воздействием IFN-γ mTOR снижает экспрессию с/ЕВРв и MARCO, ингибируя неопсонизиро-ванный фагоцитоз;
-
- IL-27 индуцирует активацию mTOR и ингибирует IFN-γ-стимулированную аутофагию;
-
- под воздействием минимально модифицированных LDL (mmLDL) активность mTORC1 усиливает индукцию хемокинов CCL2, -3, -7, усиливая IL6-сигналинг, что обусловливает хемотаксис моноцитов в очаг опухоли, которые затем пополняют ряды ОАМ;
-
- факторы роста (инсулина, GM–CSF и IL-3) приводят к STAT3-фосфорилированию, что повышает выживаемость клеток, в том числе опухолевых, повышает продукцию bVEGF и bFGF, а также TGFβ1, принимающего участие в процессах роста и метастазирования.
mTOR в макрофагах принимает участие в продукции IL-10 под воздействием различных стимулов (сигналы с TLR4, Nod2-рецепторов). IL-10, в свою очередь, активирует STAT3-сигналинг, что приводит к экспрессии факторов HIF-1α, VEGF, FGF, а также стимулированию выработки TGFβ. Продукция данных цитокинов при непосредственном (IL-10) и косвенном участии mTOR (TGFβ, MMP2, VEGF, PDGF,
FGF) обусловливает роль киназы в повышении выживаемости опухолевых клеток, росте опухоли, в том числе инвазивном, ангиогенезе, метастазировании и неблагоприятном прогнозе заболевания при ее активации в ОАМ, что следует принимать во внимание при терапевтическом подходе в вопросе опухолей.
Список литературы Роль MTOR в репрограммировании опухоль-ассоциированных макрофагов и в канцерогенезе (обзор)
- Katholnig K, Linke M, Pham H, et al. Immune responses of macrophages and dendritic cells regulated by mTOR signaling. Biochemical Society Transactions 2013; 41 (4): 927-33.
- Crisan TO, Netea MG, Joosten LA. Innate immune memory: Implications for host responses to damage-associated molecular patterns. European Journal of Immunology 2016; 46 (4): 817-28.
- Luca C, Fragkogianni S, Sims AH, et al. Human Tumor-Associated Macrophage and Monocyte Transcriptional Landscapes Reveal Cancer-Specific Reprogramming, Biomarkers, and Therapeutic Targets. Cancer Cell 2019; 35 (4): 588-602.
- Laplante M, Sabatini DM. mTOR signaling in growth control and disease. Cell 2012; 149 (2): 274-93.
- Covarrubias AJ, Aksoylar HI, Horng T. Control of macrophage metabolism and activation by mTOR and Akt signaling. Seminars in Immunology 2015; 27 (4): 286-96.
- Abdalla AE, Li Q, Xie L, et al. Biology of IL-27 and its Role in the Host Immunity against Mycobacterium Tuberculosis. International Journal Biological Sciences 2015; 11 (2): 168-75.
- Sica A, Mantovani A. Macrophage plasticity and polarization: in vivo Veritas. The Journal of Clinical Investigation 2012; 122 (3) 787-95.
- Biswas SK. Metabolic Reprogramming of Immune Cells in Cancer Progression. Immunity 2015;43: 435-49.
- Krausgruber T, Blazek K, Smallie T, et al. IRF5 promotes inflammatory macrophage polarization and TH1-TH17 responses. Nature Immunology 2011; 12 (3): 231-8.
- Jenkins SJ, Ruckerl D, Thomas GD, et al. IL-4 directly signals tissue-resident macrophages to proliferate beyond homeostatic levels controlled by CSF-1. The Journal of Experimental Medicine 2013; 210 (11): 2477-91.
- Odegaard JI, Ricardo-Gonzalez RR, Goforth MH, et al. Macrophage-specific PPARgamma controls alternative activation and improves insulin resistance. Nature 2007; 447 (7148): 1116-20.
- Mantovani A, Marchesi F, Malesci A, et al. Tumor-associated macrophages as treatment targets in oncology. Nat Rev Clin Oncol 2017; 14: 399-416.
- Allavena P, Mantovani A. Immunology in the clinic review series; focus on cancer: Tumor-associated macrophages: Undisputed stars of the inflammatory tumor microenvironment. Clin Exp Immunol 2012; 167: 195-205.
- Zumsteg A, Christofori G. Corrupt policemen: Inflammatory cells promote tumor angiogenesis. Curr Opin Oncol 2009; 21: 60-70.
- Lawrence T, Natoli G. Transcriptional regulation of macrophage polarization: enabling diversity with identity. Nat Rev Immunol 2011 Oct 25; 11 (11): 750-61.
- R. Ostuni F, Kratochvill PJ, Murray, et al. Macrophages and cancer: from mechanisms to therapeutic implications. Trends in Immunology 2015; 36 (4): 229-39.
- Mercalli A, Calavita I, Dugnani E, et al. Rapamycin unbalances the polarization of human macrophages to M1. Immunology 2013; 140 (2): 179-90.
- Sengupta S, Peterson TR, Sabatini DM. Regulation of the mTOR complex 1 pathway by nutrients, growth factors, and stress. Molecular Cell 2010; 40 (2): 310-22.
- Schmitz F, Heit A, Dreher S, et al. Mammalian target of rapamycin (mTOR) orchestrates the defense program of innate immune cells. The European Journal of Immunology 2008; 38 (11): 2981-92.
- Chen H, Cowan MJ, Hasday JD, et al. Tobacco smoking inhibits expression of proinflammatory cytokines and activation of IL-1R-associated kinase, p38, and NF-kappaB in alveolar macrophages stimulated with TLR2 and TLR4 agonists. Journal of Immunology 2007; (179): 6097-106.
- Hedl M, Abraham C. Secretory Mediators Regulate Nod2-Induced Tolerance in Human Macrophages. Gastroenterology 2011; 140 (1): 231-41.
- Wang Z, Zhou S, Sun C, et al. Interferon^ inhibits nonopsonized phagocytosis of macrophages via an mTORC1-c/EBPß pathway. Journal of Innate Immunity 2015; 7 (2): 165-76.
- Sharma G, Dutta RK, Khan MA, et al. IL-27 inhibits IFN-y induced autophagy by concomitant induction of JAK/PI3 K/Akt/mTOR cascade and up-regulation of Mcl-1 in Mycobacterium tuberculosis H37Rv infected macrophages. International Journal of Biochemistry & Cell Biology 2014; (55): 335-47.
- Bosmann M, Haggadone MD, Hemmila MR, et al. Complement activation product C5a is a selective suppressor of TLR4-induced, but not TLR3-induced, production of IL-27 (p28) from macrophages. Journal of Immunology 2012; 188 (10): 5086-93.
- Ding A, Hongfeng J, Westerterp M, et al. Disruption of mTORC1 in Macrophages Decreases Chemokine Gene Expression and Atherosclerosis. Circulation Research 2014; 114 (10): 1576-84.
- Naugler WE, Karin M. The wolf in sheep's clothing: the role of interleukin-6 in immunity, inflammation and cancer. Trends in Molecular Medicine 2008; 14 (3): 109-19.
- Goncharova EA, Goncharov DA, Damera G, et al. Signal transducer and activator of transcription 3 is required for abnormal proliferation and survival of tsc2-deficient cells: Relevance to pulmonary lymphangioleiomyomatosis. Molecular Pharmacology 2009 (76): 766-77.
- Schroer N, Pahne J, Walch B, et al. Molecular pathobiology of human cervical high-grade lesions: Paracrine stat3 activation in tumor-instructed myeloid cells drives local mmp-9 expression. Cancer Research 2011; (71): 87-97.
- Dyken van SJ, Locksley RM. Interleukin-4- and interleukin-13-mediated alternatively activated macrophages: roles in homeostasis and disease. Annu Rev Immunol 2013; 31: 317-43.
- Hudson CC, Liu M, Chiang GG, et al. Regulation of hypoxia-inducible factor 1alpha expression and function by the mammalian target of rapamycin. Molecular Cell Biology 2002; 22 (20): 7004-14.
- Kim SY, Choi YJ, Joung SM, et al. Hypoxic stress up-regulates the expression of Toll-like receptor 4 in macrophages via hypoxia-inducible factor. Immunology 2010; 129 (4): 516-24.
- Wenger RH. Cellular adaptation to hypoxia: O2-sensing protein hydroxylases, hypoxia-inducible transcription factors, and O2-regulated gene expression. The FASEB Journal 2002; 16 (10): 1151-62.
- Semenza GL. Targeting hif-1 for cancer therapy. National Reviews. Cancer 2003; (3): 721-32.
- Csibi A, et al. The mTORC1/S6K1 pathway regulates glutamine metabolism through the eIF4B-dependent control of c-Myc translation. Current biology 2014; 24 (19): 2274-80.
- Sears R, Nuckolls F, Haura E, et al. Multiple Ras-dependent phosphorylation pathways regulate Myc protein stability. Genes & Development 2000; 14 (19): 2501-14.
- Martinez FO, Gordon S, Locati M, Mantovani A. Transcriptional profiling of the human monocyte-to-macrophage differentiation and polarization: new molecules and patterns of gene expression. Journal of Immunology 2006; 177 (10): 7303-11.
- Xu X, Grijalva A, Skowronski A, et al. Obesity activates a program of lysosomal-dependent lipid metabolism in adipose tissue macrophages independently of classic activation. Cell Metabolism 2013; (18): 816-30.
- Liu H, Ma Y, Cole SM, et al. Serine phosphorylation of STAT3 is essential for Mcl-1 expression and macrophage survival. Blood 2003; 102 (1): 344-52.
- Philip B, Ito K, Moreno-Sánchez R, et al. HIF expression and the role of hypoxic microenvironments within primary tumors as protective sites driving cancer stem cell renewal and metastatic progression. Carcinogenesis 2013; 34 (8): 1699-707.
- Muraoka-Cook RS, Kurokawa H, Koh Y, et al. Conditional overexpression of active transforming growth factor beta1 in vivo accelerates metastases of transgenic mammary tumors. Cancer Research 2004; 64 (24): 9002-11.
- Chen W, Ma T, Shen X, et al. Macrophage-Induced Tumor Angiogenesis Is Regulated by the TSC2 — mTOR Pathway. Cancer Research 2012; (72): 1363.
- Ma J, Meng Y, Kwiatkowski DJ, et al. Mammalian target of rapamycin regulates murine and human cell differentiation
- through STAT3/p63/Jagged/Notch cascade. The Journal of Clinical Investigation 2010; (120): 103-14.
- Sumimoto H, Imabayashi F, Iwata T, et al. The BRAF-MAPK signaling pathway is essential for cancer-immune evasion in human melanoma cells. The Journal of Experimental Medicine 2006; (203): 1651-6.
- Cannon MJ, Ghosh D, Gujja S. Signaling Circuits and Regulation of Immune Suppression by Ovarian Tumor-Associated Macrophages. Vaccines (Basel) 2015; 3 (2): 448-66.
- Bosch van den MW M, Palsson-Mcdermott E, Johnson DS, et al. LPS Induces the Degradation of Programmed Cell Death Protein 4 (PDCD4) to Release Twist2, activating c-Maf Transcription to Promote Interleukin-10 Production. The Journal of Biological Chemistry 2014; (289): 22980-90.
- Kujawski M, Kortylewski M, Lee H, et al. Stat3 mediates myeloid cell-dependent tumor angiogenesis in mice. The Journal of Clinical Investigation 2008; 118 (10): 3367-77.
- Foekens JA, Peters HA, Look, et al. The urokinase system of plasminogen activation and prognosis in 2780 breast cancer patients. Cancer Res 2000; (60): 636-43.
- Bonde AK, Tischler V, Kumar S. Intratumoral macrophages contribute to epithelial-mesenchymal transition in solid tumors. BMC Cancer 2012; (12): 35.
- Thomas DA, Massague J. TGF-ß directly targets cytotoxic T cell functions during tumor evasion of immune surveillance. Cancer Cell 2005; (8): 369-80.
- Sica A, Melillo G, Varesio L. Hypoxia: A double-edged sword of immunity. J Mol Med 2011; (89): 657-65.


