Роль N-концевого предшественника натрийуретического пептида C-типа как диагностического маркёра лёгочной гипертензии у больных ХОБЛ
Автор: Гайнитдинова В.В., Шарафутдинова Л.А., Авдеев С.Н.
Журнал: Евразийский кардиологический журнал @eurasian-cardiology-journal
Рубрика: Оригинальные статьи
Статья в выпуске: 4, 2015 года.
Бесплатный доступ
Актуальность. Согласно литературным источникам, данные о диагностической значимости N-концевого предшественника натрийуретического пептида С-типа (NT-proCNP) для прогнозирования лёгочной гипертензии (ЛГ) у пациентов с ХОБЛ немногочисленны. Цель. Определить концентрацию NT-proCNP у больных ХОБЛ и оценить его диагностическую ценность для прогнозирования ЛГ при ХОБЛ. Материал и методы. В исследование были включены 47 пациентов с ХОБЛ (GOLD II-IV, в возрасте 59,49±0,63 лет, с длительностью заболевания 13,7±0,63 лет, индексом курения 23,09±0,93 пачек/лет). Концентрацию NT-proСNP в сыворотке крови определяли с помощью ИФА (тест Biomedica Medizin produkte GmbH&Co KG, Австрия). Максимальное систолическое давление в лёгочной артерии (СДЛА) оценивали с помощью непрерывно-волновой допплерографии. Результаты. Концентрации NT-proCNP были значительно выше у пациентов с ХОБЛ с ЛГ (СДЛА 40-55 мм рт. ст., n=16) или тяжелой ЛГ (≥55 мм рт. ст., СДЛА, n=10), чем у пациентов без ЛГ (СДЛА Objective. Available data on the diagnostic value of determination of the concentration N-terminal pro-C-type natriuretic peptide (Nt-proCNP) to predict pulmonary hypertension (PH) in patients with COPD are few. Aim. To determine the concentration of NT-proCNP in COPD patients and evaluate its diagnostic value for the prediction of PH in COPD. Methods. The study involved 47 patients with COPD (GOLD II-IV, age 59,49±0,63 years, disease duration 13,7±0,63 years, smoking history 23,09±0,93 packs/years). NT-proCNP concentration in serum was assessed by ELISA technique (test Biomedica Medizinprodukte GmbH & Co KG, Austria). The pulmonary artery systolic pressure (SPAP) was analyzed by using a color-Doppler technique. Results. Concentrations of NT-proCNP were significantly higher in COPD patients with PH (SPAP 40-55 mmHg, n=16) or severe PH (SPAP ≥55 mmHg, n=10) than in patients without PH (SPAP
Хроническая обструктивная болезнь лёгких, лёгочная гипертензия, n-концевой предшественник натрийуретического пептида с-типа
Короткий адрес: https://sciup.org/14342802
IDR: 14342802
Текст научной статьи Роль N-концевого предшественника натрийуретического пептида C-типа как диагностического маркёра лёгочной гипертензии у больных ХОБЛ
Лёгочная гипертензия (ЛГ) является частым, прогностически неблагоприятным осложнением хронической обструктивной болезни лёгких (ХОБЛ) [1]. Повышение среднего давления в лёгочной артерии (СрДЛА) >20 мм рт. ст. наблюдается у 90% пациентов с крайне-тяжёлым течением ХОБЛ (IV степенью тяжести, GOLD 2011 г.), при этом в большинстве случаев оно колеблется между 20 и 35 мм рт. ст. и только у 3-5% пациентов СрДЛА превышает 35 мм рт. ст. [2,3]. Патогенез сосудистых нарушений, связанных с ХОБЛ до конца не изучен, но предполагается, что причиной развития и становления лёгочной гипертензии является совокупное воздействие гипоксии [4], нарушения лёгочной функции с формированием воздушных ловушек [5], токсического влияния курения [6,7], сосудистого воспаления [8], дисфункции эндотелия [9,10] и неоангиогенеза [11].
Для прогнозирования развития ЛГ у больных ХОБЛ целесообразно как сочетанное использование известных биомаркёров, так и поиск новых. Одним из таких маркёров может стать N-концевой предшественник натрийуретического пептида C-типа (Nt-proCNP), являющийся паракринной молекулой и синтезирующийся, в основном, в эндотелии сосудов [12].
Задачей настоящего исследования явилось определение концентраций N-концевого предшественника натрийуретического пептида С-типа (NT-proCNP) у больных ХОБЛ и оценить его диагностическую ценность для прогнозирования ЛГ при ХОБЛ.
МАТЕРИАЛ И МЕТОДЫ
В исследование были включены 47 пациентов с тяжёлым обострением [13] ХОБЛ (II-IV степени тяжести по классификации GOLD 2011 г., мужчин 44, женщин 3, средний возраст 59,49 ±0,63 лет, длительность заболевания 13,7±0,63 лет, индекс курения 23,09±0,93 пачек/лет, ИМТ 27,22±9,06 м/кг2).
В зависимости от наличия и степени повышения СДЛА пациенты были разделены на три группы: 1-я – без лёгочной гипертензии (СДЛА <40 мм рт. ст., n=21), 2-я – с нетяжёлой лёгочной гипертензией (СДЛА 40-55 мм рт. ст., n=16), 3-я группа – с тяжёлой лёгочной гипертензией (СДЛА >55 мм рт. ст., n=10) [14].
Критерием лёгочной гипертензии с учётом параметров доп-плер-эхокардиографии было увеличение СДЛА >40 мм рт. ст. в покое [14].
Критериями исключения из исследования были: хроническая сердечная недостаточность (с ФВ левого желудочка <50%), портальная гипертензия, ТЭЛА, заболевания соединительной ткани, ВИЧ-инфекция, приём анорексигенных препаратов.
Исследование функции внешнего дыхания (ФВД) включало в себя проведение спирометрии (форсированная жизненная емкость лёгких – ФЖЕЛ, объём форсированного выдоха за 1-ю секунду – ОФВ1, модифицированный индекс Тиффно ОФВ1/ФЖЕЛ), общей бодиплетизмографии (измерение функциональной остаточной ёмкости – ФОЕ, определение жизненной ёмкости лёгких – ЖЕЛ, общей ёмкости лёгких – ОЕЛ, остаточного объема лёгких – ООЛ); исследование диффузионной способности лёгких (DLCO) и её отношения к альвеолярному объёму (DLCO/VА). Исследование ФВД проводили на оборудовании Master Screen Body (Erich Jaeger, Германия). Полученные данные сопоставляли с должными величинами (ЕРО, 1993 г.) [15].
Эхокардиографическое исследование сердца проводилось на аппарате Fillips INVVISER CHD, изучались стандартные параметры гемодинамики, СДЛА определяли с помощью непрерывно-волновой допплеркардиографии. Систолический градиент давления между правым желудочком (ПЖ) и правым предсердием (ПП) рассчитывали по формуле Бернулли с использованием пиковой скорости потока трикуспидальной регургитации [16]. Сумму транстрикуспидального градиента и давления в ПП принимали равной СДЛА (в отсутствие стеноза клапана лёгочной артерии). Давление в ПП оценивали эмпирически, используя метод B. Kircher [16].
Плазменный уровень N-концевого натрийуретического пептида С-типа (NT-pro СNP) определяли иммуноферментным методом с помощью набора Biomedica Medizinprodukte GmbH and Co KG, A-1210 (Австрия).
Статистическую обработку данных производили в пакете прикладных программ STATISTICA V.7.0 ("StatsoftInc", США). Для всех имеющихся выборок проводили анализ соответствия вида распределения количественных признаков закону нормального распределения с помощью критерия Шапиро-Уилка. Поскольку распределение признаков в группах не являлось нормальным, сравнительный анализ групп проводился с помощью непараметрических методов. Для сравнения трёх групп использовался ранговый анализ вариаций по Краскел-лу-Уоллису. В случае если нулевая гипотеза об отсутствии различий отклонялась, проводили парное сравнение групп с использованием непараметрического теста Манна-Уитни. Количественные данные представлены в виде М ± m, где М – выборочное среднее, m – стандартная ошибка средней. Различия считали статистически значимыми при p<0,05. Для анализа чувствительности диагностического теста использовали пакет прикладных программ SPSS for Windows, Release 22.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Группы пациентов не различались по возрасту, половой принадлежности, длительности заболевания. Однако ИК и частота обострений заболевания в течение года были значительно выше у пациентов с тяжёлой лёгочной гипертензией по сравнению с пациентами без ЛГ (p<0,05) и нетяжёлой ЛГ (p<0,05) (табл. 1).
Согласно спирометрической классификации (GOLD 2011 г.) II степень тяжести отмечалась у 11 (23,4%) больных, III степень тяжести - у 23 (48,9%) больных и IV степень тяжести регистрировалась у 12 (25,5%) пациентов.
Повышение СДЛА отмечалось у 21 (44,7%) пациента; нетяжёлая ЛГ (СДЛА 40–55 мм рт. ст.) регистрировалась у 16 (34 %) пациентов, тяжёлая ЛГ (СДЛА ≥ 55 мм рт. ст.) – у 10 (21,3%) пациентов.
Средние спирометрические показатели согласно классификации (GOLD 2011 г.) в группах больных без ЛГ и нетяжёлой ЛГ соответствовали III (тяжёлой) степени тяжести: форсированная жизненная ёмкость лёгких (ФЖЕЛ) составила 66,5±1,93% и 61,6±2,31% от должных величин; объём форсированного выдоха за первую секунду (ОФВ1) – 38,7±1,58% и 32,9±2,11% от должных величин, модифицированный индекс Тиффно составил 44,3±1,09 % и 42,6±1,75%, соответственно. Бронхиальная обструкция в группе больных с нетяжёлой ЛГ была сильнее по сравнению с группой больных без ЛГ (p1-2). В то же время у пациентов с тяжёлой ЛГ отмечались более значимые нарушения функции внешнего дыхания по сравнению с пациентами без ЛГ и нетяжёлой ЛГ. Так, значительно ниже был показатель ФЖЕЛ, в среднем он составлял 49,7±2,44% от должных величин (p2-3<0,001, p1-3<0,001), ОФВ1 соответствовал IV степени тяжести, в среднем составлял 27,2±2,16% от должных величин (p2-3<0,05, p1-3<0,001), отношение ОФВ1/ ФЖЕЛ - 44,2±2,54 (p2-3 =0,23, p1-3< 0,87) (табл. 1).
Определение лёгочных объёмов показало статистически значимое увеличение ОЕЛ у больных с тяжёлой ЛГ по сравнению с аналогичным показателем у больных 1-й и 2-й групп (p1-2=0,21, p2-3=0,13, p1-3<0,04); увеличение ООЛ у больных с нетяжёлой и тяжёлой ЛГ, по сравнению с ООЛ в группе больных без ЛГ (p1-2<0,001, p1-3=0,001). Также наблюдались выраженные различия между группами по отношению ООЛ/ ОЕЛ (p1-2=0,04, p2-3=0,002, p1-3<0,001). Таким образом, наиболее выраженные изменения лёгочных объемов, сопровождающихся снижением диффузионной способности лёгких и альвеолярной вентиляции, наблюдались у больных с тяжёлой лёгочной гипертензией.
Определение показателя систолического давления в лёгочной артерии у больных ХОБЛ выявил ряд особенностей. Повышение СДЛА отмечалось у 21 (44,7%) пациента; нетяжёлая ЛГ (СДЛА 40–55 мм рт. ст.) регистрировалась у 16 (34 %), тяжёлая ЛГ (СДЛА ≥ 55 мм рт. ст.) - у 10 (21,3%) пациентов.
Уровень СДЛА в группе больных без ЛГ составлял 30,8±0,45 мм рт. ст., в группе больных с нетяжёлой ЛГ – 44,6±0,57 мм рт. ст. и в группе больных с тяжёлой ЛГ СДЛА составило 64,6±1,72 мм рт. ст.
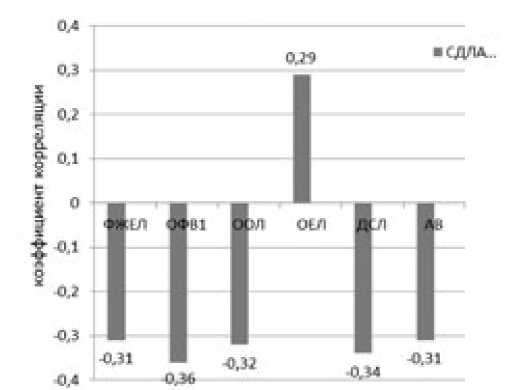
Анализ корреляционных взаимоотношений СДЛА и показателей функции внешнего дыхания показал связи умеренной силы с ФЖЕЛ (r=-0,31, p<0,05), ОФВ1 (r=-0,36, p<0,05), ООЛ (r=-0,32, p<0,05), ООЛ/ОЕЛ (r=0,29, p<0,05). Показана обратная связь между степенью ЛГ и DLСО при (r=-0,34, p<0,05), показателем альвеолярной вентиляцией (r=-0,29, p<0,05) (рис. 1).
Рисунок 1. Корреляционные взаимосвязи СДЛА с показателями функции внешнего дыхания
При сравнении концентраций NT-proCNP у больных без ЛГ, у больных с нетяжёлой ЛГ и пациентов с тяжёлой ЛГ были выявлены статистически высокозначимые различия (p1-2=0,001, p2-3=0,001, p1-3<0,001). Концентрация плазменного NT-proСNP у больных без ЛГ в среднем составила 1,42±0,03 пг/мл, у больных с нетяжёлой ЛГ – 4,14±0,51пг/мл. Наибольшее зна-
Таблица 1. Показатели комплексной оценки функции внешнего дыхания у больных ХОБЛ в зависимости и наличия и степени лёгочной гипертензии
|
Показатель |
СДЛА <40 мм рт. ст. (n=21) |
СДЛА 40-55 мм рт. ст. (n=16) |
СДЛА ≥ 55 мм рт. ст. (n=10) |
p |
||
|
1-2 |
1-3 |
2-3 |
||||
|
ФЖЕЛ, % |
66,5±1,93 |
61,6±2,31 |
49,7±2,44 |
0,07 |
<0,001 |
<0,001 |
|
ОФВ1, % |
38,7±1,58 |
32,9±2,11 |
27,2±2,16 |
0,02 |
0,002 |
0,05 |
|
ОФВ1/ФЖЕЛ |
44,3±1,09 |
42,6±1,75 |
44,2±2,54 |
0,16 |
0,87 |
0,23 |
|
ОЕЛ, л |
9,6±4,08 |
9,9±0,36 |
11,1±0,52 |
0,21 |
0,04 |
0,13 |
|
ООЛ, л |
4,9 ±0,07 |
5,2±0,08 |
5,4±1,13 |
0,001 |
0,001 |
0,38 |
|
ООЛ/ОЕЛ, % |
195,5±21,18 |
201,1±26,81 |
223,2±28,25 |
0,04 |
0,001 |
0,002 |
|
DLCO, % |
69,5±0,80 |
67,6±0,22 |
63,3±1,41 |
0,08 |
0,008 |
0,05 |
|
АВ, % |
78,6±1,25 |
76,6±1,72 |
57,7±1,09 |
0,12 |
0,001 |
0,001 |
-joUXecTBo/x

Министерство здравоохранения Российской Федерации
ФГБУ Российский кардиологический научно-производственный комплекс
Министерства здравоохранения РФ
Российское медицинское общество по артериальной гипертонии
Российское научное общество по изучению легочной гипертензии
°ciety of
IV ВСЕРОССИЙСКИЙ
КОНГРЕСС
«ЛЁГОЧНАЯ ГИПЕРТЕНЗИЯ»
Тезисы принимаются до 1 октября 2016 г.
МОСКВА» 15-16 декабря 2016 г.
чение наблюдалось в группе больных с тяжёлой ЛГ – 5,26 ±0,21пг/мл.
При изучении взаимоотношений выявлены корреляционные связи концентрации Nt-proCNP с СДЛА (r=0,53, p<0,05), СРБ (r=0,50, p<0,05), размером ПП (r=0,38, p<0,05), ТПСПЖ (r=0,35, p<0,05), КДРПЖ (r=0,39, p<0,05), SaO2 (r=-0,45, p<0,05).
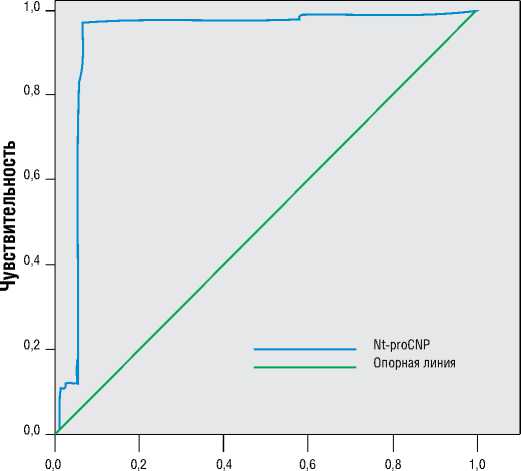
ROC-анализ для Nt-proCNP показал высокую диагностическую значимость определения концентрации этого биомаркёра для прогнозирования ЛГ у больных ХОБЛ. Показатель площади под кривой ROC для Nt-proCNP у больных с нетяжёлой ЛГ составил 0,928 (p<0,05; 95%, ДИ 0,856-0,977), с тяжёлой ЛГ - 0,932 (p<0,05; 95%, ДИ 0,886-0,977), что соответствовало отличному качеству построенной модели. Анализ показал, что чувствительность определения концентрации Nt-proCNP для прогнозирования нетяжёлой и тяжёлой ЛГ составляла 86% и 88%, а специфичность – 97%, соответственно. Т.е. диагностическая значимость положительных результатов показала, что в 86% и 88% случаев концентрации Nt-proCNP у больных с нетяжёлой и тяжёлой ЛГ превышал 2,16 пг/мл и 3,62 пг/мл (рис. 2).
Рисунок 2. ROC-кривая определения диагностической ценности концентрации Nt-proCNP у больных ХОБЛ с тяжёлой лёгочной гипертензией
1-Специфичность
Регрессионный анализ пропорциональных рисков Кокса госпитальной (22–дневной) летальности больных ХОБЛ с лёгочной гипертензией выявил уровень риска 10 предикторных переменных, одним из которых является концентрация Nt-proCNP (ОР 1,32; 95% ДИ 1,2-2,6; р=0,001).
ОБСУЖДЕНИЕ
В настоящем исследовании изучалось содержание NT-proCNP у больных ХОБЛ и его диагностическая ценность для прогнозирования ЛГ у этой категории больных.
Ремоделирование лёгочной артерии (ЛА) наблюдается уже на ранних этапах развития ХОБЛ, приводит к формированию лёгочной гипертензии, является следствием дисфункции эндотелия, коагулопатии, гипоксической вазоконстрикции, деструкции лёгочного капиллярного русла, воспалительной инфильтрацией сосудистой стенки, вызванной курением, а также сдвига напряжения за счёт перераспределения кровотока [3,14]. Частота выявления ЛГ зависит от тяжести заболевания и используемых методов диагностики [14]. ЛГ при ХОБЛ чаще бывает лёгкой и умеренной, и лишь у небольшого числа пациентов развивается тяжёлая "диспропорциональная" к степени ограничения воздушного потока ЛГ (СрДЛА >40 мм рт. ст.). Тяжёлая ЛГ у пациентов с ХОБЛ снижает среднюю выживаемость примерно на 40 месяцев [2].
В настоящем исследовании у всех больных ХОБЛ наблюдалось увеличение лёгочных объемов за счёт выраженного увеличения ООЛ, снижение показателей ФЖЕЛ, ОФВ1, диффузионной способности лёгких и объёма альвеолярной вентиляции. Наиболее значимые функциональные нарушения лёгочной вентиляции отмечены в группе больных ХОБЛ с тяжёлой ЛГ, что подтверждают выявленные корреляционные взаимосвязи ФДВ и СДЛА.
В последние годы обсуждается дисфункция эндотелия лёгочных сосудов. Эндотелиальные клетки лёгочных сосудов обладают паракринной, метаболической активностью, способностью выделять вазоактивные соединения, действующие на тонус сосудов и вызывающие гипоксическую вазоконстрикцию. В настоящее время известно, что один из видов натрийуретических пептидов – натрийуретический пептид С-типа (CNP) широко экспрессируется в различных тканях, в частности, с высокой концентрацией в сосудистом эндотелии [19], имеет некоторое структурное сходство с предсердным натрийуретическим пептидом (ANP) и мозговым натрийуретическим пептидом (BNP), в норме циркулирует в низкой концентрации. CNP, связываясь в рецепторами мозгового натрийретического пептида (NPR-B), через действие гаунилатциклазы и цГМФ оказывает вазодилатирующее действие и подавляет рост гладкомышечных клеток (ГМК) сосудов, модулируя их фенотип. Важное защитное действие CNP в отношении сердечно-сосудистой системы проявляется в его ингибирующем действии на процесс формирования фиброза, ремоделирования сердца и сосудов после травмы [20]. По сравнению с ANP и BNP, CNP оказывает ограниченный диуретический и натрийуретический эффект, но противодействует индуцированной ангиотензином II или эндотелином-1 вазоконстрикции и дополняет действия других эндотелиальных сосудорасширяющих медиаторов, таких как оксид азота (NO) и простациклин [21]. В связи с коротким периодом полураспада CNP, уровень циркулирующего в плазме пептида может не соответствовать концентрации ткани вблизи места секреции [18]. N-концевой фрагмент предшественника натрийуретического пептида С-типа (NT-proCNP) в плазме крови человека циркулирует в эквимолярных концентрациях с CNP и считается более надежным маркёром степени биосинтеза CNP [17].
Содержание CNP изучалось при хронической почечной недостаточности, при сепсисе [21], в человеческой неоинтимальной ГМК после ангиопластики [22], при атеросклеротическом стенозе аортального клапана [23], при ХСН [10, 24, 89,96], при диабетической кардиомиопатии в генетической мышиной модели заболевания [24]. На животных моделях показано, что воспалительные цитокины, такие как IL-1, TNF-a, и эндотоксины вызывают высвобождение CNP из эндотелиальных клеток [25].
В исследовании Cargill и кол. показано значительное (в 3,2
раза) повышение плазменного уровня CNP при лёгочном сердце, по сравнению с хронической сердечной недостаточностью. Авторы предположили, что причиной повреждения эндотелия, при котором CNP может просачиваться в плазму в большем количестве, является хроническая артериальная гипоксемия [26].
В настоящем исследовании показано, что значения NT-proCNP повышаются по мере увеличения степени ЛГ. У больных ХОБЛ с тяжёлой ЛГ выявлено повышение плазменного уровня NT-proCNP в 1,3 и 3,7 раза по сравнению с группами больных ХОБЛ с нетяжёлой ЛГ и без ЛГ, соответственно.
По данным литературных источников ROC анализ для NT-proCNP проводился для прогнозирования сепсиса у больных в критическом состоянии (площадь под кривой составила (AUC)=0,661). Его диагностическая значимость сопоставима с таковой для классических маркёров воспаления и бактериальной инфекции [22].
В настоящем исследовании анализ ROC-кривой для Nt-proCNP показал высокую диагностическую значимость определения концентрации исследуемого биомаркёра для прогнозирования ЛГ у больных ХОБЛ. В других исследованиях для прогнозирования ЛГ у больных ХОБЛ показана диагностическая и прогностическая ценность BNP [27].
Таким образом, у больных ХОБЛ с лёгочной гипертензией выявлено повышение концентрации NT-proCNP, коррелирующее с тяжестью ЛГ. Определение концентрации NT-proCNP является чувствительным и специфичным для прогнозирования нетяжёлой и тяжёлой ЛГ при ХОБЛ.
Список литературы Роль N-концевого предшественника натрийуретического пептида C-типа как диагностического маркёра лёгочной гипертензии у больных ХОБЛ
- Weitzenblum E., Hirth C., Ducolone A. et al. Prognostic value of pulmonary artery pressure in chronic obstructive pulmonary disease. Thorax 1981; 36:752-758.
- Chaouat A., Bugnet A-S., Kadaoui N., et al. Severe pulmonary hypertension and chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2005; 172:189-94.
- Andersen K.H., Iversen M., Kjaergaard J., et al. Prevalence, predictors and survival in pulmonary hypertension related to end-stage chronic obstructive pulmonary disease. J Heart Lung Transplant 2012; 31:373-80.
- Burrows B. Arterial oxygenation and pulmonary hemodynamics in patients with chronic airways obstruction. Am Rev Respir Dis., 1974; 110: 64-70.
- Wright J.L. Relationship of pulmonary arterial pressure and airflow obstruction to emphysema. J Appl Physiol 1993; 74:1320-4.
- Santos S., Peinado V.I., Ramirez., et al. Characterization of pulmonary vascular remodeling in smokers and patients with mild COPD. Eur Respir J 2002; 19:632-8.
- Hale K.A., Ewing S.L., Gosnell B.A., et al. Lung disease in long-term cigarette smokers with and without chronic air-flow obstruction. Am Rev Respir Dis 1984; 130:716-21.
- Peinado V.I., Barbera J.A., Abate P., et al. Inflammatory reaction in pulmonary muscular arteries of patients with mild chronic obstructive pulmonary disease. Am J Respir Crit Care Med 1999; 159:1605-11.
- Dinh-Xuan A.T., Higenbottam T.W., Clelland C.A., et al. Impairment of endothelium-dependent pulmonary-artery relaxation in chronic obstructive lung disease. N Engl J Med 1991; 324:1539-47.
- Peinado V.I., Barbera J.A., Ramirez J., et al. Endothelial dysfunction in pulmonary arteries of patients with mild COPD. Am J Physiol 1998; 274:908-13.
- Santos S., Peinado V.I., Ramirez J., et al. Enhanced expression of vascular endothelial growth factor in pulmonary arteries of smokers and patients with moderate chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2003; 167:1250-6.
- Sellitti D. F. Regulation of C-type natriuretic peptide expression. Peptides 2011; 32:1964-1971.
- Cazzola M., MacNee W., Martinez F. J. Outcomes for COPD pharmacological trials: from lung function to biomarkers. Eur Respir J. 2008; 31:416-469.
- Seeger W., Adir Y., Barberà J.A. et al. Pulmonary Hypertension in Chronic Lung Diseases. Journal of the American College of Cardiology 2013; 62 (25., Suppl D): 110-116.
- Quanjer Ph.H., Tammelling G., Gotes J.E. et al. Lung volumes and forced ventilator flows. Eur Respir J1993; 6(Suppl.16): 5-40.
- Авдеев С.Н., Неклюдова Г.В. Диагностика лёгочной гипертензии. Методические рекомендации. Москва 2014:1-51.
- Suga S., Nakao K., Itoh H., Komatsu Y., Ogawa Y., Hama N., Imura H: Endothelial production of C-type natriuretic peptide and its marked augmentation by transforming growth factor-beta. Possible existence of “vascular natriuretic peptide system”. J Clin Invest 1992; 90:1145-1149.
- Soeki T., Kishimoto I., Okumura H., Tokudome T., Horio T., Mori K., et al. C-type natriuretic peptide., a novel antifibrotic and antihypertrophic agent, prevents cardiac remodeling after myocardial infarction. J Am Coll Cardiol 2005; 5:608-16.
- Scotland R.S., Ahluwalia A., Hobbs A.J. C-type natriuretic peptide in vascular physiology and disease. Pharmacol Ther2005; 105:85-93.
- Almeida F.M., Suzuki M., Scarborough R.M., et al. Clearance function of type C receptors of atrial natriuretic factor in rats. Am J Physiol. 1989; 256:469-475.
- Vlachopoulos C., Ioakeimidis N., Terentes-Printzios D., Aznaouridis K., Baou K., Bratsas A., Lazaros G., Stefanadis C: Amino-terminal pro-C-type natriuretic peptide is associated with arterial stiffness., endothelial function and early atherosclerosis. Atherosclerosis 2010; 211:649-655
- Naruko T., Itoh A., Haze K., Ehara S., Fukushima H., Sugama Y., et al. C-type natriuretic peptide and natriuretic peptide receptors are expressed by smooth muscle cells in the neointima after percutaneous coronary intervention. Atherosclerosis 2005;181:241-50
- Peltonen T.O., Taskinen P., Soini Y., Rys J., Ronkainen J., Ohtonen P., et al. Distinct downregulation of C-type natriuretic peptide system in human aortic valve stenosis. Circulation 2007; 116:1283-9.
- Christoffersen C., Bartels E.D., Nielsen L.B. Heart specific up-regulation of genes for B-type and C-type natriuretic peptide receptors in diabetic mice. Eu J Clin Invest 2006; 36:69-75.
- Suga S., Itoh H., Komatsu Y., Ogawa Y., Hama N., Yoshimasa T., Nakao K. Cytokine-induced C-type natriuretic peptide (CNP) secretion from vascular endothelial cells-evidence for CNP as a novel autocrine/paracrine regulator from endothelial cells. Endocrinology 1993; 133:3038-3041.
- Cargill R. I., Barr Craig S., Coutie Wendy J. et al. C-type natriuretic peptide levels in cor pulmonale and in congestive heart failure. Thorax 1994; 49:1247-1249.
- Неклюдова Г.В., Авдеев С.Н., Баймаканова Г.Е. Хроническая обструктивная болезнь лёгких и лёгочная гипертензия: мозговой натрийуретический пептид как маркёр лёгочной гипертензии. Пульмонология 2013; 3:31-35.


