Роль неоадъювантного подхода в лечении первично операбельного HER2-позитивного рака молочной железы
Автор: Фролова М. А., Глазкова Е. В., Петровский А. В., Крохина О. В., Стенина М. Б., Тюляндин С. А.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Собственные исследования
Статья в выпуске: 2 т.10, 2020 года.
Бесплатный доступ
Неоадъювантная системная терапия является важной составляющей комплексного лечения первично операбельного HER2-позитивного рака молочной железы (РМЖ). В связи с этим чрезвычайно важным представляется поиск факторов, предсказывающих эффективность лечения, а также оптимальной системы оценки ответа опухоли. В исследовании проведен анализ факторов, предсказывающих достижение полной патоморфологической регрессии (пПР) при люминальном и нелюминальном HER2-позитивных подтипах. Морфологическая оценка ответа опухоли на лечение проводилась по системе RCB, также изучены дополнительные характеристики резидуальной опухоли. Показано, что комплексная оценка, включающая систему RCB и уровень Ki67, позволяет разделить больных на прогностические группы и индивидуализировать тактику адъювантной терапии.
Неоадъювантный подход, her2-позитивный рак молочной железы
Короткий адрес: https://sciup.org/140251220
IDR: 140251220 | DOI: 10.18027/2224-5057-2020-10-2-4
Текст научной статьи Роль неоадъювантного подхода в лечении первично операбельного HER2-позитивного рака молочной железы
РМЖ с гиперэкспрессией HER2/neu составляет порядка 20–30% среди всех подтипов и характеризуется высокой пролиферативной активностью и агрессивным течением. С молекулярной точки зрения различают как минимум 2 основных подтипа с гиперэкспрессией HER2 (HER2-обо-гащенный и люминальный В), которые могут отличаться по прогнозу и чувствительности к терапии. С клинической точки зрения к HER2-обогащенному подтипу можно отнести большинство HER2-позитивных опухолей, отрицательных по РЭ и РП. К люминальному В подтипу формально относят HER2-позитивные опухоли, положительные по рецепторам эстрогена (РЭ) и/или рецепторам прогестерона (РП), хотя при молекулярном анализе гормонозависимые HER2-пози-тивные опухоли практически равномерно подразделяются на 4 подтипа: HER2-обогащенный (33%), люминальный А (30%), люминальный В (15%) и normal like (21%) подтипы. Гормонозависимые опухоли составляют примерно половину всех HER2-позитивных опухолей (56%) [1].
Частота достижения пПР при HER2-позитивных опухолях высока и существенным образом коррелирует с отдаленными результатами лечения, особенно при рецептор-отрицательных опухолях. Так, в анализе CTNeoBС было показано, что при достижении пПР HR в отношении БРВ при рецептор-отрицательных опухолях составляет 0,25, в то время как при рецептор-положительных — 0,58 [2].
Анти-HER2-терапия является неотъемлемой составляющей неоадъювантной (НА) терапии HER2-позитивного РМЖ. Долгое время стандартными НА-режимами являлись последовательные антрациклин/таксан-содержащие режимы, где ко второму, таксановому, этапу добавляет- ся трастузумаб, либо безантрациклиновый режим ТСН (доцетаксел /карбоплатин /трастузумаб). Последующие попытки увеличения частоты пПР при HER2-позитивных опухолях связаны с добавлением к стандартным схемам лечения второго анти-HER2-направленного препарата, а именно лапатиниба или пертузумаба. В исследовании III фазы NeoALТTO с участием 455 больных добавление лапа-тиниба к комбинации трастузумаба и паклитаксела привело к увеличению частоты пПР с 27,6% до 46,8% (p=0,0007) [3]. Это исследование одним из первых показало, что частота достижения пПР и ее влияние на выживаемость существенно различаются при HER2-позитивных гормонозависимых опухолях и опухолях, отрицательных по рецепторному статусу. Так, при рецептор-отрицательных опухолях частота пПР в комбинированной группе составила 61,3% по сравнению с 36,5% в группе трастузумаба (р=0,002). При гормонозависимых опухолях добавление лапатиниба также приводило к значимому увеличению пПР — 41,6% против 22,7% (р=0,013), однако частота ее достижения была существенно ниже. Была продемонстрирована связь между пПР и выживаемостью, но различия были значимы только при рецептор-отрицательных опухолях. Таким образом, достижение пПР имеет разное прогностическое значение в зависимости от рецепторного статуса опухоли. Становится очевидным, что HER2-позитивные гормонозависимые опухоли и HER2-позитивные опухоли с отрицательными рецепторами стероидных гормонов являются самостоятельными заболеваниями с различной чувствительностью к терапии и разным прогнозом, дальнейшие клинические исследования для них необходимо планировать отдельно.
Собственные исследования
В исследованиях NeoSphere и TRYPHAENA исследовалась значение двойной блокады пертузумабом и трастузумабом в неоадъювантном режиме. В исследовании NeoSphere было показано, что добавление пертузумаба к терапии доцетакселом и трастузумабом приводит к увеличению частоты пПР в молочной железе и лимфоузлах с 21,5 до 39,3% (HR 0,55, p =0,0072) [4]. Причем наибольшие различия наблюдались у больных с рецептор-отрицательными опухолями — 63,2% в комбинированной группе против 36,8% в группе с трастузумабом (пПР в молочной железе) против 26 и 20% при гормонозависимых опухолях, соответственно.
В исследовании TRYPHAENA изучалась общая и кардиологическая безопасность двойной блокады пертузумабом и трастузумабом в сочетании со стандартными режимами ХТ антрациклинами и таксанами, а также доцетакселом в сочетании с карбоплатином [5]. Было показано, что частота побочных явлений не различалась весомо между группами и определялась в первую очередь токсичностью проводимой ХТ. Частота пПР также существенно не отличалась между группами и была достаточно высока — от 54,7% до 63,6%. В соответствии с результатами других исследований, наибольшая частота пПР наблюдалась у больных рецептор-отрицательными опухолями. Так, в группе двойной анти-HER2-блокады в сочетании с доцетакселом и карбоплатином частота пПР в молочной железе составила 81,1 %. На основании этих исследований в 2013 году пертузумаб получил ускоренное одобрение от FDA для использования в неоадъювантной терапии.
Интересным представляется изучение добавления препаратов платины к стандартным антрациклин/таксан-содер-жащим режимам с трастузумабом для увеличения частоты пПР, особенно при рецептор-отрицательных опухолях, где есть четкая зависимость между пПР и выживаемостью. В доклинических исследованиях был показан строгий синергичный эффект между трастузумабом и комбинацией таксанов и карбоплатина [6]. Единственным рандомизированным исследованием, изучавшим эффективность добавления карбоплатина к НА ХТ с трастузумабом при HER2-позитив-ном РМЖ — GeparSixto. В отличие от тройного негативного подтипа, при котором наблюдалось увеличение частоты пПР при добавлении карбоплатина к НА-терапии, при HER2-по-зитивном подтипе такого увеличения отмечено не было. Частота пПР составила 52,9% в группе без карбоплатина и 48,9% с карбоплатином (p=0,585) [7]. Однако следует отметить, что в этом исследовании применялась нестандартная схема ХТ для HER2-подтипа, а именно комбинация липосомального доксорубицина и паклитаксела в еженедельном режиме. Кроме того, отмечалась высокая частота редукции дозы и отмены препаратов в связи с токсичностью терапии.
В последнее время приходит понимание роли неоадъювантной терапии в определении прогноза. Так, больные с пПР имеют наилучшие показатели выживаемости. Однако, не у всех больных с резидуальной опухолью плохой прогноз. Остро встает вопрос выбора наиболее оптимальной системы оценки ответа опухоли на лечение, которая позволила бы разделить больных на прогностические группы для определения тактики после НА-терапии, а также изучение дополнительных маркеров резидуальной опухоли.
ПАЦИЕНТЫ И МЕТОДЫ
В исследовании включена 71 больная HER2-позитивным подтипом РМЖ T1-2N0-1M0 стадий; пациентки получали предоперационную ХТ по одной из схем:
-
1. 4 курса АС (доксорубицин 60 мг / м 2+ циклофосфамид 600 мг/м2) внутривенно капельно 1 раз в 3 недели, затем паклитаксел 80 мг/м2+трастузумаб 4 мг/кг (1-е введение), затем 2 мг/кг внутривенно капельно еженедельно 12 недель;
-
2. Паклитаксел 80 мг/м 2+трастузумаб 4 мг/кг (1-е введение), затем 2 мг/кг внутривенно капельно еженедельно 12 недель, затем 4 курса АС +трастузумаб 6 мг/кг 1 раз в 3 недели;
-
3. Паклитаксел 60 мг/м 2+карбоплатин AUC2+ трастузумаб 4 мг/кг (1-е введение), затем 2 мг/кг внутривенно капельно еженедельно 12 недель, затем 4 курса АС +трастузумаб 6 мг/кг 1 раз в 3 недели (только ре-цептор-отрицательные опухоли).
В таблице 1 представлена характеристика больных. Медиана возраста составила 42 года, 60% больных имели опухоли 2-й степени злокачественности. Медиана Ki67 составила 49%. У 4 больных выявлены герминальные мутации
Таблица 1. Общая характеристика больных HER2-позитивным РМЖ
|
Признак |
n= 71 (%) |
|
Возраст, медиана (диапазон) |
42 (27–68) |
|
Критерий Т Т1 Т2 |
12 (17%) 59 (83%) |
|
Критерий N N0 N1 |
39 (54,9%) 32 (45,1%) |
|
Степень злокачественности 2 3 |
42 (59,2 %) 29 (40,8%) |
|
Ki67, медиана (диапазон) |
49 (16 95) |
|
Подтип Люминальный Нелюминальный |
41 (57,7%) 30 (42,3%) |
|
Экспрессия AR, баллы Есть 7–8 5–6 3–4 |
n= 43 43 (100%) 36 (83,7%) 5 (11,6 %) 2 (4,7 %) |
|
ИОЛ, % медиана 10% < 30 > 30 |
n= 64 46 (71,9%) 18 (28,1%) |
|
Герминальные мутации Нет BRCA1/2 CHEK2 |
n= 52 45 (86,5 %) 4 (7,7 %) 3 (5,8%) |
Собственные исследования в генах BRCA1/2, у 3 в гене CHEK2. У 43 пациенток определена экспрессия рецепторов андрогенов в опухоли, и во всех случаях опухоли были положительны по этому показателю, уровень экспрессии в подавляющем большинстве случаев был высокий (7-8 баллов по Allred в 83,7% случаев).
При сравнении уровня Ki67 у больных с пПР и без пПР не было выявлено статистически значимых различий, в связи с чем было принято решение по данному признаку разделять больных по медиане (50%). У 64 больных оценен уровень ИОЛ, медиана составила 10%. Был проведен ROC анализ по выявлению порогового значения уровня ИОЛ для предсказания шанса достижения пПР, который показал, что пороговым уровнем ИОЛ может считаться 30% (чувствительность 86 %). 28,1 % больных имели высокий (>30%) уровень ИОЛ, который в 2 раза чаще определялся при нелюминальном подтипе: 41,4% против 17,2% при люминальном (р =0,05).
После окончания всего объема НА-химиотерапии больным выполнялись хирургические вмешательства различного объема.
Ответ опухоли на лечение оценивался по системе RCB (residual cancer burden), которая включает в себя комплексную оценку резидуальной опухоли, а именно размер ложа первичной опухоли, клеточность, количество метастатических лимфатических узлов, размер наибольшего метастаза в лимфатическом узле [8]. Эти данные обычно вносятся в специальную формулу, и в результате вычисляются индекс RCB (как непрерывная переменная) и класс RCB, имеющий 4 степени: 0, I, II, IV, где 0 соответствует пПР. Технически вычисление индекса RCB доступно в специальном калькуляторе на сайте онкологического центра MD Anderson [http:/ /www3.mdanderson.org/app/medcalc/index . cfm?pagename = jsconvert3].
В качестве адъювантной терапии больным проводились введения трастузумаба суммарно до 1 года (с учетом неоадъювантной терапии) и гормонотерапия при гормонозависимых опухолях в стандартном объеме. Медиана времени наблюдения составила 38,2 месяца (17,5–93,1 месяца).
РЕЗУЛЬТАТЫ
Оценка по RCB проведена у 71 прооперированной больной. Частота достижения полной патоморфологической регрессии или RCB0 составила 53%, частота достижения RCB0+1 — 74,6 %.
При однофакторном анализе признаков, влияющих на достижение RCB0 во всей группе больных, тенденцию к статистической значимости показали подтип опухоли и уровень ИОЛ. Так, при люминальном подтипе частота RCB0 составила 43,9% против 66,7% при нелюминальном (р =0,09). При уровне ИОЛ ≥30% частота RCB0 составила 72,2 % против 47,8% при низком уровне (<30%) (р =0,09). Достижение RCB0+I также чаще наблюдалось при нелюминальном подтипе: 86,7% против 65,8% при люминальном
(р =0,05). Достоверное влияние на достижение RCB0+I оказывала степень злокачественности опухоли (93,1 % при 3 степени и 61,9% при 2, р =0,004).
Факторы, влияющие на достижение RCB0 при люминальном и нелюминальном HER2-позитивном подтипе
Мы провели анализ влияния различных клинико-морфологических факторов на частоту достижения RCB0 и RCB0+I отдельно для люминального и нелюминального HER2-позитивных подтипов. Частота достижения RCB0 при нелюминальном HER2-позитивном подтипе составила 66,7%, частота RCB0+I — 86,7%. При однофакторном анализе не было выявлено признаков, влияющих на достижение RCB0 и RCB0+I, включая добавление карбоплатина к стандартной антрациклин/таксан-содержащей ХТ.
Был проведен анализ зависимости частоты RCB0 от уровня ИОЛ и проведения платиносодержащей ХТ. Оказалось, что при высоком уровне ИОЛ (≥30%) частота RCB0 составила 83,3% (5/6) в группе с карбоплатином против 50% (3/6) в группе без карбоплатина (р =0,55). При низком уровне ИОЛ частота RCB0 не отличалась в группах с карбоплатином и без него — 60% (6/10) и 71,4% (5/7) соответственно.
Частота достижения RCB0 при люминальном HER2-пози-тивном подтипе составила 43,9%, частота RCB0+I — 65,8%. При однофакторном анализе признаков, влияющих на достижение RCB0, тенденцию к статистической значимости показали такие факторы, как отсутствие экспрессии РП и высокий уровень ИОЛ. Так, при уровне экспрессии РП 7-8 баллов частота достижения RCB0 составила 33,3%, при отсутствии экспрессии — 75% (р =0,08). Частота достижения RCB0 при высоком уровне ИОЛ была в 2 раза выше, чем при низком — 83,3% против 37,9 % (р =0,07).
Возможно, высокий уровень ИОЛ в первичной опухоли при нелюминальном подтипе отвечает за чувствительность в первую очередь к препаратам платины, при люминальном — за чувствительность к химиотерапии вообще.
Достижение RCB0+I при люминальном подтипе чаще наблюдалось при 3 степени злокачественности опухоли — 93,1%, чем при 2 степени — 61,9% (р =0,06).
Изучение характеристик резидуальной опухоли
У 33 больных не была достигнута RCB0, и у них изучались дополнительные характеристики резидуальной опухоли. Индекс пролиферации Ki67 был определен в резидуальной опухоли в 15 случаях. Медиана составила 25% (диапазон 3–70). При попарном сравнении значений Ki67 до лечения и в резидуальной опухоли имело место значимое снижение индекса пролиферации на фоне проведения НАХТ (р =0,02) (рис. 1).
Уровень ИОЛ в резидуальной опухоли определен у 30 больных, медиана составила 5%. При попарном сравнении
Собственные исследования
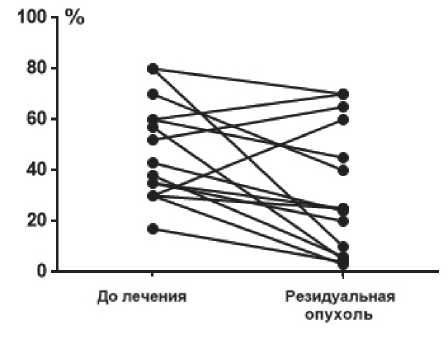
Рисунок 1. Попарное сравнение уровня Ki67 до лечения и в резидуальной опухоли при HER2-позитивном РМЖ.
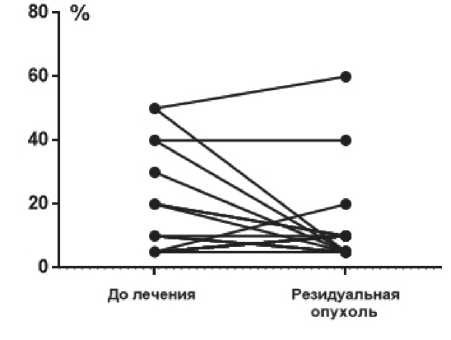
Рисунок 2. Попарное сравнение уровня ИОЛ — до лечения и в резидуальной опухоли при HER2-позитивном РМЖ.
уровня ИОЛ до лечения и в резидуальной опухоли не было выявлено значимых отличий (р =0,21)(рис. 2). Высокий уровень ИОЛ в резидуальной опухоли отмечен только у 2 больных (обе с люминальным подтипом).
Оценка выживаемости
За время наблюдения прогрессирование зафиксировано у 4 больных (5,6%). Медиана времени до прогрессирования составила 24,8 месяца (диапазон 7,0–59,3 месяцев). У одной больной (с пПР) прогрессирование (метастазы в головном мозге) наступило через 1 месяц после оперативного вмешательства, возможно, субклинические метастазы уже имелись до начала лечения. Кроме этой больной, которая погибла через 9 месяцев после обнаружения метастазов, все остальные пациентки живы. Трехлетняя БРВ во всей группе составила 94,7%, 3-летняя ОВ — 98,4%. В группе люминального HER2-позитивного РМЖ 3-летняя БРВ составила 97,6%, в группе нелюминального — 91,4%.
При анализе исходных клинико-морфологических факторов ни один из них не показал статистически значимого влияния на риск рецидива. Отметим, что чаще рецидивы наблюдались при высоком (≥50%) уровне Ki67 (8,8% про-
-*" RCBO+I 20
-- RCBII+III
0 12 24 36 48 60 72
Месяцы
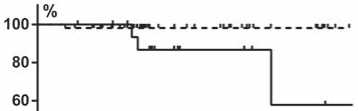
Рисунок 3. Безрецидивная выживаемость при
HER2-позитивном РМЖ у больных с RCB0+I и RCBII +III.
тив 2,7% при уровне <50%, р =0,34) и экспрессии РА менее 7-8 баллов (14,3% против 8,3%, р =0,52).
В связи с небольшим числом рецидивов нам не удалось выявить достоверных различий в выживаемости в зависимости от достижения и недостижения RCB0. Трехлетняя безрецидивная выживаемость (БРВ) при достижении RCB0 составила 97,4 %, при отсутствии RCB0 — 91,3% (ОР 0,25, 95%ДИ 0,035 1,86, р =0,18).
В то же время показатели выживаемости у больных с RCB0+I и RCBII +III имели достоверные различия. Так, трехлетняя БРВ у больных с RCB0+I составила 98,1 %, при RCBII +III — 86,7 (ОР 0,86, 95% ДИ 0,09 0,79, р =0,03) (рис. 3).
Выживаемость больных с RCBII +III и Ki67 < 20% была близка к выживаемости больных с RCB0+I, в то время как выживаемость при RCBII +III и Ki67≥20% была достоверно хуже (100%, 98,1% и 71,4% соответственно, р =0,02, рис. 4).
Нам не удалось провести анализ выживаемости в зависимости от динамики ИОЛ, так как высокий уровень ИОЛ в резидуальной опухоли отмечен только у 2 больных. Отметим, что рецидивы развились лишь у больных с уровнем ИОЛ ≤10%.
Таким образом, проведение неоадъювантной химиотерапии у больных ранним HER2-позитивным РМЖ, а также
%
100--l™i*.1.'rti1i<«* -Ж'ГТ х*ж.
20-
-
— • RCBO+I
-
-^ RCBII+III Ki67<20%
RCBII+III Ki67>20%
0 12 24 36 48 60 72
Месяцы
Рисунок 4. Безрецидивная выживаемость при HER2-позитивном РМЖ в зависимости от класса RCВ и уровня Ki67.
Собственные исследования оценка ответа опухоли на лечение по системе RCB позволяют разделить больных на прогностические группы. Определение в резидуальной опухоли такого параметра, как Ki67 позволяет получить дополнительную прогностическую информацию и выделить больных с неблагоприятным прогнозом для проведения адъювантной терапии.
ОБСУЖДЕНИЕ
Морфологическая оценка ответа опухоли на неоадъювантную терапию в нашем исследовании проводилась по современной системе RCB, которая, в отличие от тех систем, которые используются в настоящее время, позволяет получить четкую прогностическую информацию. Так, влияние класса RCB на выживаемость было продемонстрировано в когортном исследовании MDACC LAB 98 240, включившем 823 больных РМЖ T1-3N0-1 стадий после НАХТ последовательными таксан-антрациклиновыми схемами. Оказалось, что 5-летняя БРВ больных с RCB0 и RCB1 составила 92% (95% ДИ: 86–96) и 94% (95% ДИ: 88–97), соответственно, в то время как при RCBII и III эти показатели были значимо ниже — 80% (95% ДИ: 59–82) и 58% (95% ДИ: 45–81). У больных с HER2-позитивными опухолями (203 больных), которые получали последовательные антрациклин-такса-новые комбинации с трастузумабом, 5-летняя БРВ в соответствии с классами RCB составила: 95% (95% ДИ: 88–98) при 0 классе, 81 % (95% ДИ: 64–90) при I, 74% (95% ДИ: 61–84) при II и 21% (95% ДИ: 5–45) при III.
Частота достижения пПР (RCB0) в нашем исследовании во всей группе больных HER2-позитивным РМЖ составила 53%. В исследовании GeparQuattro частота достижения пПР при проведении ХТ по схеме 4 курса ЕС, затем 4 курса доцетаксела с трастузумабом у 146 больных HER2-пози-тивным раком составила 32,9% [9]. Надо сказать, что 70% больных в этом исследовании имели опухоли Т1-2 и 92% — N0-1 против 100% в нашем исследовании.
Одной из задач нашей работы стал поиск предиктивных маркеров эффективности НА-терапии в зависимости от экспрессии гормональных рецепторов. Как и предполагалось, частота пПР (RCB0) достоверно различалась при нелюминальном и люминальном подтипах, 66,7% и 43,9% соответственно, что полностью совпадает с литературными данными.
При нелюминальном подтипе не было обнаружено факторов, достоверно влияющих на достижение RCB0 и RCB0+I, что, по видимому, связано с их высокой частотой и относительно небольшим количеством больных. Надо отметить, что при экспрессии андрогеновых рецепторов менее 7 баллов и высоком уровне ИОЛ частота RCB0+I достигла 100%.
Мы изучали роль добавления карбоплатина к стандартной антрациклин/таксан-содержащей НАХТ при нелюминальном подтипе. В целом не было получено увеличения частоты RCB0. Однако частота RCB0 при нелюминальном подтипе была наибольшей (83,3%) при проведении карбоплатин-содержащей ХТ и высоком уровне ИОЛ, в то время как в группе без карбоплатина частота RCB0 составила 50%, различия не достигли статистической значимости в силу небольшого количества случаев. При низком уровне ИОЛ частота RCB0 не различалась в группах с карбоплатином и без него — 60% и 71,4% соответственно. Наши данные согласуются с результатами исследования GeparSixto, где было показано, что у больных с лимфоцит-предоминантными формами опухоли добавление карбоплатина существенно повышало эффективность лечения при HER2-позитивном подтипе, частота пПР составила 78%, а в группе без карбоплатина — 50% [10].
Интересно, что при люминальном подтипе в нашем исследовании частота RCB0 была очень высокой и составила 83,3% при высоком уровне ИОЛ при проведении стандартной антрациклин/таксан-содержащей ХТ против всего 37,9% при низком уровне. Можно предположить, что высокий уровень ИОЛ играет различную роль при нелюминальном и люминальном HER2-позитивных подтипах. Так, при нелюминальном подтипе высокий уровень ИОЛ может говорить о высокой чувствительности к платиносодержащей ХТ и предпочтении назначения режима ТСН, в то время как при люминальном подтипе — о чувствительности к ХТ в принципе.
Далее мы отметили, что при люминальном подтипе частота RCB0 существенно выше при отсутствии экспрессии рецепторов прогестерона —75%, против 33% при их высокой (7-8 баллов по Allred) экспрессии. Возможно, высокая экспрессия рецепторов прогестерона говорит о принадлежности опухоли к люминальному, а не HER2-обогащен-ному молекулярному подтипу и, соответственно, низкой чувствительности к ХТ.
Трехлетняя БРВ во всей группе составила 94,7%, 3-летняя ОВ — 98,4%. В группе люминального HER2-позитивного РМЖ 3-летняя БРВ была 97,6%, в группе нелюминального — 91,4%. Мы не ставили своей целью сравнение результатов по выживаемости с данными литературы, поскольку больные получали стандартные режимы НА-терапии. Кроме того, сравнения могут быть некорректны в связи с тем, что в большинстве исследований была смешанная популяция больных (ранние и местнораспространенные стадии).
Наибольший интерес представляет оценка выживаемости в зависимости от наличия резидуальной опухоли и ее характеристик. В связи с небольшим числом рецидивов нам не удалось выявить достоверных различий в выживаемости в зависимости от достижения или недостижения RCB0. Трехлетняя БРВ при достижении RCB0 составила 97,4% при отсутствии RCB0 91,3 % (ОР 0,25, 95% ДИ 0,035 1,86, р =0,18), тогда как показатели выживаемости у больных с RCB0+I и RCBII +III имели достоверные различия. Трехлетняя БРВ у больных с RCB0+I составила 98,1%, при RCBII +III — 86,7 (ОР 0,86, 95 %ДИ 0,09 0,79, р =0,03).
Резидуальная опухоль была изучена у 33 больных, не достигших RCB0, отмечено достоверное снижение уровня Ki67 в резидуальной опухоли после проведения НАХТ. Не
Собственные исследования было зафиксировано изменения уровня ИОЛ по сравнению с исходным. Это связано с тем, что большинство больных с исходно высоким уровнем ИОЛ (13/18) достигли RCB0. Из 5 больных с исходно высоким уровнем ИОЛ, не достигших RCB0, у 2 он остался на прежнем уровне, у 3 — снизился.
Лишь несколько исследований изучали роль ИОЛ в резидуальной опухоли при HER2-позитивном РМЖ. В исследовании Hamy (2017), изучалось значение ИОЛ в первичной и резидуальной опухоли, а также динамика изменения уровня ИОЛ [11]. Уровень ИОЛ в первичной опухоли не влиял на частоту достижения пПР. Не было обнаружено и корреляции между ИОЛ до начала лечения и выживаемостью. Авторы отметили достоверное снижение уровня ИОЛ на фоне проведения терапии. Интересно, особенностью данного исследования было то, что уровень ИОЛ определялся и у больных с пПР, и была отмечена строгая корреляция между снижением ИОЛ и достижением пПР. Поскольку в нашем исследовании высокий уровень ИОЛ в резидуальной опухоли был отмечен всего у 2 больных, мы не можем высказаться о его прогностической значимости. В обсуждаемом исследовании уровень ИОЛ >25% в резидуальной опухоли был независимым негативным прогностическим фактором в отношении безрецидивной выживаемости (HR 7,98, 95% ДИ 1,68–37,77, р =0,009). Авторы отмечают, что эти результаты отличаются от результатов изучения ИОЛ в резидуальной опухоли при ТН РМЖ, где высокий уровень ИОЛ коррелирует с лучшей выживаемостью (что показано и в нашем исследовании). Возможно, эти различия связаны с разными иммунологическими особенностями подтипов РМЖ и использованием трастузумаба при HER2-позитивном подтипе и требуют дальнейшего изучения.
Далее мы изучали роль индекса Ki67 в резидуальной опухоли. Оказалось, что выживаемость больных с RCBII +III и Ki67<20% была близка к выживаемости больных с RCB0+I, в то время как при RCBII +III и Ki67≥20% она была достоверно хуже (98,1%, 100% и 71,4% соответственно, р =0,02), что соответствует результатам, полученным при ТН подтипе. Насколько нам известно, это первое сообщение о роли Ki67 в резидуальной опухоли у больных HER2-позитивным РМЖ.
В исследовании Sheri (2015) было показано, что сочетание таких показателей, как класс RCB и Ki67 имеет большую прогностическую точность, чем каждый показатель в отдельности, 24% больных имели опухоли HER2-позитивного подтипа [12]. Однако, не сообщаются данные по выживаемости в зависимости от RCB и Ki67 отдельно для этого подтипа. Можно предположить, что низкий уровень Ki67 в резидуальной опухоли является универсальным признаком хорошего прогноза для всех подтипов, в отличие от уровня ИОЛ, как обсуждалось выше.
Разделение больных на прогностические группы в зависимости от класса RCB и дополнительных характеристик резидуальной опухоли особенно важно в свете результатов исследования KАTHERINE, где больные, не достигшие пПР при проведении стандартной антрациклин/таксан или таксан-содержащей ХТ с трастузумабом, получали адъювантную терапию T-DM1 или трастузумабом [13]. Авторами было показано значимое увеличение 3-летней выживаемости без инвазивного рака при назначении 14 курсов T-DM1 по сравнению с контрольной группой. Данный подход представляется наиболее оптимальной стратегией в настоящее время. Больные с RCBII-III и высоким уровнем Ki67 могут иметь максимальный выигрыш от постНА-терапии T-DM1.
ЗАКЛЮЧЕНИЕ
Таким образом, наше исследование подтвердило, что лечение первично операбельного HER2-позитивного РМЖ должно начинаться с неоадъювантной терапии. Учитывая различные характеристики люминального и нелюминального HER2-позитивных подтипов, различную чувствительность к терапии и факторы, влияющие на ее эффективность, необходимо планировать неоадъювантные исследования для этих подтипов отдельно. Оценка ответа опухоли на лечение по системе RCB, а также дополнительные характеристики резидуальной опухоли позволяют разделить больных по прогностическим группам для индивидуализации тактики постнеоадъювантной терапии.
Список литературы Роль неоадъювантного подхода в лечении первично операбельного HER2-позитивного рака молочной железы
- Rivenbark, A.G. Molecular and cellular heterogeneity in breast cancer: challenges for personalized medicine / A.G.Riverbank, S.M. O'Connor, W.B.Coleman //Am J Path. - 2013. - 183(4). - P. 1113-1124.
- Cortazar, P. Pathological complete response and long term clinical benefit in breast cancer: the CTNeoBC pooled analysis / P. Cortazar, L. Zhang, M. Untch et al. // Lancet. - 2014. - Jul 12. - 384 (9938). - P. 164-72.
- Baselga, J. Lapatinib with trastuzumab for HER2-positive early breast cancer (NeoALTTO): a randomised, open label, multicentre, phase 3 trial / J. Baselga, I. Bradbury, H. Eidtmann et al. // Lancet. - 2012. - 379. - P. 633-40.
- Gianni, L. Efficacy and safety of neoadjuvant pertuzumab and trastuzumab in women with locally advanced, infl ammatory, or early HER2-positive breast cancer (NeoSphere): a randomised multicentre, open label, phase 2 trial / L. Gianni, T. Pienkowski, Y.H. Im et al. // Lancet Oncol. - 2012. - 13. - P. 25-32.
- Schneeweiss, A. Pertuzumab plus trastuzumab in combination with standard neoadjuvant anthracycline containing and anthracycline free chemotherapy regimens in patients with HER2-positive early breast cancer: a randomized phase II cardiac safety study (TRYPHAENA) / A. Schneeweiss, S. Chia, T. Hickish et al. // Ann Oncol. - 2013. - 24. - P. 2278-2284.
- Pegram, M.D. Rational combinations of trastuzumab with chemotherapeutic drugs used in the treatment of breast cancer / M.D. Pegram, G.E. Konecny, C. O'Callaghan et al. // J Natl Cancer Inst. - 2004. - 96. - P. 739-49.
- von Minckwitz, G. Neoadjuvant carboplatin in patients with triple negative and HER2-positive early breast cancer (GeparSixto; GBG 66): a randomised phase 2 trial / G. von Minckwitz, A. Schneeweiss, S. Loibl et al. // Lancet Oncol. - 2014. - 15(7). - 747e56.
- Symmans, W.F. Measurement of residual breast cancer burden to predict survival after neoadjuvant chemotherapy / W.F. Symmans, F. Peintinger, C. Hatzis et al. // J Clin Oncol. - 2007. - Oct 1. - 25(28). - P. 4414-22.
- Untch, M. Neoadjuvant Treatment With Trastuzumab in HER2-Positive Breast Cancer: Results From the GeparQuattro Study / M. Untch, M. Rezai, S. Loibl et al. // JCO. - 2010. - Vol. 28, N 12. - April 20.
- Denkert, C. Tumor Infiltrating Lymphocytes and Response to Neoadjuvant Chemotherapy With or Without Carboplatin in Human Epidermal Growth Factor Receptor 2-Positive and Triple Negative Primary Breast Cancers / C. Denkert, G. von Minckwitz, J.C. Brase et al. // J Clin Oncol. - 2015. - Mar 20. - 33(9). - P. 983-91.
- Hamy, A.S. Stromal lymphocyte infiltration after neoadjuvant chemotherapy is associated with aggressive residual disease and lower disease free survival in HER2-positive breast cancer /A.S. Hamy, J.Y. Pierga, A. Sabaila // Ann Oncol. - 2017. - 28. - P. 2233-2240.
- Sheri, A. Residual proliferative cancer burden to predict longterm outcome following neoadjuvant chemotherapy /A. Sheri, I.E. Smith, S.R. Johnston // Ann Oncol. - 2015. - 26. - P. 75-80.
- von Minckwitz, G. Trastuzumab Emtansine for Residual Invasive HER2-Positive Breast Cancer / G. von Minckwitz, C.S. Huang, M.S. Mano et al. // N Engl J Med. - 2019. - Feb 14. - 380(7). - P. 617-628.


