Роль нормальной микробиоты в формировании иммунной системы и этиологии некоторых заболеваний
Автор: Волкова В.В., Горган И.В., Гурьянова А.А., Копнин А.В., Радаева О.А.
Журнал: Огарёв-online @ogarev-online
Статья в выпуске: 15 т.6, 2018 года.
Бесплатный доступ
В работе представлен анализ современных направлений изучения роли микробиоты человека в развитии плода и формировании патологических процессов во взрослом организме. По данным анкетирования на базе Медицинского института МГУ им. Н.П. Огарёва исследован уровень знаний студентов-медиков 3 курса о роли микробиоты человека в физиологических и патологических процессах организма.
Дисбиоз, здоровье, иммунная система, микробиота, слизистые оболочки
Короткий адрес: https://sciup.org/147249544
IDR: 147249544 | УДК: 616-01/09
Текст научной статьи Роль нормальной микробиоты в формировании иммунной системы и этиологии некоторых заболеваний
Связь микробиоты матери с формированием иммунной системы плода на сегодняшний день не вызывает сомнения. Значимым является понимание механизмов этого влияния, учитывая отсутствие прямого контакта между микробиотой матери и плода [1].
В эксперименте на мышах показано [2], что развитие иммунной системы плода зависит от представителей материнской микробиоты без фактического проникновения живых микроорганизмов в ткани плода. Влияние микробиоты на развитие иммунной системы было определено путем сравнения колонизированных и свободных от микроорганизмов животных. В этой модели одну из групп стерильных беременных мышей подвергли временному заражению штаммом Escherichia coli, а у другой группы искусственно поддерживали стерильное состояние во время беременности. Результаты экспериментов с использованием этого подхода показали, что, по сравнению с контрольными стерильными мышатами, у мышат, рожденных кратковременно зараженными самками, увеличено количество врожденных лимфоидных клеток класса 3 (клетки ILC3), способных продуцировать интерлейкин (IL)-17A и/или IL-22. Эти клетки являются врожденным аналогом Т-хелперов 17-го типа (Th17) и имеют общий транскрипционный фактор, определяют активность нейтрофилов.
Дальнейшие эксперименты [2] показали, что представители микробиоты влияют на экспрессию антител временно колонизированной матери, увеличивают репертуар и перенос антител к плоду и позже к новорожденному при грудном вскармливании. Эти антитела в основном содержат секреторный IgA (sIgA) и sIgM, которые могут защитить незрелые поверхности слизистых оболочек потомства, обеспечивая формирование биопленок, содержащих непатогенные микроорганизмы. Кроме этого, происходит передача метаболитов кишечных бактерий в ткани матери, а далее через плаценту к плоду, способствуя подготовке млекопитающего, находящегося в неонатальном периоде, к его собственной микробной колонизации.
Во время естественных родов организм плода впервые напрямую сталкивается с микробиотой матери – за некоторое время перед родами в родовые пути женщины начинают мигрировать бактерии, свойственные кишечной микрофлоре – бифидобактерии, лактобациллы, энтерококии и т. д. Проходя через родовые пути, плод заглатывает их содержимое, и происходит первая колонизация слизистых новорожденного. Нормальная микробиота матери главным образом влияет на формирование таковой у плода. Во время кесарева сечения этого важного для ребенка процесса не происходит, и в этом случае есть вероятность колонизации кишечника патогенными микроорганизмами, что скажется на здоровье развивающего организма.
Поскольку бактериальные метаболиты длительно циркулируют в организме матери, их транзит продолжается и во время грудного вскармливания. Человеческое грудное молоко содержит олигосахариды и молочнокислые бактерии, которые могут быть потенциальными пробиотиками. Доказано [1; 2], что бактерии из человеческого молока могут колонизировать кишечник грудного ребенка.
Взаимосвязь микробиоты и заболеваний центральной нервной системы.
При дисбалансе микробиоты кишечника энтеральная нервная система имеет дефекты развития, что сопровождается изменением моторики кишечника как врожденного, так и приобретенного характера. В кишечнике повышается IL-6, понижается содержание клаудина-8, клаудина-15 – белков, являющихся наиболее важными компонентами плотных (замыкающих) контактов [3].
Одно из первых сообщений о роли кишечной микробиоты в развитии заболеваний центральной нервной системы (ЦНС) получено при исследовании экспериментального аутоиммунного энцефаломиелита (ЕАЕ) – мышиной модели рассеянного склероза.
Воспалительное T-клеточно-индуцированное разрушение миелина является ключевым патогенетическим механизмом. Примечательно, что у стерильных мышей развивается ослабленная форма ЕАЕ или даже не развивается вовсе, по сравнению с традиционно колонизированными мышами. Это объясняется изменением баланса между Тh17 и Т-регуляторными лимфоцитами (Treg), который смещается в сторону Treg у стерильных животных [4].
Стресс при инсульте может способствовать бактериальной транслокации из кишечника в кровоток. Недавние исследования показали вторичные изменения в профиле микробиоты после тяжелой ишемии головного мозга (постинсультный дисбиоз), что способствует индукции провоспалительного иммунного ответа. Эксперименты по трансплантации сбалансированной микробиоты после ишемии головного мозга демонстрируют улучшение исхода заболевания [3].
Травма спинного мозга является еще одним нарушением ЦНС, где состав микробиоты недавно был исследован. Выявлено, что пациенты с повреждением спинного мозга имеют меньше бутират-продуцирующих бактерий в кишечнике [3].
Изменения в составе микробиоты кишечника наблюдаются у больных с рассеянным склерозом, иммуномодулирующее лечение которого приводит к возврату микробиоты к нормальному составу. Исследования выявили благотворное влияние добавки с Clostridium (C.) butyricum при ишемии или реперфузия-индуцированного повреждения головного мозга после двусторонней окклюзии общих сонных артерий. Лечение с добавлением C. butyricum снизило нейрональные повреждения и улучшило когнитивные функции [4].
Значение микробиоты в развитии аллергии.
Известно, что на риск развития аллергии и изменение микробиоты кишечника влияют факторы окружающей среды и образа жизни, такие как диета, страна рождения, воздействие антибиотиков, санитарные условия, наличие домашних животных и домашнего скота, грудное вскармливание, а также генетические факторы. Эпидемиологические и экспериментальные исследования подтверждают гипотезу о том, что состав и разнообразие микробиоты желудочно-кишечного тракта соотносится с риском развития аллергических заболеваний [5].
Некоторые исследования подтвердили снижение риска аллергических заболеваний у людей, проживающих в сельской местности. Этот факт объясняется большим контактом с микроорганизмами и расширением состава микробиотических сообществ желудочнокишечного тракта и кожи [6].
Сокращение разнообразия микробиоты желудочно-кишечного тракта связывают с ранними проявлениями неинфекционных заболеваний, включая атопию, экзему и астму. У детей с аллергией преобладают грамположительные бактерии и бактероиды [5].
При этом неоднозначной является роль некоторых на сегодняшний день патогенных микроорганизмов. Так, зафиксирована обратная связь инфекции Helicobacter pylori с риском развития аллергической астмы, атопического ринита и другими аллергическими заболеваниями. Также существуют данные о способности кишечных гельминтов защищать организм от аллергии и аутоиммунитета, подавляя активацию врожденных лимфоидных клеток и способствуя дифференциации Treg. Паразиты выпускают иммуномодулирующие вещества, которые образуются для подавления иммунного ответа, вызванного Th2, и для обеспечения сохранности гельминтов [5, 6].
Передача микроорганизмов кишечника – распространение здоровья.
Передача кишечных бактерий между людьми может способствовать укреплению здоровья путем установления, поддержания и пополнения микробного разнообразия микробиоты человека [7]. Успешное распространение «здоровых» бактерий в организме обусловлено их способностью к размножению и поддержанию своей популяции.
Большая часть наших знаний о механизмах передачи, используемых кишечными бактериями, взята из исследования передачи патогенов, что обеспечивает концептуальную основу для начала понимания трансмиссии микробиоты. Пути передачи условно-патогенных и патогенных кишечных бактерий разнообразны. Несмотря на сходство, имеются и существенные различия между механизмами, используемыми кишечными патогенами и общими бактериями для передачи. Одно из различий между патогенным и непатогенным микроорганизмом в этом контексте заключается в том, что патогенные бактерии используют для распространения воспалительные реакции, тогда как непатогенные их не используют, и поэтому их количество вовремя дисбиоза может заметно уменьшиться [7].
Иммунная система человека может различать условно-патогенные и патогенные бактерии, которые вызывают различные по течению сигнальные реакции через рецепторы врожденного иммунитета, такие как Toll-подобные рецепторы и NOD-подобные рецепторы. «Признание» организмом общих бактерий, как правило, способствует поддержанию кишечного гомеостаза, в то время как «признание» патогенов приводит к воспалению [8].
Роды – это первое крупное событие в жизни человека, при котором происходит передача бактерий и их колонизация. Состав микробиоты младенцев, рожденных кесаревым сечением, может в большей степени соответствовать микробиоте кожи, чем влагалища в первые дни жизни. Если не предпринимается никаких попыток контаминации микробиотой младенцев, рожденных кесаревым сечением, то в течение поколений может утрачиваться наиболее адекватный микробиотический состав. Активно внедряются искусственные способы переноса влагалищной микробиоты от матери к ребенку после кесарева сечения: тампонирование новорожденных марлей, которая была предварительно инкубирована во влагалище матери, что имитирует естественную передачу микрофлоры ребенку [6].
У взрослых, подверженных рецидивирующему поражению кишечника С. difficile, фекальная трансплантация микробиоты от здорового донора оказалась чрезвычайно эффективной при сопоставлении с курсами антибактериальной терапии [6].
С целью проанализировать уровень знаний студентов 3 курса о роли микробиоты человека в физиологических и патологических процессах организма нами было проведено исследование на базе Медицинского института МГУ им. Н. П. Огарёва.
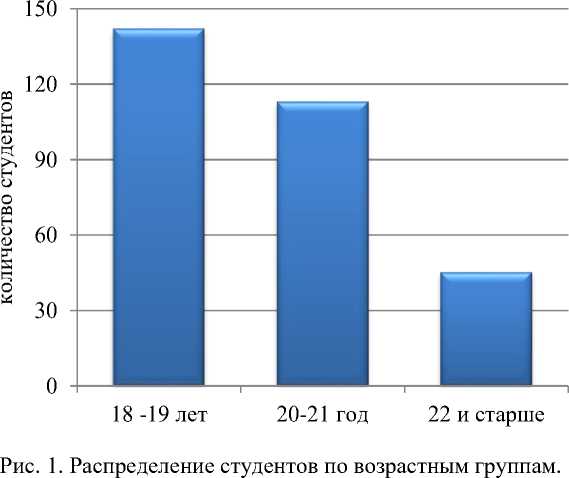
Материалы и методы. Был проведен опрос 300 студентов специальностей «Лечебное дело», «Педиатрия», «Стоматология» очной формы обучения. Распределение опрешенных по возрасту представлено на рисунке 1.
Респонденты отвечали на вопросы разработанной анкеты, результаты опроса представлены в диаграммах и проанализированы.
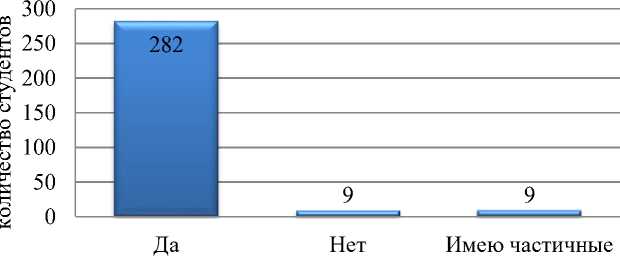
Результаты исследования. Преобладающая часть (94%) опрошенных студентов знакома с термином микробиота человека, что, вероятнее всего, обусловлено спецификой получаемого образования, но заявленное образование респондентов требует степени информированности близкой к 100% (рис. 2).
представление
Рис. 2. Ответы на вопрос «Знакомы ли Вы с понятием “микробиота”»?
При этом 275 студентов с уверенность обозначили основные функции нормальной микробиоты человека (150 человек назвали 3 функции – иммуномодулирующую, витаминообразующую, противодействие патогенным микроорганизмам, 100 человек – обозначили 2 функции, 20 человек – 1 функцию и 5 человек затруднились ответить).
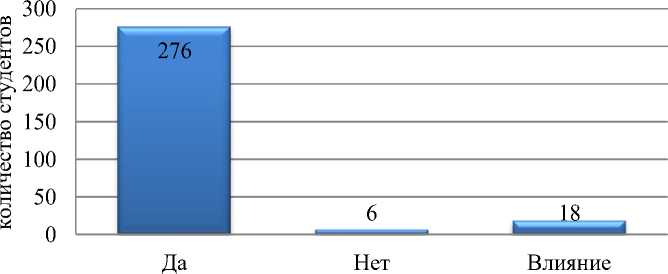
При анализе ответов на вопрос «Считаете ли Вы, что питание влияет на формирование микробиоты кожи и слизистых оболочек?» (рис. 3) можно сделать вывод, что 92% опрошенных понимают важность влияния питания на микробиоту, 6% респондентов считают, что это влияние незначительно, после дополнительных вопросов выявлено сомнение респондентов 3 курса в связи питания и микробиоты кожи. При этом 99% опрошенных уверенно отмечают связь грудного вскармливания и формирования нормомикробиоты ребенка. 75% студентов (95% студентов специальности «Педиатрия»), в первую очередь, указывают на роль sIgA, который содержится в грудном молоке.
незначительно
Рис. 3. Ответы на вопрос «Считаете ли Вы, что питание влияет на формирование микробиоты кожи и слизистых оболочек?»
30 респондентов (10%) не считают нарушения в микробиоте поводом обратиться к врачу. Данный результат, хоть и является относительно низким, показателен: даже среди людей, получающих медицинское образование, есть те, кто не считают нужным корректировать нарушения в микробиоте и возможно из-за ограниченности клинических знаний на данном этапе забывают о значение дисбиоза в патогенезе многих заболеваний.
На вопрос «Считаете ли Вы нужным прием пробиотиков/пребиотиков?» 18% опрошенных считают верным прием пробиотиков курсами вне зависимости от наличия или отсутствия показаний, что демонстрирует недостаточный уровень знаний студентов о пробиотиках и поддержании здоровья микробиоты. При этом 72% дали правильный ответ «прием пробиотиков необходим по назначению врача» (рис. 4).
Последний вопрос опроса был направлен на выявление влияния средств массовой информации на представления о полезных свойствах тех или иных продуктов (рис. 5). 62% респондентов считают более полезным прием классических молочных продуктов, а не часто рекламируемых в Интернете и на телевидении обогащенных, демонстрируя свободу мышления от средств массовой информации.
x u

Прием по назначению врача
Да, принимать курсами
Нужно принимать Не считаю нужным
на постоянной
принимать
основе
Рис. 4. Ответы на вопрос «Считаете ли Вы нужным прием пробиотиков/пребиотиков?»


Выбрал(а) бы йогурт с первого Выбрал(а) бы обычный кефир изображения (Активиа, актимель, или простоквашу иммунеле)
Рис. 5. Ответы на вопрос «Доверяете ли Вы рекламе молочных продуктов и йогуртов с заявленным добавлением пробиотиков? Какой из продуктов Вы предпочли бы, исходя из Ваших знаний?»
Вывод. Опрос студентов Медицинского института выявил высокий процент респондентов, информированных в общесоциальном объеме о вопросах, связанных с микробиотой человека, но результаты не были 100%, что требует анализа причин. Ниже процент обладающих профессиональными знаниями по данному вопросу, хотя они уже включены в программы некоторых дисциплин со 2 курса, что требует повышения внимания к данному вопросу, учитывая современные взгляды на роль микробиоты при формировании широкого спектра патологий.
Список литературы Роль нормальной микробиоты в формировании иммунной системы и этиологии некоторых заболеваний
- Pacha J. Development of intestinal transport function in mammals // Physiological Reviews. - 2000. - Vol. 80. - pp. 1633-1667.
- Macpherson A. J., de Agüero M. G., Ganal-Vonarburg S. C. How nutrition and the maternal microbiota shape the neonatal immune system // Nature Reviews Immunology. - 2017. - Vol. 17 (8). - pp. 508-517. EDN: YFMNCT
- Winek K., Dirnagl U., Meisel A. The Gut Microbiome as Therapeutic Target in Central Nervous System Diseases: Implications for Stroke // Neurotherapeutics. - 2016. - Vol. 13 (4). - pp. 762-774.
- Berer K., Mues M., Koutrolos M., Rasbi Z.A., Boziki M., Johner C., Wekerle H., Krishnamoorthy G. Commensal microbiota and myelin autoantigen cooperate to trigger autoimmune demyelination // Nature. - 2011. - Vol. 479 (7374). - pp. 538-541.
- Brew B. K., Allen C. W., Toelle B. G., Marks G. B. Systematic review and meta-analysis investigating breast feeding and childhood wheezing illness // Paediatric and Perinatal Epidemiology. - 2011. - Vol. 25. - pp. 507-518. EDN: YCHKKL
- Browne H. P., Neville B. A., Forster S. C., Lawley T. D. Transmission of the gut microbiota: spreading of health // Nature Reviews Microbiology. - 2017. - Vol. 15 (9). - pp. 531-543.
- Falkow S. What is a pathogen? // ASM News. - 1997. - Vol. 63. - pp. 359-365.
- Rakoff-Nahoum S., Paglino J., Eslami-Varzaneh F., Edberg S., Medzhitov R. Recognition of commensal microflora by Toll-like receptors is required for intestinal homeostasis // Cell. - 2004. - Vol. 118. - pp. 229-241.


