Роль онконевральных антител паранеопластической полиневропатии в ранней диагностике рака
Автор: Королева Е.С., Гольдберг Виктор Евгеньевич, Алифирова В.М., Симолина Елена Ивановна
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 1 (55), 2013 года.
Бесплатный доступ
Проведенное исследование показывает значимость онконевральных антител как маркеров паранеопластической полиневропатии в ранней диагностике некоторых форм рака. У 2/3 пациентов клиника полиневропатии возникала минимум за 6 мес до обнаружения опухоли, нейрональные антитела детектированы в сыворотке крови более чем у 50 % больных.
Паранеопластическая полиневропатия, онконевральные антигены, рак молочной железы, мелкоклеточный рак легкого
Короткий адрес: https://sciup.org/14056298
IDR: 14056298 | УДК: 616–006.6–07:616.85:616–097
Текст научной статьи Роль онконевральных антител паранеопластической полиневропатии в ранней диагностике рака
Актуальность изучения влияния злокачественных новообразований на нервную систему связана с ранней диагностикой рака. Клиническая манифестация паранеопластической полиневропатии (ППНП) предшествует обнаружению первичного очага малигнизации у 70 % пациентов и позволяет сосредоточиться на поиске определенного типа опухоли. У 75 % таких больных впоследствии получают положительные результаты скрининга на наличие злокачественного опухолевого процесса. Клиническое подозрение в данном случае составляет основу успешной совместной работы онкологов и неврологов [1, 5, 10, 13].
Клетки некоторых типов злокачественных опухолей, большей частью мелкоклеточного рака легких (МКРЛ) и рака молочной железы (РМЖ), эктопически синтезируют внутриклеточные нейрональные белки с молекулярной массой от 20 до 80 кДа, которые относятся к группе гетероорганных антигенов, то есть антигенов, присущих тканям, не гомологичным опухоли (феномен антигенной дивергенции). В ответ развивается аутоиммунная реакция организма, продукция онконевральных аутоантител, которые вместе с Т-лимфоцитами взаимодействуют с теми структурами нервной системы, в которых присутствуют нормальные белки, идентичные пара-неопластическим антигенам. В конечном счете, это влечет за собой повреждение нейронов и периферических нервных волокон [8, 9, 11, 14, 15].
Нейрональные аутоантитела представляют собой IgG, циркулирующие в крови и проникающие в цереброспинальную жидкость (ЦСЖ) путем пассивной диффузии приблизительно 800:1. Обобщая литературные данные, можно предположить, что определенные онконевральные антитела связаны с определенными типами опухолей: anti-Hu – ассоциированы с МКРЛ, anti-Ri – с РМЖ, anti-Yo – детектируются при раке яичников. У пациентов с МКРЛ в 35 % случаев образуются антитела к потенциалзависимым кальциевым каналам, в 23 % случаев образуются антитела к Hu-антигену [2, 4].
В подавляющем большинстве случаев при развитии ППНП играют роль следующие типы нейрональных антител: anti-Hu (ANNA-1), anti-CV2 (CRMP5), ANNA-3, anti-MAG и анти-амфифизиновые антитела [10, 12]. Примерно у 80 % пациентов с прогрессирующей полиневропатией и идентифицированными в сыворотке крови anti-Hu антителами, концентрация которых превышает 1:500, выявляется МКРЛ. При РМЖ в крови часто накапливаются anti-CV2 антитела, приводящие к неврологическому дефициту со стороны периферических нервов [11].
Материал и методы
Обследовано 88 пациентов в отделении химиотерапии ФГБУ «НИИ онкологии» СО РАМН за период с 01.01.2011 по 30.06.2012. Среди них 61 пациентка с РМЖ, средний возраст которых составил 53 ± 9 лет, и 27 больных с МКРЛ, средний возраст которых составил 58 ± 7 лет. Во всех случаях диагноз полиневропатии был установлен согласно критериям ВОЗ (1999) и подтвержден данными электронейромиографии. Критериями включения в исследование являлись подтвержденный гистологически рак без метастатического поражения головного и спинного мозга, при отсутствии других заболеваний центральной и периферической нервной системы на момент обследования. Для проверки достоверности лабораторного метода исследования была набрана контрольная группа, состоящая из 24 человек с неотягощенным онкологическим и неврологическим анамнезом, средний возраст – 32 ± 8 лет.
Аутоантитела класса IgG человека к 6 различным нейрональным антигенам (амфифизину, CV2/CRMP5, PNMA2 (Ma2/Ta), Ri, Yo и Hu) определяли in vitro в сыворотке крови 24 пациенток с РМЖ (I группа) и 24 пациентов с МКРЛ (II группа) с помощью набора Neuronal Antigens Profile EUROLINE,IgG (Euroimmun AG, Германия), основанного на методе иммуноблоттинга и содержащего тестовые стрипы, на которые нанесены параллельные полосы высокоочищенных антигенов.
Статистическая обработка результатов проводилась с использованием пакета прикладных программ SPSS 17.0 for Windows. Критический уровень значимости при проверке статистических гипотез в данном исследовании принимался равным 0,05 (р – достигнутый уровень значимости). Описание качественных данных проводилось путем построения таблиц сопряженности с указанием абсолютных и относительных (%) частот встречаемости признаков. Для определения достоверности различий качественных признаков использовали анализ таблиц сопряженности (кри- терий χ2 Пирсона, а также двусторонний точный тест Фишера в случае, если ожидаемое значение хотя бы в одной ячейке таблицы сопряженности было меньше 5). Проверка на нормальность распределения количественных данных проводилась по критерию Шапиро–Вилка. Обобщение результатов исследования проводили с использованием описательных статистик: медиана (Me) и интерквартальный размах (в виде 25 и 75 процентилей, Q1 – Q3) – для данных, не соответствующих нормальному закону распределения; среднее значение (M) и стандартное отклонение (σ) – для нормально распределенных данных. Сравнение двух независимых выборок проводили при помощи критерия Стьюдента для нормально распределенных количественных признаков, критерия Манна–Уитни – для сравнения количественных признаков, не подчиняющихся нормальному закону распределения, и порядковых признаков [3, 6, 7].
Результаты и обсуждение
В процессе проведения исследования установлено, что у 87 % женщин, страдающих РМЖ III стадии, и у 71 % пациентов с МКРЛ III стадии неврологические симптомы возникли до диагностики злокачественной опухоли за 24 (8–30) и 11 (6–12) мес соответственно. Манифестация полиневропатии имела место у 53 % онкологических больных на доклинической стадии опухолевого процесса, что является характерным диагностическим признаком ППНП. Различия по продолжительности полиневропатии до верификации диагноза при данных патогномоничных формах рака являются статистически значимыми, p=0,008. Длительность онкологического заболевания существенно не отличалась в двух группах и составила 8 (3–26) мес при РМЖ и 6 (0–12) мес при МКРЛ.
Онконевральные антитела детектированы в сыворотке крови 71 % пациентов с РМЖ, у 25 % больных с МКРЛ и в 17 % образцов, полученных от здоровых доноров. При РМЖ маркеры ППНП представлены anti-MA2 антителами в 58 % случаев. При МКРЛ 13 % обнаруженных IgG относились к классу anti-Yo антител, 8 % – к классу anti-Hu антител (рис. 1). Обнаруженные антитела свойственны данным формам малигнизаций и участвуют в повреждении периферических нервов. Кроме того, у 17 % пациентов с диагнозом РМЖ в сыворотке кро-
Результаты сравнительного анализа иммуноблоттинга в сравниваемых группах
Таблица
|
Антитела |
Z |
p12 |
Z |
p13 |
Z |
p23 |
|
Anti-CV2 |
0,72 |
0,474 |
0,72 |
0,474 |
0,00 |
1,00 |
|
Anti-MA2 |
3,74 |
0,001* |
3,02 |
0,004* |
0,52 |
0,604 |
|
Anti-Yo |
0,00 |
1,000 |
0,94 |
0,350 |
0,52 |
0,604 |
|
Anti-Hu |
0,00 |
1,000 |
0,00 |
1,000 |
0,72 |
0,474 |
Примечание: * – различия статистически значимы в сравниваемых группах (p<0,05); p12 – достигнутый уровень значимости при сравнении частоты встречаемости признака в группах 1 и 2; p13 – достигнутый уровень значимости в группах 1 и 3; p23 – достигнутый уровень значимости в группах 2 и 3; Z – критерий с поправкой Йейтса на непрерывность.
ви встречались одновременно 2 вида нейрональных антител – anti-MA2 и anti-Yo антитела.
Проводя сравнительный анализ данных иммуноблоттинга исследуемых групп пациентов со злокачественными новообразованиями и контрольной группы, выявили ряд статически значимых различий между больными и здоровыми индивидами, а также между двумя формами рака (таблица). Обращает на себя внимание тот факт, что 17 % участников группы контроля имели антителопозитивные результаты исследования сыворотки крови. У половины из них обнаружили признаки аксонально-демиелинизирующей полиневропатии по результатам электронейромиографии при
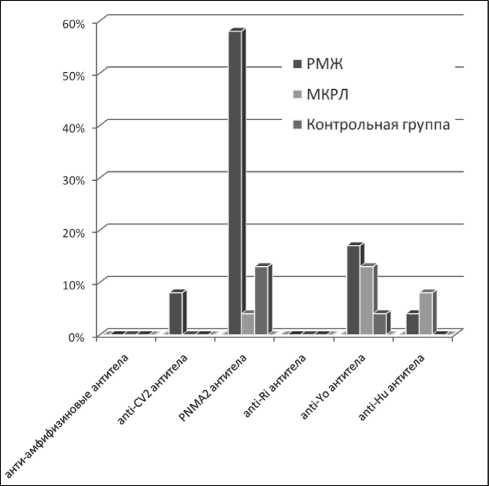
Рис. 1. Распределение различных типов нейрональных антител среди онкологических пациентов и здоровых доноров (группа контроля)
отсутствии клинических симптомов поражения периферических нервных волокон. Выяснили также отягощенный онкологический анамнез, причем раком легкого, нейрональные антитела которого и были обнаружены в крови этих людей, болели их самые близкие родственники – отец, брат. Привычными методами визуализации объемных образований у лиц, подозрительных в отношении рака, выявлено не было. Дальнейшая тактика ведения таких пациентов включает тщательное обследование у онколога и невролога каждые 6 мес, поскольку злокачественная опухоль в подобных ситуациях может обнаружиться в течение ближайших 2–4 лет.
Заключение
Проведенное исследование, несомненно, показывает значимость онконевральных антител как маркеров ППНП в ранней диагностике некоторых форм рака. Действительно, у 2/3 пациентов анализируемой выборки клиника полиневропатии возникла минимум за 6 мес до обнаружения опухоли и подтверждена данными неврологического обследования и результатами электронейромиографии. Нейрональные антитела детектированы в сыворотке крови более чем у 50 % данной когорты онкологических больных. В большинстве случаев типы антител соответствуют виду новообразования, при котором они выявлены. Кроме того, онконевральные антитела, обнаруженные у здоровых людей, позволяют предположить, опираясь на результаты клинического, параклинического неврологического обследования и методы визуализации, дальнейший онкологический прогноз относительно локализации опухоли и сроков ее клинической манифестации.
СИБИРСКИЙ ОНКОЛОГИЧЕСКИЙ ЖУРНАЛ. 2013. № 1 (55)


