Роль паттерн-распознающих рецепторов клеток врождённого иммунитета в патогенезе заболеваний крупного рогатого скота (обзор)
Автор: Калашникова Л.А., Муругина Н.Е., Багаль И.Е., Калашников А.Е., Калашников В.Е.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Обзоры, проблемы
Статья в выпуске: 2 т.60, 2025 года.
Бесплатный доступ
Проблема повышения естественной резистентности высокопродуктивного крупного рогатого скота (КРС) в условиях промышленного содержания приобретает все большую актуальность. Инфекции молочных желез, органов репродуктивной системы, вирусные заболевания КРС влекут за собой экономические потери, связанные со снижением мясной продуктивности, продукции молока, увеличением затрат на ветеринарное обслуживание и выбраковку больных животных. Ключом к поддержанию гомеостаза в организме и сохранению здоровья животного служит своевременное распознавание патогенов клетками врожденной иммунной системы. В настоящее время на модели человека и мышей установлены многие молекулярные механизмы активации клеток иммунной системы, показана роль паттерн-распознающих рецепторов (ПРР) (J. Xu с соавт., 2011; I.F. Moretti с соавт., 2018), адапторных белков, факторов транскрипции в формировании иммунного ответа (T. Kawai с соавт., 2008), который включает в себя не только распознавание и удаление чужеродных патогенов, но и элиминацию поврежденных клеток собственного организма (O. Takeuchi с соавт., 2010; N. Kano с соавт., 2022). В представленном обзоре собраны современные данные о роли ПРР в распознавании патогенов и активации клеток врожденной иммунной системы КРС: описаны основные иммуногенные структуры (PAMP и DAMP), оказывающие влияние на клетки врожденной иммунной системы КРС, дана информация по строению, функциям основных групп ПРР, включая Толл-подобные (TLR), NOD-подобные (NLR), лектиноподобные рецепторы С-типа (CLR) и RIG-1-подобные (RLR) рецепторы, показаны особенности строения этих рецепторов у КРС (Z. Sladek с соавт., 2009; S.K. Mishra с соавт., 2019). У КРС выявлено и картировано 10 функциональных TLR (от TLR1 до TLR10), каждый из которых распознает специфические молекулярные паттерны, ассоциированные с патогенами (M. Maurić Maljković с соавт., 2023), 32 типа молекул CLR, большинство из которых можно идентифицировать как ортологи белков человека и мыши (A. Holder с соавт., 2023). Семейство NOD-подобных рецепторов состоит из 4 подсемейств. NOD1 и NOD2 играют ауторегулирующую роль (N. Inohara с соавт., 1999) и участвуют в передаче сигнала адапторным белкам (G. Magnuson с соавт., 2010). RLRs включает три рецептора: RIG-I, MDA5 и LGP2 (K. Wicherska-Pawłowska с соавт., 2021). RIG-I-подобные рецепторы представляют собой цитоплазматические рецепторы нуклеиновых кислот для РНК вирионов. Установлена их роль в индукции врожденного иммунного ответа при защите от ротавирусной инфекции (P.S. Paul с соавт., 1993; K. de Verdier Klingenberg с соавт., 1998) и распознавании вируса диареи у КРС (Y. Ma с соавт., 2022). Для лучшего понимания роли ПРР в активации клетки отображены пути внутриклеточной передачи сигнала от рецепторов при их активации (J. Napetschnig с соавт., 2013; T. Kawai с соавт., 2008). Показано значение ПРР в формировании воспалительных заболеваний КРС (M. Maurić Maljković с соавт., 2023). Отдельно уделено внимание влиянию полиморфизма генов ПРР на устойчивость КРС к инфекционным заболеваниям, таким как мастит (A.Q. de Mesquita с соавт., 2012), туберкулез (A. Bhaladhare с соавт., 2016), паратуберкулез (R. Mucha с соавт., 2009; J.B. Okuni с соавт., 2021) и другим болезням (M. Bjelka с соавт., 2020). Идентификация однонуклеотидных полиморфизмов ПРР открывает перспективы для селекционных стратегий на основе маркеров, скрининга рисков заболеваний и повышения генетической резистентности молочного скота к болезням (M. Maurić Maljković с соавт., 2023).
Паттерн-распознающие рецепторы, врожденный иммунитет, крупный рогатый скот, бактериальные инфекции, вирусные инфекции, полиморфизм
Короткий адрес: https://sciup.org/142245105
IDR: 142245105 | УДК: 636.2.034:636.082.2 | DOI: 10.15389/agrobiology.2025.2.183rus
Текст обзорной статьи Роль паттерн-распознающих рецепторов клеток врождённого иммунитета в патогенезе заболеваний крупного рогатого скота (обзор)
Организм любого животного ежедневно контактирует со множеством инфекционных агентов. Кроме того, внутри организма происходят события, приводящие к образованию поврежденных и видоизмененных клеток, в том числе опухолевых, которые необходимо своевременно распознавать и элиминировать.
Первой линией защиты организма-хозяина от патогенов служит
∗ Исследование выполнено за счет гранта Российского научного фонда (проект ¹ 23-26-00235).
система врожденного иммунитета, обладающая способностью распознавать вредоносные стимулы. Клетки врожденной иммунной системы — макрофаги, нейтрофилы, дендритные клетки, NK-клетки, эозинофилы, базофилы, тучные клетки — снабжены молекулами рецепторов, распознающих патогены, которые на начальных стадиях иммунного ответа взаимодействуют с различными лигандами. Внутриклеточные сигнальные каскады, запускаемые этими рецепторами, приводят к увеличению экспрессии многих генов, в том числе медиаторов воспаления, которые обеспечивают элиминацию патогенов и инфицированных клеток. Нарушения активации рецепторов, распознающих патогены, могут приводить к иммунодефицитным состояниям, индукции аутоиммунных заболеваний или септическому шоку (1, 2).
Цель настоящего обзора — показать роль паттерн-распознающих рецепторов в распознавании патогенов, активации врожденного иммунитета и развитии воспалительных процессов у крупного рогатого скота, проанализировать влияние полиморфизмов генов ПРР на устойчивость животных к инфекционным заболеваниям, а также представить современные знания о компонентах врожденной иммунной системы, уделяя особое внимание самым интересным недавним открытиям.
PAMP, DAMP. Иммуногенные структуры, которые непосредственно распознаются клетками иммунной системы организма-хозяина через связывание с рецепторами распознавания паттернов, можно разделить на патоген-ассоциированные молекулярные паттерны (pathogen-associated molecular patterns, PAMP) и молекулярные образы, связанные с повреждением клеток и структур организма (damage-associated molecular patterns, DAMP).
PAMP — это молекулярные иммуногенные структуры, которые отсутствуют у организма-хозяина. К PAMP относят бактериальные липопротеины, пептидогликаны, флагеллин, липополисахарид, вирусные двух- и одноцепочечные РНК, ДНК и др. (3, 4).
К DAMP относят митохондриальную ДНК (5), гистоны (6), одно- и двуцепочечную ДНК (7), протеины теплового шока (hsp60) (8), ядерный белок HMGB (9), гиалурон внеклеточного матрикса (10) и другие молекулы, образующиеся при разрушении клеток из-за некроза/некроптоза и прочих типов клеточной гибели (11). Некоторые DAMP активно экспортируются из живых клеток посредством экзоцитоза секреторных лизосом и активации пор клеточных мембранных каналов (12). Клеточные стрессоры, которые могут привести к выделению DAMP (13), включают разнообразные физические (травма, радиация), химические (токсины, осмолярность), метаболические (ишемия/реперфузия) и инфекционные (вирусы, бактерии, простейшие) факторы окружающей среды (14-16).
Паттерн- распознающие рецепторы. Клетки врожденной иммунной системы распознают молекулярные компоненты патогенов (PAMP, DAMP) при помощи паттерн-распознающих рецепторов (ПРР). ПРР включают Toll-подобные (Toll-like receptor, TLR), NOD-подобные (Nod-like-receptor, NLR), лектиноподобные рецепторы С-типа (C-type lectin-like receptor, CLR), а также RIG-1-подобные (RIG-I-like receptors, RLR) рецепторы (1). Активация ПРР вызывает запуск внутриклеточных сигнальных путей, приводящих к транслокации в ядро факторов транскрипции (17), где последние индуцируют экспрессию генов иммунного ответа, включая гены цитокинов, хемокинов и антибактериальных пептидов (18, 19).
ПРР также оказывают ряд эффектов, не связанных с транскрипцией, в частности влияют на метаболическое репрограммирование клеток (20-22), способствуют стабилизации мРНК и активируют трансляцию (23). В конеч- ном итоге активация клеток врожденной иммунной системы через ПРР в зависимости от комбинации действующих на них стимулов, инициирует или подавляет воспаление, способствует повреждению или, наоборот, регенерации тканей (24, 25).
Toll-подобные рецепторы. Среди ПРР у КРС лучше всего изучены TLR. У коров описано и охарактеризовано 10 видов Toll-подобных рецепторов (TLR1-TLR10), которые участвуют в распознавании как PAMP, так и DAMP (26). TLR1, TLR2, TLR4, TLR5 и TLR6 экспрессируются на поверхности клеток (27), TLR3, TLR4, TLR7, TLR8, TLR9 и TLR10 — на внутриклеточных мембранных структурах, таких как эндоплазматический ретикулум, эндосомы, лизосомы и эндолизосомы (28-31). В строении всех TLR выделяют три домена: внеклеточный, обогащенный лейцином N-концевой LRR-домен (leucin reach repeat domain), который взаимодействует с лигандами, трансмембранный домен и внутриклеточный C-концевой домен Toll/IL1R (TIR) (32), отвечающий за передачу сигнала в клетку.
После взаимодействия с патогенами молекулы TLR образуют гомо-и гетеродимеры, вследствие чего два внеклеточных домена приобретают m-образную конфигурацию с N-концами, простирающимися в противоположных направлениях, и С-концами, сходящимися в средней области (32). При этом внутриклеточные домены TIR оказываются в непосредственной близости друг от друга и могут участвовать в гомотипическом взаимодействии. Это создает молекулярную основу начального уровня, содержащую домен TIR, на которой могут собираться и олигомеризоваться другие молекулы адапторов (Myd88, TRIF), запускающие в клетке активационные сигнальные каскады (рис. 1).
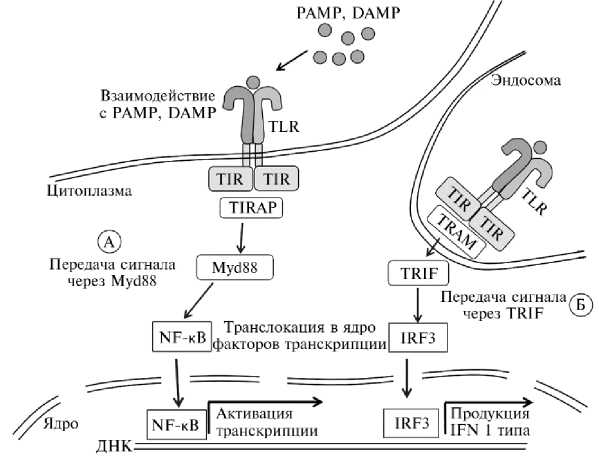
Рис. 1. Строение и пути активации Toll-подобных рецепторов (TLR): А — классический, MyD88-зависимый путь активации TLR, Б — альтернативный путь активации TLR; PAMP — патоген-ассоциированные молекулярные паттерны, DAMP — молекулярные паттерны, ассоциированные с повреждением, TIR — рецептор толл/интерлейкина-1, TIRAP — адапторный белок, содержащий домен TIR, Myd88 — митоген-активируемая протеинкиназа, NF- κ B — ядерный фактор транскрипции κ B, TRIF — адапторный белок, содержащий домен TIR, IRF3 — регуляторный фактор интерферона 3, TRAM — адапторный белок, содержащий домен TIR, IFN — интерферон (32).
В рамках классического сигнального пути, ассоциированного с Myd88, происходит формирование олигомерного комплекса, называемого миддосомой (32). Затем следующие активационные каскады в клетке приводят к миграции факторов транскрипции NF-κB в ядро, дальнейшей активации транскрипции генов. TLR4 способен запускать альтернативный активационный каскад, где при посредстве мостикового адаптера TRAM вместо MyD88 используется другой адаптор — TRIF (30, 33). При этом происходит активация транскрипционного фактора IRF3, который приводит к активации экспрессии IFNβ (30).
Из всех молекул Toll-рецепторов TLR1, TLR2 и TLR4 обладают особым значением в патогенезе заболеваний крупного рогатого скота (КРС), поскольку распознают PAMP грамположительных (пептидогликаны) и гра-мотрицательных (липополисахарид) бактерий, включая Staphylococcus aureus , Streptococcus uberis и Escherichia coli , вызывающих мастит у коров (34). Так, TLR1 и TLR2 распознают компоненты клеточной стенки грамположитель-ных бактерий (пептидогликан, липотейхоевая кислота) (35), липопротеины (36), а TLR4 играет ведущую роль в распознавании грамотрицатель-ных бактерий. В качестве основного лиганда TLR4 выступает липополисахарид (ЛПС) (37).
Показано, что липотейхоевая кислота — агонист TLR2, а также PAMP грамположительных бактерий, в том числе Staphylococcus aureus , способна инициировать клинический мастит у коров (35). В инициации воспаления молочной железы КРС также играет роль ЛПС — PAMP, который служит компонентом внешней оболочки Escherichia coli и распознается TLR4 (38, 39). Воздействие ЛПС также способствует формированию эндометритов у коров (40). При длительном кормлении коров высококонцентрированной пищей ЛПС накапливается в пищеварительном тракте, переносится из рубца в кровоток и, попадая по воротной вене в печень, провоцирует ее воспаление и повреждение (41).
Грибы ответственны за широкий спектр инвазий: от доброкачественной поверхностной колонизации кожи и слизистых оболочек до смертельных инфекций. Грибы содержат следующие PAMP: хитин (полимер N-ацетилглюкозамина) (42, 43), линейные β -глюканы, маннаны, DHN-меланин, ДНК грибов, которые распознаются TLR2, TLR4 и TLR9 (44-46). Основные грибы, ответственные за инфекции КРС, — это условно-патогенные Aspergillus fumigatus , Candida albicans и Penicillium spp. (47-49). Грибковая инфекция может провоцировать репродуктивные сбои у КРС, вызывая инфекцию матки при наличии определенных предрасполагающих факторов, таких как длительная антибиотикотерапия, наличие персистирующего эндометрита или некротических очагов (49).
Интересна роль TLR4 в патогенезе микоплазменной инфекции. U.K. Shandilya и соавт. (50) показали, что нокаут гена TLR4 в бычьих MACT-клетках усиливает воспаление в ответ на воздействие Mycobacterium avium subsp. paratuberculosis . Таким образом, TLR4 способствует не усилению, а подавлению ответа клеток иммунной системы на инфекции, вызванные микобактериями. Эти результаты указывают на противоположную роль TLR4 в реализации иммунного ответа для липополисахаридных и микобактериальных молекулярных компонентов инфекций и заставляют задуматься о последствиях генетического отбора для улучшения устойчивости к определенным инфекциям.
Toll-рецепторы также играют роль в распознавании паразитарных антигенов. M. Bakshi и соавт. (51) показали, что антигены нематоды Ostertagia ostertagi (oESP-L4 и OoESP-Ad) активируют клетки врожденной иммунной системы, приводя к увеличению в макрофагах, полученных из периферической крови коров, экспрессии генов TNF- α , IL-1 , IL-6 и IL-10 . 186
Авторы показали (51), что антигены нематоды OoESP-Ad либо имеют общие сайты связывания с Toll-рецепторами, либо связаны с конкурирующим механизмом активации макрофагов.
За распознавание вирусной одноцепочечной и двуцепочечной РНК отвечают соответственно TLR7, TLR8 и TLR3. Молекула TLR8 КРС локализована на мембране эндоплазматического ретикулума и в неактивированном состоянии образует гомодимеры, что отличает ее от строения TLR8 у и человека. При активации рецептора происходит реорганизация доменов с образованием компетентных для передачи сигналов димеров (52). TLR7 и TLR8 вовлечены в распознавание вируса бычьего герпеса 1 типа (53) и вируса диареи (54); TLR3, TLR7, TLR8 участвуют в распознавании вируса лейкоза крупного рогатого скота (55).
TLR9 КРС имеет много общего с TLR9 человека. Этот рецептор распознает участки чужеродных нуклеиновых кислот, например мотив ДНК GTCGTT, который служит компонентом клеточной стенки многих бактерий, входящих в состав микробиоты кишечника, — протеобактерий, Bacter-oidetes и актинобактерий (включая бифидобактерии) (56).
При активации TLR9 взаимодействие с GTCGTT индуцирует выработку интерлейкина-6 (IL-6) В-лимфоцитами и выработку IL-6 и IL-12 моноцитами и макрофагами (57).
Toll-рецепторы участвуют в распознавании DAMP, высвобождающихся в результате клеточного стресса или некроза, которые включают белки теплового шока, фибронектины, протеины межклеточного матрикса и др. (58). У КРС показано, что DAMP, такие как гиалуронан внеклеточного матрикса и HMGB ядерного белка, способствуют повреждению тканей при эндометриозе, вызванном действием бактериального ЛПС (40, 60).
NOD-подобные рецепторы. Цикл роста ряда патогенных микроорганизмов включает инфицирование цитоплазмы. Например, гены вирусов часто транскрибируются и транслируются, а вирусные частицы собираются в цитоплазме. Кроме того, некоторые бактерии и паразиты обладают так называемыми механизмами бегства, например проделывают отверстия в мембране фагосом и проникают в цитоплазму. Следовательно, в цитоплазме появляются патогены и их компоненты, а также другие компоненты, образующиеся в результате инфекции и повреждения, поэтому необходимы ПРР, распознающие PAMP в цитоплазме клетки (59).
К таким рецепторам относят NOD-подобные рецепторы (NOD-like receptors, NLR). Семейство NLR состоит из 4 подсемейств: NLRA, NLRB, NLRC и NLRP. Среди этих рецепторов следует выделить NOD1 и NOD2, относящиеся к группе NLRC.
Оба рецептора, NOD1 и NOD2, имеют трехдоменную структуру и состоят из C-концевого домена LRR, который участвует в распознавании лиганда и играет ауторегулирующую роль (60); центрального домена NACHT (Nucleotide-binding domain, Apaf-1, CIITA, HET-E, and TP1), который обеспечивает олигомеризацию и активацию рецептора, и N-концевого домена CARD (caspase activation and recruitment domain), который участвует в передаче сигнала адапторным белкам (61). NOD1 и NOD2 различаются тем, что содержат одну или две копии домена CARD, соответственно (62). При сравнении аминокислотных остатков NOD1 буйвола, коровы, козы, овцы и человека было обнаружено большое сходство в доменах CARD, NACHT и LRR (63).
В отсутствие лигандов молекулы NOD1 и NOD2 имеют свернутую конформацию, при этом LRR домен прикрывает NACHT- и CARD-домены, предотвращая передачу сигнала (64). Связывание агонистов, например му-рамилпептидов, с LRR-доменом NOD-рецептора приводит к олигомеризации NOD-рецепторов через NACHT-домены. Это создает возможность для взаимодействия CARD-доменов с доменами молекул адапторных белков (65) и дальнейшей активации внутриклеточных сигнальных путей. В итоге происходит миграция факторов транскрипции NF-κB в ядро клетки, а затем активация транскрипции генов. Олигомеризация NOD-рецепторов также может приводить к образованию инфламмасом NLRC4 и, как следствие, активации каспазы 1 и процессингу IL-1β (рис. 2) (66).
Рецепторы NOD1 и NOD2 распознают мурамилпептиды — мономерные фрагменты пептидогликана бактерий. NOD2 также может распознавать одноцепочечную РНК вирусов. Мурамилпептиды способствуют нейтрофильному воспалению в молочной железе коров. Совместно с липо-тейхоевой кислотой, мурамилдипептид (МДП) запускает врожденный иммунный ответ при мастите, вызванном Staphylococcus aureus (67). Интрамам-марная инстилляция МДП и ЛПС приводит к увеличению поверхностной экспрессии на макрофагах маркера воспаления CD44 (25).
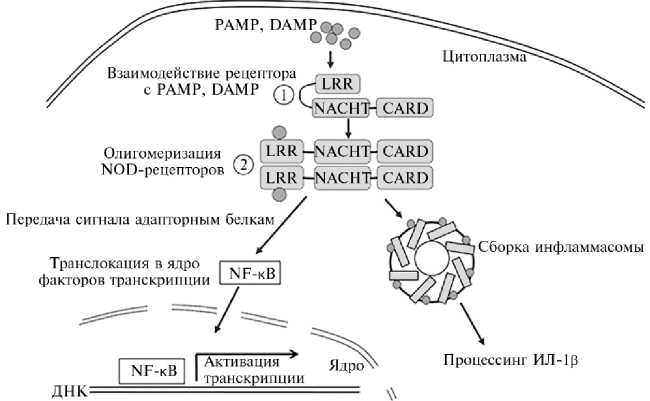
Рис. 2. Строение и механизм активации NOD-подобных рецепторов: 1 — свернутая конформация NOD-рецептора, 2 — олигомеризация NOD-рецептора; PAMP — патоген-ассоциированные молекулярные паттерны, DAMP — молекулярные паттерны, ассоциированные с повреждением, LRR — обогащенные лейцином повторы, NACHT — NAIP (белок-ингибитор апоптоза нейронов), C2TA (активатор транскрипции МНС 2-го класса), HET-E (несовместимость с гетерокарионами) и TP1 (белок, связанный с теломеразой 1), CARD —домены активации и рекрутирования каспаз, NF- κ B — ядерный фактор транскрипции κ B, Ил-1 β — интерлейкин-1 β (66).
Лектиноподобные рецепторы С-типа (CLR). CLR отвечают за связывание углеводных компонентов. Обнаруженные у КРС лектиноподобные рецептороы С-типа представлены преимущественно на дендритных клетках и макрофагах, а наибольшее число CLR сконцентрировано в лимфоузлах. Транскрипты мРНК CLR также были выявлены в гранулоцитах, В-клетках и Т-клетках быков (68, 69). У КРС выявлено 32 типа молекул CLR. Большинство из них можно идентифицировать как ортологи белков человека и мыши (69).
Общая структура лектиноподобных рецепторов, ассоциированных с мембранами макрофагов и дендритных клеток, представляет собой цитоплазматический домен, трансмембранный домен и один или несколько доменов распознавания углеводов. После связывания лиганда с доменом распознавания углеводов CLR происходит передача активационного сигнала в клетку через мотив активации иммунорецепторного тирозина (immunoreceptor tyrosine-based activation motif, ITAM) или ингибирующий мотив имму-норецепторного тирозина (immunoreceptor tyrosine-based inhibitory motif, ITIM) в их цитоплазматическом домене (70). CLR Mincle, обнаруженный также у быков, связывается c ITAM через остаток аргинина (Arg42) в своем трансмембранном домене (71). Фосфорилирование FcRg-связанного мотива ITAM/ITIM рекрутирует протеинтирозинкиназы, содержащие домен SH2 (например, Syk). Syk может, в свою очередь, активировать MALT1, что приводит к активации транскрипционного фактора NF-κB, активации транскрипции и образованию иммунорегуляторных цитокинов и хемокинов, включая IL-6, IL-12, IL-23 и IL-1β (рис. 3) (72).
CLR распознают углеводные фрагменты собственных и чужих антигенов, например маннозу, фруктозу, галактозу (73), участвуют в распознавании β -глюканов грибов (74, 75). У КРС лектиноподобные рецепторы С-типа играют ключевую роль в распознавании PAMP простейших паразитов (76). В частности, они участвуют в распознавании антигенов Neospora can-inum — внутриклеточного паразита, заражающего коров в качестве промежуточного хозяина, что впоследствии приводит к абортам (76). CLR скота участвуют в распознавании корд-фактора (6,6´-димиколат-трегалозы) микобактерий. A. Holder и соавт. (69) показали у КРС возможность связывания лектиноподобными рецепторами С-типа углеводных компонентов бактериальной стенки у Esherichia coli , Klebsiella pneumoniae , Staphylococcus aureus и Mycobacterium bovis . Установлено, что лектиноподобный рецептор быков boMincle играет роль в удалении поврежденных клеток и поддержании гомеостаза организма.
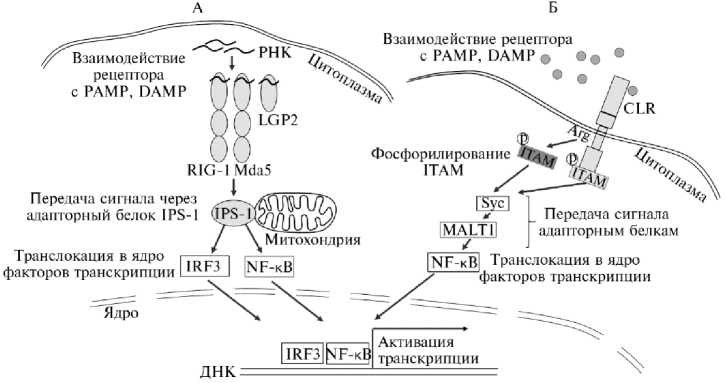
Рис. 3. Механизм активации лектиноподобных (А) и RIG-I-подобных (Б) рецепторов коров: PAMP — патоген-ассоциированные молекулярные паттерны, DAMP — молекулярные паттерны, ассоциированные с повреждением, LGP2 — RIG-I-подобный рецептор 3, RIG-1 — индуцируемый ретиноевой кислотой ген 1, MDA5 — RIG-I-подобный рецептор, белок 5, ассоциированный с дифференциацией меланомы, фермент РНК хеликаза, IPS-1 — митохондриальный адапторный белок IPS, IRF3 — регуляторный фактор интерферона 3, NF- κ B — ядерный фактор транскрипции κ B, CLR — лектиновые рецепторы С-типа, ITAM — тирозинсодержащие активационные последовательности аминокислот в иммунорецепторах, Syc — растворимый белок, сплайсинговая изоформа рецептора цитокинов, MALT1 — белок транслокации лимфомы лимфоидной ткани, ассоциированной со слизистой оболочкой, 1 (69, 78).
RIG-1-ïîäîáíûå (RLR) ðåöåïòîðû. RIG-I-подобные рецепторы представляют собой цитоплазматические рецепторы нуклеиновых кислот для РНК вирионов, промежуточных молекул репликации РНК, а также продук- тов их транскрипции.
Семейство RLRs включает три рецептора: RIG-I (retinoid acid inducible gene I), MDA5 (melanoma differentiation factor 5) и LGP2 (laboratory of genetics and physiology 2) (77). RIG-I и Mda5 используют для передачи сигнала в клетке адаптер IPS-1, локализованный в митохондриях. IPS-1-зави-симые пути приводят к активации IRF3 и NF- κ B, индуцируя соответственно продукцию IFN типа I и провоспалительных цитокинов (см. рис. 3). В LGP2 отсутствуют CARD-подобные домены, этот рецептор отрицательно или положительно регулирует ответы RIG-I и Mda5 (78).
Распознавание клетками иммунной системы двуцепочечной РНК приводит к индукции врожденного иммунного ответа при защите от ротавирусной инфекции (79, 80). RIG-I участвует в распознавании вируса диареи у КРС, который приводит к диарее и эрозиям слизистых оболочек, что сопровождается респираторными и репродуктивными заболеваниями животного (54).
Полиморфизм паттерн-распознающих рецепторов. Мутации генов ПРР могут приводить к структурно-функциональным изменениям рецепторов, в связи с чем возможно нарушение распознавания PAMP, DAMP, а также передачи сигнала с рецептора в клетку. Следствием нарушения передачи сигнала с рецептора в клетку может стать изменение экспрессии генов цитокинов и других белков, отвечающих за активацию клеток врожденной иммунной системы и элиминацию патогенов.
В настоящее время ведется активное изучение новых мутаций генов ПРР сельскохозяйственных животных, в том числе у КРС. При помощи методов секвенирования, ПЦР выявляют новые полиморфные варианты генов ПРР. Проводятся исследования по определению частоты встречаемости полиморфных вариантов генов у разных пород КРС. Оценка влияния полиморфизма с использованием программных инструментов Variant Effect Predictor и SIFT позволяет идентифицировать связь однонуклеотидных полиморфизмов (single nucleotide polymorphism, SNP) с устойчивостью к бактериальным и вирусным инфекциям (81). С практической точки зрения представляют интерес работы, посвященные изучению роли полиморфизма ПРР в устойчивости к инфекциям КРС.
Необходимо отметить, что наибольшее число исследований полиморфизма ПРР в нашей стране и за рубежом посвящено Toll-рецепторам. Показано, что мутации в генах Toll-рецепторов могут влиять на устойчивость к заболеваниям, вызванным бактериальными патогенами (82). Например, мутации в генах TLR1 , TLR2 , TLR4 , TLR6 ассоциированы с числом соматических клеток в молоке коров (83) и заболеваемостью маститом (84-86); мутации TLR1, TLR2 , TLR4 и TLR9 ассоциированы с заболеваемостью КРС бруцеллезом (87) и инфекциями, вызванными микобактериями (88-90). В гене TLR2 обнаружен локус SNP rs55617172, для которого выявлена связь с резистентностью к туберкулезу у скота (91).
K. Nov a k с соавт. (81) обнаружили ассоциацию полиморфизма генов TLR1 и TLR2 с легкостью отела, продуктивным долголетием коров и индексом жизнеспособности телят. Авторы предположили, что в основе механизмов этих эффектов может лежать устойчивость к инфекции, а легкость отела, вероятно, связана с участием TLR2 в передаче сигналов в миометрии.
При генотипировании генов Toll-рецепторов быков-производителей голштинской, холмогорской, симментальской пород и бизонов из разных регионов России (более 275 животных) при помощи NGS («Pacific Biosci-ence», США) была определена первичная вариабельность генов врожденного иммунитета бактериальных TLR1, TLR2, TLR4, TLR5, TLR6 и вирус- ных TLR3, TLR7, TLR8, TLR 9 и TLR10. Всего обнаружили 262 мутации, из которых 31 подтверждена при помощи технологии SNP-типирования SNAPSHOT («Thermo Fisher Scientific», США) (92, 93). Для бактериальных рецепторов изначальная изменчивость варьировала от 4 до 24, для вирусных — от 7 до 64 вариаций на каждый ген, при этом часть выявленных мутаций были синонимичными, то есть вследствие вырожденности генетического кода последовательность аминокислот в белке, кодируемом этим геном, не изменялась. Более 192 SNP обладали важной биологической значимостью (92, 93).
Дополнительно при помощи технологии SNAPSHOT типировали 15 генетических вариантов для генов TLR1 , TLR2 , TLR5 и TLR6 , которые также были выявлены у симментальской породы красно-пестрого чешского скота (94). Показано, что эти варианты присутствуют в области белковых молекул соответствующих рецепторов. Ряд мутаций соответствует синонимичным заменам, часть — молчащим вариантам, то есть замены оснований не приводили к изменению аминокислоты или функциональности аминокислоты при трансляции измененной мРНК. Большая часть из выявленных вариантов имеет высокую биологическую значимость, приводя к структурным изменениям белковых молекул (92, 95, 96).
В литературе встречаются также данные по полиморфизму NOD- рецепторов КРС. Исследование полиморфизма NOD-рецепторов, проведенное Mishra S.K. и соавт. (63), показало 23 SNP в гене NOD1 буйволов, из которых две замены приводят к замене аминокислот функционально важных доменов CARD и LRR (соответственно Asp66Asn и Glu887Asp). Эти изменения могут повлиять на общую структуру и биологическую функцию белка NOD1, в том числе на взаимодействие рецептора NOD1 с его агонистом iE-DAP, что нуждается в более детальном изучении.
В гене NOD2 выявлено 46 полиморфных сайтов, а анализ ассоциации с фенотипом мастита молочных буйволов показал значительные различия в частотах аллелей в локусе G1135A между животными с маститом относительно здоровых особей (97). Выявлен полиморфизм NOD2 (rs110536091, rs111009394) в породе Ankole Longhorn, но животные с разными аллелями не показали различий в чувствительности к паратуберкулезу (98). P. V a zquez с соавт. (95) обнаружили, что аллель С гена NOD2 (SNP c.*1908C>T) встречается у животных, инфицированных Mycobacterium avium subsp. paratuberculosis , значительно чаще, чем у здоровых, что подтверждает гипотезу о том, что ген NOD2 КРС играет роль в восприимчивости животных к MAP-инфекции.
Итак, функциональная активность паттерн-распознающих рецепторов (ПРР) врожденной иммунной системы, расположенных как на поверхности (TLR1, TLR2, TLR7, TLR8, CLR), так и в цитоплазме клеток (TLR4, NOD1, NOD2, RIG-I), их способность к связыванию антигена, эффективность передачи сигнала в клетке, наличие ингибиторов и активаторов транскрипции служат определяющими факторами активации клеток врожденной иммунной системы, непосредственным результатом деятельности которой становится удаление патогенов. Полиморфизм генов иммунной системы активно исследуется. В частности, технологии секвенирования нового поколения (next-generation sequencing, NGS) выявляют значительное число полиморфных вариантов генов ПРР, а оценка влияния полиморфизма с использованием программных инструментов Variant Effect Predictor и SIFT позволяет выделять среди множества SNP несинонимичные мутации, которые приводят к изменению функциональной активности молекул ПРР. Наличие мутаций в генах ПРР может оказывать существенное влияние на работу рецепторов, а именно нарушать связывание рецептора с PAMP и DAMP, снижать эффективность взаимодействия рецептора с внутриклеточными адапторами, такими как Myd88, TRIF, ITAM, IPS-1 и др. Это, в свою очередь, будет приводить к нарушению эффективности передачи сигнала в клетке и оказывать влияние на активацию транскрипционных факторов NF-κB, IRF3, которые регулируют экспрессию генов цитокинов. Изменение цитокинового профиля активации клетки в ответ на действие патогена способно вызвать снижение устойчивости животных к маститу, стафилококковой, микоплазменной и другим инфекциям. Нарушение продукции цитокинов может способствовать развитию хронического воспаления, аутоиммунной патологии. В условиях высокопродуктивного животноводства важно сокращать частоту и сроки болезненных состояний животных. Поэтому изучение связи изменчивости генов ПРР с их функциональной активностью, а также с устойчивостью к заболеваниям открывает новые возможности для селекции животных с лучшими показателями иммунитета. При организации селекционно-племенной работы важно ориентироваться на получение линий крупного рогатого скота, более устойчивых к действию факторов окружающей среды, в том числе инфекционных агентов.


