Роль печени в регуляции белково-стероидного взаимодействия у здоровых и облучённых животных
Бесплатный доступ
Изучение роли печени в регуляции белково-стероидного взаимодействия у здоровых и облучённых животных позволяет дополнить ряд теоретических положений радиобиологии о факторах, оказывающих влияние на патогенез острой лучевой болезни. Актуальность исследования обусловлена его теоретической значимостью в создании целостной концепции радиобиологических закономерностей патогенеза острой лучевой болезни. Целью экспериментов является изучение влияния печени на фракционный состав 11-оксикортикостероидов (11-ОКС) в плазме крови здоровых и облучённых животных. Эксперименты были проведены на 7 беспородных собаках весом от 22 до 27 кг. У собак определяли суммарную концентрацию 11-ОКС, уровень свободных, связанных с белком и связанных с глюкуроновой кислотой кортикостероидов в крови бедренной, воротной и печёночной вен. На первом этапе опыты проводили на здоровых животных. 4 животных были подвергнуты ангиостомии методом кожного лоскута. Кровь получали в условиях отсутствия воздействий, через 90 мин после внутривенной инъекции 40 ед. адренокортикотропного гормона (АКТГ), введения в желудок гидрокортизона в дозе 50 или 100 мг. Общее содержание 11-ОКС, мкг%, определяли флюориметрическим методом в авторской модификации. Для определения свободной 11-ОКС использовали метод гельфильтрации в авторской модификации. Фракцию, связанную с белками плазмы, выделяли на колонке с сефадексом Г-25. Глюкурониды определяли после инкубации плазмы с b-глюкуронидазой. На втором этапе опыты проводили на облучённых животных, которые были подвергнуты g-облучению на установке ЭГО-2 при средней мощности дозы 5,75 Гр/мин в дозе 3,5 Гр, вызывающему острую лучевую болезнь IV стадии. Результаты исследования показали, что печень инактивирует свободные 11-ОКС, связывая их с глюкуроновой кислотой, степень задержки и инактивации свободных кортикоидов коррелирует с концентрацией последних в крови. Печень не влияет на уровень связанных с белком гормонов. Связывание кортикостероидов с белками плазмы крови происходит вне печени. При острой лучевой болезни способность печени инактивировать биологически активные кортикостероиды снижается.
Острая лучевая болезнь, печень, плазма крови, стероидные гормоны, белково-стероидное взаимодействие, 11-оксикортикостероиды, глюкуроновая кислота, ангиостомия, адренокортикотропный гормон, гидрокортизон, свободный гормон
Короткий адрес: https://sciup.org/170199715
IDR: 170199715 | УДК: 591.436:616-001.28:616-008.9 | DOI: 10.21870/0131-3878-2023-32-2-78-87
Текст научной статьи Роль печени в регуляции белково-стероидного взаимодействия у здоровых и облучённых животных
Известно, что печень играет ведущую роль в инактивации стероидных гормонов, что имеет большое значение для поддержания устойчивого гормонального баланса в организме. В печени синтезируются белки, обладающие способностью связываться с кортикостероидами, регулируя, таким образом, биологическую активность гормонов в организме [3, 15, 16]. Поэтому для создания целостной концепции радиобиологических закономерностей патогенеза острой лучевой болезни необходимо изучить вопросы о влиянии печени на фракционный состав 11-оксикортикостероидов (11-ОКС) в плазме крови животных как в норме, так и при острой лучевой болезни.
Материалы и методы
Для изучения роли печени в регуляции фракционного состава 11-ОКС плазмы крови и степени её нарушения при действии на организм ионизирующей радиации серия экспериментов проводилась в два этапа на 7 беспородных собаках весом от 22 до 27 кг. Целесообразно предположить, что печень избирательно влияет на те или иные гормональные фракции, учитывая различное физиологическое значение и биологическую активность циркулирующих в крови кортикостероидов – свободных, связанных с белками плазмы, конъюгированных с глюкуроновой кислотой. Поэтому у собак определяли суммарную концентрацию 11-ОКС, а также уровень свободных, связанных с белком и связанных с глюкуроновой кислотой кортикостероидов в крови бедренной, воротной и печёночной вен.
На первом этапе опыты проводили на здоровых животных. В ходе эксперимента 4 животных были подвергнуты ангиостомии методом кожного лоскута, который, не нарушая целостности сосудов, даёт возможность получать кровь из крупных сосудов брюшной полости в предельно физиологических условиях. Кожные ангиостомические канюли накладывали на воротную и печёночную вены. Кровь из указанных сосудов получали без каких-либо воздействий, а также через 90 мин после внутривенной инъекции 40 ед. адренокортикотропного гормона (АКТГ) или введения в желудок гидрокортизона в дозе 50 или 100 мг. Общее содержание 11 -ОКС (мкг%) определяли флюориметрическим методом Guillemin et al. [17] в авторской модификации. Для определения свободной 11-ОКС использовали метод гельфильтрации De Moor et al. [18] в авторской модификации. Фракцию, связанную с белками плазмы, выделяли на колонке с сефадексом Г-25. Глюкурониды определяли после инкубации плазмы с β-глюкуронидазой.
На втором этапе эксперименты были продолжены на облучённых животных, которые были подвергнуты γ-облучению на установке ЭГО-2 при средней мощности дозы 5,75 Гр/мин в дозе 3,5 Гр, вызывающему острую лучевую болезнь IV стадии. Собак тестировали на первые сутки после облучения, на 5 и 12 сутки лучевой болезни. Все собаки погибли в период с 13 по 17 сутки после облучения.
Результаты и их обсуждение
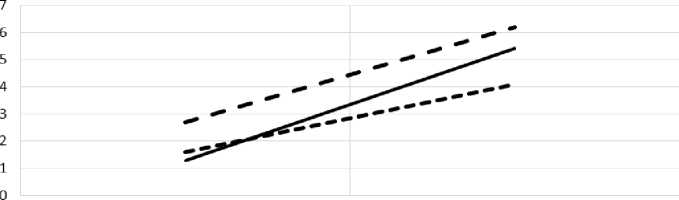
Исследование фракционного состава 11-ОКС в периферической крови, полученной из бедренной вены, показало, что большая часть гормонов находится в связанном состоянии. Повышение уровня кортикостероидов после стимуляции коры надпочечников экзогенным АКТГ обеспечивается увеличением всех изучаемых фракций 11-ОКС (рис. 1).
Анализ фракционного состава 11-ОКС в крови из воротной и печёночной вен показал, что в притекающей к печени крови (из воротной вены) в состоянии покоя соотношение фракций и общее количество 11-ОКС практически соответствуют таковым, обнаруженным в периферической венозной крови. Однако, пройдя через сосудистую систему печени, кортикостероидный состав крови меняется, причём уменьшается количество свободных 11-ОКС и увеличивается количество глюкуронидов; связанные же с белками кортикостероиды не претерпевают количественных изменений. Следовательно, печень в состоянии покоя метаболизирует часть свободных стероидов, связывает их с глюкуроновой кислотой и выделяет в кровь, что полностью согласуется с теоретическими положениями о роли печени в метаболизме стероидных гормонов (рис. 2).
До введения АКТГ После введения АКТГ
Свободные ——Связанные с белком ---Глюкурониды
Рис. 1. Фракционный состав 11-ОКС в периферической венозной крови до и после введения АКТГ (в мкг%).
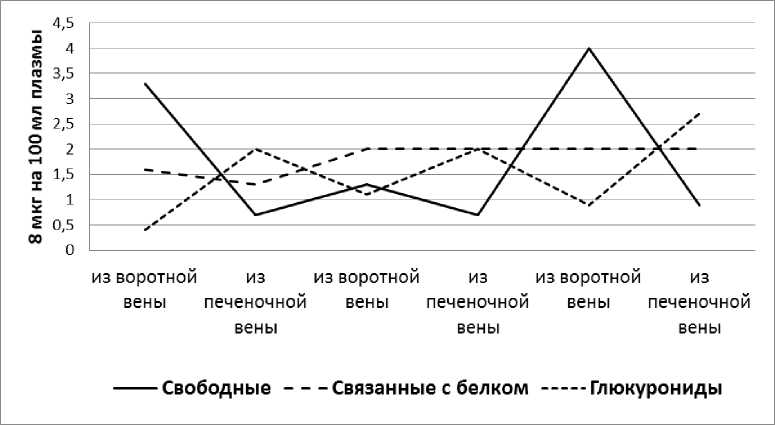
Рис. 2. Влияние печени на фракционный состав 11-ОКС плазмы крови в норме.
Функциональное состояние печени было изменено с помощью искусственного нарушения устойчивого баланса кортикостероидов посредством введения экзогенных АКТГ или гидрокортизона (рис. 3-5).
После введения АКТГ соответственно увеличению свободной фракции 11-ОКС увеличивается задержка её печенью. Активизируется также процесс синтеза глюкуронидов в печени, уровень их в крови увеличивается. Однако выделение глюкуронидов печенью происходит лишь при низких их концентрациях в притекающей к печени крови. Если же уровень глюкуронидов в крови воротной вены превышает 3-4 мкг%, наблюдается противоположный эффект – печень начинает задерживать их. Фракция связанных с белками плазмы кортикостероидов, несмотря на её значительное увеличение (до 6 мкг%), проходит через печень в неизменённом виде.
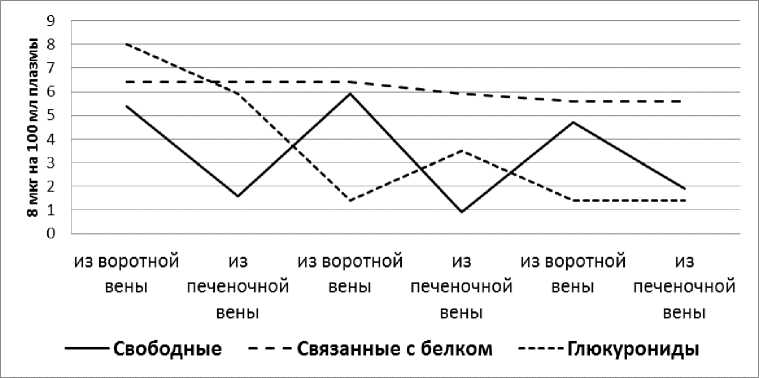
Рис. 3. Влияние печени на фракционный состав 11-ОКС плазмы крови после введения АКТГ.
Аналогичная реакция печени в отношении свободной и связанной с белками фракции наблюдается и при введении в желудок 50 мг гидрокортизона. Что касается глюкуронидов, концентрация которых в притекающей крови повышается до 4-10 мкг%, была отмечена постоянная и активная задержка их печенью (рис. 4).
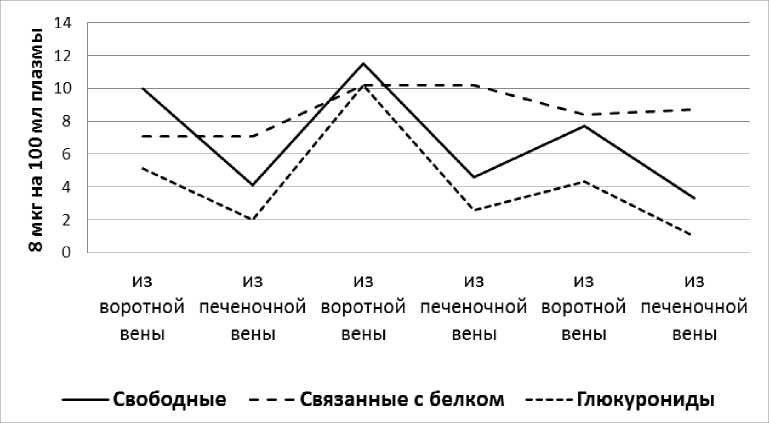
Рис. 4. Влияние печени на фракционный состав 11-ОКС плазмы крови после введения 50 мг гидрокортизона.
Увеличение вводимой в желудок дозы гидрокортизона до 100 мг ещё больше повышает уровень 11-ОКС в крови, не изменяя характера реакции печени в отношении отдельных фракций стероидов. Характерно, что повышение суммарных стероидов обеспечивается за счёт свободной фракции и глюкуронидов; уровень кортикоидов, связанных с белками, не превышает 10,4 мкг%. Эта цифра, по-видимому, характеризует максимальную ёмкость кортикостероид-связывающих белков плазмы у собак (рис. 5).
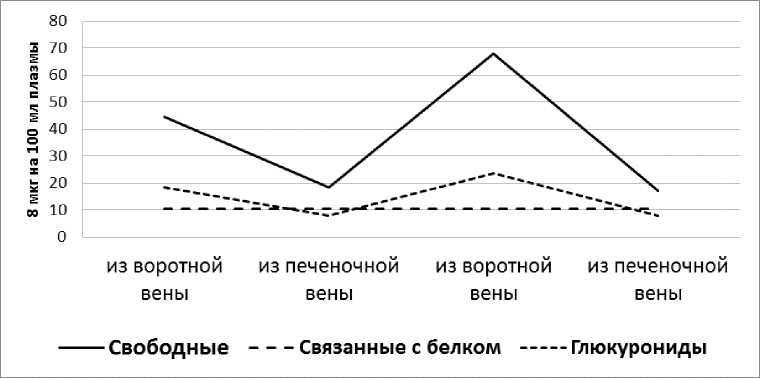
Рис. 5. Влияние печени на фракционный состав 11-ОКС плазмы крови после введения 100 мг гидрокортизона.
Резкое увеличение концентрации глюкуронидов в крови воротной вены после алиментарной нагрузки гидрокортизоном позволило предположить, что связывание поступающего в кровь гормона с глюкуроновой кислотой осуществляется уже в кишечнике в процессе всасывания. Такое предположение удалось подтвердить путём прямого определения глюкуронидов в притекающей к кишечнику и оттекающей от него крови. В процессе всасывания гидрокортизона из кишечника концентрация глюкуронидов в крови, полученной из воротной вены (оттекающая от кишечника кровь), была в 2,5 раза выше, чем в артериальной (притекающей к кишечнику) (p˂0,001).
Обобщая приведённые результаты на ангиостомированных собаках, можно видеть характер влияния печени на концентрацию исследуемых фракций 11-ОКС в крови. Задержка свободных кортикоидов печенью возрастает соответственно увеличению их концентрации в притекающей к печени крови, процент задержанных печенью кортикостероидов при этом почти не меняется (61,0-78,0). Связанные с белками плазмы кортикоиды свободно проходят через печень даже при максимальной их концентрации, т.е. при полном насыщении кортикостероид-связывающего белка. Отношение печени к глюкуронидам изменяется в зависимости от их концентрации в крови. При низком содержании глюкуронидов (в экспериментах без введения гормонов, а также в ряде случаев после введения АКТГ) печень выделяет в кровь дополнительное количество связанных с глюкуроновой кислотой кортикостероидов.
При увеличении их концентрации в притекающей крови свыше 3-4 мкг% (в ряде случаев после введения АКТГ и всегда после введения гидрокортизона) печень начинает активно задерживать их и, по-видимому, экскретирует с желчью, т.е. активизируется процесс внутрипечёночной циркуляции кортикостероидов. Такое повышение уровня глюкуронидов в крови до прохождения адренокортикальных гормонов через печень может быть вызвано высоким содержанием последних. Иными словами, усиленная секреция кортикостероидов стимулирует дополнительный, внепечёночный механизм их инактивации.
На втором этапе эксперименты были продолжены на облучённых животных в дозе 3,5 Гр, вызвавшей острую форму лучевой болезни. Функциональные изменения печени, возникающие под влиянием радиации при уровне кортикостероидов в крови после введения 40 ед. АКТГ, связаны с нарушением гомеостатических закономерностей, лежащих в основе гормонинактивирую-щей функции печени (рис. 6).
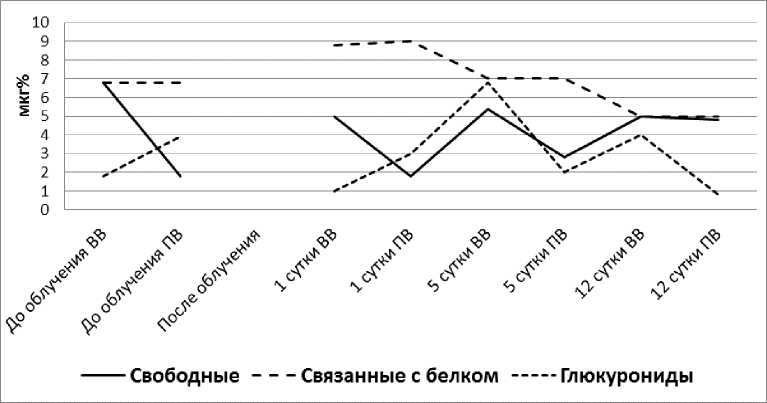
Рис. 6. Влияние печени облучённой собаки (3,5 Гр) на фракционный состав 11-ОКС после введения 40 ед. АКТГ.
ВВ - в плазме крови воротной вены; ПВ – в плазме крови печёночной вены.
Это проявляется в неустойчивости реакции печени облучённых животных на одинаковую степень повышения уровня кортикостероидов в крови. Диапазон ответной реакции печени при этом может значительно превышать нормальную реакцию, свойственную здоровому организму. Задержка свободных 11-ОКС печенью облучённых собак колебалась в пределах, превышающих диапазон нормальных колебаний, характерных для всех животных, прошедших испытание по этому тесту. Однако на фоне общей дисфункции гормонинактивирующей способности печени можно отметить отчётливую тенденцию к снижению задержки свободных кортикостероидов, усиливающуюся по мере развития заболевания. На 12-е сутки после облучения речь идёт уже о резком подавлении задержки свободных 11-ОКС печенью. Удаление из крови глюкуронидов характеризовалось лишь широкой вариабельностью, резкого торможения этой функции печени нельзя было отметить даже в терминальной стадии заболевания. Печень облучённых животных, как и у здоровых собак, была совершенно индифферентна к фракции кортикостероидов, связанных с белками плазмы. Нам не удалось отметить какого-либо различия между концентрацией этой фракции в притекающей и оттекающей от печени крови, что ещё раз подтверждает положение о внепечёночном комплексообразовании кортикостероидов с белками плазмы. Вместе с тем, обращает на себя внимание факт снижения в крови абсолютного количества связанных с белком кортикостероидов по мере развития заболевания.
Результаты свидетельствуют о снижении ёмкости кортикостероид-связывающего белка у собак по мере развития острого лучевого заболевания. Следствием снижения гормонинактиви-рующей функции печени и подавлением кортикостероид-связывающей способности плазменных белков при лучевой болезни можно считать увеличение концентрации свободных 11-ОКС в крови, оттекающей от печени.
Заключение
Таким образом, результаты, полученные в данной серии экспериментов, позволили сделать следующие выводы.
-
1. Роль печени в регуляции фракционного состава кортикостероидов сводится, прежде всего, к контролю над уровнем в крови свободной, биологически активной фракции гормонов; степень задержки и инактивации свободных кортикоидов коррелируют с концентрацией последних в крови.
-
2. Интенсивность образования глюкуронидов в печени и дальнейшая их судьба (выведение в кровь или в кишечник) в конечном счёте, видимо, определяется уровнем свободных кортикоидов в крови. Дополнительное экстрагепатическое образование глюкуронидов значительно стимулирует внутрипечёночную циркуляцию кортикостероидов.
-
3. Как в условиях покоя, так и при гормональных нагрузках печень остаётся совершенно индифферентной по отношению к фракции кортикостероидов, связанных с белками плазмы, их концентрация в притекающей к печени и оттекающей от неё крови всегда одинакова. Это свидетельствует о том, что комплексообразование гормонов коры надпочечников с белками плазмы крови происходит вне печени.
-
4. При острой лучевой болезни снижается способность печени инактивировать биологически активные кортикостероиды.
Список литературы Роль печени в регуляции белково-стероидного взаимодействия у здоровых и облучённых животных
- Анохин П.К. Очерки физиологии функциональных систем. М.: Книга по требованию, 2021. 450 с.
- Гребенюк А.Н., Стрелова О.Ю., Легеза В.И., Степанова Е.Н. Основы радиобиологии и радиационной медицины: учебное пособие. СПб.: ООО Издательство ФОЛИАНТ, 2012. 232 с.
- Докшина Г.А. Эндокринные и метаболические аспекты лучевой болезни. Томск: Издательство Томского ун-та, 1984. 223 с.
- Мороз Б.Б., Кендыш И.Н. Радиобиологический эффект и эндокринные факторы. М.: Атомиздат, 1975. 228 с.
- Романцев Е.Ф., Блохина В.Д., Кощеенко Н.Н., Филиппович И.В. Ранние радиационно-биохимические реакции. М.: Атомиздат, 1966. 268 с.
- Gagliardi L., Ho J.T., Torpy D.J. Corticosteroid-binding globulin: the clinical significance of altered levels and heritable mutations //Mol. Cell Endocrinol. 2010. V. 31, N 6. P. 24-34.
- Klieber M.A., Underhill C., Hammond G.L., Muller Y.A. Corticosteroid-binding globulin, a structural basis for steroid transport and proteinase-triggered release //J. Biol. Chem. 2007. V. 282, N 4). P. 29594-29603.
- Lewis J.G., Borowski K.K., Shand B.I., George P.M., Scott R.S. Plasma sex hormone-binding globulin, corticosteroid-binding globulin, cortisol, and free cortisol levels in outpatients attending a lipid disorders clinic: a cross-sectional study of 1137 subjects //Horm. Metab. Res. 2010. V. 42. N 4. P. 274-279.
- Lewis J.G., Elder P.A. Corticosteroid-binding globulin reactive centre loop antibodies recognise only the intact natured protein: elastase cleaved and uncleaved CBG may coexist in circulation //J. Steroid Biochem. Mol. Biol. 2011. V. 127, N 3-5. P. 289-294.
- Zhou A., Wei Z., Stanley P.L., Read P.J., Stein P.E., Carrell R.W. The S-to-R transition of corticosteroid-binding globulin and the mechanism of hormone release //J. Mol. Biol. 2008. V. 380, N 1. P. 244-251.
- Hamrahian A.H., Oseni T.S., Arafah B.M. Measurements of serum free cortisol in critically ill patients //N. Engl. J. Med. 2004. V. 350, N 16. P. 1629-1638.
- Lewis J.G., Elder P.A. Intact or «active» corticosteroid-binding globulin (CBG) and total CBG in plasma: determination by parallel ELISAs using monoclonal antibodies //Clin. Chim. Acta. 2013. V. 416. P. 26-30.
- Nguyen P.T., Lewis J.G., Sneyd J., Lee R.S., Torpy D.J., Shorten P.R. Development of a formula for estimating plasma free cortisol concentration from a measured total cortisol concentration when elastase-cleaved and intact corticosteroid binding globulin coexist //J. Steroid Biochem. Mol. Biol. 2014. V. 141. P. 16-25.
- Vincent R.P., Etogo-Asse F.E., Dew T., Bernal W., Alaghband-Zadeh J., le Roux C.W. Serum total cortisol and free cortisol index give different information regarding the hypothalamus-pituitary-adrenal axis reserve in patients with liver impairment //Ann. Clin. Biochem. 2009. V. 46, N 6. P. 505-507.
- Юдаев Н.А. Биохимия гормонов и гормональной регуляции. М.: Медицина, 1976. 378 с.
- Berliner D., Koller H., Dougherty T. Tissue retention of cortisol and metabolites induced by ACTH: an extra adrenal effect //Endocrinology. 1961. V. 68. P. 621-632.
- Guillemin R., Clayton G., Lipscomb H., Smith J. Fluorometric measurement of rat plasma and adrenal corticosterone concentration; a note on technical details //J. Lab. Clin. Med. 1959. V. 53, N 5. P. 830-832.
- De Moor P., Hoirwegh K., Heromans G., Declerck-Raskin M.M. Protein binding of corticosteroid studied by gel filtration //J. Clin. Invest. 1962. V. 41, N 4. P. 816-827.


