Роль ПЭТ в лечении в-клеточных лимфопролиферативных заболеваний в рутинной клинической практике в России
Автор: Бабичева Л. Г., Поддубная И. В.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Собственные исследования
Статья в выпуске: 2 т.10, 2020 года.
Бесплатный доступ
Цель. Оценка роли позитронно-эмиссионной томографии (ПЭТ) в диагностике и лечении В-клеточных лимфопролиферативных заболеваний (В-ЛПЗ) в российской клинической практике в период с 2014 по 2017 год. Материалы и методы. В пострегистрационное многоцентровое исследование EQUILIBRIUM было включено 1000 пациентов в возрасте от 21 до 91 года с верифицированным диагнозом В-клеточной неходжкинской лимфомы (В-НХЛ) или хронического лимфолейкоза (ХЛЛ), получивших не менее 4 циклов ритуксимаб-содержащей терапии препаратом Ацеллбия®. Основным способом оценки распространенности заболевания, размеров и локализации поражений являлась компьютерная томография, которая проведена 76,2 % пациентов. Позитронно-эмиссионная томография (ПЭТ) на том или ином этапе была проведена 324 (32,4%) пациентам: в 152 (47 %) случаях - при первичной диагностике, промежуточная ПЭТ - 102 (31%) пациентам и подавляющему большинству - 310 (96%) больным - после полной программы индукционной химио-иммунотерапии. Результаты. По данным результатов промежуточной ПЭТ полная ремиссия была достигнута у 44 (43%) из 102 пациентов, частичная ремиссия - в 53 (52%) случаях, стабилизация отмечена у 5 (5 %) больных; прогрессирование среди пациентов, которым выполнялась промежуточная ПЭТ, не выявлено. Основным проявлением эффективности на этапе финальной ПЭТ-оценки среди 310 больных было достижение полной ремиссии (ПР) - в 235 (75,8%) случаях; частичная ремиссия (ЧР) зарегистрирована всего у 61 (19,7%) больного, также зарегистрировано 14 (4,5%) случаев прогрессирования заболевания. Медиана наблюдения за пациентами составила 15 месяцев (диапазон от 1 до 42 мес.). Медиана общей выживаемости (ОВ), также как и медиана бессобытийной выживаемости (БСВ), как и ожидалось, за этот период времени достигнута не была. Отмечено статистически достоверное влияние результатов промежуточной ПЭТ на БСВ (р = 0,07661) без существенного воздействия на ОВ (р = 0,69868). Глубина ответа, зафиксированная при финальной ПЭТ, оказалась прогностически значимым фактором как для БСВ, так и для ОВ (р = 0,00000). Заключение. Современным методом диагностики и оценки эффекта при В-клеточных лимфопролиферативных заболеваниях является позитронно-эмиссионная томография, которая в рутинной клинической практике выполняется лишь у 1 / 3 пациентов. Тем не менее, роль этого метода в оценке эффективности терапии не вызывает сомнений.
Неходжкинская лимфома, ритуксимаб, ацеллбиа, позитронно-эмиссионная томография, оценка эффекта
Короткий адрес: https://sciup.org/140251222
IDR: 140251222 | DOI: 10.18027/2224-5057-2020-10-2-5
Текст научной статьи Роль ПЭТ в лечении в-клеточных лимфопролиферативных заболеваний в рутинной клинической практике в России
В последние десятилетия особое внимание профессиональных сообществ устремлено в сторону изучения рутинной клинической практики. Эти исследования позволяют в режиме реального времени отвечать на многие клинические вопросы, включая оценку качества оказания медицинской помощи пациентам. В анализе могут использоваться не только первичные данные, возможна и ретроспективная оценка историй болезней. Подобные исследования требуют меньших затрат, но при этом имеют определенные временные ограничения.
После регистрации и внедрения биоаналога ритуксимаба (Ацеллбия®) в российскую клиническую практику появилась необходимость проведения ретроспективно-проспективного пострегистрационного исследования EQUILIBRIUM с целью изучения эффективности и безопасности препарата и его комбинаций в условиях рутинной клинической практики терапии B-клеточных лимфопролиферативных заболеваний в России. В рамках этого протокола удалось оценить частоту использования и роль оценки эффекта терапии В-НХЛ и ХЛЛ с помощью позитронно-эмиссионной томографии.
Собственные исследования
МАТЕРИАЛЫ И МЕТОДЫ
Исследование EQUILIBRIUM проводилось на базе 44 аккредитованных медицинских центров России и соответствовало принципам Хельсинкской декларации ВОЗ (2008), направленной на соблюдение интересов пациентов.
В исследование было включено 1000 пациентов в возрасте от 21 до 91 года с верифицированным диагнозом В-клеточной неходжкинской лимфомы (В-НХЛ) или хронического лимфолейкоза (ХЛЛ), получивших не менее 4 циклов ритуксимаб-содержащей терапии препаратом Ацеллбия®.
Среди пациентов, включенных в исследование, имму-номорфологические варианты были распределены следующим образом: хронический лимфолейкоз/лимфома из малых лимфоцитов (ХЛЛ/ЛМЛ) — 401 (40,1%) пациент, диффузная В-крупноклеточная лимфома (ДВККЛ) и другие агрессивные лимфомы– 295 (29,5%) больных; фолликулярная лимфома (ФЛ) и другие индолентные лимфомы– 253 (25,3 %); мантийноклеточная лимфома– 51 (5,1 %) случай.
Основным визуальным методом оценки распространенности заболевания, размеров и локализации поражений являлась компьютерная томография, которая проведена 762 пациентам (76,2%). Позитронно-эмиссионная томография использовалась у трети больных — 324 (32,4%), еще реже выполнялась магнитно-резонансная томография — у 84 (8,4%) больных.
Данная статья посвящена роли выполнения ПЭТу пациентов с В-клеточными лимфопролиферативными заболеваниями, которая проведена всего 324 пациентам на различных этапах: в половине случаев — 158 (49%) — при агрессивных НХЛ, 110 (34%) пациентам с индолентными НХЛ, при мантийноклеточной лимфоме — 24 (7%) и при хроническом лимфолейкозе — 32 (10%) больным (рис. 1).
Позитронно-эмиссионная томография явилась способом оценки распространенности в дебюте заболевания у 152 пациентов: более чем в половине случаев при агрессивных вариантах НХЛ (77, 50,7%), у трети больных индолентными НХЛ (51, 33,6%) и по 12 (7,9%) пациентов с мантийноклеточной лимфомой (МКЛ) и хроническим лимфолейкозом (ХЛЛ). Возможность использования ПЭТ в качестве промежуточной оценки эффекта после 2–4 курсов химиоиммунотерапии была осуществлена всего 102 пациентам. По аналогии с диагностической ПЭТ чаще она применялась при аНХЛ — в 62 (60,8%) случаях, при иНХЛ — 24 (23,5%) больным, 11 пациентам (10,8%) с МКЛ и всего 5 больным (5%) с ХЛЛ (табл. 1).
Таблица 1. Частота использования ПЭТ в диагностике, промежуточной и финальной оценке эффекта при В-ЛПЗ
|
ПЭТ (количество) |
аНХЛ |
иНХЛ |
МКЛ |
ХЛЛ |
|
Диагностическая (152) |
77 (50,7%) |
51 (33,6 %) |
12 (7,9%) |
12 (7,9%) |
|
Промежуточная (102) |
62 (60,8%) |
24 (23,5%) |
11 (10,8%) |
5 (5%) |
|
Финальная (310) |
152 (49%) |
105 (34%) |
23 (7,4 %) |
30 (9,6 %) |
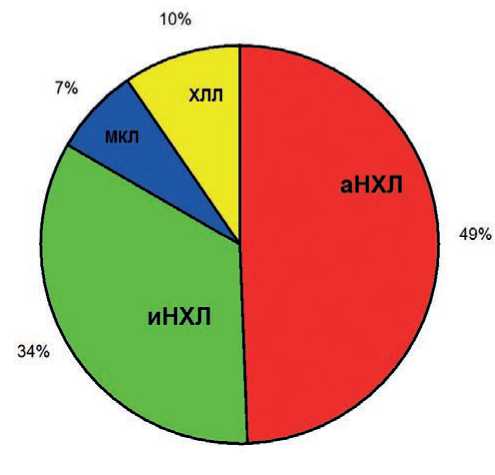
Рисунок 1. Частота выполнения ПЭТ при различных вариантах В-ЛПЗ.
После всей программы индукционной химиоиммунотерапии (6–8 курсов) проводилась финальная оценка эффективности лечения при помощи ПЭТ. Такой вариант был использован значительно чаще, чем с диагностической или с целью промежуточной оценки эффекта — 310 пациентам: почти в половине случаев 152 (49%) при аНХЛ, несколько реже — 105 (34%) при иНХЛ, а также 23 пациентам (7,4%) с МКЛ и 30 больным (9,6%) ХЛЛ (табл. 1).
НЕПОСРЕДСТВЕННАЯ ЭФФЕКТИВНОСТЬ
Промежуточная оценка эффекта при помощи ПЭТ была проведена 102 пациентам после 2–4 курсов химиоиммунотерапии. В результате осуществления усредненной промежуточной оценки установлено, что основным ответом на терапию на этом этапе лечения было достижение частичной ремиссии (53 случая, 52%); полная ремиссия достигнута у 44 (43%) и стабилизация —у 5 (5%) больных.
Проведена оценка промежуточной эффективности в зависимости от варианта В-ЛПЗ: среди 62 пациентов с аНХЛ полная ремиссия, так же как и частичная ремиссия, была достигнута у равного количества пациентов — по 29 (47%), стабилизация выявлена у 4 (6%) больных. Промежуточная ПЭТ была выполнена 24 пациентам с иНХЛ, при этом в 13 (54%) случаях достигнута полная, а в 11 (46%) случаях частичная ремиссия. В группе МКЛ 10 из 11 пациентов достигли частичной ремиссии после 2–4 курсов терапии. Аналогичным образом среди 5 пациентов с ХЛЛ большинство достигли частичной ремиссии — в 3 случаях. Следует отметить, что ни в одном случае при промежуточной оценке эффекта не было выявлено прогрессирования заболевания (табл. 2).
Собственные исследования
Таблица 2. Результаты промежуточной ПЭТ при различных вариантах В-ЛПЗ
|
Промежуточная ПЭТ (102) |
ПР |
ЧР |
Стабилизация |
|
аНХЛ (62) |
29 (47%) |
29 (47 %) |
4 (6%) |
|
иНХЛ (24) |
13 (54%) |
11 (46 %) |
– |
|
МКЛ (11) |
1 |
10 |
|
|
ХЛЛ (5) |
1 |
3 |
1 |
Таблица 3. Результаты финальной ПЭТ при различных вариантах В-ЛПЗ
|
Промежуточная ПЭТ (310) |
ПР |
ЧР |
Прогрессирование |
|
аНХЛ (152) |
120 (79 %) |
25 (16%) |
7 (5%) |
|
иНХЛ (105) |
78 (74%) |
22 (21%) |
5 (5%) |
|
МКЛ (23) |
20 (87 %) |
3 (13%) |
– |
|
ХЛЛ (30) |
17 (57%) |
11 (37%) |
2 (6%) |
По окончании всей программы химио-иммунотерапии (по завершению 6–8 курсов) 310 пациентам проводилась финальная оценка эффективности терапии, которая продемонстрировала выразительное усиление эффекта: полная ремиссия была достигнута у большинства больных — в 235 (75,8%) случаях, частичная ремиссия установлена еще у 61 (19,7%) пациента, прогрессирование выявлено у 14 (4,5%) больных. Нами проведен анализ эффективности терапии в зависимости от варианта В-ЛПЗ: финальная оценка позволила сделать вывод о значительном усилении эффекта во всех нозологических группах — полная ремиссия достигнута у 120 (79%) из 152 больных аНХЛ, в 78 (74%) из 105 случаев иНХЛ, у 20 (87%) из 23 пациентов с МКЛ и в 17 (57%) из 30 случаях ХЛЛ (табл. 3).
Несмотря на невозможность прямого сравнения данных первой/промежуточной оценки эффективности (после 2–4 курсов) и второй — финальной — оценки эффективности (после завершения всей программы индукционного лечения — 6–8 курсов химио-иммунотерапии) из-за несоответствия количества пациентов в группах, мы приводим в сводной таблице результаты обеих ПЭТ с целью установления сроков реализации эффекта терапии. Доля пациентов с полной ремиссией увеличилась на 32,8% за счет улучшения эффекта среди пациентов с частичным ответом до полного к концу всей программы лечения, при этом определенная доля пациентов со стабилизацией при промежуточном анализе перешла в группу с прогрессированием заболевания (табл. 4).
ОТДАЛЕННЫЕ РЕЗУЛЬТАТЫ ТЕРАПИИ В ЗАВИСИМОСТИ ОТ ГЛУБИНЫ ОТВЕТА ПО ДАННЫМ ПЭТ
Медина прослеженности составила 15 месяцев (диапазон от 1 до 40 мес). Хотя она невелика, для оценки судьбы больных с В-клеточными лимфопролиферативными заболеваниями даже при таком сроке наблюдения можно сделать определенные заключения. Нами зарегистрировано 11 (3,4%) летальных исходов и 27 (8,33%) событий среди пациентов, которым выполнялась ПЭТ на различных этапах терапии.
При анализе отдаленных результатов терапии методом Breslow (Generalized Wilcoxon) и построении кривых выживаемости методом Каплана–Майера выявлены статистически значимые различия в БСВ в зависимости от глубины ответа по данным промежуточной ПЭТ (p =0,07661) (рис. 2).
Таблица 4. Оценка ответа и динамика эффективности терапии по данным ПЭТ
|
ПР |
ЧР |
Стабилизация |
Прогрессирование |
|
|
Промежуточная оценка (102) |
44 (43%) |
53 (52 %) |
5 (5%) |
– |
|
Динамика ответа |
+ 32,8% |
–32,3 % |
– |
– |
|
Финальная оценка (310) |
235 (75,8 %) |
61 (19,7%) |
– |
14 (4,5%) |
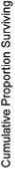
Cumulative Proportion Surviving (Kaplan-Meier) о Complete Censored
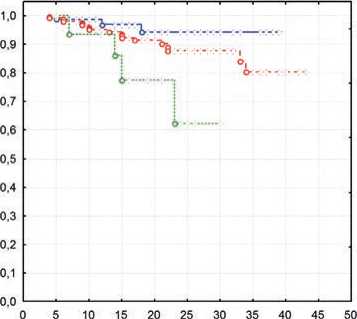
Рисунок 2. БСВ в зависимости от глубины ответа по данным промежуточной ПЭТ.
При этом результативность лечения по данным промежуточной ПЭТ не оказал статистически значимого влияния на ОВ (р =0,69868) (рис. 3).
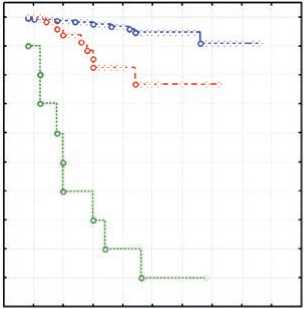
Анализ влияния эффективности терапии по данным финальной ПЭТ после 6–8 курсов химио-иммунотерапии позволил выявить статистически высокодостоверные различия как по БСВ (p =0,00000), так и по ОВ (p =0,00000), что делает прогностическую роль оценки эффективности терапии с помощью ПЭТ неоспоримой (рис. 4, 5).
Собственные исследования
Cumulative Proportion Surviving (Kaplan-Meier)
--ПР
--• ЧР Стабилизация
Рисунок 3. ОВ в зависимости от глубины ответа по данным промежуточной ПЭТ.
Cumulative Proportion Surviving (Kaplan-Meier) о Complete Censored
E
О
1.0
0,9
0,8
0,7
0.6
0.5
0.4
0.3
0.2
0.1
0.0
0 5 10 15 20 25 30 35 40 45 50
ПР
ЧР
Прогрессирование
Рисунок 4. БСВ в зависимости от глубины ответа по данным финальной ПЭТ.
1.0
0.9
a 0.8
| 0.7
о 0.6
> 0.4
| 0.3 о
0.2
0.1
0 5 10 15 20 25 30 35 40 45 50 _ прогрессирование
Time
Рисунок 5. ОВ в зависимости от глубины ответа по данным финальной ПЭТ.
Cumulative Proportion Surviving (Kaplan-Meier) о Complete Censored

ЗАКЛЮЧЕНИЕ
В настоящее время одним из наиболее информативных методов визуальной диагностики является позитронноэмиссионная томография (ПЭТ). Международными ассоциациями изучается роль этого исследования не только в диагностике, но и в оценке прогноза и эффекта терапии с возможностью персонализации по результатам ПЭТ.
Диагностическая чувствительность этого метода зависит от гистологического типа опухоли, точнее, от ее пролиферативной активности. Так, агрессивные варианты НХЛ являются хорошо визуализируемыми при помощи ПЭТ с 18-ФДГ, например лимфома Ходжкина (ЛХ), диффузная В-клеточная крупноклеточная лимфома (ДВККЛ), первичная медиастинальная лимфома (ПМВКЛ), лимфома Беркитта и ряд агрессивных вариантов Т-клеточных лимфом. Для фолликулярной лимфомы (ФЛ) данные противоречивы, и продолжается изучение возможностей использования ПЭТ. Лимфомы, подобные лимфоме из клеток мантии (МКЛ), лимфоме маргинальной зоны (ЛМЗ), лимфоцитарной (ЛМЛ), а также первичные кожные лимфомы не являются прямым показанием для использования ПЭТ/КТ в связи с низким, как правило, накоплением 18-ФДГ.
Для правильной интерпретации результатов ПЭТ, согласно отечественным рекомендациям, следует соблюдать режим ее применения: до начала лечения — для определения чувствительности метода и стадирования, промежуточное исследование — в процессе лечения, для возможности проведения ПЭТ-адаптированной терапии по окончании терапии — для констатации эффекта, при рецидиве — для рестадирования и далее, в процессе противорецидивного лечения — по аналогии с первичными больными.
В нашем исследовании ПЭТ на различных этапах выполнялась более чем у трети пациентов — 324 (32,4%): в половине случаев — при агрессивных НХЛ (49%), у трети больных с индолентными НХЛ (34%), при мантийноклеточной лимфоме — редко (7%) и при хроническом лимфо-лейкозе у 10% больных.
ПЭТ с целью определения распространенности в дебюте заболевания выполняется лишь у 15% пациентов с В-ЛПЗ, в большинстве случаев — при агрессивных вариантах НХЛ (50,7%). Промежуточная оценка эффекта с использованием ПЭТ проведена лишь 10% больных, также большей частью при агрессивных НХЛ (60,8%).
Финальная оценка эффекта при помощи ПЭТ была осуществлена большинству пациентов — 310 из всех 324, у которых этот метод использовался, при этом лишь половине из них выполнялось инициальное ПЭТ исследование, позволяющее сделать сравнительную оценку эффективности терапии, что в корне не правильно. Этот факт требует дальнейшего внедрения клинических рекомендаций в рутинную практику с одновременным повышением возможности использования ПЭТ в различных регионах Российской Федерации.
По результатам промежуточной ПЭТ чаще всего достигалась ЧР — 52%, чуть реже — ПР (43%), стабилиза-
Собственные исследования ция —у 5%. Следует отметить отсутствие случаев раннего прогрессирования у этих пациентов.
Несмотря на перечисленные погрешности применения ПЭТ в рутинной клинической практике и на то, что пациенты были с различными по пролиферативной активности НХЛ, остается неоспоримым факт высокой прогностической ценности результатов промежуточной ПЭТ для БСВ (p = 0,07661).
Финальная ПЭТ продемонстрировала хорошие результаты: ПР — 75,8 %, ЧР — 19,7 %, прогрессирование — всего в 4,5% случаев. Анализ влияния эффективности терапии по данным финальной ПЭТ позволил выявить высокодостоверные различия как по БСВ (p =0,00000), так и по ОВ (p =0,00000), что делает прогностическую роль оценки эффективности терапии по данным ПЭТ неоспоримой.
Список литературы Роль ПЭТ в лечении в-клеточных лимфопролиферативных заболеваний в рутинной клинической практике в России
- Асланиди И.П., Мухортова О.В., Катунина Т.А. и соавт. Современные аспекты использования позитронно-эмиссионной томографии у больных лимфомами. Клиническая онкогематология, 2015; 1:(13-25).
- Российские клинические рекомендации по диагностике и лечению лимфопролиферативных заболеваний под редакцией проф. Поддубной И.В., проф. Савченко В.Г. 2018г. ООО "Буки Веди"
- Albano D., Bosio G., Bertoli M., et al. 18F-FDG PET/CT in primary brain lymphoma. J Neurooncol, 2018; 136(3):577- 83.
- Ayers E.C., Fardin S., Gholami S., et al. Personalized Management Approaches in Lymphoma Utility of Fluorodeoxyglucose- PET Imaging. PET Clin; 2016, 11(3):209-18.
- Barrington S.F., Kluge R. FDG PET for therapy monitoring in Hodgkin and non-Hodgkin Lymphomas. Eur J Nucl Med Mol Imaging, 2017; 44(Suppl.1):97-110.
- Borchmann P., Goergen H., Kobe C., et al. PET-guided treatment in patients with advanced-stage Hodgkin's lymphoma (HD18): final results of an open-label, international, randomised phase 3 trial by the German Hodgkin Study Group. Lancet, 2018; 390(10114):2790-802.
- Cheson B.D. PET/CT in Lymphoma: Current Overview and Future Directions. Semin Nucl Med, 2018; 48(1):76-81.
- Dercle L., Seban R.D., Lazarovici J., et al. 18F-FDG PET and CT-scan Detect New Imaging Patterns of Response and Progression in Patients with Hodgkin Lymphoma Treated by Anti-PD1 Immune Checkpoint Inhibitor. J Nucl Med, 2018; 59(1):15-24.
- Gallamini A., Barrington S.F., Biggi A., et al. The predictive role of interim positron emission tomography for Hodgkin lymphoma treatment outcome is confirmed using the interpretation criteria of the Deauville five-point scale. Haematologica, 2014; 99(6):1107-13.
- Kobe C., Dietlein M., Hellwig D. PET/CT for Lymphoma Post-therapy Response Assessment in Hodgkin Lymphoma and Diffuse Large B-cell Lymphoma. Semin Nucl Med, 2018; 48(1):28-36.
- Metser U., Dudebout J., Baetz T., et al. [18F]-FDG PET/CT in the Staging and Management of Indolent Lymphoma: A Prospective Multicenter PET Registry Study. Cancer, 2017; 123(15):2860-66.
- Younes A., Hilden P., Coiffier B., et al. International Working Group consensus response evaluation criteria in lymphoma (RECIL 2017). Ann Oncol, 2017; 28(7):1436-47.


