Роль рамановской спектрометрии в определении чувствительности возбудителей хронического тонзиллита
Автор: Буренков Е. С.
Журнал: Вестник медицинского института "РЕАВИЗ": реабилитация, врач и здоровье @vestnik-reaviz
Рубрика: Клиническая медицина
Статья в выпуске: 3 (51), 2021 года.
Бесплатный доступ
Цель работы: изучить чувствительность возбудителей хронического тонзиллита к сочетанию антибиотиков амоксициллин + клавулановая кислота с помощью спектроскопии комбинационного рассеяния. Материалы и методы. В исследовании приняли участие 117 пациентов (все мужчины) в период обострения хронического тонзиллита, которым назначался для его купирования амоксициллин/клавулановая кислота по стандартной схеме. Определение чувствительности микрофлоры миндалин проводилось с помощью метода спектроскопии комбинационного рассеяния. Принцип метода заключался в определении иррадикации микрофлоры в пробах под действием антибиотика по наличию в ней продуктов микробного метаболизма. Результаты. Клинический анализ результатов проведённого лечения у данной группы пациентов показал, что у 96 (82 %) из них был достигнут быстрый клинический эффект. У 13 (11,1 %) пациентов пришлось увеличить сроки приёма антибиотика в среднем ещё на 3-5 дней, а у 8 пациентов для ликвидации обострения потребовалось назначение второго антибиотика. Выводы. Полученные результаты позволяют рекомендовать метод спектроскопии комбинационного рассеяния для определения чувствительности микрофлоры к антибиотикам, как высоко информативный в клинической практике.
Антибиотики, хронический тонзиллит, спектроскопия комбинационного рассеяния, антибиотикорезистентность
Короткий адрес: https://sciup.org/143175604
IDR: 143175604 | УДК: 576.851.252.616 | DOI: 10.20340/vmi-rvz.2021.3.CLIN.1
Текст научной статьи Роль рамановской спектрометрии в определении чувствительности возбудителей хронического тонзиллита
УДК 576.851.252.616
Cite as: Burenkov E.S. The role of Raman spectrometry in determining the sensitivity of the causes of chronic tonzillitis. Bulletin of the Medical Institute Reaviz. Rehabilitation, Doctor and Health. 2021;3(51):44-50.
Выбор антибиотика для лечения обострений хронического тонзиллита определяется как клиническими рекомендациями, так и индивидуальной чувствительностью микрофлоры пациента [1]. Второе условие становится наиболее актуальным, особенно в наши дни, когда антибио-тикорезистентность многих возбудителей является значимой проблемой для современной медицины [2]. В связи с этим актуальным становится вопрос о необходимости установления эффективности выбранного антибиотика для каждого конкретного пациента в ранние сроки заболевания. Однако, наиболее часто используемый для этого диско-диффузионный метод требует до 3–5 суток для получения данных, что не позволяет рано назначить индивидуально эффективную этиотропную терапию [3, 4].
Целью данной работы стало изучение чувствительности возбудителей хронического тонзиллита к антибиотику амокси-циллин/клавулановая кислота (амоксиклав) с помощью спектроскопии комбинационного рассеяния.
В исследовании приняли участие 117 пациентов (все мужчины) в период обострения хронического тонзиллита, которым назначался для его купирования амоксиклав по стандартной схеме. Средний возраст обследованных составлял 29,7 ± 3,4 года.
Определение чувствительности микрофлоры миндалин к амоксиклаву проводилось с помощью метода спектроскопии комбинационного рассеяния (КР). Принцип метода заключался в определении ирради-кации микрофлоры в пробах под действием антибиотика по наличию в ней продуктов микробного метаболизма.
Спектральные характеристики изучались с помощью экспериментального стенда, включающего в себя высокоразреша- ющий цифровой спектрометр Andor Shamrock sr-303i с встроенной охлаждаемой камерой DV420A-OE, волоконнооптический зонд для спектроскопии комбинационного рассеяния RPB785, совмещённый с лазерным модулем LuxxMaster LML-785.0RB-04 (с регулируемой мощностью до 500 мВт, длина волны 785 нм). Схема прибора представлена на рисунке 1.
Выделение КР спектра на фоне автофлуоресценции проводилось методом полиномиальной аппроксимации флуоресцентной составляющей и вычитания её из регистрируемых спектров. Обработку спектров КР проводили в программе Wolfram Mathematica 9. Исследуемый спектр при обработке очищали от шумов сглаживающим медианным фильтром (5 точек). На выбранном интервале 400–2200 см-1 при помощи итерационного алгоритма определяли аппроксимирующую линию (полином пятой степени) автофлуоресцентной составляющей, а затем вычитали эту составляющую, получая выделенный спектр КР. Эффективность эрадикации инфекции в нёбных миндалинах с помощью спектроскопии комбинационного рассеяния определяли в четырёх спектральных областях 1155 см-1, 1525 см-1, 1033 см-1 и 1611 см-1.
Микрофлора от пациента выделялась непосредственно перед определением её чувствительности к антибиотикам, и её взвесь стандартизировалась по МакФарланду.
Для изучения чувствительности флоры к антибиотику пробы формировались согласно приведённым в таблице 1 данным. Для исключения воздействия факторов ротовой жидкости на действие антибиотика использовалось две серии тестов: в первом случае к взвеси микробов и антибиотика добавлялась ротовая жидкость (слюна), во втором случае ротовая жидкость заменя- лась физиологическим раствором (забуфе-ренным фосфатным буфером для поддержания рН). В качестве антибиотика использовался амоксиклав для парентерального введения (1000/200 мг). Концентрация лекарственного вещества определялась из расчёта эффективной лекарственной дозы, рекомендованной в инструкции к препарату (105,4 мг/л амоксициллина и 28,5 мг/л кла-вулановой кислоты).
До оценки чувствительности микрофлоры к антибиотику пробы инкубировались при температуре 37 °С в течение двух часов, после чего результаты оценивались методом спектроскопии комбинационного рассеяния.
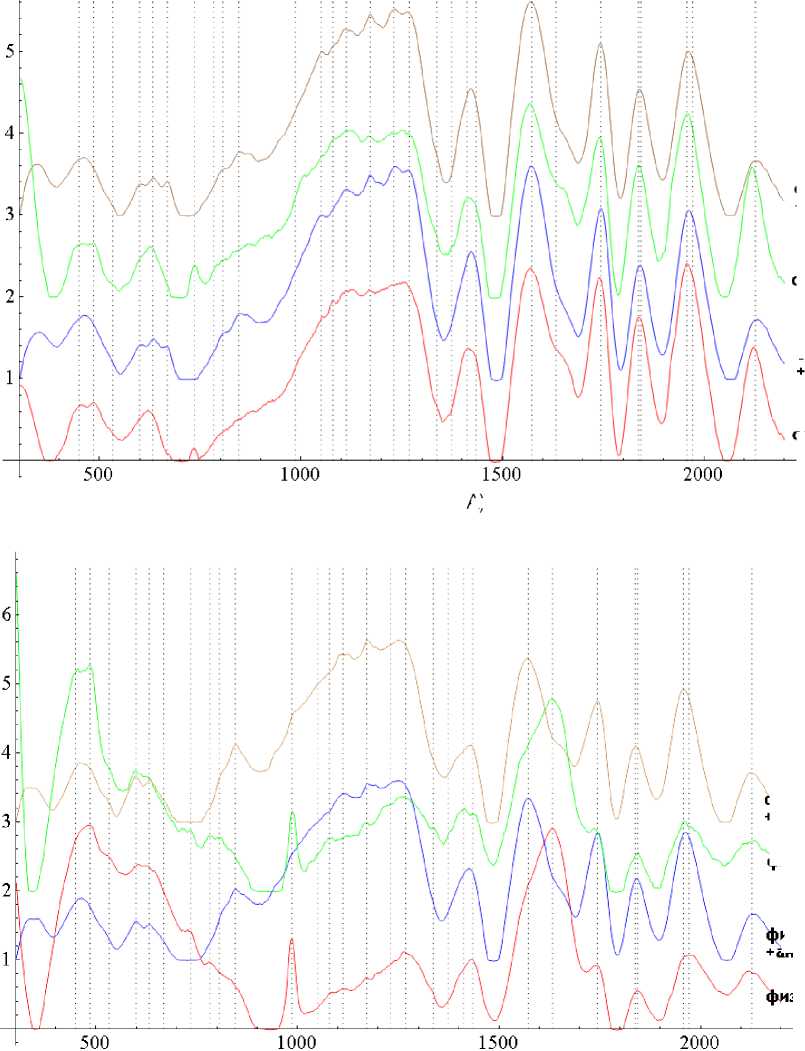
На рисунке 2 представлены спектры комбинационного рассеяния (КР) проб, содержащих в качестве растворителя ротовую жидкость и физиологический раствор со штаммами микрофлоры, полученной от пациентов.
В таблице 2 приведена расшифровка основных линий, наблюдаемых в спектре КР исследуемых объектов.
Из рисунка 2 можно видеть спектральные особенности на волновых числах 735 см-1 и 783 см-1, 986 см-1 и 1635 см-1, соотвествующие аденину, нуклеиновым кислотам, протеинам и амиду I.
Образцы на основе физ. раствора позволяют оценить чистый спектр культуры и антибиотика без наложения его на спектр ротовой жидкости (слюны).
Также видно, что при действии антибиотика Амоксиклав дозировкой 105,4 мг/28,5 мг/л линии 735 см-1 и 783 см-1, 986 см-1 и 1635 см-1, соответствующие аденину, компонентам ДНК, протеинам и амиду I (или идентифицирующая наличие стрептококковой культуры) исчезают.
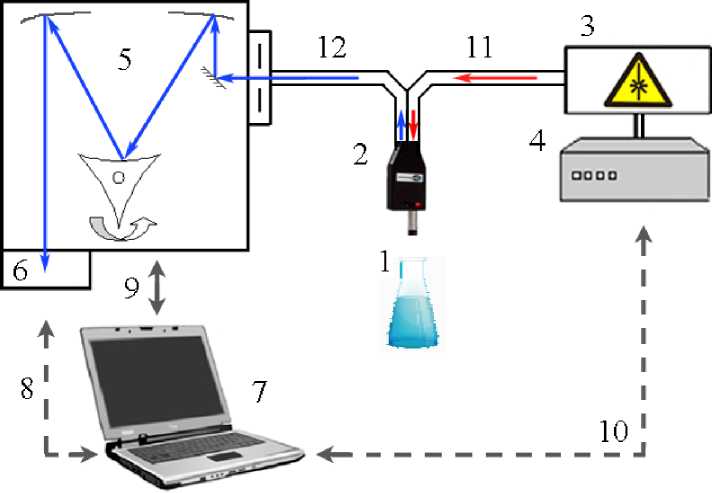
Рис. 1. Экспериментальный стенд: 1 – объект; 2 – КР пробник RPB785; 3 – лазерный модуль LuxxMaster Raman Boxx; 4 – источник питания лазерного модуля; 5 – спектрометр Shamrock sr-303i; 6 – встроенная охлаждаемая камера DV420A-OE; 7 – компьютер; 8–10 – управляющие кабели; 11 – передающее оптоволокно; 12 – приёмное оптоволокно
Fig. 1. Experimental stand: 1 – object; 2 – КР probe RPB785; 3 – LuxxMaster Raman Boxx laser module; 4 – power supply for the laser module; 5 – Shamrock sr-303i spectrometer; 6 – built-in cooled camera DV420A-OE; 7 – computer; 8–10 – control cables; 11 – transmitting fiber; 12 – receiving fiber
Таблица 1. Содержание проб для определения чувствительности микрофлоры к антибиотику (Амок-сиклав) из группы ингибиторозащищенных пенициллинов с помощью метода спектроскопии комбинационного рассеяния
Table 1. Contents of samples for determining the sensitivity of microflora to antibiotics (Amoxiclav) from the group of inhibitor-protected penicillins using Raman spectroscopy
|
Содержание проб |
Проба 1 |
Проба 2 |
Проба 3 |
Проба 4 |
|
Ротовая жидкость, мл |
4,5 |
4,5 |
||
|
Амоксиклав, 0,527/0,143 мг |
+ |
+ |
||
|
Забуференный (фосфатным буфером) физ. раствор |
4,5 |
4,5 |
||
|
Взвесь возбудителя, стандартизированная по плотности 0,5 по МакФарланду, мл |
0,5 |
0,5 |
0,5 |
0,5 |
Таблица 2. Расшифровка спектров комбинационного рассеяния для проб
Table 2. Interpretation of Raman spectra for samples
|
Волновое число, см-1 |
Вещество |
|
533 |
Lysozymes, proteins, guanine, thymine |
|
632 |
ring2 deformation + ring2 breathing |
|
735 |
adenine, glycosidic ring mode |
|
783 |
nucleic acids, 776 (w) Nucleotides (Cytosine, uracil) ring stretching10,20 DNA/RNA |
|
806 |
υ (CN) tyrosin, porine, valin |
|
846 |
op. bending ring2 + d(CH ring2) |
|
986 |
Glycine CNC symmetric stretch 998 (m) ν (C-C) aromatic ring breathing of phenylalanine Protein |
|
1079 |
Lipids, nucleic acids, proteins, carbohydrates,lauric acid |
|
1172 |
Aromatic amino acids δ (C-H),in tyrosine, Protein |
|
1269 |
Phospholipid, amide III, proteins, lipids, thymine, |
|
1337 |
υ (NH2) adenine, polyadenine, DNA |
|
1374 |
tryptophan, porphyrins, lipids, guanine, thymine, protein |
|
1435 |
Acetates, CH stretching peaks |
|
1573 |
(s) ν (C=C)11 Lipid |
|
1633 |
(m) Amide I and unsaturated lipids, amide I and ν (C=C) inlipid,Protein, Lipid |
|
1744 |
acetates |
А)
слюна* культура2
слюна* культура1
физраствор+культура2
зраствор+культура1
слюна+культура2 +антибиотик слюна* культура1 антибиотик физраствор* культура2 +антибиотик израствор+культура1 антибиотик
Б)
Рис. 2. Спектры комбинационного рассеяния для исследуемых образцов: А) пробы 1-2; Б) пробы 3-4
Fig. 2. Raman spectra for the studied samples: A) samples 1-2; B) samples 3-4
Из рисунка 2 также можно видеть, что штаммы стрептококка в ротовой жидкости и физ. растворе спектрально не различаются.
Также можно отметить, что линии на 632 см-1, 846 см-1, соотвествующие компонентам вносимого препарата (антибиотик Амоксиклав дозировкой 105,4 мг/28,5 мг/л), проявляются в спектрах исследуемых веществ при его добавлении.
Показано, что при дозировке антибиотика 105,4 мг/28,5 мг/л при чувствительности микрофлоры к антибиотику исчезают линии на волновых числах 735 см-1 и 783 см-1, 986 см-1 и 1635 см-1, соотвеству-ющие аденину, цитозину, протеинам и амиду I, что говорит об эффективности лече- ния – разрушении микроорганизма под воздействием антибиотика. Однако было отмечено, что у части пациентов для полного исчезновения этих линий из спектра требовалась более длительная инкубация (от 4,5 до 6 часов).
Результаты проведенного исследования приведены в таблице 3.
Клинический анализ результатов проведённого лечения у данной группы пациентов показал, что у 96 (82 %) из них был достигнут быстрый клинический эффект. У
13 (11,1 %) пациентов пришлось увеличить сроки приёма антибиотика в среднем ещё на 3–5 дней, а у 8 пациентов для ликвидации обострения потребовалось назначение второго антибиотика.
Таким образом данные о чувствительности возбудителей хронического тонзиллита к антибиотику амоксиклав, полученные с помощью метода спектроскопии комбинационного рассеяния, статистически не отличались от результатов его применения в клинической практике.
Таблица 3. Результаты определения чувствительности микрофлоры к антибиотику (Амоксиклав) с помощью метода спектроскопии комбинационного рассеяния
Table 3. Results of determining the sensitivity of microflora to an antibiotic (Amoxiclav) using the method of Raman spectroscopy
|
Методы определения эффективности антибиотиков |
I группа, n = 117 |
||
|
Абс. |
% |
||
|
- количество проб с исчезновением линий на волновых числах 735 см-1 и 783 см-1, 986 см-1 и 1635 см-1 через 2 ч инкубации; |
98 |
83,8 |
|
|
- количество проб с исчезновением линий на волновых числах 735 см-1 и 783 см-1, 986 см-1 и 1635 см-1 через 4 ч инкубации; |
12 |
10,2 |
|
|
- количество проб с исчезновением линий на волновых числах 735 см-1 и 783 см-1, 986 см-1 и 1635 см-1 через 6 ч инкубации |
7 |
6 |
|
Выводы
-
1. Метод спектроскопии комбинационного рассеяния высоко информативен для определения чувствительности микрофлоры к антибиотикам.
-
2. Указанный метод может быть использован как в клинической практике, так и при проведении скрининговых работ по чувствительности микрофлоры к новым антибиотикам.
Список литературы Роль рамановской спектрометрии в определении чувствительности возбудителей хронического тонзиллита
- Vladimirova T.Yu. et al. Vozmozhnosti primeneniya antibakterial’nykh sredstv pri khronicheskom tonzillite. Vestnik otorinolaringologii. 2017;82(2):55-59.
- Gofman V.V., Bakulina L.S. Pochemu primeneniye antiseptikov i antibiotikov ne dayet zhelayemogo effekta pri lechenii bol’nykh khronicheskim kompensirovannym tonzillitom? Rossiyskaya otorinolaringologiya. 2013;2(63):21-25.
- Volchok N.V., Drazhina O.G. Khronicheskiye tonzillity u beremennykh: mikrobnyy spektr i ego chuvstvitel’nost’. Meditsinskiy zhurnal. 2015;2:42-44.
- Rybak N.A., Sokolova T.N., Ershova M.V. Antibiotikorezistentnost’ mikroflory nebnykh mindalin pri khronicheskom tonzillite. Zhurnal Grodnenskogo gosudarstvennogo meditsinskogo universiteta. 2016;2(54):87-89.


