Роль рецептора трансформирующего фактора роста I типа (TGF-BRI) в прогрессировании люминального подтипа рака молочной железы
Автор: Бабышкина Н.Н., Вторушин С.В., Дронова Т.А., Крахмаль Н.В., Завьялова М.В., Цыганов М.М., Паталяк С.В., Слонимская Е.М., Чердынцева Н.В.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 2 т.16, 2017 года.
Бесплатный доступ
Введение. Перекрестные связи между сигнальными путями эстрогеновых рецепторов и рецепторов факторов роста могут играть важную роль в возможном снижении устойчивости опухолей молочной железы к эндокринной терапии. Целью исследования явилось изучение взаимосвязи белковой и генной экспрессии рецептора трансформирующего фактора роста βI типа (TGF-βRI) и его полиморфных вариантов с эффективностью адъювантной терапии тамоксифеном при люминальном раке молочной железы (РМЖ). Материал и методы. В исследование включено 105 пациенток с люминальным подтипом РМЖ (T1-3N0-3M0), получавших тамоксифен в адъювантном режиме в стандартной дозировке 20 мг/сут. При оценке отдаленных результатов лечения пациентки, имевшие прогрессирование заболевания на фоне приема тамоксифена, составили тамоксифен-резистентную группу (ТАМ-Р), больные без признаков прогрессирования - тамоксифен-чувствительную группу (ТАМ-Ч). Уровень экспрессии гена TGF-BRI и полиморфизм TGF-BR1 (rs334354) были изучены с помощью ПЦР в режиме реального времени. Белковая экспрессия TGF-βRI в опухоли была оценена иммуногистохимическим методом. Результаты. Выявлен высокий уровень экспрессии мРНК TGF-BRI в опухоли у больных люминальным А подтипом по сравнению с люминальным B РМЖ (р=0,050). Показано, что носители мутантных генотипов и аллелей гена TGF-BRI (rs334354) чаще встречались у пациенток с люминальным А раком молочной железы (p=0,019 и p=0,007 соответственно). Уровень экспрессии белка TGF-βRI был значимо выше в тамоксифен-чувствительной группе по сравнению с тамоксифен-резистентными пациентками без учета подтипа опухоли (p=0,043). При разделении больных по молекулярному подтипу выявлена тенденция к взаимосвязи высокого уровня белковой экспрессии TGF-βRI с чувствительностью к терапии тамоксифеном среди больных люминальным В раком молочной железы (p=0,090). Заключение. Уровень экспрессии TGF-βRI в опухолевой ткани может рассматриваться в качестве потенциального молекулярно-генетического маркера эффективности эндокринной терапии тамоксифеном у больных люминальным раком молочной железы.
Люминальный рак молочной железы, эндокринная терапия, тамоксифен, рецептор трансформирующего фактора роста βi типа (tgf-bri), полиморфизм генов
Короткий адрес: https://sciup.org/140254104
IDR: 140254104 | УДК: 618.19-006.6-08:577.112:577.21:577.169 | DOI: 10.21294/18144861-2017-16-2-27-35
Текст научной статьи Роль рецептора трансформирующего фактора роста I типа (TGF-BRI) в прогрессировании люминального подтипа рака молочной железы
Люминальный рак молочной железы (РМЖ) является наиболее часто встречающимся молекулярным подтипом, который характеризуется наличием позитивной экспрессии рецепторов к стероидным гормонам и высокими показателями чувствительности к эндокринной терапии [1, 2]. Люминальный РМЖ представляет собой гетерогенную группу опухолей: люминальный А подтип является положительным по экспрессии к эстро-ген/прогестерону (ERa/PR), без гиперэкспрессии рецептора эпидермального фактора роста 2-го типа (HER2), с низким индексом пролиферативной активности Ki67; люминальный В тип может быть представлен подтипами, положительными по экспрессии к ERa/PR, без гиперэкспрессии HER2, с высоким индексом Ki67, а также опухолями, позитивными по экспрессии рецепторов как к стероидным гормонам, так и к HER2. Несмотря на то, что эндокринотерапия является наиболее эффективным и низкотоксичным методом лечения больных люминальным РМЖ, преодоление развития резистентности к данной терапии остается одной из актуальных проблем.
В качестве возможных механизмов формирования резистентности к эндокринной терапии в настоящее время рассматривается двунаправленное взаимодействие между эстрогеновыми рецепторами и сигнальными путями трансформирующего фактора роста в1 (IGF—Pl), который играет важную роль в процессах клеточной пролиферации и дифференцировки большинства эпителиальных опухолей [3]. В TGF-β1/Smad-сигнальную трансдукцию вовлечены два типа мембранных рецепторов – TGF-βRI и TGF-βRII. Классический сигнальный каскад включает связывание TGF-β1 с внеклеточным доменом рецептора II типа, что приводит к последующей активации рецептора I типа и фосфорилированию белков Smad2 и Smad3. Smad2/3 комплексируются с Smad4 и образуют гетеромерный комплекс Smad2/3/4, который транс-лоцируется внутрь клеточного ядра, где может связываться с активирующими белками и функционировать как транскрипционный активатор, индуцирующий экспрессию генов-мишеней, вовлеченных в регуляцию процессов клеточного цикла [4]. Клинико-экспериментальные исследования свидетельствуют о том, что ядерные эстрогеновые рецепторы блокируют TGP—ei сигнальный путь посредством деградации его основных компонентов Smad2/3 и активации МАРК [5, 6]. В свою очередь, Smad3 и Smad4 способны выступать в роли коактиваторов и корепрессоров соответственно ERα-индуцированной экспрессии генов-мишеней, ответственных за регуляцию пролиферации [7, 8].
Среди мембранных рецепторов TGP—P1 наиболее полно представлены результаты исследования в плане прогностической значимости лишь для TGF-βRII, однако они далеко не однозначны. Показано, что высокий уровень экспрессии TGF-
PRII ассоциирован с наличием метастазов в регионарные лимфоузлы и низкими показателями пятилетней безметастатической выживаемости у больных РМЖ независимо от молекулярного подтипа [9]. Согласно другим данным, отсутствие экспрессии TGF-βRII в опухолевой ткани связано с гематогенным метастазированием у больных HER2 позитивным РМЖ [10]. Единичные исследования посвящены изучению TGF-βRII как маркера чувствительности к адъювантной гормональной терапии. В недавних работах было продемонстрировано, что потеря экспрессии TGF-βRII является одним из механизмов неэффективности эндокринной терапии у больных РМЖ [11]. Следует отметить, что в литературных источниках не изучена роль TGF-βRI в сопоставлении с эффективностью терапии тамоксифеном у больных РМЖ. Однако TGF-βRI является не менее важным звеном TGF-β1/Smad сигнального пути. Наличие в структуре рецептора консервативного 30 аминокислотного региона, так называемого SG-субдомена, содержащего SGSGSG последовательность, фосфорилирование которого определяет передачу внутриклеточного сигнала, является уникальной особенностью TGF-βRI [12].
TGF-βRI представляет собой трансмембранный серин/треонинкиназный рецептор с молекулярной массой 55 кД, который содержит сигнальный пептид, богатый цистеином N-гликозилированный внеклеточный домен, цитоплазматический киназный домен и короткий С-концевой хвост. В настоящее время выделено множество полиморфных форм гена TGP—PRI, один из которых - однонуклеотидный полиморфизм (SNP) в 7 интроне Int7G24A (rs334354) – представляет собой замену гуанина (G) на аденин (А) в 24 позиции донорного сайта. Функциональная роль данного интронного варианта остается не до конца понятной, хотя предполагается, что подобные мутационные замены нуклеотидов могут опосредованно влиять на экспрессию гена на уровне транскрипции либо изменять сплайсинг РНК [13]. В настояшее время имеются единичные данные о взаимосвязи Int7G24A SNP с клиническим течением рака молочной железы [13]. Следует отметить, что прогностическая значимость данной интронной мутации во взаимосвязи с уровнем экспрессии как гена, так и белка TGF-βRI у больных люминальным РМЖ остается в настоящее время неизученной.
Целью исследования явилось изучение взаимосвязи белковой и генной экспрессии рецептора трансформирующего фактора роста βI типа и его полиморфных вариантов с эффективностью адъювантной терапии тамоксифеном при люминальном раке молочной железы.
Материал и методы
В исследование были включены 105 пациенток с операбельным раком молочной железы T1-4N0 _ 3M 0
стадии, получавших лечение в отделении общей онкологии НИИ онкологии Томского НИМЦ с 2002 по 2014 г. У всех больных диагноз был подтвержден морфологически. Всем пациенткам было выполнено радикальное хирургическое лечение, лучевая и химиотерапия – по показаниям. Обязательным условием для включения больных в исследование было проведение адъювантной эндокринтерапии (тамоксифен в стандартной дозировке 20 мг/сут). Неоадъювантное лечение не проводилось. Для определения подтипа люминального рака молочной железы была использована классическая панель из иммуногистохимических маркеров ERa, PR, HER2 и Ki67. К люминальному А подтипу РМЖ относили опухоли с негативной экспрессией HER2, позитивной экспрессией рецепторов к эстрогенам и прогестерону и пролиферативной активностью менее 20 %. К люминальному В подтипу – гормон-положительные опухоли как с позитивной, так и с негативной экспрессией HER2 и высоким уровнем пролиферативной активности (Ki67≥20 %).
Из 105 пациенток, включенных в исследование, 65 (61,9 %) имели люминальный А подтип рака молочной железы, 40 (38,1 %) - люминальный В подтип (табл. 1). Возраст больных варьировался от 30 до 79 лет, в среднем – 54,5 ± 0,9 года. Доля молодых женщин (до 50 лет включительно) в обеих группах составила 43,1 % и 40,0 % соответственно, соотношение женщин старше 50 лет также статистически не различалось в зависимости от подтипа опухоли (р=0,915). В зависимости от размера первичной опухоли наблюдалась тенденция к увеличению размера опухолевого узла у больных люминальным В РМЖ (р=0,053). Не было найдено ассоциаций между исследуемыми группами и менструальным статусом пациенток (р=0,220), лимфогенным метастазированием (р=0,477), гистологическим типом опухоли (р=0,898) и адъювантной химиотерапией (р=0,826). Таким образом, сравниваемые группы пациенток с люминальным раком молочной железы были сопоставимы по основным клиникоморфологическим параметрам.
Отдаленные результаты лечения оценивались по факту прогрессирования заболевания в виде отдаленных метастазов, на основании которых были сформированы две группы больных. Первую группу составили пациентки без признаков прогрессирования (тамоксифен-чувствительная группа – ТАМ-Ч, n=53), вторую - с прогрессированием заболевания (тамоксифен-резистентная подгруппа – ТАМ-Р, n=39). Все случаи прогрессирования наблюдались на фоне адъювантной терапии тамоксифеном. Среднее время до прогрессирования – 28,6 ± 17,8 мес.
Материалом для исследования служили образцы опухолевой и прилежащей нормальной ткани. Для изучения уровня экспрессии гена TGF-βRI из опухолевой и прилежащей нормальной ткани с помощью набора RNeasy Plus mini Kit, содержащего ДНК–азу I (Qiagen, Германия), была выделена тотальная РНК. Для получения кДНК на матрице РНК проводили реакцию обратной транскрипции с помощью набора RevertAid™ (Fermentas, Литва). Уровень экспрессии гена TGF-βRI оценивали при помощи количественной ПЦР в режиме реального таблица 1
Клинико-морфологическая характеристика больных рМж в зависимости от молекулярного подтипа опухоли
Для оценки полиморфных вариантов гена TGF-βRI проводилось выделение ДНК из образцов опухолевой ткани с помощью наборов QIaamp DNA FFPE tissue kit (Qiagen, Германия). Качественная и количественная оценка ДНК проведена на спектрофотометре NanoDrop–1000 («NanoDrop», США). Изучение полиморфных вариантов TGF-βRI Int7G24A (rs334354) выполнено с помощью полимеразной цепной реакции в режиме реального времени. Последовательность праймеров и проб подбирали при помощи программы OligoAnalysisVector NTI с использованием генетического банка данных ( gov). Реакционная смесь для ПЦР объемом 15 мкл включала 100 нг геномной ДНК; 0,5–1,5 мкл специфической пары праймеров и проб с концентрацией 1 о.е./мл; 200 мкМ каждого дезоксинуклеотидтрифосфата; 1,2–2,0 мкл буфера (60 мМTris-HCl (pH 8,5 при 25°C), 1,5 мМ MgCl2; 25 мМKCl; 10 мМ 2-меркаптоэтанол; 0,1 % Тритон X-100) и 0,5–1,0 ед. Taq ДНК-полимеразы («Медиген», Новосибирск). Программа амплификации предполагала предварительную денатурацию при 95°С в течение 2 мин, с последующими 40 циклами денатурации при 95°С (10 сек), отжиг при 60°С (30 сек) на ам-плификаторе CFX96 («Bio–Rad», США).
Изучение экспрессии рецепторов к половым гормонам, HER2, Ki67 и TGF–βRI проводили на парафиновых срезах иммуногистохимическим способом. Использовались антитела фирмы «Dako» к рецепторам эстрогенов (клон 1D5, RTU, мышиные), прогестерона (клон PgR 636, RTU, мышиные), к онкопротеину c-erbB-2 (HER2) (рабочее разведение 1:500, кроличьи), к Ki67 (клон MIB-1, RTU, мышиные «Novocastra») и к TGF–βRI (клон 8А11, рабочее разведение 1:50, «Novocastra»).
Работа проведена с соблюдением принципов добровольности и конфиденциальности в соответствии с «Основами законодательства РФ об охране здоровья граждан» (Указ Президента РФ от 24.12.93, № 2288) на основании разрешения локального комитета по биомедицинской этике НИИ онкологии Томского НИМЦ.
Статистическую обработку полученных данных проводили с помощью программы STATISTICA 7.0. Применялся критерий χ2, обсуждались результаты с достоверностью различий при р<0,05.
Результаты
Выявлено, что у больных люминальным А подтипом уровень экспрессии гена TGF-βRI значимо выше (7,07 ± 2,99) по сравнению с люминальным В РМЖ (1,81 ± 0,55; р=0,050; рис. 1). При сравнении особенностей белковой экспрессии TGF–βRI в опухолевой ткани больных люминальным А и В подтипами статистически значимых различий обнаружено не было (табл. 2). Оценка полиморфных вариантов гена TGF-βRI показала значимое увеличение частоты встречаемости мутантного Int7G24AA генотипа и Int7G24A аллеля среди больных с люминальными А опухолями по отношению к люминальным В подтипам (p=0,019 и p=0,007 соответственно).
Изучение взаимосвязи исследуемых маркеров с эффективностью адъювантной терапии тамоксифеном было проведено как в общей группе больных РМЖ, так и в группах пациенток с люминальным таблица 2
Экспрессия белка tgf–bri и полиморфизм гена TGF-BRI у больных рМж
|
Параметры |
Число больных |
Люминальный A |
Люминальный B |
p |
|
TGF-βRI экспрессия |
||||
|
Негативная |
40 |
25 (45,5 %) |
15 (39,5 %) |
|
|
Позитивная |
53 |
30 (54,5 %) |
23 (60,5 %) |
0,566 |
|
TGF-βRI (rs334354 ) |
||||
|
GG |
64 |
32 (59,3 %) |
32 (84,2 %) |
|
|
GA |
21 |
16 (29,6 %) |
5 (13,2 %) |
0,019* |
|
AA |
7 |
6 (11,1 %) |
1 (2,6 %) |
|
|
G allele |
80 (74,1 %) |
69 (90,8 %) |
0,007* |
|
|
А allele |
28 (25,9 %) |
7 (9,2 %) |
Примечание: * – статистически значимые различия между показателями у больных люминальным A и люминальным B раком молочной железы.
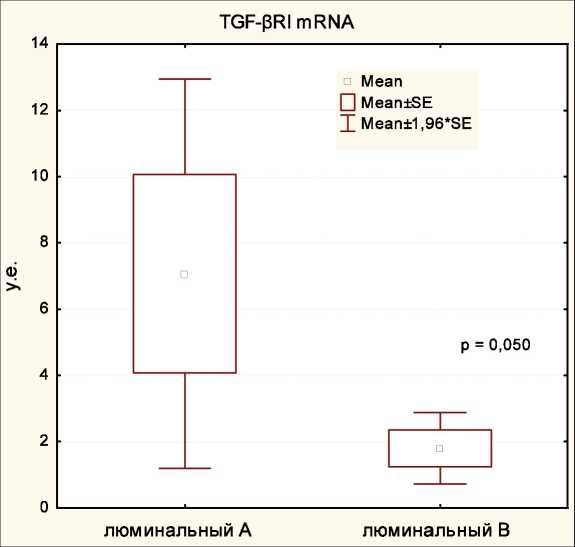
Рис. 1. Экспрессия гена TGF-BRI в образцах опухолевой ткани у больных люминальным А и люминальным В подтипами рака молочной железы. Моноплексная ПЦР, в качестве стандартного гена использован ген GAPDH . Каждая реакция проводилась трижды, приведены средние значения ± SE
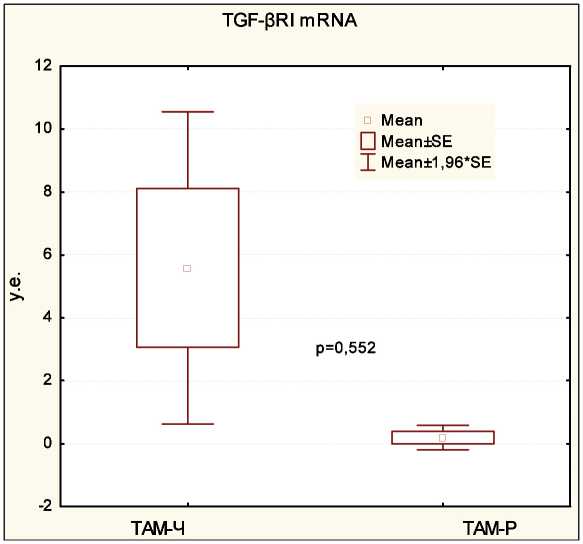
Рис. 2. Экспрессия гена TGF-BRI в образцах опухолевой ткани у больных общей группы в зависимости от эффективности лечения тамоксифеном. Моноплексная ПЦР, в качестве стандартного гена использован ген GAPDH . Каждая реакция проводилась трижды, приведены средние значения ± SE
таблица 3
Экспрессия белка tgf-bri и полиморфизм гена TGF-BRI в общей группе больных в зависимости от эффективности лечения тамоксифеном
|
Параметры |
Число больных ТАМ-Ч ТМА-Р p |
|
TGF-βRI экспрессия Негативная Позитивная |
35 21 (40,4 %) 14 (66,7 %) 38 31 (59,6 %) 7 (33,3 %) 0,043 |
|
TGF-βRI (rs334354 ) GG GA AA G allele А allele |
48 33 (64,7 %) 15 (71,4 %) 18 13 (25,5 %) 5 (23,8 %) 0,664 6 5 (9,8 %) 1 (4,8 %) 79 (77,5 %) 35 (83,4 %) 23 (22,5 %) 7 (16,6 %) 0,572 |
Примечание: * – статистически значимые различия между показателями в ТАМ-Ч и ТАМ-Р группах.
таблица 4
Экспрессия белка tgf-bri и полиморфизм гена TGF-BRI у больных люминальным а и в подтипами рМж в зависимости от эффективности лечения тамоксифеном
|
Параметры |
Люминальный A |
р |
Люминальный В |
p |
||
|
ТАМ-Ч |
ТМА-Р |
|||||
|
ТАМ-Ч |
ТМА-Р |
|||||
|
TGF-βRI экспрессия Негативная |
12 (37,5 %) |
9 (60,0 %) |
0,148 |
9 (45,0 %) |
5 (83,3 %) |
0,090 |
|
Позитивная |
20 (62,5 %) |
6 (40,0 %) |
11 (55,0 %) |
1 (16,7 %) |
||
|
TGF-βRI (rs334354 ) GG GA |
17 (54,8 %) 10 (32,3 %) |
10 (66,7 %) 4 (26,6 %) |
0,445 |
16 (80,0 %) 3 (15,0 %) |
5 (83,3 %) 1 (16,7 %) |
0,885 |
|
AA G allele А allele |
4 (12,9 %) 44 (70,9 %) 18 (29,1 %) |
1 (6,7 %) 24 (80,0 %) 6 (20,0 %) |
0,502 |
1 (5,0 %) 35 (87,5 %) 5 (12,5 %) |
0 (0,0 %) 11 (91,7 %) 1 (8,3 %) |
0,576 |
А и В подтипом опухоли. Анализ уровня экспрессии мРНК гена TGF-βRI не выявил статистически значимых различий в общей группе больных РМЖ без учета подтипа опухоли (p=0,552; рис. 2). Дальнейшая стратификация пациенток в зависимости от молекулярного подтипа подтвердила найденные закономерности. Тамоксифен-чувствительные пациентки как с люминальным А, так и с люминальным В РМЖ, имели более высокий уровень генной экспрессии TGF-βRI по сравнению с тамоксифен-резистентной группой соответственно люминального А и В РМЖ (p=0,637 и p=0,542 соответственно). Следует отметить, что в отличие от экспрессии гена, уровень белковой экспрессии TGF-βRI был связан с эффективностью гормональной терапии тамоксифеном в общей группе больных. TGF-βRI-позитивно окрашенные клетки выявлены в 59,6 % наблюдений у пациенток без прогрессирования по сравнению с 33,3 % больных тамоксифен-резистентной группы (p=0,043, табл. 3). При разделении группы больных по молекулярному подтипу выявлена тенденция к взаимосвязи высокого уровня экспрессии белка TGF-βRI с чувствительностью к терапии тамоксифеном только среди больных люминальным В раком молочной железы (p=0,090, табл. 4). При изучении распределения генотипов и аллелей гена TGF-βRI как в общей группе пациенток, так и в зависимости от подтипа опухоли значимых ассоциаций с эффективностью проводимой терапии не обнаружено.
Обсуждение
Литературные данные об экспрессии гена TGF-βRI и его белкового продукта при раке молочной железы немногочисленны, в основном они проводятся в общих группах больных без учета молекулярного подтипа опухоли, касаются или количественного распределения содержания мРНК, либо полуколичественной оценки белка в опухоли и не сопоставляются между собой. В единичных исследованиях определена прогностическая роль экспрессии мРНК гена TGF-βRI, высокие уровни которого связаны с неблагоприятным исходом для больных раком молочной железы, особенно при малых опухолях [14]. Подобные закономерности были выявлены при изучении белковой экспрессии TGF-βRI: низкие показатели безметастатической выживаемости больных РМЖ связаны с высоким уровнем экспрессии белка TGF-βRI [15]. Существует ряд работ, посвященных изучению полиморфизма гена TGF–βR1 (rs334354), однако представлены результаты исследования только его рисковой значимости, которые получены для общей выборки больных РМЖ без сопоставления с молекулярными подтипами. Так, в работе Song et al. не выявлено ассоциаций между мутантным аллелем Int7G24A и риском развития РМЖ [16]. Более ранние опубликованные данные указывают на взаимосвязь носительства данного полиморф- ного варианта с инвазивным и метастатическим РМЖ [13].
Полученные результаты свидетельствуют о том, что прогностически благоприятный люминальный А подтип РМЖ характеризуется более высоким уровнем экспрессии мРНК TGF-βRI и высокой частотой встречаемости мутантных генотипов и аллелей гена TGF-βRI (rs334354) по сравнению с люминальным В РМЖ . Можно полагать, что подобные нуклеотидные замены в интроне приводят к возникновению функционально активного варианта гена TGF-βRI. Кроме того, известно, что антипро-лиферативные эффекты TGF-β1 на ранних стадиях РМЖ могут поддерживаться за счет высокой активности не только лиганда, но и его рецепторов, что способствует, в конечном итоге, более благоприятному клиническому течению заболевания.
Наиболее значимым полученным результатом является прогностическая ценность уровня белковой экспрессии TGF-βRI в опухолевой ткани у больных люминальным подтипом РМЖ. Проведенное исследование указывает на то, что низкий уровень экспрессии белка TGF-βRI является одним из факторов, связанных с неэффективностью лечения тамоксифеном, в большей степени, по-видимому, для пациенток с люминальным В подтипом РМЖ. Можно предположить, что низкая функциональная активность TGF-βRI может обусловливать неполноценную функциональную реализацию TGF-β1/Smad сигнальной трансдукции, приводящую к активации пролиферативных процессов в опухоли, в том числе и посредством запуска альтернативных сигнальных каскадов. Вероятно, ключевую роль при этом имеет функциональный статус эстрогеновых рецепторов (активация ERα, наличие мутаций и точечных замен), которые могут быть вовлечены в супрессию TGF-β1/Smad пути. Следует подчеркнуть, что пока не изучен вклад TGF-βRI в реализацию механизмов опухолевой прогрессии у больных, получавших терапию тамоксифеном. Вероятно, экспрессия TGF-βRI в опухоли может рассматриваться в качестве маркера резистентности к терапии тамоксифеном, как и TGF-βRII, низкий уровень экспрессии которого является независимым предиктором ответа на тамоксифен у пременопаузальных больных [11]. Однако полученные данные требуют дополнительного подтверждения.
Заключение
Проведенное исследование указывает на то, что уровень белковой экспрессии TGF-βRI может рассматриваться в качестве потенциального молекулярно-генетического маркера эффективности эндокринной терапии тамоксифеном у больных люминальным раком молочной железы.
Работа выполнена при финансовой поддержке Президента РФ, грант № МД-9084.2016.7 (молекулярно-генетические исследования), и РФФИ, грант № 16-54-76015 ЭРА_а (набор биологических образцов и клинические данные пациентов).
Список литературы Роль рецептора трансформирующего фактора роста I типа (TGF-BRI) в прогрессировании люминального подтипа рака молочной железы
- Стенина М.Б., Фролова М.А. Рак молочной железы: наиболее важные научные события и выводы последних лет. Практическая онкология. 2011; 12 (1): 6-11
- Семиглазов В.Ф., Палтуев Р.М., Семиглазов В.В., Дашян Г.А., Семиглазова Т.Ю., Криворотько П.В., Николаев К.С. Общие рекомендации по лечению раннего рака молочной железы St. Gallen-2015, адаптированные экспертами Российского общества онкомаммологов. Опухоли женской репродуктивной системы. 2015 3:43-60. DOI: 10.17650/1994-4098-2015-11-3-43-60
- Band A.M., Laiho M. Crosstalk of TGF-β and estrogen receptor signaling in breast cancer. J Mammary Gland Biol Neoplasia. 2011; 16 (2): 109-15. DOI: 10.1007/s10911-011-9203-7
- Derynck R., Zhang Y.E. Smad-dependent and Smad-independent pathways in TGF-beta family signaling. Nature. 2003 Oct 9; 425 (6958): 577-84
- Kleuser B., Malek D., Gust R., Pertz H.H., Potteck H., Kleuser B., Malek D., Gust R., Pertz H.H., Potteck H. 17-Beta-estradiol inhibits transforming growth factor-beta signaling and function in breast cancer cells via activation of extracellular signal-regulated kinase through the G protein-coupled receptor 30. Mol Pharmacol. 2008 Dec; 74: 1533-43. DOI: 10.1124/mol.108.046854


