Роль ренальной денервации в улучшении результатов катетерной аблации у пациентов с фибрилляцией предсердий и артериальной гипертензией
Автор: Заманов Дмитрий Анатольевич, Дмитриев А.Ю., Антонов С.И., Пристромова Л.В., Иваницкая Э.Э., Пустовойтов А.В., Корчагин Е.Е., Артеменко С.Н., Шабанов В.В., Романов А.Б., Покушалов Е.Л.
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Нарушения ритма сердца
Статья в выпуске: 4 т.19, 2015 года.
Бесплатный доступ
Цель Оценить эффективность ренальной денервации в сочетании с изоляцией легочных вен у пациентов с фибрилляцией предсердий и резистентной или умеренно резистентной артериальной гипертензией. Материал и методы Анализ включил результаты двух проспективных рандомизированных исследований. Критерии включения в исследования: пациенты с симптоматичной пароксизмальной или персистентной фибрилляцией предсердий, умеренно резистентной (артериальное давление >1-40/90 и 160/100 мм рт. ст.; п = 50). Результаты 110 пациентов рандомизировали на 2 группы: изоляция легочных вен (п = 55) и изоляция легочных вен в сочетании с ренальной денервацией (п = 55). Через 18 мес. после оперативного лечения у 35 (63,6%) из 55 пациентов в группе сочетанной процедуры отсутствовали пароксизмы предсердных тахиаритмий. В группе стандартной изоляции легочных вен 22 (40%) из 55 пациентов не имели предсердных тахиаритмий (р = 0,013; лог-ранк тест). У 16 (64%) из 25 пациентов с резистентной гипертензией, которым выполняли сочетанную процедуру, отсутствовали пароксизмы предсердных тахиаритмий по сравнению с 6 (24%) из 25 пациентов с изолированной изоляцией легочных вен (р = 0,004; лог-ранк тест). При умеренно резистентной гипертензии у 19 (63,3%) из 30 пациентов второй группы отсутствовали пароксизмы предсердных тахиаритмий по сравнению с 16 (53,3%) из 30 пациентов со стандартной изоляцией легочных вен (р = 0,43; лог-ранк тест). Наибольший эффект от выполнения ренальной аблации наблюдался у пациентов с персистирующей фибрилляцией предсердий и резистентной артериальной гипертензией (вероятность риска 0,24; 95% доверительный интервал 0,08-0,69; р = 0,012) Выводы Ренальная денервация улучшает результаты изоляции легочных вен, что особенно выражено у пациентов с персистирующей фибрилляцией предсердий и резистентной артериальной гипертензией.
Фибрилляция предсердий, ренальная денервация, резистентная артериальная гипертензия, умеренно резистентная артериальная гипертензия
Короткий адрес: https://sciup.org/142140693
IDR: 142140693
Текст научной статьи Роль ренальной денервации в улучшении результатов катетерной аблации у пациентов с фибрилляцией предсердий и артериальной гипертензией
Ренальная симпатическая денервация – новый метод, позволяющий эффективно контролировать течение резистентной гипертензии [1]. Исследователи отмечают, что помимо гипотензивного ренальная денервация увеличивает антиаритмический эффект при фибрилляции предсердий (ФП) и желудочковых тахиаритмиях [2–3].
Артериальная гипертензия (АГ) – фактор риска развития ФП и в ряде случаев, при изолированной ее форме, может вызвать аритмию [4–6].
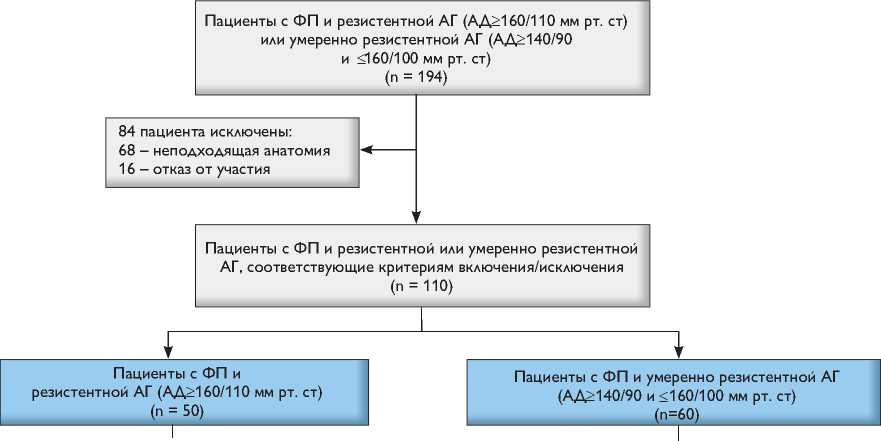
Рандомизация 1 : 1 Рандомизация 1 : 1


Рис. 1. Дизайн исследования. ФП – фибрилляция предсердий; АГ – артериальная гипертензия; АД – артериальное давление; ИЛВ – циркулярная изоляция легочных вен; РДН – ренальная денервация
Симпатическая нервная система играет важную роль в формировании и поддержании ФП [7, 8]. Часто увеличение симпатического тона предшествует ФП, и гиперактивация симпатической нервной системы может быть предиктором рецидива ФП после катетерной аблации [9, 10]. Исследователи отмечают, что автономная денервация, влияющая на симпатический и парасимпатический компоненты автономной иннервации предсердий, в сочетании с изоляцией легочных вен (ИЛВ) может быть эффективной процедурой [11, 12].
По данным работ, ренальная денервация увеличивает эффективность ИЛВ у пациентов с фибрилляцией предсердий и резистентной артериальной гипертензией [2]. Однако авторы включили пациентов только с тяжелой резистентной АГ и оценивали потенциальную роль ренальной денервации при умеренно резистентной артериальной гипертензии.
Цель данного исследования – оценить роль ренальной денервации в сочетании с изоляцией легочных вен у пациентов с пароксизмальной/персистирующей фибрилляцией предсердий и умеренно резистентной/ре-зистентной артериальной гипертензией.
Материал и методы
В работе использовали данные двух проспективных рандомизированных исследований. Первое исследование включало 60 пациентов с умеренно резистентной АГ (артериальное давление, АД, ≥ 140/90 и ≤ 160/100 мм рт. ст.); второе – 50 пациентов с АД ≥ 160/100 мм рт. ст. (рис. 1).
Критерии включения:
-
1) Пациенты с симптоматичной пароксизмальной или персистирующей медикаментозно-рефрактерной ФП (неэффективность I С или III класса антиаритми-
- ческих препаратов), направленные на катетерную аблацию фибрилляции предсердий. Пароксизмальная и персистирующая формы определяли согласно рекомендациям.
-
2) Артериальной давление ≥ 140/90 и <160/100 мм рт. ст. (первое исследование, умеренно резистентная АГ).
-
3) Артериальное давление ≥ 160/100 мм рт. ст., несмотря на лечение тремя или более антигипертензивными препаратами, включая один диуретический препарат (второе исследование, резистентная АГ).
-
4) Скорость клубочковой фильтрации ≥ 45 мл/ мин/1*73м2.
Артериальное давление измеряли в соответствии с рекомендациями Объединенного национального комитета VII, Европейского общества кардиологов и Европейского общества гипертензии. В нашем анализе мы использовали среднее значение трех измерений [13–16].
Основные критерии исключения: вторичные причины гипертензии; выраженный стеноз или удвоение почечных артерий; застойная сердечная недостаточность III–IV функционального класса по нью-йоркской классификации сердца (NYHA); фракция выброса левого желудочка <35%; диаметр левого предсердия >60 мм по трансторакальной эхокардиографии; аблация ФП в анамнезе; ангиопластика или стентирование почечных артерий в анамнезе; сахарный диабет первого типа.
Оба исследования были рандомизированные и носили двойной слепой характер. Протокол исследования одобрен локальным этическим комитетом, исследование проводили в соответствии со стандартами оперативного лечения и Хельсинской декларации.
Первичная конечная точка исследования – рецидив любой предсердной тахиаритмии (ФП/ТП/ПТ) продолжительностью более 30 с через 3 мес. после одной процедуры аблации без антиаритмической терапии. «Слепой» период (первые три месяца после аблации) исключили из анализа [20, 22].
Вторичные конечные точки: анализ подгрупп пациентов; оценка осложнений; изменение показателей АД через 3, 6, 9, 12, 18 мес. после операции.
Определение гипертензии. Гипертензия считалась резистентной к лечению, если при адекватной терапевтической стратегии (коррекция образа жизни, два гипотензивных препарата, относящихся к разным классам в адекватных дозах, и один диуретик) артериальное давление не опускалось менее 160/100 мм рт. ст. Если пациенту применяли адекватную гипотензивную терапию, но прием препаратов прерывался и показатели АД варьировали от 140/90 до 160/100 мм рт. ст., гипертензию считали умеренно резистентной [13–16].
Изоляция легочных вен. Процедура радиочастотной изоляции легочных вен подробно описана ранее [12]. Всем пациентам выполняли циркулярную ИЛВ без дополнительных линейных воздействий. Электрическую кардиоверсию проводили в конце аблации при сохранении ФП. Блок входа и выхода подтверждали с помощью катетера Lasso. При документированном или выявленном во время операции типичном трепетании предсердий проводили аблацию кавотрикуспидального перешейка.
Ренальная денервация. В группе ренальной денервации всем пациентам после ИЛВ выполняли билатеральную ренальную денервацию. Для этого использовали технику, описанную Krum и соавторами [17]. Детальное описание процедуры также представлено в литературе [2, 18].
Анатомию почечных артерий оценивали с помощью ангиографии. 84 пациентам 3D-модель почечных артерий и аорты строили с помощью навигационной системы Carto (Biosense Webster, US). Почечную денервацию проводили с помощью аблационного катетера NaviStar ThermoCool (BiosenseWebster Inc., Diamond Bar, CA) сразу после ИЛВ. 25 пациентам ренальную денервацию выполняли с помощью катетера Symplicity (Medtronic Inc., Mountain View, CA). Радиочастотное воздействие мощностью 8–10 Вт осуществлялось по спирали от дистальной части почечной артерии (от бифуркации) к устью. Продолжительность каждого воздействия составила 2 мин. Для подтверждения почечной денервации использовали высокочастотную стимуляцию (ВЧС) перед первым и после каждого воздействия в почечных артериях (стимулятор В-53, Биоток, Россия). Достижение почечной симпатической денервации расценивали как отсутствие повышения АД (более чем на 15 мм рт. ст. по данным прямого измерения АД) при ВЧС после воздействия.
Контрольное наблюдение. Еженедельно в течение первого месяца после оперативного вмешательства проводили запись ЭКГ. Холтеровское мониторирование ЭКГ выполняли через 3, 6, 9, 12 и 18 мес. после операции. Артериальное давление измеряли стандартно всем пациентам согласно рекомендациям [13]. Антигипертензивная терапия не менялась у всех пациентов, включенных в исследование, за исключением появившихся показаний для отмены или увеличения/уменьше-ния дозировки препарата.
Все пациенты принимали антиаритмические препараты в течение 6–8 нед. после аблации. Антиаритми-
Таблица 1 Дооперационные характеристики пациентов
|
Параметр |
Все пациенты, n = 110 |
р* |
Пациенты с резистентной АГ, n = 50 |
р** |
Пациенты с умеренно резистентная АГ, n = 60 |
р# |
|||
|
ИЛВ, n = 55 |
ИЛВ + РДН, n = 55 |
ИЛВ, n = 25 |
ИЛВ + РДН, n = 25 |
ИЛВ, n = 30 |
ИЛВ + РДН, n = 30 |
||||
|
Возраст |
59±10 |
58±10 |
0,74 |
59±11 |
58±9 |
0,4 |
58±9 |
57±10 |
0,8 |
|
Пол (муж./жен.), n |
37/18 |
36/19 |
0,72 |
17/8 |
18/7 |
0,46 |
20/10 |
18/12 |
0,7 |
|
Пароксизмальная/персис-тирующая формы ФП, n |
27/28 |
24/31 |
0,6 |
10/15 |
8/17 |
0,74 |
17/13 |
16/14 |
0,6 |
|
Длительность ФП, лет |
4,8±3,2 |
5,1±3,5 |
0,24 |
5,5±3,4 |
5,7±4,2 |
0,67 |
4,2±2,9 |
4,4±3,1 |
0,4 |
|
Сахарный диабет 2 типа, n (%) |
8 (15) |
7 (13) |
0,63 |
3 (12) |
4 (16) |
0,74 |
5 (17) |
3 (10) |
0,3 |
|
Фракция выброса левого желудочка, % |
64±5 |
65±5 |
0,54 |
65±6 |
67±5 |
0,51 |
63±4 |
62±5 |
0,52 |
|
Левое предсердие, мм |
48±5 |
48±6 |
0,84 |
50±6 |
48±7 |
0,42 |
47±5 |
48±6 |
0,62 |
|
Скорость клубочковой фильтрации, мл/мин/1,73 м2 |
77,6±5,1 |
76,4±6,2 |
0,51 |
81,2±4,8 |
79,2±5,9 |
0,48 |
76,2±5,2 |
74,4±6,5 |
0,42 |
|
Систолическое артериальное давление, мм рт. ст. |
162±7 |
164±8 |
0,79 |
179±10 |
182±8 |
0,61 |
151±5 |
150±5 |
0,8 |
|
Диастолическое артериальное давление, мм рт. ст. |
87±5 |
88±5 |
0,81 |
95±4 |
96±5 |
0,58 |
83±6 |
82±6 |
0,7 |
|
Антигипертензивные препараты, |
n (%) |
||||||||
|
Диуретики |
54 (98) |
55 (100) |
0,7 |
24 (96) |
25 (100) |
0,84 |
30 (100) |
30 (100) |
1 |
|
Ингибиторы ангиотензинпре-вращающего фермента / антагонист рецепторов ангиотензина II |
55 (100) |
54 (98) |
0,7 |
25 (100) |
24 (96) |
0,84 |
30 (100) |
30 (100) |
1 |
|
Бета-блокаторы |
30 (55) |
28 (51) |
0,68 |
22 (88) |
21 (84) |
0,62 |
8 (27) |
7 (23) |
0,6 |
|
Блокаторы кальциевых каналов |
37 (67) |
38 (69) |
0,87 |
18 (72) |
17 (68) |
0,58 |
19 (63) |
21 (70) |
0,74 |
|
Антиаритмическая терапия, n (макс-мин) |
3,4±1,1 (2–5) |
3,5±1,1 (2–5) |
0,95 |
3,7±1,1 (2–5) |
3,8±1,2 (2–5) |
0,36 |
3,1±1,1 (2–5) |
3,2±0,9 (2–5) |
0,72 |
АГ – артериальная гипертензия; ИЛВ – циркулярная изоляция легочных вен; РДН – ренальная денервация; ФП – фибрилляция предсердий; * – сравнение между группами для всех пациентов; ** для пациентов с резистентной артериальной гипертензией; # для пациентов с умеренно резистентной артериальной гипертензией ческую терапию отменяли, несмотря на наличие или отсутствие ФП, чтобы предотвратить ее возможное влияние на сердечный ритм после «слепого» периода. Для исключения послеоперационных осложнений всем пациентам выполняли магнитно-резонансную ангиографию и измеряли скорость клубочковой фильтрации через 6 мес. после процедуры аблации.
Статистический анализ
Результаты представлены как среднее значение ± стандартное отклонение или в цифровом и процентном виде. Метод χ2 использовали для сравнения качественных признаков. Эффективность лечения в группах наблюдения определяли с помощью лог-рангового критерия, что графически выражалось методом Каплана – Майера. Регрессионный анализ Кокса использовали для оценки вероятности риска возникновения ФП. Поскольку два исследова- ния были cхожи по дизайну и популяции, применили метод метаанализа для оценки результатов. Для этих целей мы использовали регрессионную модель пропорциональных рисков с типом исследования в качестве дополнительного фактора. Для оценки гетерогенности анализировали связь между лечением и типом исследования, типом лечения и формой ФП. Результаты представлены в виде графика «форест-плот» (forest plot) с вероятностью риска (ВР) и 95% доверительным интервалом (ДИ) ВР для основного эффекта. Предопределенный анализ подгрупп (па-роксизмальная/персистирующая ФП, резистентная/ умеренно резистентная АГ) представлен в виде графика «форест-плот». Значения p основаны на двустороннем тесте, показатель <0,05 считали статистически значимым. Cтатистические расчеты проводили с использованием программного обеспечения STATA 12.1 (STATACorp, США).
ИЛВ + РДН
ИЛВ
0505 ,752 1 , , , 000
ТП/ПТ/ПФ еивтстустО
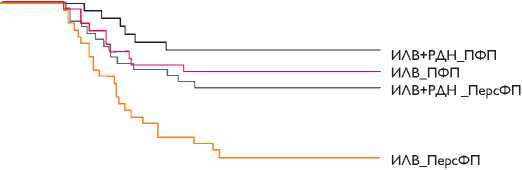
Рис. 2, а. Частота развития ФП/ТП/ПТ у пациентов после изоляции легочных вен и изоляции легочных вен в сочетании с ренальной денервацией. ИЛВ – изоляция легочных вен; РДН – ренальная денервация; ФП – фибрилляция предсердий;
ТП – трепетание предсердий; ПТ – предсердная тахикардия
Результаты
Сто девяносто четыре пациента с фибрилляцией предсердий и эссенциальной гипертензией скрини-ровали для включения в исследование. Восемьдесят четыре пациента исключили до рандомизации из-за неподходящей анатомии почечных артерий или отказа участвовать в исследовании. Оставшихся пациентов с резистентной (n = 50) и умеренно резистентной (n = 60) гипертензией рандомизировали на две группы: изоляция легочных вен или изоляция в сочетании с ренальной денервацией. Пациентов наблюдали в течение 18 мес. после оперативного лечения. Доопера-ционные характеристики пациентов представлены в табл. 1.
Блок входа и выхода после ИЛВ подтвержден у 110 (100%) пациентов. Сорока девяти (44,5%) пациентам с типичным трепетанием предсердий выполняли аблацию кавотрикуспидального перешейка (23 пациентам группы ИЛВ и 26 пациентам – ИЛВ в сочетании с денервацией почечных артерий). Средняя продолжительность процедуры составила 154±28 для группы изолированной ИЛВ и 189±32 мин для сочетанной ИЛВ (в том числе 32±8 мин для ренальной аблации; р = 0,1). Среднее время рентгеноскопии составило 26±15 и 29±14 мин соответственно (включая 8±2 мин для аблации почечных артерий;
р = 0,14). В группе ренальной аблации общее количество воздействий в каждой почечной артерии составило 4,4±0,7 (от 4 до 6, медиана 5).
Высокочастотную стимуляцию выполнили 72 (65%) пациентам (34 пациентам в группе изолированной и 38 – в группе сочетанной ИЛВ). Повышение артериального давления на 15 мм рт. ст. в ответ на ВЧС выявлено у всех пациентов. Ренальную денервацию после ВЧС успешно провели 38 пациентам без повышения артериального давления на ВЧС после аблации (р<0,001 по сравнению с дооперационными значениями).
Осложнения во время операционного вмешательства выявлены у двух пациентов (1,8%; по одному из каждой группы). Во время изоляции легочных вен возник гемоперикард, который успешно устранили методом пункции перикарда по Марфану. Осложнений, связанных с процедурой ренальной аблации, не наблюдалось. Скорость клубочковой фильтрации также не изменилась по сравнению с дооперационными значениями у пациентов, которым выполняли ренальную денервацию, и составила 76,4±6,2 и 79,2±5,7 мл/мин/1*73м2 соответственно (p = 0,45).
Для всей когорты пациентов через 18 мес. после оперативного лечения у 35 (63,6%) из 55 пациентов в группе ИЛВ в сочетании с денервацией почечных ар-
ТП/ПТ/ПФ еивтстуст
1,0
0,75
0,50
0,25
0,0
|
0 |
1 3 |
6 |
1 9 |
12 |
1 15 |
18 |
|
|
Кол-во с риском |
Месяцы |
||||||
|
ИЛВ+РДН_ПФП |
24 |
24 |
20 |
18 |
18 |
18 |
18 |
|
ИЛВ+РДН _ПерсФП |
31 |
31 |
21 |
18 |
17 |
17 |
17 |
|
ИЛВ_ПФП |
27 |
27 |
20 |
17 |
17 |
17 |
17 |
|
ИЛВ_ПерсФП |
28 |
28 |
12 |
8 |
5 |
5 |
5 |
Рис. 2, б . Частота развития ФП/ТП/ПТ у пациентов с пароксизмальной и персистирующей формами фибрилляции пред-
– пароксизмальная
– персистирующая терий отсутствовали пароксизмы ФП/ТП/ПТ. В группе стандартной ИЛВ только 22 (40%) из 55 пациентов не имели пароксизмы ФП/ТП/ПТ (р = 0,013; лог-ранк тест; ВР 1,98, 95% ДИ [1,13–3,46], р = 0,016, регрессионный анализ Кокса; рис. 2, а). Все пациенты не принимали ан-тиаритмические препараты.
По данным магнитно-резонансной томографии через 6 мес. после оперативного в группе пациентов с ренальной денервацией не выявили ни одного случая стеноза почечных артерий. В отдаленный период наблюдения также не выявлено каких-либо осложнений. Таким образом, общий процент осложнений в группе ИЛВ и ИЛВ в сочетании с ренальной денервацией составил 1,8% (р = 1).
У 18 из 24 (75%) пациентов с пароксизмальной формой ФП в группе ИЛВ в сочетании с ренальной денервацией отсутствовали пароксизмы ФП/ТП/ПТ через 18 мес. после оперативного лечения по сравнению с 17 из 27 (62,9%) пациентов, которым выполняли изолированную ИЛВ (лог-ранк тест, p = 0,31). Напротив, у пациентов с персистирующей формой ФП ренальная денервация значимо увеличивала эффективность оперативного лечения: 17 из 31 пациента (54,8%) в группе сочетанной процедуры не имели пароксизмов предсердных тахиаритмий в конце периода наблюдения по сравнению с 5 из 28 (17,9%) пациентов в группе изолированной ИЛВ (лог-ранк тест, p = 0,006; рис. 2, б). Все пациенты не принимали антиаритмические препараты.
Ренальная денервация значимо не увеличивала эффективность у пациентов с пароксизмальной ФП (ВР 0,48; 95% ДИ [0,17–1,8]; p = 0,26). Наиболее выраженный эффект ренальной денервации наблюдался у пациентов с персистирующей ФП (ВР 0,36; 95% ДИ [0,21– 0,84]; p = 0,017), резистентной АГ (ВР 0,37; 95% ДИ [0,15–0,89]; p = 0,026) и у пациентов с персистирующей ФП и резистентной АГ (ВР 0,24; 95% ДИ [0,08–0,69]; p = 0,01),
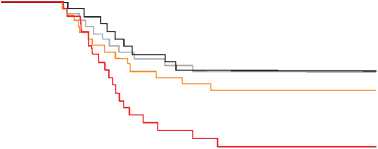
У 16 (64%) из 25 пациентов с резистентной гипертензией, которым выполняли ИЛВ в сочетании с ренальной денервацией, отсутствовали пароксизмы предсердных тахиаритмий по сравнению с 6 (24%) из 25 пациентов с ИЛВ (р = 0,004; лог-ранк тест). При умеренно резистентной гипертензии у 19 (63,3%) из 30 пациентов с сочетанной ИЛВ отсутствовали пароксизмы предсердных тахиаритмий по сравнению с 16 (53,3%) из 30 пациентов со стандартной процедурой изоляции легочных вен ИЛВ (р = 0,43; лог-ранк тест; рис. 2, в).
Пациенты с изолированной ИЛВ не показали значительного изменения систолического или диастолического артериального давления. Напротив, у пациентов, которым выполняли ренальную денервацию в сочетании с ИЛВ, наблюдалось значительное снижение систолического и диастолического АД в течение всего периода наблюдения.
Среднее снижение систолического и диастолического артериального давления в конце периода на-
1,0
ИЛВ + РДН_РезАГ
ИЛВ + РДН_умерен-резАГ
ИЛВ_умерен-резАГ
ИЛВ_РезАГ
ТП/ПТ/ПФ еивтстуст
0,75
0,50
0,25
0,0
|
Кол-во с риском |
1 0 |
1 3 |
1 6 |
1 9 Месяцы |
12 |
1 15 |
18 |
|
ИЛВ + РДН_РезАГ |
25 |
25 |
19 |
16 |
16 |
16 |
16 |
|
ИЛВ_РезАГ |
25 |
25 |
11 |
8 |
6 |
6 |
6 |
|
ИЛВ + РДН_умерен-резАГ |
30 |
30 |
22 |
20 |
19 |
19 |
19 |
|
ИЛВ_умерен-резАГ |
30 |
30 |
21 |
17 |
16 |
19 |
19 |
Рис. 2, в. Частота развития ФП/ТП/ПТ у пациентов с резистентной и умеренно резистентной артериальной гипертен- зией. ИЛВ – изоляция легочных вен; РДН – ренальная денервация; РезАГ – резистентная артериальная гипертензия; умерен-резАГ
– умеренно резистентная артериальная гипертензия; ИЛВ_РезАГ по сравнению с ИЛВ_умерен-рез АГ (p = 0,09); ИЛВ + РДН_РезАГ по сравнению с ИЛВ + РДН_умерен-резАГ (p = 0,79); ИЛВ_РезАГ по сравнению с ИЛВ + РДН_РезАГ (p = 0,026); ИЛВ_умерен-резАГ по сравнению с ИЛВ + РДН_умерен-резАГ (лог-ранк тест, p = 0,43; ВР 1,36 95% ДИ [0,62–3,01], р = 0,43). ИЛВ + РДН_Р против ИЛВ_умер Рез (лог-ранк тест, p = 0,18)
блюдения после выполнения ренальной денервации в группе пациентов с резистентной и умеренно резистентной АГ составило 27±6/11,4±5 и 12,1±4/7,9±5 мм рт. ст. соответственно (р<0,001). Также в конце периода наблюдения в группе пациентов ренальной денервации 22 пациента (5 пациентов с резистентной и 17 с умеренно резистентной АГ) имели систолическое давление ниже 140 мм рт. ст.
Врачи и пациенты были проинструктированы не менять антигипертензивную терапию кроме выявленных показаний для отмены или увеличения/ уменьшения дозировки препарата. Девяти (30%) пациентам с умеренно резистентной АГ и четырем (16%) пациентам с резистентной АГ в период наблюдения снизили дозы гипотензивных препаратов в связи с выраженным гипотензивным эффектом. После ренальной денервации ни у одного пациента увеличены объемы антигипертензивной терапии.
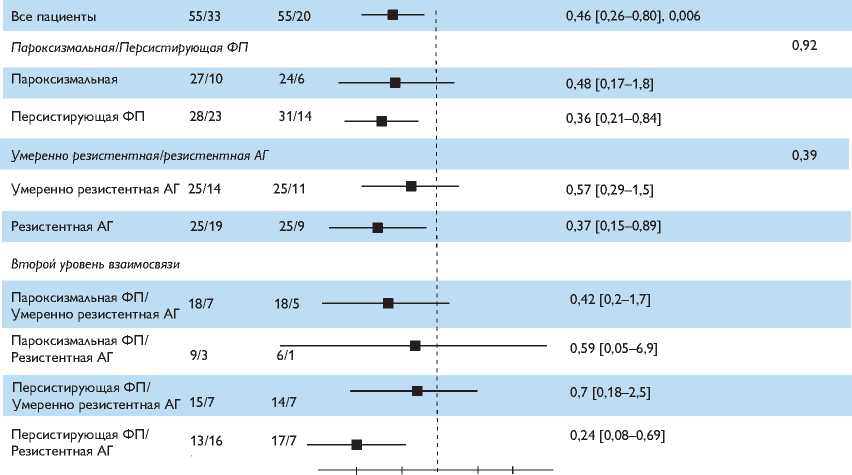
На рис. 3 показан график типа «форест плот» для двух исследований. Выполнение ренальной денервации в сочетании с ИЛВ сопровождалось снижением риска развития рецидивов ФП/ТП/ПТ на 54% (ВР 0,46; 95% ДИ [0,26–0,80], p = 0,006). Результат был скорректирован для типа исследования и фор- мы ФП. Дальнейший анализ взаимосвязи данных факторов не продемонстрировал влияния на эффективность лечения, что подтверждает однородность эффекта лечения среди исследований и формы фибрилляции предсердий.
Скорректированный результат лечения в подгруппах подтвержден метаанализом. Среди подгрупп наблюдался схожий эффект. Из-за ограничений в объеме выборки мы не оценивали значимость результатов. Однако доверительные интервалы для пациентов с персистирующей формой ФП и подгруппой пациентов с персистирующей ФП и резистентной гипертензией не пересекли единицу (линию идентичности). Результаты в данных подгруппах не были скорректированы для множественного статистического тестирования.
Обсуждение
Результаты проведенного исследования у пациентов с резистентной и умеренно резистентной АГ продемонстрировали:
-
• Ренальная денервация в сочетании с изоляцией легочных вен у пациентов с ФП и АГ значимо превосходит стандартную процедуру изоляции легоч-
Подгруппа
ИЛВ, n ИЛВ + РДН, n ВР [95% ДИ], р
р для взаимосвязи
0,125 0,25 0,50 1,00 2,00 4,00 8,00
V..............A
ИЛВ + РДН ИЛВ
Рис. 3. Риск развития рецидивов ФП/ТП/ПТ. ИЛВ – изоляция легочных вен; РДН – ренальная денервация; РезАГ – резистентная артериальная гипертензия; ФП – фибрилляция предсердий; АГ – артериальная гипертензия; ВР – вероятность риска; ДИ – доверительный интервал ных вен в отношении сохранения синусового ритма: 63,6 и 40% соответственно.
-
• Сохранение синусового ритма у пациентов с ФП и умеренно резистентной АГ после выполнения ренальной денервации в сочетании с изоляцией легочных вен превышает, но статистически не отличается по сравнению со стандартной процедурой изоляции легочных вен и составляет 63,3 и 53,3% соответственно.
-
• Наибольшая эффективность ренальной денервации в отношении сохранения синусового ритма наблюдается у пациентов с резистентной АГ и персистирующей формой ФП (ВР 0,24; 95% ДИ 0,08–0,69).
-
• Процент осложнений при сочетанной процедуре не превышает процент осложнений после стандартной аблации ФП и составляет 1,8 и 1,8% соответственно.
-
• Ренальная денервация у пациентов с резистентной и умеренно резистентной АГ ведет к стойкому снижению систолического/диастоличес-кого артериального давления в течение периода наблюдения на 27±6/11,4±5 и 12,1±4/7,9±5 мм рт. ст. соответственно.
Результаты метаанализа двух проспективных рандомизированных исследований подтверждают данные предыдущих публикаций, но на большей когорте пациентов [2]. Ренальная денервация в сочетании с изоляцией легочных вен снижает риск рецидива ФП на 54%. Данный эффект более выражен у пациентов с резистентной АГ и персистирующей ФП, хотя также наблюдали тенденцию увеличения эффективности у пациентов с умеренно резистентной АГ и пароксизмальной ФП, но она не была статистически достоверной. Это может быть связано с небольшим количеством включенных пациентов, и влияние ренальной денервации при умеренно резистентной АГ и пароксизмальной ФП требует дальнейшего изучения.
Проведенное исследование не оценивало причину эффективности ренальной денервации: снижение сосудистого тонуса или уменьшение симпатической активности или их сочетание. Артериальная гипертензия – наиболее частая сопутствующая патология при ФП и поэтому должна контролироваться у пациентов, которым была выполнена катетерная аблация фибрилляции предсердий [4, 5].
Мы предполагали, что результат ренальной денервации в сочетании с изоляцией легочных вен более выражен у пациентов с персистирующей фибрилляцией предсердий и резистентной артериальной гипертензией. Результаты подтвердили данный факт. Вклад ренальной денервации при персистирующей ФП, причина которой не только триггерная активность легочных вен, но и процессы ремоделирования предсердий, а также при резистентной гипертензии более весомый, чем при пароксизмальной ФП и умеренно резистентной артериальной гипертензии.
Количество принимаемых антигипертензивных препаратов не отличалось у пациентов, которым выполняли ренальную денервацию в сочетании с изоляцией легочных вен или стандартную процедуру изоляции легочных вен, что не влияет на оценку эффективности методов лечения.
В нашем исследовании ренальная денервация приводила к значимому устойчивому снижению систолического и диастолического АД в течение периода наблюдения. Эти результаты сопоставимы с выполненными ранее работами как у пациентов с резистентной, так и умеренно резистентной АГ [16, 17]. Хотя исследование Simplicity HTN-3 [19] не продемонстрировало значимого снижения АД, мы продемострировали два отличия в методологии:
-
1) Использовали ВЧС для подтверждения интраоперационной эффективности ренальной денервации, что не продемонстрировано в исследовании Simplicity HTN-3: это важно в оценке «острой» эффективности ренальной денервации. Высокочастотная стимуляция в области устья почечной артерии приводила к внезапному повышению АД на 30 мм рт. ст., и это может быть использовано для подтверждения интраоперационной эффективности ренальной денервации. Данные наблюдения схожи с анатомическими результатами
Norvell и соавторов, которые показали, что аорторенальное ганглионарное сплетение расположено около устья ренальной артерии в области отхождения от аорты [21].
-
2) Для измерения АД использовали рекомендации Европейского общества кардиологов и Европейского общества по лечению АГ [13, 14]. При использовании 24-часового амбулаторного измерения АД результаты могли быть иные.
Ренальная денервация в сочетании с изоляцией легочных вен являлась безопасной методикой, сопоставимой по проценту осложнений со стандартной процедурой изоляции легочных вен. Аналогичные данные продемонстрированы в ряде исследований с применением ренальной денервации. Таким образом, разработанный алгоритм лечения пациентов с ФП и АГ сочетанием ренальной денервации и изоляции легочных вен увеличил эффективность лечения данной группы пациентов.
Ограничения исследования. Главное ограничение исследования – относительно небольшой объем выборки, поэтому результаты требуют дальнейшего подтверждения в более крупных исследованиях. Формальный расчет объема выборки для данных исследований был невозможен, так как отсутствуют данные о влиянии ренальной денервации у исследуемой когорты пациентов. Однако исследование рандомизированное проспективное, «слепое». Полученные данные относятся к периоду наблюдения 18 мес., поэтому мы не можем экстраполировать результаты на долгосрочную вероятность поддержания синусового ритма и контроля артериального давления. Более того, использование имплантируемых мониторов для оценки сердечного ритма позволит более точно детектировать рецидивы ФП, чем запись ЭКГ и 24-часовое Холтеровское мониторирование ЭКГ [22, 23].
Заключение
Ренальная денервация в сочетании с изоляцией легочных вен значимо улучшает эффективность лечения пациентов с фибрилляцией предсердий и артериальной гипертензией по сравнению со стандартной процедурой изоляции легочных вен. Данный эффект наиболее выражен у пациентов с персистирующей фибрилляцией предсердий и резистентной артериальной гипертензией.
Список литературы Роль ренальной денервации в улучшении результатов катетерной аблации у пациентов с фибрилляцией предсердий и артериальной гипертензией
- Schlaich М.Р., Schmieder R.E., Bakris G., Schmieder R.E., Bakris G., Blankestijn P.J., Bohm M., Campese V.M., Francis D.P., Grassi G., Hering D., Katholi R., Kjeldsen S., Krum H., Mahfoud F., Mancia G., Messerli F.H., Narkiewicz K., Parati G., Rocha-Singh K.J., Ruilope L.M., Rump L.C., Sica D.A., Sobotka P.A., Tsioufis C., Vonend O., Weber M.A., Williams B., Zeller T. International expert consensus statement: Percutaneous transluminal renal denervation for the treatment of resistant hypertension//J. Am. Coll. Cardiol. 2013. Vol. 62. № 22. P. 2031-45.
- Pokushalov E., Romanov A., Corbucci G., Artyomenko S., Baranova V., Turov A., Shirokova N., Karaskov A., Mittal S., Steinberg J.S. A randomized comparison of pulmonary vein isolation with versus without concomitant renal artery denervation in patients with refractory symptomatic atrial fibrillation and resistant hypertension//J. Am. Coll. Cardiol. 2012. Vol. 60. P. 1163-1170.
- Ukena C, Bauer A., Mahfoud F., Schreieck J., Neuberger H.R., Eick C., Sobotka P.A., Gawaz M., Bohm M. Renal sympathetic denervation for treatment of electrical storm: first-in-man experience//Clin. Res. Cardiol. 2012. Vol. 101. P. 63-67.
- Huxley R.R., Lopez F.L., Folsom A.R., Agarwal S.K., Loehr L.R., Soliman E.Z., Maclehose R., Konety S., Alonso A. Absolute and attributable risks of atrial fibrillation in relation to optimal and borderline risk factors: The Atherosclerosis Risk in Communities (ARIC) study//Circulation. 2011. Vol. 123. P. 1501-8.
- Fuster V., Ryden L.E., Cannom D.S., Crijns H.J., Curtis A.B., Ellenbogen K.A., Halperin J.L., Kay G.N., Le Huezey J.Y., Lowe J.E., Olsson S.B., Prystowsky E.N., Tamargo J.L., Wann L.S. 2011 ACCF/AHA/HRS focused updates incorporated into the АСС/AHA/ESC 2006 guidelines for the management of patients with atrial fibrillation: A report of the american college of cardiology foundation/american heart association task force on practice guidelines//Circulation. 2011. Vol. 12. P. e269-367.
- Katritsis D.G., Toumpoulis I.K., Giazitzoglou E., Korovesis S., Karabinos I., Paxinos G., Zambartas C, Anagnostopoulos C.E. Latent arterial hypertension in apparently lone atrial fibrillation//J. Interv. Card. Electrophysiol. 2005. Vol. 13. P. 203-7.
- Schotten U., Verheule S., Kirchhof P., Goette A. Pathophysiological mechanisms of atrial fibrillation: A translational appraisal//Physiol. Rev. 2011. Vol. 91. P. 265-325.
- Lau D., Mackenzie L., Kelly D., Kelly D.J., Psaltis P.J., Brooks A.G., Worthington M., Rajendram A., Kelly D.R., Zhang Y., Kuklik P., Nelson A.J., Wong C.X., Worthley S.G., Rao M., Faull R.J., Edwards J., Saint D.A., Sanders P. Hypertension and atrial fibrillation: Evidence of progressive atrial remodeling with electrostructural correlate in a conscious chronically instrumented ovine model//Heart Rhythm. 2010. Vol. 7. P. 1282-1290.
- Bettoni M., Zimmermann M. Autonomic tone variations before the onset of paroxysmal atrial fibrillation//Circulation. 2002. Vol. 105. P. 2753-9.
- Arimoto T., Tada H., Igarashi M., Sekiguchi Y., Sato A., Koyama T., Yamasaki H., Machino T., Kuroki K., Kuga K., Aonuma K. High washout rate of iodine-123-metaiodobenzylguanidine imaging predicts the outcome of catheter ablation of atrial fibrillation//J. Cardiovasc. Electrophysiol. 2011. Vol. 22. P. 1297-1304.
- Katritsis D.G., Pokushalov E., Romanov A., Giazitzoglou E., Siontis G.C., Po S.S., Camm A.J., loannidis J.P. Autonomic Denervation Added to Pulmonary Vein Isolation for Paroxysmal Atrial Fibrillation: A Randomized Clinical Trial//J. Am. Coll. Cardiol. 2013. Vol. 62. № 24. P. 2318-25.
- Pokushalov E. The role of autonomic denervation during catheter ablation of atrial fibrillation//Curr. Opin. Cardiol. 2008. Vol. 23. №1. P.55-9.
- Chobanian A.V., Bakris G.L., Black H.R. Cushman W.C., Green L. A., Izzo J.L. Jr., Jones D.W., Materson B.J., Oparil S., Wright J.T. Jr., Roccella E.J. et al. The Seventh Report of the Joint National Committee on Prevention, Detection, Evaluation, and Treatment of High Blood Pressure: the JNC 7 report//JAMA. 2003. Vol. 289. P. 2560-72.
- Mancia G., De Backer G., Dominiczak A., Cifkova R., Fagard R., Germano G., Grassi G., Heagerty A.M., Kjeldsen S.E., Laurent S„ Narkiewicz K., Ruilope L., Rynkiewicz A., Schmieder R.E., Struijker Boudier H.A., Zanchetti A.; European Society of Hypertension; European Society of Cardiology. 2007 Guidelines for the Management of Arterial Hypertension: The Task Force for the Management of Arterial Hypertension of the European Society of Hypertension (ESH) and of the European Society of Cardiology (ESC)//J. Hypertens. 2007. Vol. 25. P. 1105-87.
- Mancia G., Laurent S., Agabiti-Rosei E., Ambrosioni E., Burnier M., Caulfield M.J., Cifkova R., Clement D., Coca A., Dominiczak A., Erdine S., Fagard R., Farsang C., Grassi G., Haller H., Heagerty A., Kjeldsen S.E., Kiowski W., Mallion J.M., Manolis A., Narkiewicz K., Nilsson P., Olsen M.H., Rahn K.H., Redon J., RodicioJ., Ruilope L., Schmieder R.E., Struijker-Boudier H.A., van Zwieten PA., Viigimaa M., Zanchetti A.; European Society of Hypertension Reappraisal of European guidelines on hypertension management a European Society of Hypertension Task Force document//J. Hypertens. 2009. Vol. 27. P. 2121-58.
- Ott C., Mahfoud F., Schmid A., Ditting T., Sobotka PA., Veelken R., Spies A., Ukena C., Laufs U., Uder M., Bohm M., Schmieder R. E. Renal Denervation in Moderate Treatment-Resistant Hypertension//J. Am. Coll. Cardiol. 2013. Vol. 62. № 20. P. 1880-6.
- Krum H., Schlaich M., Whitbourn R., Sobotka PA., Sadowski J., Bartus K., Kapelak B., Walton A., Sievert H., Thambar S., Abraham W.T., Esler M. Catheter-based renal sympathetic denervation for resistant hypertension: a multicentre safety and proof-of-principle cohort study//Lancet. 2009. Vol. 373. P. 1275-81.
- Заманов Д.А., Дмитриев А.Ю., Шильников Н.В., Иваницкая Э.Э., Романов А.Б., Покушалов Е.А. Модуляция автономной нервной системы с помощью денервации почечных артерий для лечения фибрилляции предсердий//Патология кровообращения и кардиохирургия. 2014. № 4. С. 113-122.
- Bhatt D.L., Kandzari D.E., O'Neill W.W., D'Agostino R., Flack J.M., Katzen B.T., Leon M.B., Liu M., Mauri L., Negoita M., Cohen S. A., Oparil S., Rocha-Singh K., Townsend R.R., Bakris G.L.; SYMPLICITY HTN-3 Investigators. A controlled trial of renal denervation for resistant hypertension//N. Engl. J. Med. 2014. Vol. 370. № 15. P. 1393-401.
- Joshi S., Choi A.D., Kamath G.S., Raiszadeh F., Marrero D., Badheka A., Mittal S., Steinberg J.S. Prevalence, predictors, and prognosis of atrial fibrillation early after pulmonary vein isolation: Findings from 3 months of continuous automatic ECG loop recordings//J. Cardiovasc. Electrophys. 2009. Vol. 20. P. 1089-1094.
- Norvell J.E. The aorticorenal ganglion and its role in renal innervation//J. Comp. Neur. 1968. Vol. 133. P. 101-112.
- Pokushalov E., Romanov A., Corbucci G., Artyomenko S., Turov A., Shirokova N., Karaskov A. Ablation of paroxysmal and persistent atrial fibrillation: 1-year follow-up throughcontinuous subcutaneous monitoring//J. Cardiovasc. Electrophysiol. 2011. Vol. 22. P. 369-75.
- Шабанов B.B., Романов А.Б., Артеменко C.H., Елесин Д.В., Стерльников А.Г., Байрамова С.А., Покушалов Е.А. Определение оптимального подхода в лечении пациентов с ранними рецидивами фибрилляции предсердий после первой процедуры аблации//Патология кровообращения и кардиохирургия. 2013. № 1. С. 113-122.


