Роль ростовых и транскрипционных факторов в оценке эффективности неоадъювантной химиотерапии у больных мышечно-инвазивным раком мочевого пузыря
Автор: Усынин Евгений Анатольевич, Спирина Людмила Викторовна, Слонимская Елена Михайловна, Кондакова Ирина Викторовна, Григорьев Евгений Геннадьевич, Горбунов Алексей Константинович
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 6 т.15, 2016 года.
Бесплатный доступ
Проведен анализ молекулярных маркеров, ассоциированных с эффективностью предоперационной химиотерапии у больных с мышечно-инвазивным раком мочевого пузыря. Цель исследования - изучение связи уровня экспрессии транскрипционных факторов, сосудистого эндотелиального фактора роста, активности протеасом и кальпаинов в опухоли с эффективностью неоадъювантной химиоте- рапии больных мышечно-инвазивным раком мочевого пузыря. Материал и методы. В исследование включены 50 больных с переходно-клеточным раком мочевого пузыря T2a-3bN0M0(G2-G3) стадии. Со- держание транскрипционных и ростовых факторов изучено методом ИФА, активность протеасом- флюорометрическим методом. Результаты. Достижение частичной регрессии новообразований после цитостатической терапии сопряжено с высокой активностью ростовых (VEGF) и транскрипционных (NF-κB, HIF-1) факторов в ткани опухоли. На фоне высокой активности ростовых и транскрипционных факторов отмечается низкая активность 26S протеасомного комплекса по отношению к пациентам со стабилизацией опухолевого процесса. Заключение. Выявлены дополнительные молекулярные критерии, которые могут рассматриваться в качестве предикторов неоадъювантной химиотерапии рака мочевого пузыря.
Рак мочевого пузыря, транскрипционный фактор hif-1α, транскрипционный фактор nf-κb, протеасомы, кальпаины
Короткий адрес: https://sciup.org/140254079
IDR: 140254079 | УДК: 616.62-006.6-08:615.28:577.112 | DOI: 10.21294/1814-4861-2016-15-6-22-27
Текст научной статьи Роль ростовых и транскрипционных факторов в оценке эффективности неоадъювантной химиотерапии у больных мышечно-инвазивным раком мочевого пузыря
В 2014 г. в России зарегистрировано 14 908 новых случаев рака мочевого пузыря (РМП). Доля РМП в общей структуре онкологической заболеваемости составляет 4,9 %. В период с 2004 по 2014 г. заболеваемость выросла на 27,51 % у женщин, на 14,13 % – у мужчин и на 16,70 % – у лиц обоих полов [1, 2]. Согласно рекомендациям по лечению мышечно-инвазивного рака мочевого пузыря (American Society of Clinical Oncology (ASCO), 2015; European association of Urology (EAU), 2016), тактика лечения определяется при участии уролога, химиотерапевта и радиолога, которые оценивают целесообразность проведения неоадъювантной химиотерапии (НАХТ) и возможности органосохраняющего лечения. Предоперационная химиотерапии обладает рядом преимуществ, она позволяет воздействовать на микрометастазы на ранних этапах лечения, потенциально отражает чувствительность к химиопрепаратам in vivo. Предположительно пациенты, ответившие на предоперационную химиотерапию, могут обладать более благоприятным прогнозом в отношении исхода заболевания [3–6]. На основании анализа более 3000 случаев доказано, что у пациентов с локализованным раком мочевого пузыря, не выходящим за пределы органа, НАХТ значимо улучшает безрецидивную выживаемость на 9 %, а общую выживаемость – на 5 % по сравнению с радикальной цистэктомией [7, 8].
Ведется поиск лабораторных, клинических, морфологических и молекулярно-генетических параметров, позволяющих предсказывать эффективность неоадъювантной химиотерапии. В исследование R. Takata et al. [9] было включено 27 пациентов РМП с T2a-3bN 0 M0 стадией, которые получали 2 курса неоадъювантной химиотерапии по схеме M-VAC. На основании биопсии опухоли, полученной при трансуретральной резекции, была изучена панель из 2 764 814 генов с использованием микрочипов. Авторы выделили 14 генов у 9 пациентов с регрессией опухоли в результате НАХТ. На основании профиля экспрессии этих генов была создана система прогнозирования эффективности химиотерапии. У пациентов с эффективным лечением показатели 3-летней без-рецидивной выживаемости составили 57 %. У
больных, не ответивших на лечение, показатели 3-летней безрецидивной выживаемости составили 12 %. В связи с небольшим числом наблюдений было рекомендовано продолжить исследование.
Роль ангиогенеза в прогрессировании и реци-дивировании опухолей мочевого пузыря активно изучается [10], VEGF рассматривается как независимый фактор в отношении риска развития рецидивов и метастазов. Установлено, что плотность микрососудов в опухоли является важным признаком, связанным с рецидивированием, опухолевым прогрессированием, метастазированием в лимфоузлы, кроме того, выявлены ассоциации между полиморфизмом гена VEGF и риском развития рецидива рака мочевого пузыря [11, 12]. Есть данные, что развитие злокачественных новообразований тесно связано с активностью факторов транскрипции, комплексом протеаз и кальпаинов, которые определяют такие важные свойства опухолей, как инвазия и метастазирование [13]. Протеасомы играют важную роль в поддержании функциональной активности клеток, в частности, в регуляции работы сигнальных систем, которые активируются при взаимодействии ростовых факторов с соответствующими рецепторами [14–16]. В экспериментальных условиях показано изменение активности и состава пула 26S протеасом в онкогенезе. Активно изучается роль протеасом в патогенезе злокачественных образований различных локализаций, в частности мочевого пузыря [17, 18]. С представленных позиций поиск новых предсказательных молекулярных маркеров, сопряженных с эффективностью неоадъювантной химиотерапии рака мочевого пузыря, является актуальным.
Цель исследования - изучение связи транскрипционных факторов, сосудистого эндотелиального фактора роста, активности протеасом и кальпаинов в опухолевой ткани у больных с мышечно-инвазивным раком мочевого пузыря с эффективностью неоадъювантной химиотерапии.
Материал и методы
В исследование включено 50 пациентов с гистологически верифицированным диагнозом переходно-клеточный рак мочевого пузыря T2-3bN0M 0 Комбинированное органосохраняющее лечение п. ациентов предполагало проведение 2 курсов предоперационной химиотерапии по схеме M-VAC (метотрексат – 30 мг/м2 в 1, 15 и 22-й дни; винбластин – 4 мг/м2 в 1, 15 и 22-й дни; цисплатин – 70 мг/м2 во 2-й день; доксорубицин – 30 мг/м2 во 2-й день), перерыв между курсами составил 4–6 нед. В последующем этим пациентам выполнялась ТУР мочевого пузыря с проведением 2 курсов послеоперационной химиотерапии по той же схеме. Непосредственная эффективность НАХТ оценивалась по шкале RECIST на основании результатов цистоскопии и СКТ/МРТ.
Материалом для исследования явились образцы опухолевой ткани, полученные при выполнении диагностической биопсии до начала лечения и после хирургического этапа. Они замораживались и хранились при –80°С. В опухолевом материале определяли активность протеасом и кальпаинов, а также количественное содержание VEGF, VEG-FR2, HIF-1α, NF-κBp50 и NF-κBp65, phospho-m-TOR. Для получения гомогенатов замороженную ткань (100 мг) гомогенизировали в жидком азоте, затем ресуспендировали в 300 мкл 50 мМ трис-HCl буфера (pH=7,5), содержащего 2 мМ АТФ, 5 мМ хлорид магния, 1 мМ дитиотреитол, 1 мМ ЭДТА и 100 мМ хлорид натрия. Гомогенат центрифугировали 60 мин при 10 000 g и 4°С.
Химотрипсинподобную активность протеасом определяли в гомогенатах опухолевых тканей по гидролизу флуорогенного олигопептида N-Succi-nyl-Leu-Leu-Val-Tyr-7-Amido-4-Methylcoumarin, утилизирующегося химотрипсинподобными центрами протеасом [5], на флуориметре «Hitachi-850» (Япония) при длине волны возбуждения 380 нм и эмиссии 440 нм. Реакционная смесь для определения активности 20S протеасом содержала 20 мМ трис- HCl (pH=7,5), 1 мМ дитиотреитол, 30 мкМ N-Succinyl-Leu-Leu-Val-Tyr-7-Amido-4-Methylcou-marin. Реакцию проводили при 37°C в течение 20 мин и останавливали 1 % додецил сульфатом натрия. Для оценки активности примесных протеаз в образцах применяли специфический ингибитор протеасом - MG132. Удельную активность про-теасом выражали в единицах активности на 1 мг белка.
Образцы осветленных гомогенатов опухолей использовались для определения содержания VEGF (R&D Systems, DSL, США), HIF-1α, NF- κ B p50 и NF- k B p65 субъединиц (Caymanchem, США) методом твердофазного иммуноферментного анализа на ИФА-анализаторе «Anthos 2020». Приготовление и очистка ядерных экстрактов тканевого гомогената проводились в соответствии с рекомендациями фирмы-производителя наборов. Уровень белка в гомогенатах и ядерных экстрактах определялся по методу Лоури. Результаты определения содержания VEGF, VEGFR2, phospho-TOR выражали в пг/мг белка, а HIF-1α, NF κ B p50 и NF κ B p65 – в условных единицах на мг белка в лунке.
Статистическую обработку результатов проводили с применением пакета статистических программ «Statistica 8.0». В зависимости от вида распределения результаты представлены как m ± M, где m – среднее выборочное, M – ошибка среднего, или как медиана с интерквартильным размахом (25-й и 75-й процентили). Значимость различий исследовали с помощью t-критерия Стьюдента или критерия Манна – Уитни.
Результаты и обсуждение
По нашим данным, неоадъювантная полихимиотерапия у больных РМП обладает высокой эффективностью. Из 50 пациентов, включенных в таблица
Уровень экспрессии молекулярных маркеров опухоли в зависимости от непосредственной эффективности неоадъювантной химиотерапии
|
Показатель |
Частичная регрессия (n=23) |
Стабилизация (n=24) |
Прогрессирование (n=2) |
|||
|
До НАХТ |
После НАХТ |
До НАХТ |
После НАХТ |
До НАХТ |
После НАХТ |
|
|
Тотальная активность протеасом, ×103 Ед/мг белка |
46,0 (38,2–80,0) |
54,6 (38,2–84,0) |
50,0 (38,2–80,0) |
51,6 (40,1–75,3) |
50,0 |
50,5 |
|
Активность 26S протеасом, ×103 Ед/мг белка |
15,6* (10,4–19,3) |
20,8** (20,6–25,8) |
17,7 (10,9–20,3) |
17,3 (10,0–21,6) |
16,7 |
17,8 |
|
Активность 20S протеасом, ×103 Ед/мг белка |
35,0 (24,2–48,5) |
38,4 (29,5–46,3) |
45,0 (24,2–60,5) |
47,1 (24,2–60,5) |
43,0 |
48,0 |
|
Общая активность кальпаинов, ×103 Ед/мг белка |
25,4 (21,5–51,9) |
26,2 (29,4–68,5) |
34,0 (25,3–68,9) |
33,9 (24,2–71,4) |
25,0 |
33,0 |
|
NF- κ B p65, Ед/мг белка в лунке |
22,3* (16,0–42,9) |
13,1** (3,9–25,3) |
12,6 (6,0–17,9) |
10,4 (7,0–16,3) |
18,2 |
22,0 |
|
NF- κ B p50, Ед/мг белка в лунке |
14,8 (10,5–20,25) |
11,9 (5,4–42,0) |
11,9 (5,65–20,25) |
11,5 (5,65–20,25) |
11,6 |
11,8 |
|
HIF-1 α , Ед/мг белка в лунке |
10,2 (6,6–14,3) |
5,2 (4,4–10,8) |
8,0 (3,6–14,3) |
7,2 (3,7–11,3) |
10,5 |
11,3 |
|
VEGF, Ед/мг белка в лунке |
124,8* (101,5–186,2) |
90,2** (81,5–134,7) |
73,6 (55,5–140,0) |
76,4 (58,0–145,5) |
130,8 |
180,3 |
Примечание:* – различия значимы по сравнению с группой больных со стабилизацией (p<0,05); ** – различия значимы по сравнению с показателями больных до лечения (p<0,05).
исследование, в 1 (2 %) случае отмечена полная регрессия опухоли, в 23 (46,0 %) – зарегистрирована частичная регрессия (ЧР) первичной опухоли, в 24 (48,0 %) – стабилизация процесса, в 2 (4 %) случаях наблюдалось прогрессирование заболевания.
Был изучен экспрессионный профиль ростовых, транскрипционных факторов, активность протеасом и кальпаинов в зависимости от непосредственной эффективности НАХТ у больных мышечно-инвазивным раком мочевого пузыря (таблица). Установлено, что у пациентов с ЧР исходно наблюдался более высокий пороговый уровень ростовых и транскрипционных факторов по сравнению с больными, у которых зарегистрирована стабилизация процесса. Так, уровень ростового фактора VEGF до лечения у пациентов с частичной регрессией опухоли составил 124,8 (101,5–186,2) × 103Ед/мг белка, со стабилиза-
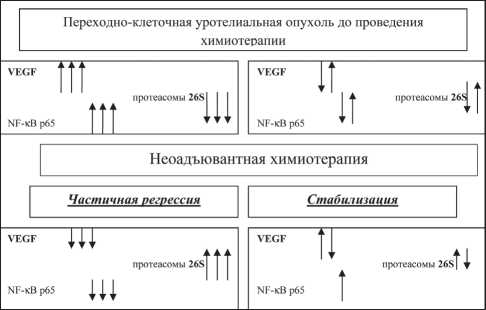
Рис. 1. Взаимосвязь ростовых транскрипторных факторов и протеасомной активности с эффективностью неоадъювантной химиотерапии цией процесса – 73,6 (55,5–140,0) × 103 Ед/мг белка (р<0,05). Аналогичная картина отмечена при определении уровня экспрессии NF-κB p65. У больных с частичной регрессией эти показатели составили 22,3 (16,0–42,9) × 103 Ед/мг белка, со стабилизацией – 12,6 (6,0–17,9) × 103 Ед/мг белка (р<0,05). При определении активности протеасом выявлены достоверные различия активности 26S протеа-сомного комплекса. Активность 26S протеасом у пациентов с ЧР была ниже, чем у больных со стабилизацией процесса – 15,6 против 17,7 × 103 Ед/мг белка (р<0,05).
Таким образом, до начала лечения пациенты имеют различный исходный уровень активности ростовых, транскрипционных факторов и активность протеасом. В случае высокой активности ростовых и транскрипционных факторов в сочетании с низкой активностью протеасом до начала лечения прогнозируется высокая эффективность химиотерапии. При изучении динамики вышеуказанных параметров (рис. 1) после завершения цитостатической терапии отмечено, что у пациентов с частичной регрессией опухоли регистрируется снижение активности ростовых и транскрипционных факторов на фоне возрастающей активности 26S протеасом.
В результате НАХТ у пациентов с частичной регрессией опухоли зарегистрировано снижение активности VEGF от 124,8 × 103 Ед/мг белка до 90,2 × 103Ед/мг белка (р<0,05). Активность NF-κB p65 также снижалась от 22,3 × 103 Ед/мг белка до 13,01 × 103 МЕ/мг белка (р<0,05) после лечения. Активность протеасом возрастала и составила 20,8 × 103 Ед/мг белка (р<0,05), что на 25 % выше по отношению к этому показателю до лечения. Сле- дует отметить, что активность ростовых и транскрипционных факторов у пациентов с частичной регрессией опухоли по окончании химиотерапии были выше исходных значений VEGF, NF-κB p65, определяемых у пациентов в группе со стабилизацией. Различия оказались не значимыми, но возможно, что выявленная тенденция позволит объяснить низкую эффективность НАХТ у группе больных со стабилизацией опухолевого процесса. Наиболее полно эффект химиотерапии реализуется на биологически более активных опухолях. В случаях низкой биологической активности опухолевой ткани действие цитостатиков менее эффективно
Список литературы Роль ростовых и транскрипционных факторов в оценке эффективности неоадъювантной химиотерапии у больных мышечно-инвазивным раком мочевого пузыря
- Тахауов Р.М., Чойнзонов Е.Л., Писарева Л.Ф., Карпов А.Б., Одинцова И.Н. Заболеваемость злокачественными новообразованиями населения Томской области. Здравоохранение Российской Федерации. 2003; 2: 30-32.
- Каприн А.Д., Старинский В.В., Петрова Г.В. Злокачественные новообразования в России в 2014 году. М., 2016; 236.
- Винтизенко С.И., Слонимская Е.М., Усынин Е.А., Юрмазов З.А., Хурсевич Н.А. Неоадъювантная химиотерапия в органосохранном лечении мышечно-инвазивного рака мочевого пузыря. Сибирский онкологический журнал. 2009; 2: 21-24.
- Волкова М.И., Матвеев В.Б., Медведев С.В., Носов Д.А., Фигурин К.М., Хмелевский Е.В., Черняев В.А. Клинические рекомендации по диагностике и лечению больных раком мочевого пузыря. М., 2014.
- Попов А.М., Карякин О.Б. Органосохраняющее лечение инвазивного рака мочевого пузыря. Российский онкологический журнал. 2005; 3: 49-52.


