Роль сахарного диабета в развитии поражения почек при COVID-19
Автор: Абдурахимов Абдухалим Холиддин, Шадманов Алишер Каюмович, Шагазатова Барно Хабибуллаевна, Хегай Любовь Николаевна
Журнал: Re-health journal @re-health
Рубрика: Нефрология
Статья в выпуске: 2 (14), 2022 года.
Бесплатный доступ
Настоящий обзор обобщает результаты отечественных и зарубежных клинических и экспериментальных исследований, посвященных ролю сахарного диабета в развитии поражения почек при COVID-19 и имеющихся в базах данных www.elibrary.ru, www.cyberleninka.ru, поисковой системе Google Scholar. Поиск проводился по ключевым словам: COVID-19, SARS-CoV-2, поражение почек, гипергликемия, сахарный диабет 2-го типа (СД2), диабетическая нефропатия, коморбидность.
COVID-19, SARS-CoV-2, поражение почек, гипергликемия, сахарный диабет 2-го типа (СД2), диабетическая нефропатия, коморбидность
Короткий адрес: https://sciup.org/14124677
IDR: 14124677
Текст научной статьи Роль сахарного диабета в развитии поражения почек при COVID-19
Настоящий обзор обобщает результаты отечественных и зарубежных клинических и экспериментальных исследований, посвященных ролю сахарного диабета в развитии поражения почек при COVID-19 и имеющихся в базах данных , , поисковой системе Google Scholar. Поиск проводился по ключевым словам: COVID-19, SARS-CoV-2, поражение почек, гипергликемия, сахарный диабет 2-го типа (СД2), диабетическая нефропатия, коморбидность.
Ushbu adabiyotlar sharhida , Google Scholar qidiruv tizimi bazalarida mavjud COVID-19 da buyrak zararlanishini rivojlanishida qandli diabetning roliga bag‘ishlangan mahalliy va xorijiy klinik va eksperimental tadqiqotlar natijalari sarhisob qilingan. Qidiruv COVID-19, SARS-CoV-2, buyrak kasalligi, giperglikemiya, 2-tur qandli diabet (QD 2-turi), diabetik nefropatiya va komorbidlik kabi kalit so'zlar bilan amalga oshirildi.
This review summarizes the results of domestic and foreign clinical and experimental studies on the role of diabetes mellitus in the development of kidney damage in COVID-19 and available in databases , , the Google Scholar search engine. The search was conducted by keywords: COVID-19, SARS-CoV-2, kidney damage, hyperglycemia, type 2 diabetes mellitus (DM2), diabetic nephropathy, comorbidity.
Коронавирусная болезнь 2019 (COVID-19) – это инфекционное острое респираторное заболевание, вызванное новым коронавирусом. Всемирная организация здравоохранения (ВОЗ) была проинформирована о случаях пневмонии неизвестной микробной этиологии, связанной с городом Ухань, провинция Хубэй, Китай, 31 декабря 2019 года. Позже ВОЗ объявила, что в образцах, взятых у этих пациентов, был обнаружен новый коронавирус. С тех пор эпидемия обострилась и быстро распространилась по всему миру, причем ВОЗ сначала объявила чрезвычайную ситуацию в области общественного здравоохранения, вызывающую международную озабоченность, 30 января 2020 года, а затем официально объявила ее пандемией 11 марта 2020 года [5, 32].
По данным Центра системных наук и инженерии Университета Джона Хопкинса (данные обновляются ежедневно), во всем мире зарегистрировано более 520 миллиона случаев COVID-19, из которых на сегодняшний день 6 262 580 смертей. В США самое большое количество зарегистрированных инфекций (82 421 624 случаев) и смертей в мире (999 518 случаев), Германия занимает первое место по количеству зарегистрированных случаев заболевания в последние 28 дней - 2 346 818 случаев инфицирования по состоянию 14.05.2022 (рис. 1) [33].
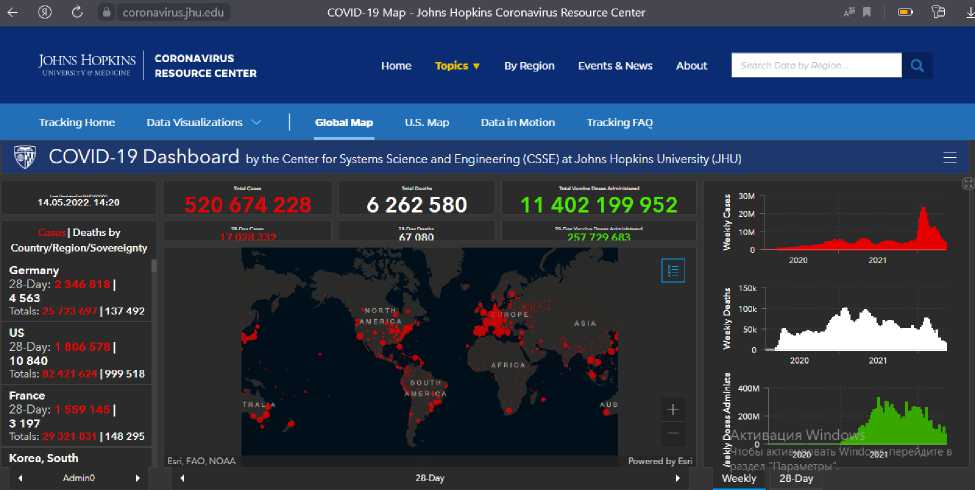
Рис. 1. Данные по заболеваемости и летальности от COVID-19 по всему миру (на 14.05.2022) [33].
Анализ существующих публикаций показал, что пожилые пациенты и пациенты с коморбидным фоном возглавляют группу риска при COVID-19, а риск смертности может достигать 20 % [5]. У таких пациентов приобретенный иммунный ответ может быть ослаблен и в большей степен и компенсироваться врожденным иммунным ответом, который ведет не только к элиминации вируса, но и к обширному тканевому повреждению за счет развития цитокинового шторма, сопровождающегося острым респираторным дистресс-синдромом. Случаи заражения COVID-19 чаще встречаются среди пациентов с отягощенным соматическим статусом: нарушенной работой сердечно-сосудистой системы и сахарным диабетом [8].
Частота тяжелого течения COVID-19.
Для определения степени тяжести COVID-19 использовалась классификация, представленная во «Клинический протокол лечения пациентов с новой коронавирусной инфекцией» (табл. 1) [1].
Таблица 1.
РАЗДЕЛЕНИЕ ПАЦИЕНТОВ ПО СТЕПЕНИ ТЯЖЕСТИ
|
Индикаторы |
Степень тяжести |
|||
|
Легкое течение |
Средне-тяжелое течение |
Тяжелое течение |
Крайне тяжелое течение |
|
|
Клиника |
Легкие катаральные явления (боль в горле, заложенность носа, малопродуктивный кашель), общая слабость, миалгия, изменение обоняния и вкуса, потоотделение |
Затрудненное дыхание и одышка при обычных (бытовых) нагрузках, малопродуктивный кашель, боль в грудной клетке, симптомы интоксикации (головная боль, недомогание, мышечные боли, снижение аппетита) |
Малопродуктивный кашель, затрудненное дыхание, одышка при незначительной нагрузке или в покое, симптомы интоксикации (головная боль, ломота во всем теле, бессонница, анорексия, тошнота, рвота); снижение уровня сознания и ажитация |
Острый респираторный дистресс-синдром ОДН с необходимостью респираторной поддержки (инвазивная вентиляция легких); септический шок; полиорганная недостаточность |
|
Температура |
<38,5 °С, эпизодические более 3 дней |
> 38,5 °С, более 4–5 дней |
повышение температуры тела (чаще фебрильная) |
стойкая фебрильная лихорадка |
|
ЧДД* |
< 22/мин |
≥ 22/мин |
> 24/мин |
≥ 30/мин |
|
ССС |
60–90 уд/м |
91–100 уд/м |
<120 уд/мин, аритмия |
> 120 уд/м, аритмия |
|
SрO2 * комнатным воздухом |
≥ 94% (≥95% у беременных) |
≤ 93% |
≤ 90% |
≤ 80% |
|
КТ (рентгенография) грудной клетки |
0- 5% |
<25% – 50% |
50%–75% |
>75% или ОРДС Увеличение объемапоражения 50% за 24–48 ч; гидроторакс |
|
КТ-0 /КТ-1 |
КТ-1 /КТ-2 |
КТ-3 /КТ-4 |
КТ-4 |
|
|
Наблю дение или лечение |
Амбулаторное наблюдение на дому. Мониторинг мобильными бригадами – при осложненном коморбидном** фоне и/или лиц старше 65 лет. |
Лечение в распределительном центре, COVID-стационаре лиц с изменениями на КТ или рентгенографии, COVID ПЦР (+) или ИФА IgM(+). – Если нет коморбидного фона и ЧДД < 22/мин, SрO2 ≥ 94%, КТ < 25% –мониторинг и лечение мобильной бригадой. |
Лечение в отделениях с респираторной поддержкой и наличием ОРИТ. |
Лечение в ОРИТ – нарушение сознания – SрO2 < 92% на фоне кислородотерапии – ЧДД > 35/мин. |
Примечание: *- показатели частоты дыхательных движений и SpO2 изменчивы при “Омикрон”; **- осложненный коморбидный фон - это наличие сопутствующих заболеваний и/или состояний: АГ, ХСН, онкологических заболеваний, гиперкоагуляции, ДВС-синдрома, ОКС,СД, цирроза печени, длительный прием стероидов и биологической терапии по поводу воспалительных заболеваний кишечника, ревматоидного артрита, получающие сеансы гемодиализа или перитонеальный диализ, наличие иммунодефицитных состояний, в том числе ВИЧ без антиретровирусной терапии, получающие химиотерапию; отсутствие условий для лечения на дому или гарантий выполнения рекомендаций (общежитие, учреждения социального обеспечения, пункт временного размещения, социально неблагополучная семья, неблагоприятные социально-бытовые условия).
По данным анализа более 70000 случаев COVID-19, зарегистрированных в Ухане, легкое течение инфекции было отмечено у 81% больных, тяжелое – у 14% и крайне тяжелое (дыхательная недостаточность, полиорганная недостаточность и/или септический шок) – у 5% [29]. В целом летальность пациентов с подтвержденной SARS-CoV-2 инфекцией составила 2,3%, однако она была значительно выше среди людей старческого возраста (8,0% в возрасте 70-79 лет и 14,8% в возрасте≥80 лет) и особенно среди больных, находившихся в критическом состоянии (49,0%). Более высокая летальность была также установлена при наличии сердечно-сосудистых заболеваний (10,5%), сахарного диабета (7,3%), хронических заболеваний легких (6,3%), артериальной гипертонии (6,0%) и злокачественных новообразований (5,6%). В Италии, которая относится к числу стран, в наибольшей степени пострадавших от COVID-19, летальность оказалась выше, чем в Китае, и составила 7,2% [23], что может объясняться более высокой долей людей старше 70 лет [24]. В Италии именно в этой возрастной группе наблюдалось более 85% зарегистрированных случаев смерти. C другой стороны, в некоторых странах, включая Россию, Германию и Южную Корею, регистрируется более низкая летальность больных с COVID-19 [21].
По данным мета-анализа 6 исследований (n=1558), независимыми факторами, ассоциировавшимися с тяжелым течением COVID-19, были артериальная гипертония (отношение шансов 2,29; p<0,001), сахарный диабет (2,47, р<0,001), хроническая обструктивная болезнь легких (5,97, р<0,001), сердечно-сосудистые болезни (2,93, р<0,001) и цереброваскулярная болезнь (3,89, р=0,002). Все эти исследования проводились в Китае и были относительно небольшими, в то время как данные о факторах риска развития тяжелой SARS-CoV-2 инфекции в других популяциях остаются ограниченными [6].
Степень поражения почек при COVID-19. Патофизиологические механизмы, приводящие к острому повреждению почек (ОПП), при инфекции COVID-19 не выяснены, но могут быть обусловлены воздействием на почечные канальцы и эндотелиальные клетки, которое происходит при цитокиновом шторме и, как следствие, повреждением микроциркуляторного русла в результате нарушений в системе свертываемости крови (рис. 2) [19, 25, 26].
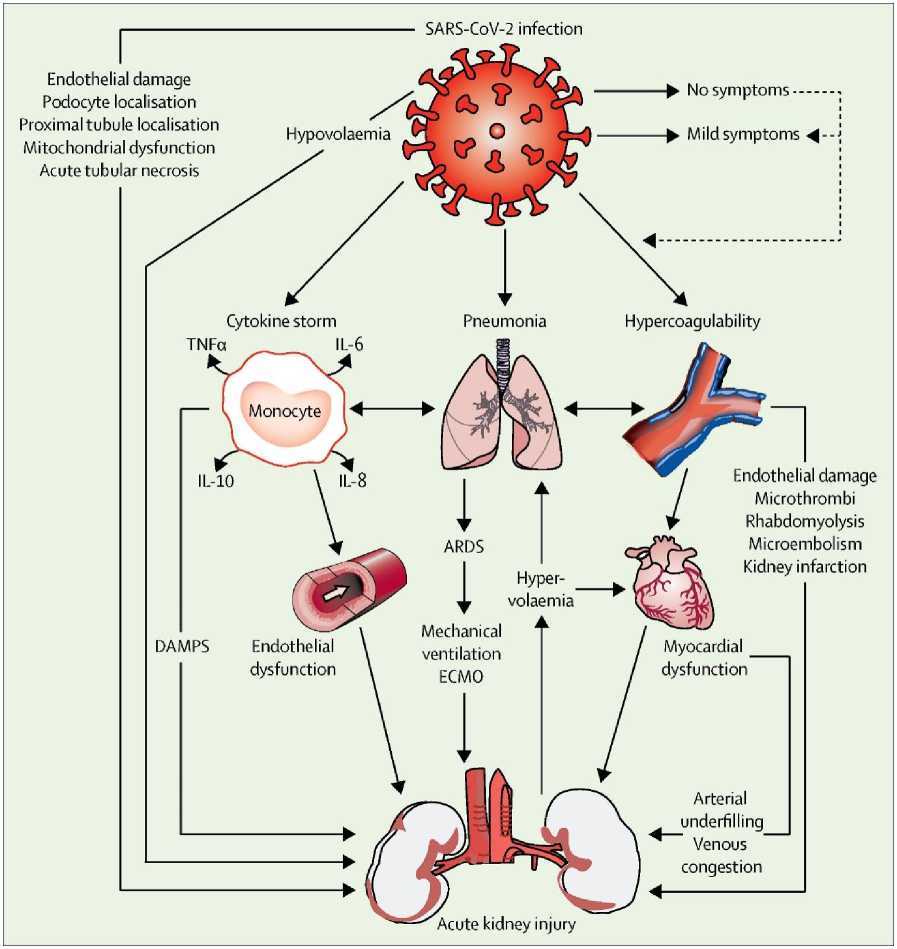
Рис. 2. Механизм поражения почек при COVID-19.
Основным проявлением повреждения почек при COVID-19 считается ОПП [12, 16, 30]. Высокая экспрессия АПФ2 в почках наблюдается в проксимальных канальцах и в меньшей степени в подоцитах. При этом в эндотелии клубочков и мезангии экспрессия АПФ2 минимальна. Этим объясняется преимущественное поражение канальцевого аппарата почек и развития ОПП по типу острого канальцевого некроза [12].
Клинико-морфологические ассоциации между патоморфологическими изменениями в легких и почках позволили выявить общие закономерности повреждения сосудистого русла с повышенным тромбообразованием и фибринолизом, что может быть связано не только с системными проявлениями ДВС-синдрома, но и являться самостоятельным повреждением почек при COVID-19. Острое повреждение почек ассоциируется с тяжестью повреждения легких, и его появление следует рассматривать в рамках полиорганной недостаточности. Отдельным механизмом повреждения почечной ткани при COVID-19 является «цитокиновый шторм», ассоциированный, в свою очередь, с вирусной нагрузкой. Накопление SARS-CoV-2 в почечных канальцах может служить вирусным резервуаром, а активация CD68+-макрофагов приводит к их инфильтрации в тубулоинтерстиции и усиливает отложение C5b-9 в канальцах [12, 31].
В Китае проведена оценка распространенности острого повреждения почек у пациентов с cOVId-19 и определена связь между маркерами дисфункции почек и смертью пациентов с cOVId-19. В проспективное когортное исследование вошел 701 пациент с cOVId-19, 113 (16,1%) из которых умерли в стационаре. При поступлении у 43,9% пациентов была протеинурия и у 26,7% – гематурия. Повышенный креатинин сыворотки крови, азотемия и расчетная клубочковая фильтрация ниже 60 мл/мин/1,73 м2 выявлены у 14,4, 13,1 и 13,1% пациентов соответственно. Острая почечная недостаточность развилась у 5,1% пациентов [16].
Были проанализированы данные аутопсий 37 пациентов с подтвержденным диагнозом COVID-19 в возрасте от 28 до 94 лет, у 35 из них обнаружена гиперкреатининемия (в среднем – 275 мкмоль/мл) [11]. У всех умерших пациентов преобладал воспалительный процесс в легких, сопровождавшийся микроангиопатией с тромбозом сосудов и кровоизлияниями, в ткани почек также выявлена ангиопатия. У всех пациентов отмечались признаки острого поражения канальцев почки разной степени выраженности, начиная от нарушения щеточной каемки, заканчивая фокусами некроза проксимальных канальцев. Авторы предполагают, что острое повреждение канальцев почки при COVID-19 имеет многофакторную природу – как результат гипоксии и недостаточности правого желудочка вследствие пневмонии, так и за счет снижения сердечного выброса вследствие дисфункции левого желудочка и, соответственно, гипоперфузии почек [10] и при этом не исключено и непосредственное воздействие SArS-coV-2 на эндотелиальные клетки [26].
Также SArS-coV-2 может вызывать митохондриальную дисфункцию, острый тубулонекроз, формирование вакуолей из-за резорбции протеина, коллапсную гломерулопатию [27] и выход плазмы в капсулу Боумена–Шумлянского. Другой потенциальный механизм острого повреждения канальцев почки связан с SArS-coV-2-ассоциированным иммунным ответом – цитокиновым штормом. В качестве возможных причин повреждения почек авторы указывают также рабдомиолиз, синдром активации макрофагов, микротромбоз и микроэмболия вследствие гиперкоагуляции и эндотелиита.
Связь COVID-19 с развитием сахарного диабета. Одной из первых опубликованных работ, посвященных оценке взаимосвязи коронавируса SARS и углеводного обмена, является исследование, проведенное в Китае в 2009 г. В проспективное наблюдение были включены 39 пациентов без СД и терапии стероидными препаратами в анамнезе, госпитализированных по поводу лабораторно подтвержденной коронавирусной пневмонии. У 20 из этих 39 пациентов (51%) отмечалась гипергликемия, сохраняющаяся на протяжении нескольких дней. Уровень гликемии нормализовался к окончанию госпитализации у всех пациентов. Повторная оценка состояния углеводного обмена у этих пациентов была проведена через 3 года. СД был установлен лишь у 2 из 39 человек (5%), что подтверждает транзиторный характер гликемии, развившейся на фоне коронавирусной инфекции, т.е. СГ. Проводилось иммуногистохимическое исследование биоптатов легких, сердца, почек и поджелудочной железы 42-летнего пациента, умершего от коронавирусной пневмонии, при этом экспрессия АПФ2 отмечалась во всех исследуемых органах, в том числе и в поджелудочной железе. Причем уровень экспрессии АПФ-2 в клетках эндокринной части был выше, чем в экзокринной. Учитывая единый механизм внедрения вирусов SARS, можно предположить возможность возникновения гипергликемии и при COVID-19 [10].
Было показано, что острая гипергликемия усиливает экспрессию AПФ2 в клетках, что может способствовать проникновению вирусных клеток. Однако хроническая гипергликемия, как уже отмечено, снижает экспрессию AПФ2, делая клетки уязвимыми к воспалительному и повреждающему действию вируса. Взаимодействие между COVID-19 и СД может иметь двунаправленный характер. Как было отмечено выше, SARS-CoV-2 проникает в клетки человека через АПФ2. АПФ2 широко экспрессируется в печени и поджелудочной железе, а его дефицит играет роль в развитии инсулинорезистентности и нарушении секреции инсулина. После эндоцитоза вирусного комплекса экспрессия АПФ2 снижается, что приводит к двум типам последствий. Во-первых, попадание SARS-CoV-2 в островковые клетки поджелудочной железы может непосредственно усугубить повреждение бета-клеток. Во-вторых, подавление АПФ2 после проникновения вируса может привести к продукции ангиотензина II без противодействия, что ухудшает секрецию инсулина. Эти данные предполагают, что инфекция может вызвать развитие СД или, как минимум, тяжелой стресс-гипергликемии. Факт, что инфекция COVID-19 вызывает гипергликемию у людей без ранее существовавшего СД, уже зарегистрирован некоторыми исследователями [2].
Хроническое воспаление, повышенная коагуляционная активность, нарушение иммунного ответа и потенциальное прямое повреждение поджелудочной железы SARS-CoV-2 могут быть одними из основных механизмов ассоциации между СД и COVID-19. Доля больных СД среди заболевших COVID-19 колеблется от 16,2% в Китае до 25% в РФ [6].
Одни из исследователей изучали влияние сахарного диабета на прогрессирование и прогноз больных COVID‐19. В ограниченной выборке было обнаружено, что сывороточные уровни связанных с воспалением биомаркеров, таких как IL‐6, С‐реактивный белок, сывороточный ферритин и индекс свертывания крови, а также D‐димер были значительно выше у пациентов с сахарным диабетом по сравнению с теми, у кого их не было, что указывает на то, что пациенты с диабетом предрасположены к гипервоспалительному состоянию, которое в конечном итоге приводит к быстрому ухудшению инфекции. Среди пациентов с сахарным диабетом 29,2% находились на инсулинотерапии и увеличивали дозу инсулина после поступления, тогда как 37,5% находились на пероральной противодиабетической терапии до поступления и начинали инсулинотерапию после поступления. Это означает, что пациенты имели плохой гликемический контроль во время госпитализации [18].
Российские исследователи нашли закономерность, что высокая гипергликемия у больных с инфекцией SARS-CoV-2 и сахарным диабетом ассоциируется со снижением сатурации О2, большей выраженностью дыхательной недостаточности и тяжелым течением пневмонии. При поступлении в стационар пациентов с COVID‐19 и СД была замечена обратная зависимость между уровнем насыщения кислородом крови и гипергликемии. Чем выше была гипергликемия, тем ниже уровень сатурации О2 [3].
Роль метаболического синдрома в течении COVID-19. Установлено, что более 80% больных СД2 страдают избыточным весом и ожирением [17].
Пациенты с ожирением имеют хронически более высокие концентрации лептина (провоспалительный адипокин) и более низкие концентрации адипонектина (противовоспалительный адипокин). Эта неблагоприятная гормональная среда также приводит к нарушению регуляции иммунного ответа. Пациенты с ожирением и СД имеют более высокую концентрацию ряда провоспалительных цитокинов, таких как фактор некроза опухоли альфа (ФНО альфа), моноцитарный хемотаксический фактор 1 (MCP-1) и интерлейкин 6 (ИЛ-6), в основном вырабатываемых висцеральной и подкожной жировой тканью. Было показано, что ожирение ослабляет адаптивные иммунные реакции на вирус гриппа, и нарушение регуляции провоспалительного ответа способствовало тяжелым поражениям легких, наблюдаемым у пострадавших во время пандемии гриппа. Вероятно, в случае COVID-19 это тоже имеет место. Наличие ожирения у пациента с СД 2-го типа может увеличить риск тромбоэмболических осложнений. Развитие диссеминированного внутрисосудистого свертывания крови и высокая частота венозных тромбоэмболий сопровождают тяжелые формы COVID-19 с более высокой частотой у пациентов с индексом массы тела (ИМТ) ˃ 35 кг/м2. Ожирение также затрагивает функцию легких, уменьшая объем форсированного выдоха и жизненную емкость легких. Вместе эти кардиометаболические, тромботические и кардиореспираторные последствия ожирения при СД 2-го типа приводят к ослаблению метаболического ответа и увеличению тяжести течения COVID-19. Во французском исследовании риск искусственной вентиляции легких у пациентов с инфекцией COVID-19, поступивших на интенсивное лечение, был более чем в семь раз выше у людей с ИМТ > 35 кг/м2 по сравнению с пациентами с ИМТ < 25 кг/м2 [2].
Аналогичная ситуация отмечена во Франции, где люди с ожирением составляли 47,6% от всех госпитализированных с диагнозом COVID-19, что в 2 раза превышает показатели официальной распространенности ожирения во Франции - 21,6%. Из них 14,5% имели морбидное ожирение (ИМТ> 40 кг/м2). При этом у лиц с ИМТ >35 кг/м2 потребность в переводе пациентов на искусственную вентиляцию легких возрастала в 1,6 раза независимо от возраста, наличия артериальной гипертензии и СД. Таким образом, наличие ожирения у больных СД2 является дополнительным независимым фактором риска тяжелого течения COVID-19 [15].
Роль почек в поддержании гомеостаза глюкозы в крови. Поддержание гомеостаза глюкозы требует сложного взаимодействия ряда органов и систем организма: слаженной работы печени, поджелудочной железы, мышечной и жировой ткани, нейроэндокринной системы, что в физиологических условиях обеспечивает низкую вариабельность гликемии в течение суток. Уровень глюкозы в крови у здорового человека колеблется от 3,0 ммоль/л после физических нагрузок до 9,9 ммоль/л в период пищеварения [13].
Основная функция почек в гомеостазе глюкозы отводилась регуляции метаболизма молекул инсулина. Известно, что почки инактивируют 30—40% молекул инсулина, что составляет 6—8 ЕД/сут. Клиренс инсулина почками осуществляется с помощью двух основных механизмов. Первый включает клубочковую фильтрацию молекул инсулина с последующей реабсорбцией их из просвета проксимального отдела нефрона внутрь эпителиоцита. Данный процесс протекает посредством эндоцитоза. Второй механизм не связан с клубочковой фильтрацией. Он включает диффузию молекул инсулина из просвета перитубулярных капилляров, связывание их с базолатеральной мембраной и поступление в эпителиальные клетки. Внутри эпителиоцитов молекулы инсулина подвергаются деградации с помощью лизосомальных ферментов, инсулиновой протеазы и глютатион-инсулинтрансгидрогеназы. Нарушение функции почек увеличивает период полураспада инсулина, поэтому при почечной недостаточность потребность в инсулине у больных сахарным диабетом (СД) снижается. В почках в процессе глюконеогенеза происходит синтез молекул глюкозы, а также поглощение молекул глюкозы из крови для обеспечения энергетических потребностей самой почечной ткани; однако наиболее важная функция почек в гомеостазе глюкозы заключается в реабсорбции молекул глюкозы из клубочкового ультрафильтрата (рис. 3) [13].
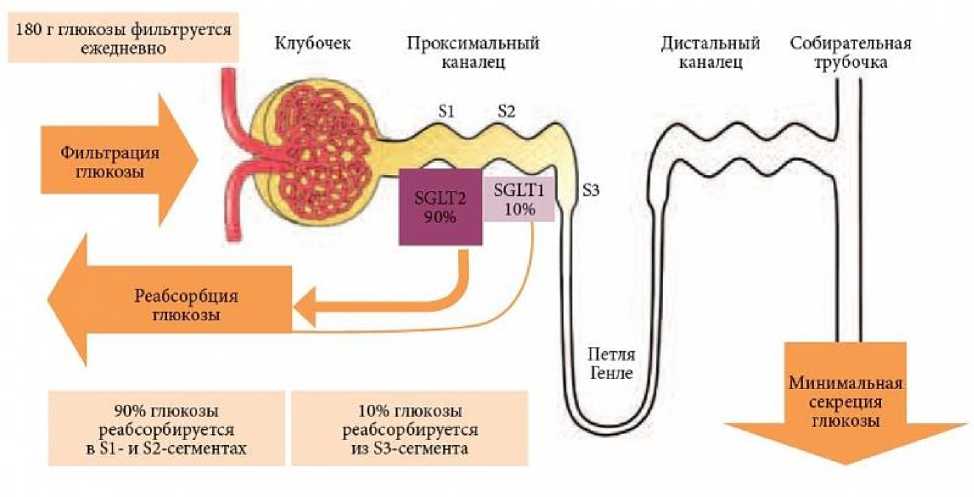
Рис. 3. Роль почек в поддержании гомеостаза глюкозы в крови.
Механизм развития диабетической нефропатии (ДН). Возможные механизмы усугубления диабетической нефропатии при тяжелом течении COVID-19. В патогенезе диабетической нефропатии принимают участие многие факторы, в том числе метаболические (гипергликемия, неферментативное гликозилирование, полиоловый путь окисления глюкозы, оксидативный стресс и др.), гемодинамические (артериальная гипертензия, клубочковая гиперфильтрация, повышение уровня вазоактивных гормонов), генетические (полиморфизм генов АПФ; I/D), экзогенные (потребление белка, курение). Все эти факторы приводят к активации внутриклеточных сигнальных путей, усилению секреции факторов роста и провоспалительных медиаторов и далее – к разрастанию внеклеточного матрикса, повышению сосудистой проницаемости, появлению протеинурии (рис. 4).
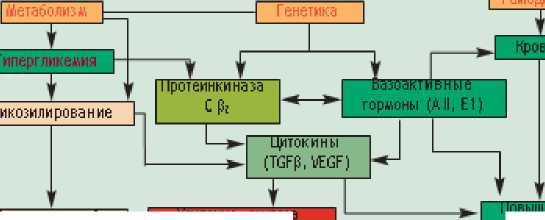
Усиление синтеза внеклеточного матрикса
Внеклеточный ~ матрикс, т перекрестные связи
мика
ление
сосудистой проницаемости

Накопление матрикса
Рис. 4. Патогенез диабетической нефропатии
Известно, что гипергликемия вызывает дилатацию афферентных артериол почечных клубочков, их гиперперфузию и повышение СКФ посредством таких механизмов, как усиление синтеза гормона роста, инсулиноподобного фактора роста, глюкагона, простагландинов, оксида азота. Помимо перечисленных факторов, к повышению СКФ приводят усиление синтеза сорбитола, увеличение внеклеточного объема жидкости с повышением секреции предсердного натрийуретического пептида, глюкозурия, снижение уровня инсулина и другие механизмы, которые также являются следствием гипергликемии. Важную роль в патогенезе ДН играет активация внутрипочечной ренин-ангиотензиновой системы (РАС). Гипергликемия активирует эту систему (путем активации протеинкиназы
С, изоформы
β2), что является одним из важнейших механизмов повреждения микроциркуляторного русла почек и формирования ДН (рис. 5). A Normal В Diabetes
Afferent vasodilation:
-
• Hyperglycemia
-
• High blood amino acid levels
-
• Low NaCI delivery to macula densa
Bowman’s capsule
Proximal convoluted tubule -
Increased NaCI filtration and glucose filtration
Decreased Vasoconstricted feedback
Efferent vasoconstriction:
• High local angiotensin
II level
Tubuloglomerular feedback
Efferent
arteriole
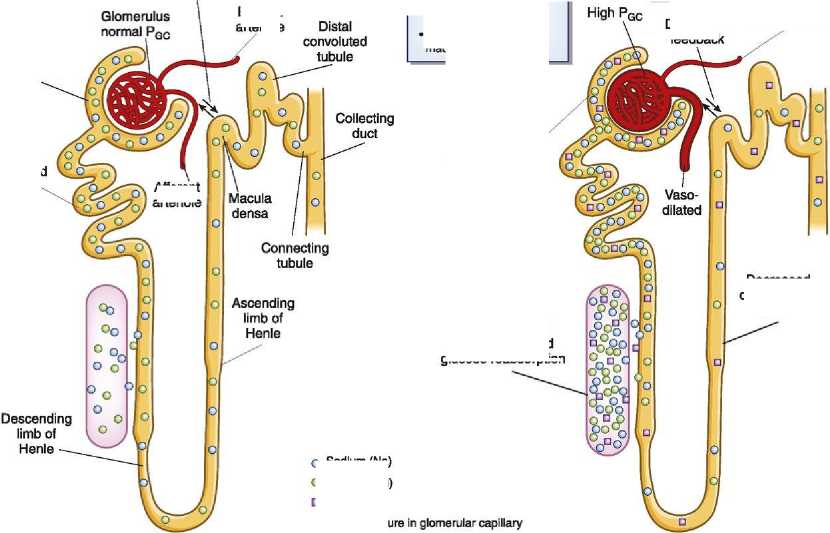
Decreased distal delivery of NaCI
O Sodium (Na)
O Chloride (Cl) □ Glucose
Pgc-
Afferent arteriole
Increased NaCI reabsorption and glucose reabsorption
Рис. 5. Функциональное состояние нефрона в норме и при СД.
Гипергликемия запускает не только гемодинамическое, но и метаболическое звено патогенеза ДН, связанное с процессами неферментативного гликозилирования белков, липидов, нуклеиновых кислот и также приводящее к накоплению внеклеточного матрикса и нефрофиброзу. Конечные продукты гликозилирования вызывают не только изменение структуры и свойств внеклеточного матрикса, но и усиление продукции провоспалительных цитокинов, развитие оксидативного стресса, нарушение метаболизма клеток. Помимо неферментативного гликозилирования, в патогенезе ДН выделяют полиоловый путь метаболизма глюкозы. В тканях, в которых поглощение глюкозы не зависит от инсулина (хрусталик, сетчатка, периферическая нервная система, почки), избыток глюкозы индуцирует внутриклеточное образование полиолов, в частности сорбитола, и фруктозы. Это сопровождается повышением осмолярности цитоплазмы клеток, снижением уровня свободного миоинозитола, потерей Na+/K+АТФазной активности, снижением клеточного окислительно-восстановительного потенциала.
Клиникоморфологическими последствиями таких изменений являются повышенная продукция мезангиального матрикса, изменение структуры и функции гломерулярной базальной мембраны, ее утолщение, альбуминурия, перифериическая нейропатия, диабетическая катаракта [11].
Список литературы Роль сахарного диабета в развитии поражения почек при COVID-19
- Акилов Х.А. и др. Клинический протокол лечения пациентов с новой коронавирусной инфекцией. Версия №9 (16.01.2022). Министерство здравоохранения РУз; 2022 г.
- Бабенко А. Ю., Лаевская М. Ю. Сахарный диабет и COVID-19. Как они связаны? Современные стратегии борьбы //Артериальная гипертензия. – 2020. – Т. 26. – №. 3. – С.304-311.
- Беликина Д. В. и др. COVID-19 при сопутствующем сахарном диабете: особенности клинического течения, метаболизма, воспалительных и коагуляционных нарушений//Современные технологии в медицине. – 2020. – Т. 12. – №. 5. – С. 6-18.
- Белялов Ф. И. Проблема коморбидности при заболеваниях внутренних органов//Вестник современной клинической медицины. – 2010. – Т. 3. – №. 2. – С. 44-47.
- Васильев А. О. и др. ОРГАНИЗАЦИЯ ОКАЗАНИЯ МЕДИЦИНСКОЙ ПОМОЩИ ПОЖИЛЫМ ПАЦИЕНТАМ В УСЛОВИЯХ ПАНДЕМИИ COVID-19: ОБЗОР СУЩЕСТВУЮЩЕЙ ПРАКТИКИ //Проблемы социальной гигиены, здравоохранения и истории медицины. – 2020. – Т. 28. – №. S2. – С. 1081-1086.
- Глыбочко П. В. и др. Клиническая характеристика 1007 больных тяжелой SARS-CoV-2 пневмонией, нуждавшихся в респираторной поддержке //Клиническая фармакология и терапия. – 2020. – Т. 29. – №. 2. – С. 21-29.
- Грачева Т. В., Левчик Е. Ю. Качество жизни пациентов в отдалённые сроки после хирургического лечения осложнённых форм синдрома диабетической стопы //Вестник хирургии имени ИИ Грекова. – 2010. – Т. 169. – №. 3. – С. 29-33.
- Елсукова О. С., Никитина Е. А., Журавлева О. Л. Изучение коморбидной патологии у пациентов с Сахарным диабетом 2 типа //Современная медицина: актуальные вопросы. – 2014. – №. 31.
- Зубарев, П.Н., Ивануса, С.Я., Рисман, Б.В., Минаков О.Е., Андреев А.А., Остроушко А.П. Синдром диабетической стопы. // Вестник экспериментальной и клинической хирургии. – 2017. -№10(2). – с. 165-72.
- Ковылина М. В. и др. Острое повреждение почек при COVID-19: клинико-морфологические сопоставления на основании данных аутопсийных исследований//Урология. – 2020. – №. 6. – С. 5-10.
- Колесник А. Почки и диабет: от понимания проблемы к своевременной и адекватной терапии //Диагностика и лечение. – 2009. – Т. 15. – С. 29.
- Литвинов А. С. и др. Клинико-морфологические параллели повреждения легких и почек при COVID-19 //Нефрология. – 2020. – Т. 24. – №. 5. – С. 97-107.
- Мкртумян А. М., Маркова Т. Н., Мищенко Н. К. Роль почек в гомеостазе глюкозы//Проблемы эндокринологии. – 2017. – Т. 63. – №. 6. – С. 385-391.
- Синдром диабетической стопы: классификация, диагностика, основные принципы лечения / И.К. Клецкова, Я.Л. Навменова, Н.В. Холупко, Е.Н.Ващенко – Гомель: ГУ «РНПЦ РМ и ЭЧ», 2019.– 16 с.
- Шестакова М. В., Мокрышева Н. Г., Дедов И. И. Сахарный диабет в условиях вирусной пандемии COVID-19: особенности течения и лечения //Сахарный диабет. – 2020. – Т. 23. – №. 2. – С. 132-139.
- Cheng Y. et al. Kidney disease is associated with in-hospital death of patients with COVID-19 //Kidney international. – 2020. – Т. 97. – №. 5. – С. 829-838.
- Daousi C. et al. Prevalence of obesity in type 2 diabetes in secondary care: association with cardiovascular risk factors //Postgraduate medical journal. – 2006. – Т. 82. – №. 966. – С. 280-284.
- Guo W. et al. Diabetes is a risk factor for the progression and prognosis of COVID‐19//Diabetes/metabolism research and reviews. – 2020. – Т. 36. – №. 7. – С. e3319.
- Joannidis M. et al. Lung–kidney interactions in critically ill patients: consensus report of the Acute Disease Quality Initiative (ADQI) 21 Workgroup //Intensive care medicine. – 2020. – Т.46. – №. 4. – С. 654-672.
- Kovylina M. V. et al. Acute kidney injury in COVID-19: Clinical and morphological comparisons based on autopsy data //Urologiia (Moscow, Russia: 1999). – 2020. – №. 6. – С. 5-10.
- Lazzerini M., Putoto G. COVID-19 in Italy: momentous decisions and many uncertainties//The Lancet Global Health. – 2020. – Т. 8. – №. 5. – С. e641-e642.
- Li Z. et al. Caution on kidney dysfunctions of COVID-19 patients. – 2020.
- Livingston E., Bucher K. Coronavirus disease 2019 (COVID-19) in Italy //Jama. – 2020. – Т. 323. – №. 14. – С. 1335-1335.
- Onder G., Rezza G., Brusaferro S. Case-fatality rate and characteristics of patients dying in relation to COVID-19 in Italy //Jama. – 2020. – Т. 323. – №. 18. – С. 1775-1776.
- Ronco C., Reis T. Kidney involvement in COVID-19 and rationale for extracorporeal therapies //Nature Reviews Nephrology. – 2020. – Т. 16. – №. 6. – С. 308-310.
- Su H. et al. Renal histopathological analysis of 26 postmortem findings of patients with COVID-19 in China //Kidney international. – 2020. – Т. 98. – №. 1. – С. 219-227.
- Varga Z. et al. Endothelial cell infection and endotheliitis in COVID-19 //The Lancet. – 2020. – Т. 395. – №. 10234. – С. 1417-1418.
- Wang L. et al. Coronavirus disease 19 infection does not result in acute kidney injury: an analysis of 116 hospitalized patients from Wuhan, China //American journal of nephrology. – 2020. – Т. 51. – №. 5. – С. 343-348.
- Wu Z., McGoogan J. M. Characteristics of and important lessons from the coronavirus disease 2019 (COVID-19) outbreak in China: summary of a report of 72 314 cases from the Chinese Center for Disease Control and Prevention //jama. – 2020. – Т. 323. – №. 13. – С. 1239-1242.
- Yao X. H. et al. A pathological report of three COVID-19 cases by minimal invasive autopsies//Zhonghua bing li xue za zhi= Chinese journal of pathology. – 2020. – Т. 49. – №. 5. – С. 411-417.
- Ye M. et al. Glomerular localization and expression of angiotensin-converting enzyme 2 and angiotensin-converting enzyme: implications for albuminuria in diabetes //Journal of the American Society of Nephrology. – 2006. – Т. 17. – №. 11. – С. 3067-3075.
- https://bestpractice.bmj.com/topics/en-gb/3000201
- https://coronavirus.jhu.edu/map.html


