Роль сиртуина 1 в регуляции клеток меланомы
Автор: Дубовцева Ирина Юрьевна, Аксененко Мария Борисовна, Рукша Татьяна Геннадьевна
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 6 т.18, 2019 года.
Бесплатный доступ
Меланома кожи остается одним из самых опасных злокачественных новообразований среди населения со светлым типом кожи. Поиск новых эффективных способов лечения, включая терапию, основанную на выборе молекулярных мишеней, - одна из основных и сложных задач в изучении меланомы. Среди направлений экспериментальной онкологии выделяется исследование роли микроРНК, которые участвуют во многих физиологических и патологических процессах на эпигенетическом уровне. Ранее было выявлено, что уровень miR-204-5p снижается в злокачественных новообразованиях, в частности при меланоме кожи. Основной целью данной работы было определение функциональной роли гена-мишени miR-204-5p SIRT1 в патогенезе меланомы кожи. По итогам бионформатического анализа были идентифицированы гены-мишени данной микроРНК, влияющие на апоптоз, пролиферацию и жизнеспособность клеток. Оценка уровня пролиферации клеток меланомы под воздействием малых интерферирующих РНК осуществлялась при помощи MTT-теста и флуоресцентной микроскопии. Определение относительной активности люциферазы проводилось с использованием нуклеотидной последовательности ДНК 3'-некодирующей области гена SIRT1 и синтетического аналога miR-204-5p in vitro. Результаты двойного люциферазного теста показали, что miR-204-5p подавляет экспрессию SIRT1 посредством связывания с его 3'-некодирующей областью. Пролиферативная активность клеток меланомы снижалась через 48 ч в клетках меланомы после осуществления селективного нокдауна SIRT1. Результаты флуоресцентной микроскопии показали однонаправленную тенденцию с результатами МТТ-теста. МикроРНК miR-204-5p может регулировать пролиферацию клеток меланомы посредством воздействия на SIRT 1, который, в свою очередь, воздействует на активность процессов внутриклеточной сигнализации, имеющих отношение к динамике клеточного цикла.
Меланома, микрорнк, сиртуин 1, гены-мишени, апоптоз
Короткий адрес: https://sciup.org/140254308
IDR: 140254308 | УДК: 616.5-006.81.04:576.5 | DOI: 10.21294/1814-4861-2019-18-6-82-89
Текст научной статьи Роль сиртуина 1 в регуляции клеток меланомы
Меланома кожи (МК) – злокачественная опухоль нейроэктодермального происхождения, которая является самым опасным злокачественным новообразованием кожи, встречающимся среди населения со светлым типом кожи [1, 2]. Воздействие ультрафиолетового излучения, в том числе и кратковременное, и присутствие специфических фенотипических характеристик – светлый цвет кожи, светлые или рыжие волосы, веснушки, более 10 диспластических невусов, а также более 100 обычных приобретенных меланоцитарных невусов – являются установленными факторами риска для развития меланомы кожи [3–6]. Во всем мире на протяжении последних лет наблюдается рост уровня заболеваемости меланомой среди лиц со светлым типом кожи [7]. Лечение меланомы на ранних стадиях в большинстве случаев проходит успешно, однако при диссеминированной МК результаты терапии неудовлетворительные [8]. Поиск новых терапевтических направлений, в том числе на основе выбора молекулярных мишеней при лечении МК, является одной из ключевых задач современной онкологии.
Одной из тенденций экспериментальной онкологии является изучение некодирующих РНК. МикроРНК – эндогенные одноцепочечные молекулы РНК длиной около 22 нуклеотидов. МикроРНК играют важную роль в регуляции многих физиологических и патологических процессов [9]. Анализ экспрессии микроРНК при различных злокачественных новообразованиях человека предполагает использовать их в качестве потенциальных биомаркеров опухоли [10]. Традиционно считается, что микроРНК негативно регулируют экспрессию генов посредством связывания с 3’ нетранслируемым регионом целевой мРНК, приводя к деградации или репрессии трансляции данной мРНК [11]. МикроРНК miR-204-5p относится к одной из минимально экспрессируемых микроРНК в клетках меланомы по сравнению с меланоцитарными невусами [12]. Показано, что восстановление уровня miR-204-5p в опухолевых клетках приводит к изменению выраженности их пролиферации, миграции и инвазии [13]. Помимо этого, определено, что эктопическая экспрессия miR-204-5p в клетках меланомы вызывает потерю резистентности к вемурафенибу, а также изменяет уровни компонентов сигнального каскада МАРК, принимающего ключевое участие в регуляции пролиферации клеток меланомы [14].
Целью исследования являлось определение функциональной роли гена-мишени miR-204-5p сиртуина 1 (SIRT1) в патогенезе меланомы.
Материал и методы
Эксперименты проводились на клеточных линиях меланомы человека BRO. Клеточная линия меланомы BRO была предоставлена ФГБНУ «НИИ фундаментальной и клинической иммунологии» (г. Новосибирск, Россия). Клетки культивировали в среде RPMI-1640 с L-глутамином (Gibco, Life Technologies, Пейсли, Великобритания) с 10 % фетальной бычьей сывороткой (FBS; Gibco; Thermo Fisher Scientific, Inc., Нью-Йорк, США) при 37 °C и 5 % CO2 в CO2-инкубаторе Sanyo MSO-5AC (Sanyo MSO-5AC; Sanyo Electric Co., Ltd., Осака, Япония).
Поиск и анализ генов-мишеней для miR-204-5p осуществлен с помощью четырех независимых баз данных: TargetScan (версия 7.0; http://www. , miRDB (версия 5.0; miRDB), miRTarBase (версия 4.5; http://mirtarbase. , miRWalk 2.0 . На следующем этапе выбирались гены-мишени miR-204-5p, которые были общими для всех вышеперечисленных баз данных. Далее были выделены гены-мишени, TargetScore которых в базе miRDB был 80 и выше. После этого выбраны гены-мишени, функциональная роль которых была ассоциирована с регуляцией процесса клеточной пролиферации. Для характеристики молекулярных и биологических различий был проведен анализ генных онтологий (биологических процессов и молекулярных функции) при помощи системы PANTHER v10.0. (www. . В анализ включены онтологии со статистической значимостью p<0,05.
На первом этапе осуществлялись дизайн и подбор последовательности малых интерферирующих РНК, а также выбор скрамблированных последовательностей при помощи программы siDirect 2 [15]. После анализа программой выдавалось несколько последовательностей малых интерферирующих РНК, из которых выбиралась одна, соответствующая следующим требованиям: длина последовательности – 20–25 нуклеотидов, содержание G/C нуклеотидов 35– 55 %, на 3’ каждой из цепей добавлялся неспаренный дезоксидинуклеотид dTdT (для увеличения стабильности дуплекса и эффективности загрузки siРНК в комплексе с RISC), при анализе последовательности siРНК с помощью системы BLAST не обнаруживались транскрипты других генов, полностью комплементарные последовательности выбранных siРНК, отобранные последовательности не должны были содержать нуклеотидных повторов, а также более 3 одинаковых нуклеотидов подряд.
Для оценки специфичности нокдауна и вызываемых ими побочных изменений в клетке применялся отрицательный контроль. При этом использовались скрамблированные siРНК, которые имели тот же нуклеотидный состав, что и целевые siРНК, но другую нуклеотидную последовательность. Малые интерферирующие РНК были подобраны при помощи программы Wizard Software v.3.1. (Invitrogen, Thermo Fisher Scientific, Юджин, США). Синтез siРНК и их скрамблированных последовательностей осуществлялся компанией ООО «Синтол» (г. Москва, Россия).
Трансфекция siРНК в клетки меланомы линии BRO осуществлялась при достижении клетками 70 % конфлюэнтности с помощью Lipofectamine 3000 (Thermo Fisher Scientific, Inc, Карлсбад, США).
Оценка пролиферации/жизнеспособности клеток меланомы осуществлялась на основе МТТ-теста. Для этого клетки меланомы культивировали в 24-луночном планшете без каких-либо вмешательств 24 ч. По достижении клеточной концентрации 3×106 в 500 мкл питательной среды RPMI-1640 с L-глутамином (Gibco, Life Technologies, Пейсли, Великобритания) и 10 % фетальной бычьей сывороткой (FBS; Gibco; Thermo Fisher Scientific, Inc., Нью-Йорк, США) была заменена питательная среда и клетки трансфецировались малыми интерферирующими РНК к SIRT 1. Трансфекция проводилась при помощи Lipofectamine 3000 (Thermo Fisher Scientific, Inc, Карлсбад, США) с малыми интерферирующими смысловыми, антисмысловыми, скрамблированными РНК к SIRT 1 согласно инструкции производителя. По истечении 24 ч трансфекции из лунок удалялась питательная среда, клетки промывались фосфатно-буферным раствором (Phosphate Buffered Saline, VWR International, LL AMRESCO, Солон, США), трипсинизи-ровались с использованием Trypsin-EDTA (Gibco; Thermo Fisher Scientific, Пейсли, Великобритания) и рассеивались в 96-луночный планшет в концентрации 1×104 клеток в 1 мл по 100 мкл в лунку. После клетки инкубировались еще в течение 24 ч при 37 °C в 5 % CO2 в CO2-инкубаторe (Sanyo MSO-5AC; Sanyo Electric Co., Ltd., Осака, Япония).
В дальнейшем питательная среда удалялась, в каждую лунку добавлялся раствор 3-(4,5-диметил-2-тиазолил)-2,5-дифенил-2H-тетразолия бромида (МТТ) (Invitrogen, Thermo Fisher Scientific, Юджин, США) в концентрации 5 мг/мл, в соотношении 15 мкл раствора МТТ и 135 мкл питательной среды. Клетки с раствором МТТ инкубировались 4 ч при 37 °С с 5 % содержанием CO2 в CO2-инкубаторе. По интенсивности накопления формазана, который имеет фиолетовую окраску, оценивалась метаболическая активность клеток в лунках через 24, 48 и 72 ч после трансфекции. Измерения проводили на спектрофотометре Efos-9305 (Shvabe Photosystems, г. Москва, Россия) на длине волны 560 нм. Отрицательным контролем являлась культура клеток меланомы без воздействия малых интерферирующих РНК. Негативным контролем являлись клетки, трансфецированные со скрамблированными малыми интерферирующими РНК. Эксперимент проводили в трех технологических повторах.
Для проведения флуоресцентной микроскопии 150 мкл трансфецированных клеток меланомы в концентрации 5×104 клеток/мл рассеивали в 96-луночный планшет и инкубировали 24 ч при 37 °C в 5 % CO2. По прошествии 24, 48 и 72 ч клетки окрашивали с использованием CyQUANT Direct Cell Proliferation Assay (Thermo Fisher Scientific, Орегон, США) в соответствии с протоколом производителя. После 30-минутной инкубации при комнатной температуре проводили флуоресцентную микроскопию (×460) с использованием системы флуоресцентной визуализации клеток Floid® Cell Imaging Station (Floid Software, версия № 22809; Thermo Fisher Scientific, Inc., Юджин, США). Подсчёт производится в 10 полях зрения. Ядра пролиферирующих клеток окрашивались в зелёный цвет, тогда как непролиферирующие ядра живых клеток оставались неокрашенными. Эксперимент проводили в трех технологических повторах.
Функциональная валидация SIRT1 как гена-мишени miR-204-5p в клетках меланомы выполнялась на основе двойного люциферазного теста. С этой целью произведены синтез нуклеотидной последовательности ДНК 3’-некодирующей области гена SIRT1 человека, клонирование синтезированного фрагмента ДНК, вставка в плазмидный вектор системы The Ambion® pMIR-REPORT Luciferase miRNA Expression Reporter Vector System (Invitrogen™, Applied Biosystems, Фостер, США) по сайтам рестрикции, которые были рекомендованы производителем плазмидного вектора. Состав вышеуказанного вектора включал репортерную плазмиду со вставкой гена ренилловой люциферазы и нормировочную плазмиду β-галактозидазы в соотношении 10:1. Далее осуществлялась наработка готовой конструкции плазмидного вектора со встроенными фрагментами ДНК до количества 20 мкг. Осуществлена трансфекция конструкции в клетки меланомы линии BRO при помощи
Таблица
Гены-мишени miR-204-5p, участвующие в регуляции клеточной пролиферации
Название гена-мишени
Target score*
Биологические процессы
FOXC1 (forkhead box C1)
SIRT1(sirtuin 1)
TGFBR1 (TGF beta receptor 1)
USP47 (ubiquitin specific peptidase 47)
Пролиферация, миграция клеток, негативная регуляция митотического цикла
Пролиферация клеток, связывание с белками, ионами металлов, кератиновыми нитями, участие в клеточном иммунном ответе, поддержание гомеостаза триглицеридов и холестерина, организация хроматина, ангиогенез, эксцизионная репарация ДНК в ответ на УФИ-индуцированное повреждение клетки, позитивная регуляция p53 зависимого апоптоза
Позитивная регуляция клеточной пролиферации и миграции, апоптоз, ангиогенез, индуцирование серин-треонин протеинкиназной активности
Пролиферация, клеточная дифференцировка
Примечание: * – по результатам базы данных miRDB, версия 5.0.
Lipofectamine 3000 (Thermo Fisher Scientific, Inc, Карлсбад, США). Отрицательными контролями служили: исходная культура клеток меланомы линии BRO (интактные клетки без трансфекции); плазмидная ДНК без вставки нуклеотидной последовательности ДНК 3’-некодирующей области гена SIRT1; клетки, трансфецированные мимиком (синтетическим аналогом) miR-204-5p mirVana®miRNA (Ambion, ThermoFisher Scientific, USA) (без плазмиды) с конечным содержанием имитатора (мимика микроРНК) 30 nM. В качестве положительного контроля использовали клетки, трансфецированные вектором: плазмида pcDNA 3.1 (+), модифицированная pcDNA3m3-c_ greGFP2+ (GFP из Clytia gregaria, мутированный для созревания при 37 ºС) в концентрации, эквивалентной концентрации репортерного гена (GFP вектор был любезно предоставлен лабораторией фотобиологии ФГБНУ «Института биофизики» Сибирского отделения Российской академии наук обособленного подразделения ФИЦ КНЦ СО РАН, г. Красноярска). Контроль эффективности трансфекции производился путём определения процента трансфецированных клеток с помощью метода флуоресцентной микроскопии на приборе Invitrogen™ EVOS™ FLoid™ Cell Imaging Station (Invitrogen, Thermo Fisher Scientific, Юджин, США).
Через 24 ч после трансфекции опухолевых клеток выполнялась оценка люциферазной активности с помощью набора Dual-Light® Systems (Applied Biosystems, Фостер, США). Для этого в клеточные лизаты последовательно добавлялись: буфер А (Dual-Light® Systems Applied Biosystems, Фостер, США); субстрат Galacton-Plus® в соотношении 1:100 с буфером B (Dual-Light ® Systems Applied Biosystems, Фостер, США), содержащий люциферин из расчёта 100 мкл на лунку. Измерение люциферазной и β-галактозидазной активности проводилось при помощи планшетного люмино-метра Mithras LB 940 Multimode Reader (Berthold
Статистическая значимость рассчитывалась критерием Стьюдента для зависимых выборок и U-тестом Манна – Уитни в программном пакете для статистического анализа «Statistica 12.0» компании StatSoft. Результаты считались значимыми при p<0,05. Данные представляли в виде среднего и его стандартной ошибки.
Результаты
На основе биоинформатического анализа для miR-204-5p выявлено 235 генов-мишеней, участвующих в 32 биологических процессах. Общими в четырех примененных базах данных являлись 36 генов, имеющих target score в базе miRDB от 80 и выше. Проведен анализ генных онтологий молекулярных и биологических паттернов при помощи системы PANTHER версия 10.0. При помощи вышеуказанной базы данных установлена функциональная роль генов-мишеней, которые были определены по результатам нескольких био-информационных систем анализа. Среди них были выявлены гены-мишени, биологические паттерны которых связаны с процессом клеточной пролиферации (таблица).
Описаны 34 сигнальных механизма, в реализации которых принимают участие вышеуказанные гены-мишени miR-204-5p. Среди них можно выделить сигнальный путь апоптоза, кадгеринов, эн-дотелина, p53, сигнальный путь Wnt, сигнальный путь хемокинов и цитокинов при воспалении.
На следующем этапе были проанализированы потенциальные сайты связывания miR-204-5p c выявленными генами-мишенями при помощи баз данных: TargetScanHuman Release 7.1 , база данных miRDB и (http://www.
Для валидации SIRT1 как гена-мишени miR-204-5p была выполнена оценка относительной люциферазной активности репортерной конструкции. Проведение флуоресцентной микроскопии с GFP-плазмидой показало наличие более 50 % клеток, имеющих характерное зеленое свечение, что позволяет говорить об эффективности проведенной трансфекции и об отсутствии ложноотрицательной реакции (рис. 1).
Относительная люциферазная активность в отрицательном контроле (плазмида без вставки) составила 1,27 ± 1,45. В интактных клетках (без проведения трансфекции) люциферазное свечение не выявлялось, что указывало на отсутствие ложноположительной люциферазной реакции в образцах. Относительная люциферазная активность в лизатах опухолевых клеток меланомы линии BRO c трансфекцией репортерной конструкции составила 10,50 ± 2,04. В клетках, которые инкубировались с мимиком (имитатором) miR-204-5p, люциферазная активность значительно снизилась и составила 0,25 ± 0,11 (p=0,001). Таким образом, двойной люциферазный репортерный анализ показал, что микроРНК miR-204-5p ингибирует люциферазную активность репортерных систем,
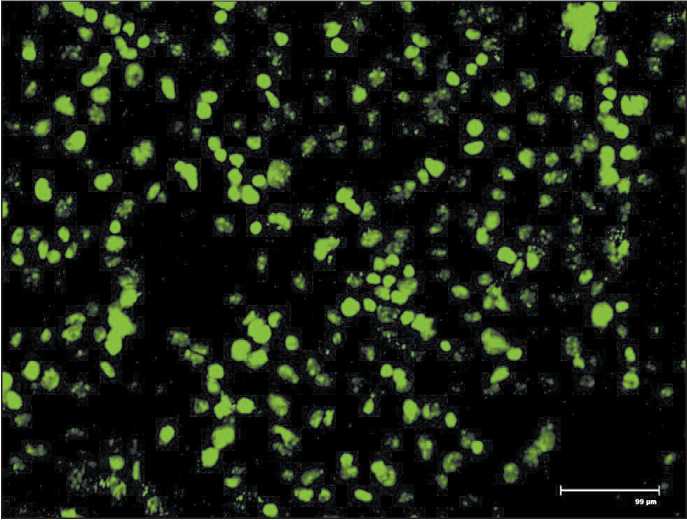
Рис. 1. Микрофото. GFP-трансфецированные клетки меланомы линии BRO, детекция методом флуоресцентной микроскопии. Наличие характерного зеленого свечения клеток меланомы при флуоресцентной микроскопии подтверждает эффективность трансфекции репортерной плазмиды. Флуоресцентная микроскопия, ×460
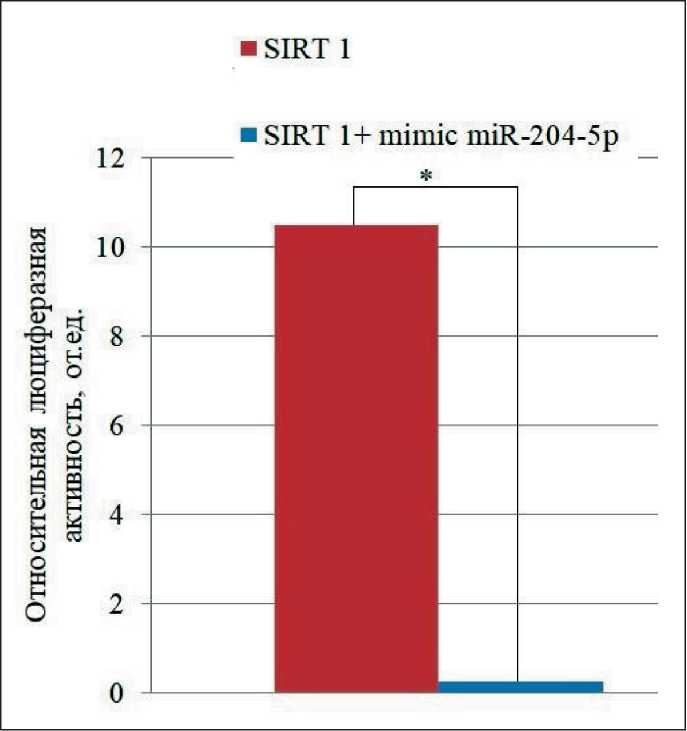
Рис. 2 . Относительная активность ренилловой люциферазы через 48 ч после трансфекции мимика miR-204-5p в клетках меланомы линии BRO. Нормализацию активности ренилло-вой люциферазы осуществляли по β-галактозидазной активности. Примечание: * – статистически значимые различия при воздействии на клетки плазмиды SIRT1 без и после добавления имитатора miR-204-5p (p=0,021)
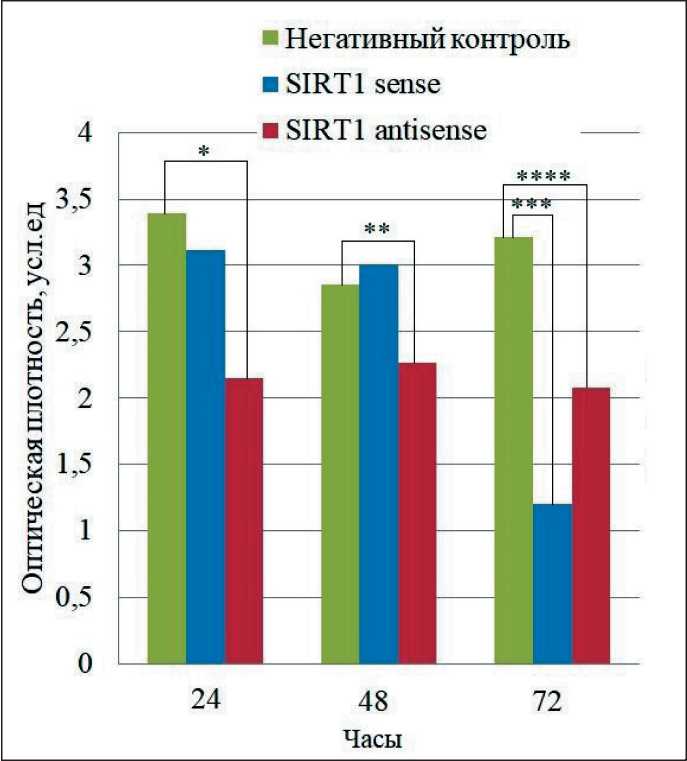
Рис. 3. Результаты МТТ-теста в клетках меланомы линии BRO после «сайленсинга» гена SIRT1 малыми интерферирующими РНК.
Примечание: * – статистически значимые различия пролиферативной активности клеток меланомы линии BRO, транс-фецированных малыми интерферирующими РНК к SIRT1, и клетками контроля через 24 ч после трансфекции (p=0,0300);
** – статистически значимые различия пролиферативной активности клеток меланомы линии BRO, трансфецирован-ных малыми интерферирующими РНК к SIRT1, и клетками контроля через 48 ч после трансфекции (p=0,037);
***/**** – статистически значимые различия пролиферативной активности клеток меланомы линии BRO, трансфецирован-ных малыми интерферирующими РНК к SIRT1 и клетками контроля через 72 ч после трансфекции (p=0,033/0,031)
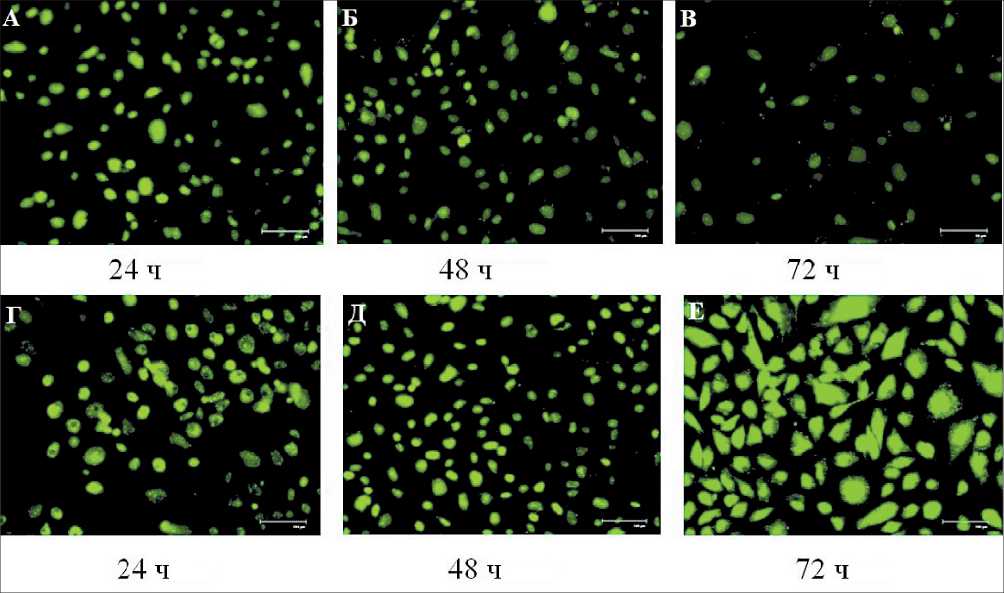
Рис. 4. Микрофото. Оценка клеточной пролиферации клеток меланомы линии BRO методом флуоресцентной микроскопии с использованием системы детекции CyQUANT после трансфекции малых интерферирующих РНК к SIRT1 и трансфекции скрам-блированных последовательностей РНК: а) через 24 ч после трансфекции малых интерферирующих РНК к SIRT1;
б) через 48 ч после трансфекции малых интерферирующих РНК к SIRT1; в) через 72 ч после трансфекции малых интерферирующих РНК к SIRT; г) через 24 ч после трансфекции скрамблированных последовательностей РНК; д) через 48 ч после трансфекции скрамблированных последовательностей РНК; е) через 72 ч после трансфекции скрамблированных последовательностей РНК. Ядра пролиферирующих клеток окрашивались в зелёный цвет, тогда как ядра непролиферирующих живых клеток оставались неокрашенными. Флуоресцентная микроскопия, ×460
содержащих нетранслируемую область гена SIRT 1 на 14,29 % (рис. 2).
При трансфекции малых интерферирующих РНК гена SIRT1 в клетки меланомы с последующим осуществлением МТТ-теста выявлено, что пролиферативная активность клеток меланомы снижалась через 72 ч в клетках, где был осуществлен селективный нокдаун SIRT1, но не в контрольной серии экспериментов (рис. 3).
В результате визуализации клеток методом флуоресцентной микроскопии с использованием CyQUANT Direct Cell Proliferation Assay установлено, что под воздействием смысловой интерферирующей РНК к SIRT1 клеточная пролиферация уменьшилась на третьи сутки в полтора раза (p=0,048). Уменьшилась жизнеспособность клеток под воздействием антисмысловой интерферирующей РНК к SIRT1 в два раза (p=0,036). У клеток под воздействием скрамблированными интерферирующими РНК к SIRT1 пролиферация увеличилась в 2,5 раза (p=0,017) (рис. 4).
Обсуждение
По результатам биоинформатического анализа miR-204-5p является регулятором нескольких сигнальных путей, участвующих в канцерогенезе, таких как меланогенез, сигнальный путь эстрогенов, нарушение транскрипции при раке, регуляции плюриопотентных стволовых клеток. Биоинфор-матический анализ показал, что SIRT1 является геном-мишенью для miR-204-5p. По данным других авторов, белки SIRT1 дифференциально экспрессируются в меланоме [16]. SIRT1 представляет собой гистондеацетилазу класса III (HDAC), которая может деактивировать гистоны или многие негистоновые белки, включая p53, NF-κB, AP-1 и PGC-1α [17, 18]. SIRT1 играет важную роль в регуляции апотоза, транскрипции, участвует в устранении повреждений ДНК и может служить потенциальной мишенью для терапии злокачественных новообразований [19]. Есть данные, что SIRT1 способствует сохранению жизнеспособности опухолевых клеток при раке поджелудочной железы [20], легких [21], лимфоме [22] путем ингибирования SIRT1-опосредованных сигнальных путей. Вместе с тем роль SIRT1 в регуляции пролиферации клеток меланомы остается малоизученной. В этой связи было определено изменение пролиферации клеток меланомы после трансфекции малыми интерферирующими РНК к SIRT1.
С учетом данных, полученных при помощи био-информатического анализа, была создана генная конструкция для определения SIRT1 как функциональной мишени miR-204-5p. При сравнительном анализе клеток, содержащих синтетический аналог микроРНК, и контроля были получены результаты, свидетельствующие об изменении относительного уровня люциферазной активности. Полученные результаты подтверждают, что SIRT1 является функциональной мишенью для miR-204-5p. С учетом этого стоит отметить наличие литературных данных, указывающих, что снижение уровня SIRT1 в опухолевых клетках ведет к изменению экспрессии и функционирования регулятора клеточного цикла ингибитора циклин-зависимой киназы 1А р21 [23]. В другом исследовании показано, что SIRT1 может индуцировать активацию сигнального каскада МАРК [24], являющегося одним из ключевых регуляторов пролиферации клеток меланомы. SIRT1 относится к классу полифункциональных белков, который посредством ферментативной активности регулирует многочисленные процессы в клетках,
Список литературы Роль сиртуина 1 в регуляции клеток меланомы
- Молочков В.А., Демидова Л.В. Меланоцитарные невусы и меланома кожи. М., 2012. 112 с.
- Давыдов М.И., Ганцев Ш.Х. Онкология. М., 2010. 920 с.
- Gandini S., Sera F., Cattaruzza M.S., Pasquini P., Picconi O., Boyle P., Melchi C.F. Meta-analysis of risk factors for cutaneous melanoma: II. Sun exposure. Eur J Cancer 2005; 41: 45-60. DOI: 10.1016/j.ejca.2004.10.016
- Gandini S., Sera F., Cattaruzza M.S., Pasquini P., Picconi O., Melchi F.C., Boyle P. Meta-analysis of risk factors for cutaneous melanoma: III. Family history, actinic damage and phenotypic factors. Eur J Cancer 2005; 40: 41-59. DOI: 10.1016/j.ejca.2005.03.034
- Berwick M., Buller D.B., Cust A., Gallagher R., Lee T.K., Meyskens F., Pandey S., Thomas N.E., Veierød M.B., Ward S. Melanoma epidemiology and prevention. Cancer Treat Res. 2016; 167: 17-49. DOI: 10.1007/978-3-319-22539-5_2


