Роль системы иммунитета в противоопухолевой активности модификаторов биологических реакций различной природы
Автор: Чердынцева Н.В., Литвяков Н.В., Кокорев О.В., Кузнецова А.А., Малиновская Е.А., Смольянинов Е.С., Евтушенко В.А.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 1 (1), 2002 года.
Бесплатный доступ
Короткий адрес: https://sciup.org/14053879
IDR: 14053879
Текст статьи Роль системы иммунитета в противоопухолевой активности модификаторов биологических реакций различной природы
Н.В. Чердынцева, Н.В. Литвяков, О.В. Кокорев, А.А. Кузнецова, Е.А. Малиновская,Е.С. Смольянинов, В.А. Евтушенко
Одним из современных подходов к повышению эффективности лечения злокачественных новообразований является использование биоте-рапевтических воздействий в сочетании с классическими методами (химио-, лучевая терапия, операционное вмешательство). Преимущество такого комплексного подхода заключается в одновременном повреждающем воздействии на опухолевые клетки и активизации защитных механизмов организма, оказывающих, в свою очередь, противоопухолевый эффект [2, 8]. В качестве наиболее перспективных биотерапевтических воздействий рассматриваются модификаторы биологических реакций (МБР) – агенты различной природы, проявляющие свой противоопухолевый эффект путем модуляции ответа организма на опухоль. В число МБР входят природные и синтетические иммуномодуляторы и адаптогены, цитокины и их индукторы, цитостатические препараты, а также физические факторы. Современные представления о механизмах канцерогенеза, взаимоотношениях опухоли и организма, о роли системы иммунитета в противоопухолевой защите, которая осуществляется в тесном взаимодействии с факторами неиммунной природы, а также данные последних лет о механизмах действия МБР различной природы позволяют утверждать, что иммунологические факторы принимают активное участие в реализации их модулирующего действия. В этой связи одним из основных направлений биотерапии является применение агентов, модулирующих активность противоопухолевого иммунитета. Целью настоящей работы было изучение противоопухолевого действия модифика- торов биологических реакций различной природы и его механизмов.
Материалы и методы
Экспериментальные модели. В работе использованы половозрелые мыши массой 18–20 г, разводки питомника Сибирского отделения Научноисследовательской лаборатории экспериментально-биологических моделей Томского научного центра РАМН (Томск) следующих линий: C57Bl/6 (H–2b), F1 (CBA/C57Bl/6) (H–2b/k), DBA/2j (H–2d). Карцинома легких Льюис (LLC), полученная в лаборатории опухолевых штаммов Онкологического научного центра РАМН (Москва), пассировалась методом подкожных трансплантаций на мышах C57Bl/6, опытным мышам перевивалась в область бедра п/к в концентрации 1 x 10 6 кл/мышь.
Терапевтические агенты. Циклофосфан (ЦФ) вводили внутрибрюшинно в дозе 60 мг/кг на 3-и и 7-е сут после трансплантации опухоли. 5-фторурацил (5-ФУ) вводили внутримышечно в дозе 25 мг/ кг через день 3 раза, начиная с 7-х сут после перевивки опухоли.
Субалин – препарат на основе живых рекомбинантных бактерий, продуцирующих человеческий альфа-интерферон (любезно предоставлен его авторами из НИКТИ БАВ ГНЦ ВБ «Вектор», г. Бердск) – вводили перорально по 5х108 микробных клеток (2 дозы) в 0,5 мл воды ежедневно в течение 10–14 сут.
Препарат саназол (АК-2123)-N-(2-метокси-этил)-2-(3нитро-1триазолил) ацетоамид – гипоксический радиосенсибилизатор из класса нитро- триазолов, синтезированный в Киотском университете (Япония), обладающий низкой токсичностью. В экспериментальных исследованиях на мышах саназол использовали в дозе 1 мг/кг внутрибрюшинно в течение 7–12 дней.
Низкоэнергетическое лазерное излучение генерировалось лазерной установкой на парах меди "Малахит" с частотой импульсов 15–22 кГц. В составе лазерного луча присутствуют две спектральные линии – зеленая (510,6 нм) и желтая (578,2 нм). Лазерное облучение в дозе 30 Дж/см2 на область опухоли (длительность экспозиции 1 мин) проводили ежедневно в течение 5 дней.
Методы оценки терапевтической эффективности . Оценку противоопухолевой и антимета-статической активности исследуемых агентов проводили в соответствии с принятыми в экспериментальной онкологии методами [6]. Определяли торможение роста опухоли (%), индекс ингибиции метастазирования (ИИМ,%) и процент торможения роста метастазов (ТРМ), характеризующий уменьшение суммарной площади метастатических колоний в легких.
Методы оценки функциональной активности клеток иммунной системы. Активность макрофагов оценивали по их антипролиферативному действию на клетки-мишени мастоцитомы Р-815 (пассировалась в асцитной форме на мышах DBA) и LLC (пассировалась в асцитной форме на мышах C57Bl/6) в цитостатическом тесте, а также по цитолитическому действию на клетки-мишени LLC. Подсчитывали цитостатический индекс (ИЦС, %) и цитотоксический индекс (ИЦТ, %) [1]. Естественную киллерную активность лимфоцитов крови оценивали в мембранотоксическом тесте по отношению к клеткам-мишеням человеческого эритромиелолейкоза К-562 [7]. Пролиферативную активность лимфоцитов оценивали в реакции бласттрансформации по включению 3Н-тимидина в ДНК клеток при добавлении в культуральную среду Т-клеточного митогена ФГА в оптимальной концентрации 10 мкг/мл (“Serva”, Германия) и без него (спонтанная пролиферация).
Результаты обработаны статистически, достоверность различий между выборками определяли с помощью непараметрического критерия Вил-коксона–Манна–Уитни.
Результаты и обсуждение
Мы показали, что интраперитонеальное введение ультранизких доз саназола сочетанно с цитостатической терапией циклофосфаном в дозе 60
мг/кг привело к двукратному усилению ингибиции роста первичной опухоли и практически полной отмене метастазирования у мышей с LLC (табл. 1). Существенное увеличение торможения роста опухоли и ингибиции метастазирования при сочетанной терапии циклофосфаном и субалином свидетельствует о потенцирующем действии пробиотика на антибластомную активность цикло-фосфана. Как и в случае применения саназола, более выраженный ингибирующий эффект суб-алина и его сочетания с цитостатиком отмечен в отношении метастазов, но не первичного опухолевого узла. Умеренная противоопухолевая и антиметастатическая активность саназола и суб-алина выявлена также на модели меланомы В-16 у мышей C57Bl/6 (данные не представлены). Несмотря на низкий индекс ингибиции метастазирования при использовании субалина в моноварианте, обращает на себя внимание значительное торможение роста метастатических колоний (уменьшение их суммарной площади) в легких при применении субалина не только в сочетании с цитостатической терапией, но и в самостоятельном варианте (табл.1).
Терапия карциномы легких Льюис 5-ФУ в комбинации с излучением лазера на парах меди привела к достоверному усилению противоопухолевого и антиметастатического эффекта. Лазерное излучение также ингибировало рост и метастазирование опухоли, при этом антиметаста-тическое действие было более выражено, чем влияние на первичный опухолевый узел (табл.1).
Таблица 1
Влияние цитостатиков в комбинации с модификаторами биологических реакций на рост и метастазирование карциномы легких Льюис у мышей C57Bl/6
|
Группа |
Доза |
ТРО, % |
ИИМ, % |
ТРМ, % |
|
Контроль |
– |
– |
– |
` |
|
ЦФ |
60 мг/кг |
40 |
70 |
80,5 |
|
ЦФ+саназол |
60+1,0 мг/кг |
66 * |
100 * |
н/о |
|
ЦФ+субалин |
60+2,0 дозы |
79* |
98,8* |
98,5* |
|
5-ФУ |
25 мг/кг |
63 |
40 |
н/о |
|
5-ФУ+НЛИ |
25мг/кг+30Дж/см2 |
80* |
77* |
н/о |
|
Саназол |
1,0 мг/кг |
0 |
72 |
н/о |
|
Субалин |
2 дозы |
37** |
5 |
41** |
|
НЛИ |
30Дж/см2 |
37** |
51** |
н/о |
Примечание. ЦФ – циклофосфан; 5-ФУ – 5-фторурацил; ТРО – торможение роста опухоли; ИИМ – индекс ингибиции метастазирования; ТРМ – торможение роста метастазов; в каждой группе от 8 до 10 животных; н/о – не определяли; * – различия достоверны по сравнению с группой ЦФ или 5-ФУ; ** – различия достоверны по сравнению с контрольной группой.
В связи с отмеченным существенным антиме-тастатическим эффектом саназола, субалина и излучения лазера на парах меди представляется очевидным предположение о важной роли в его реализации эффекторных клеток иммунной системы – прежде всего ЕКК, макрофагов, цитотоксических Т-лимфоцитов, поскольку известно, что эти клетки наиболее эффективно реализуют свое противоопухолевое действие в отношении небольшого числа опухолевых клеток, что имеет место при формировании метастатических колоний [12].
При оценке естественной киллерной активности спленоцитов выявлено достоверное ее усиление у мышей, получавших циклофосфан в сочетании с саназолом, общая литическая активность селезенки также возрастала, наряду со способностью спленоцитов оказывать цитостатическое действие на опухолевые клетки-мишени (табл.2).
Таблица 2
Естественная киллерная активность и цитостатическая активность спленоцитов у мышей линии С57Вl/6 с карциномой легких Льюис, леченных циклофосфаном и саназолом (X ± m)
|
Группа животных |
|||
|
LLC (1) |
LLC+ЦФ (2) |
LLC+ЦФ+ саназол (3) |
|
|
Количество спленоци-тов, млн |
147,0 ± 21,0 |
121,0 ± 14,0* |
141,0 ± 11,0 |
|
ИМТ,% |
62 |
60* |
70 |
|
ЕКА спле-ноцитов в пересчете на селезенку, ЛЕ |
1500 ± 83 |
1215 ± 146* |
1786 ± 194 |
|
Индекс цитостази-са сплено-цитов, % |
62,8 ± 6,4* |
81,4 ± 2,1 * |
91,2 ± 1,9 |
Примечание. ЕКА – естественная киллерная активность; ИМТ – индекс мембранотоксичности; ЛЕ – литические единицы; * – различия достоверны по сравнению с группой 3 (в каждой группе по 6–8 животных).
Эти результаты согласуются с опубликованными нами ранее данными о способности саназола модулировать противоопухолевую активность макрофагов и лимфоцитов у мышей C57Bl/6 с меланомой В-16, причем отмечалась положительная корреляция между активностью эффекторных клеток и ингибирующим действием препарата на рост и метастазирование опухоли при разных схемах его введения [15]. Саназол проявляет иммуномодулирующее действие и при введении безопухолевым мышам [14].
При сочетанной терапии мышей с LLC цик-лофосфаном и субалином мы отметили существенное уменьшение ростстимулирующей активности макрофагов по отношению к опухолевым клеткам по сравнению с их высокой фидерной активностью у мышей, леченных циклофосфаном. Введение субалина мышам с карциномой легких Льюис, не подвергавшимся дополнительным терапевтическим воздействиям, приводило к значительному увеличению мембранотоксической активности ЕКК и тотальной литической активности селезенки, а также существенно усиливало цитотоксическое и антипролиферативное действие макрофагов на клетки LLC (рис. 1). Обратимый ингибитор функциональной активности макрофагов каррагенан при введении in vivo уменьшал или отменял их активацию под влиянием субалина. Введение каррагенана мышам с LLC, леченным субалином, существенно снижало ан-тиметастатическую активность последнего: отмечено повышение интенсивности метастазирования и более чем двукратное увеличение суммарной площади легочных метастазов по сравнению с мышами, получавшими только субалин [5]. Эти данные свидетельствуют о том, что макрофаги являются одной из первоочередных мишеней действия субалина. При использовании "бести-мусных" мышей nude также показана необходимость полноценного Т-клеточного звена для реализации его антибластомного эффекта [11].
Возрастание литического потенциала селезенки под влиянием субалина и саназола связано с повышением функциональной активности ЕК клеток, увеличением скорости созревания предшественников и ускорением рециклинга (скорости их восстановления). Основным фактором, регулирующим эти процессы, является интерферон, стимулирующее влияние на продукцию которого в организме оказывают оба препарата [12]. Определенное значение в повышении литического потенциала селезенки имеют миграционнопролиферативные процессы, так как отмечено увеличение ее клеточности субалином и саназо-лом. Согласно представленным выше данным и результатам исследований, проведенных ранее, триггерным фактором иммуномодулирующей активности субалина является продуцируемый им в кишечнике альфа-интерферон, ключевая роль которого в активации неспецифических факторов иммунитета и специфической реакции на антиген на местном уровне (в слизистой кишечника, в частности) и системно (кровь, селезенка) экспериментально доказана [17].
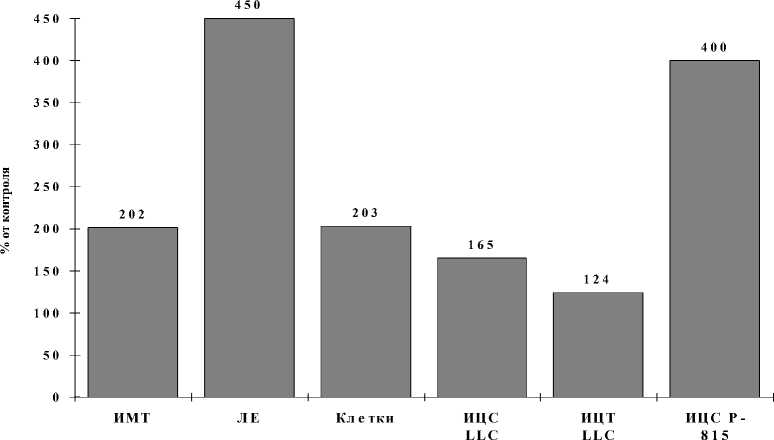
Рис. 1. Влияние субалина на активность ЕК клеток селезенки и перитонеальных макрофагов у мышей F1(CBAxC57Bl/6) с карциномой легких Льюис:
ИМТ – индекс мембранотоксичности спленоцитов по отношению к клеткам К-562; ЛЕ – литическая активность селезенки, литические единицы; ИЦТ LLC – индекс цитотоксичности перитонеальных макрофагов по отношению к клеткам карциномы легких Льюис; ИЦС LLC – индекс цитостазиса перитонеальных макрофагов по отношению к клеткам карциномы легких Льюис; ИЦС Р-815 – индекс цитостазиса перитонеальных макрофагов по отношению к клеткам мастоцитомы Р-815; клетки – количество спленоцитов. По оси ординат – прирост (%) по сравнению с контролем (мыши – опухоленосители, не получавшие субалин)
Повышение противоопухолевого эффекта цитостатика при включении в схему лечения излучения лазера на парах меди сочетается с восстановлением либо усилением функциональной активности эффекторных клеток иммунной системы, это справедливо в отношении как неспецифических эффекторных механизмов (ЕКК, цитостатические лимфоциты), так и процессов, лежащих в основе формирования специфического иммунного ответа (активация пролиферативного ответа лимфоцитов на Т- и В-клеточные митогены) (рис. 2). При исследовании противоопухолевой активности НЛИ было выявлено, что излучение лазера на парах меди при достаточно высокой мощности дозы (30 Дж/см2) индуцирует некробиотиче-ские и дистрофические процессы в ткани опухоли на фоне своеобразной воспалительной реакции, по-видимому опосредующей его противоопухолевое действие. Кроме этого, модулирующее действие НЛИ на иммунологические факторы может быть реализовано путем регуляции активности компонентов антиоксидантной системы. В частности, отмеченное нами повышение активности су- пероксиддисмутазы в крови, с одной стороны, способствует восстановлению иммунокомпетентности; ее снижение в опухоли, с другой стороны, приводит к повышению чувствительности опухолевых клеток к эндогенным и экзогенным свободнорадикальным повреждающим воздействиям [10]. В реализацию противоопухолевого действия НЛИ могут вносить вклад различные механизмы, связанные как с прямым повреждением опухолевых клеток (термический, фотодинамический эффекты), так и с активацией эндогенных факторов, приводящих к стимуляции важнейших гомеостатических систем организма, обеспечивающих интегральный терапевтический эффект [4].
Общепринятая в настоящее время точка зрения о триггерном механизме действия НЛИ, независимо от длины волны и, соответственно, первичной точки приложения (первичного фотоакцептора), вызывающем системный ответ на уровне целостного организма, дает основания считать очевидным вовлечение иммунологических механизмов в реализацию его противоопухолевой активности. Известно, что клетки иммунной систе- о
*
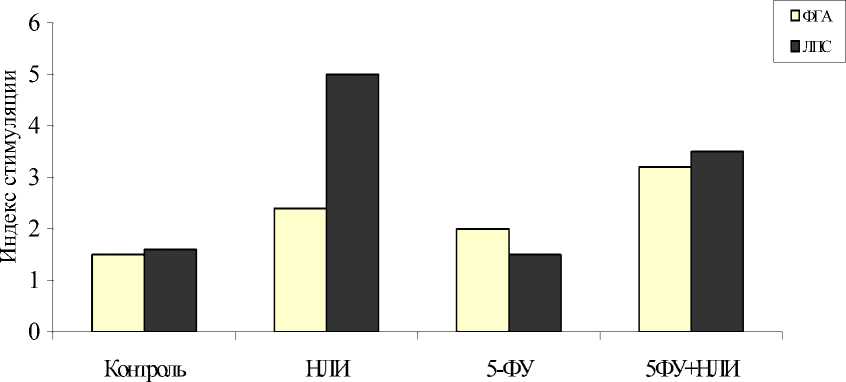
Рис. 2. Изменение пролиферативного ответа спленоцитов на ФГА и ЛПС у мышей с карциномой легких Льюис, леченных 5-фторурацилом и излучением лазера на парах меди:
• – различия достоверны по сравнению с группой 5-ФУ; о – различия достоверны по сравнению с контрольной группой
мы являются одной из непосредственных точек приложения действия НЛИ, которое способно изменять экспрессию их мембранных рецепторов, функциональную активность, пролиферативный потенциал, стимулировать продукцию цитокинов, а также действовать через модуляцию компонентов антиоксидантной системы организма [3].
Установлено, что модификация активности естественных киллеров различными агентами может быть одним из механизмов их антимета-статического действия [14]. Цитостатическая активность иммунокомпетентных клеток также может выступать важным фактором, воздействующим на процесс метастазирования, что подтверждается экспериментальными результатами ряда авторов как в отношении макрофагов, так и спле-ноцитов [18]. Полученные нами данные указывают на то, что модуляция активности спленоцитов и макрофагов под действием использованных МБР может играть важную роль в усилении терапевтической эффективности цитостатиков.
Важное значение в реализации модулирующего действия МБР имеет многокомпонентность ответной реакции и тесное взаимодействие иммунной системы с факторами неиммунной природы. В совокупности это обеспечивает, с одной стороны, изменения опухолевых клеток, приводящие к реверсии трансформированного фенотипа, индукции их дифференцировки и созрева- ния, снижению метастатического потенциала, устранению резистентности к цитостатическим воздействиям; с другой – усиление или восстановление эффекторных противоопухолевых реакций хозяина и селективную супрессию или устранение компонентов, способствующих опухолевому росту.


