Роль соматотропного гормона в эндокринном и локальном контроле репродуктивной функции у домашней курицы (Gallus Domesticus L.) (обзор)
Автор: Смекалова А.А., Лебедева И.Ю.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Обзоры, проблемы
Статья в выпуске: 6 т.59, 2024 года.
Бесплатный доступ
Долгое время преобладала концепция, согласно которой гипофизарный соматотропный гормон (СТГ) считался исключительно метаболическим гормоном, способствующим росту и развитию организма до завершения полового созревания. Однако исследования последних десятилетий показали, что область воздействия СТГ на организм значительно шире (K.L. Hull с соавт., 2001; M. Lu с соавт., 2019). Установлено, что помимо гипофиза СТГ продуцируется во многих клетках и тканях, включая нервные (C. Arámburo с соавт., 2014), иммунные (G. Mo с соавт., 2022) и репродуктивные (S. Harvey, 2010; M. Lunа с соавт., 2014), где он играет аутокринную/паракринную роль. В работах различных авторов показано, что СТГ участвует в регуляции разнообразных процессов, связанных с репродуктивной функцией у млекопитающих и человека, таких как половая дифференциация, половое созревание, стероидогенез, гаметогенез и овуляция, а также беременность и лактация (J.R. Silva с соавт., 2009; J. Devesa с соавт., 2019; C.W. Chang с соавт., 2022; X.Y. Zhou с соавт., 2023). Напротив, гораздо меньше известно об участии СТГ в регуляции функции репродуктивной системы у самок птиц. В представленной обзорной статье рассмотрены общие сведения о структурно-функциональных свойствах СТГ и его рецептора (G.P. Baumann, 2009; M.J. Waters, 2016). Представлены современные взгляды на механизмы активации сигнальных путей гормона, на ключевых молекулярных посредников, участвующих в передаче его внутриклеточного сигнала, а также на основные механизмы регуляции синтеза/секреции СТГ (F. Dehkhoda с соавт., 2018; S.J. Frank, 2020; Y. Chhabra с соавт., 2021). Приводится информация о внегипофизарной экспрессии СТГ и его рецептора в яичнике и яйцеводе домашней курицы (Gallus domesticus L.), представляющей удобную модель для изучения процессов, связанных с репродукцией у птиц (M. Luna с соавт., 2014; A. Hrabia, 2015). Рассмотрены взаимосвязи концентрации СТГ в крови и содержания соматотропных рецепторов в репродуктивных тканях с функциональной активностью и/или стадией развития последних, а также возрастом и репродуктивным статусом птиц (A. Hrabia с соавт., 2008; A. Hrabia с соавт., 2013; Smekalova с соавт., 2019). Систематизированы накопленные данные о роли СТГ в эндокринном и локальном контроле воспроизводительной функции кур, а именно влиянии на репродуктивные ткани при введении птицам in vivo (A. Hrabia с соавт., 2011; H. Mohammadi с соавт., 2016; A. Hrabia, 2022) и на стероидогенную активность фолликулярных клеток, их пролиферацию и апоптоз in vitro (A. Hrabia с соавт., 2012, 2014; A. Smekalova с соавт., 2020; А. Смекалова с соавт., 2021). Показано, что влияние СТГ на фолликулярные клетки яичника домашней курицы зависит от степени зрелости фолликула, взаимодействия слоев стенки фолликула, стадии овуляторного цикла и возраста птицы (A. Smekalova с соавт., 2020; O.V. Aleynikova с соавт., 2021). Также рассматриваются инсулиноподобные факторы роста как возможные медиаторы действия СТГ на репродуктивную систему кур (O. Onagbesan с соавт., 2009; S.M. Ahumada-Solórzano с соавт., 2016). Сделан вывод о том, что СТГ играет значительную роль в регуляции созревания фолликулов, их подготовки к овуляции и образования яичных компонентов, а также может выступать как фактор выживания клеток яйцевода.
Соматотропный гормон, рецепторы, внутриклеточные сигнальные каскады, домашние куры, репродуктивная функция, яичник, яйцевод
Короткий адрес: https://sciup.org/142244122
IDR: 142244122 | УДК: 636.5:577.17:612.62 | DOI: 10.15389/agrobiology.2024.6.1076rus
Текст обзорной статьи Роль соматотропного гормона в эндокринном и локальном контроле репродуктивной функции у домашней курицы (Gallus Domesticus L.) (обзор)
Соматотропный гормон (СТГ), или гормон роста, представляет собой полипептид, вырабатываемый главным образом в соматотропных клетках передней доли гипофиза (аденогипофиза). На протяжении длительного времени СТГ рассматривался исключительно как метаболический гормон, стимулирующий рост и развитие организма до завершения его полового созревания. Однако в последние три десятилетия были получены многочисленные свидетельства того, что воздействие СТГ на организм носит плейотропный характер (1-4). Кроме того, СТГ синтезируется не только в клетках аденогипофиза, но во многих других клетках и тканях, включая
* Работа выполнена в рамках государственного задания (тема FGGN-2024-0014).
нервные (5), иммунные (6, 7) и репродуктивные (8-10). При этом локальная продукция гормона свидетельствует о его аутокринной/паракринной роли в регуляции функции соответствующих клеток, тканей и органов.
Влияние СТГ на воспроизводительную систему самок млекопитающих было убедительно продемонстрировано различными исследовательскими группами (11-13). Значительное внимание уделяется участию этого гормона в регуляции фертильности женщин (14-16), а также в процессах их репродуктивного старения (17-19). Однако о влиянии СТГ на воспроизводительную систему у других классов позвоночных имеются лишь фрагментарные сведения.
Цель представленного обзора заключалась в кратком анализе известной информации о соматотропном гормоне и механизмах его действия, а также в обобщении и систематизации имеющихся в настоящее время данных об участии СТГ в регуляции воспроизводительной функции у домашней курицы ( Gallus domesticus L.), представляющей наиболее удобную модель для изучения процессов, связанных с репродукцией у птиц.
Соматотропный гормон: структура, функции, регуляция секреции, рецепторы и внутриклеточные сигнальные пути. Основная информация о структурно-функциональных свойствах СТГ, его рецепторах и механизмах проведения внутриклеточных сигналов была получена на млекопитающих.
Высвобождение СТГ в гипофизе носит импульсный характер и в основном регулируется двумя гормонами гипоталамуса: рилизинг-гормоном СТГ (СТГ-РГ; стимуляция) и соматостатином (ингибирование). Несколько коротких и длинных петель обратной связи понижают секрецию СТГ. Повышение в крови содержания этого гормона и инсулиноподобного фактора роста-1 (ИФР-1), вырабатываемого печенью в ответ на него, вызывает высвобождение соматостатина и ингибирует высвобождение СТГ-РГ и СТГ (20).
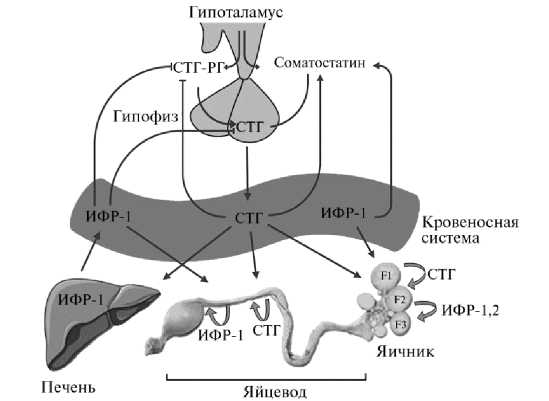
Рис. 1. Схема регуляции центральной и локальной продукции соматотропного гормона (СТГ) у кур: ИФР-1 — инсулиноподобный фактор роста-1, ИФР-1,2 — инсулиноподобные факторы роста-1 и -2, СТГ-РГ — СТГ-рилизинг-гормон, F1, F2, F3 — преовуляторные фолликулы в порядке их овуляции.
Выделяют также ультракороткую обратную связь, посредством которой соматостатин и СТГ модулируют свое собственное высвобождение (аутокринная регуляция) (20, 21). Схема регуляции синтеза/секреции СТГ у домашней курицы подобна таковой у млекопитающих (22), а репродуктивные органы также служат внегипофизарным источником СТГ, где реализуется его аутокринное/паракринное воздействие, частично опосредованное ИФР-1 или ИФР-2 (рис. 1). Помимо СТГ-РГ, существуют и другие нейропептиды и гормоны, способные стимулировать высвобождение СТГ у кур, такие как тиреотропин-рилизинг-гормон (ТРГ), глюкагоноподобный пептид 1 (ГПП1), грелин, нейропептид W, полипептид, активирующий аденилатциклазу гипофиза (PACAP), лептин и гонадотропин-рилизинг-гормон (ГнРГ) (21-23).
Ген СТГ расположен в 27-й хромосоме домашней курицы и состоит из пяти экзонов и четырех интронов аналогично гену СТГ млекопитающих (24). В разных участках этого гена выявлено наличие полиморфизмов и их связь с яичной и мясной продуктивностью (25-28).
У кур, как и у млекопитающих, существует множество структурных форм СТГ, различных по молекулярной массе, соотношение которых меняется в зависимости от роста и развития организма. Наличие различных изоформ гормона обусловлено разными вариантами сплайсинга и посттрансляционной модификации, например гликозилированием, фосфорилированием, димеризацией и олигомеризацией (29-31). Тем не менее только вариант куриного СТГ с массой 22 кДа способен связываться со своими рецепторами в радиорецепторном анализе (32).
Биологическая активность СТГ реализуется только после его ассоциации с рецептором, расположенным в плазматической мембране клетки-мишени, что подтверждается проявлением карликовости в постнатальном периоде в случае дефекта гена рецептора СТГ у человека и домашней курицы (33, 34). Соматотропные рецепторы присутствуют практически во всех тканях, где реализуются плейотропные действия СТГ. К ним относится регуляция обмена веществ, постнатального роста, когнитивной функции, работы иммунной, сердечной, мочеполовой и репродуктивной систем, а также кишечника. Гормон оказывает эти действия главным образом через изменения экспрессии генов, инициируемые активацией его мембранного рецептора и последующей внутриклеточной передачей сигнала (35). При этом некоторые физиологические эффекты СТГ реализуются не напрямую, а посредством индукции ИФР-1 или ИФР-2.
Рецептор СТГ относится к семейству рецепторов цитокинов класса I, в которое входит более 30 членов. Соматотропный рецептор представляет собой белок из 638 аминокислот с одним внеклеточным доменом, трансмембранным доменом, однократно пересекающим плазматическую мембрану, и цитоплазматическим внутриклеточным доменом (рис. 2, А). Внеклеточный домен состоит из двух модулей (верхний и нижний), подобных фибронектину III, которые служат центром связывания лиганда (35-38). Рецепторы СТГ способны высвобождать свой внеклеточный домен в кровь, продуцируя циркулирующий СТГ-связывающий белок, который регулирует доступность гормона для связывания с мембранными рецепторами (39).
Для активации соматотропных рецепторов необходимо образование комплекса, состоящего из одной молекулы гормона и двух молекул рецептора. Такой олигомерный комплекс образуется посредством связывания СТГ с рецепторным гомодимером, который формируется либо конститутивно, либо после индуцирующего воздействия гормона (40, 41). Взаимодействие СТГ с рецепторами происходит в два этапа: сначала гормон связывается с помощью своего мотива «сайт 1» с одной молекулой рецептора, вызывая конформационные изменения второго рецептора, после чего свя-1078
зывается с ним через свой мотив «сайт 2». Рецептор СТГ не обладает собственной тирозинкиназной активностью, поэтому для дальнейшей передачи сигнала необходимо связывание внутриклеточного домена, а именно его консервативного мотива Box1, с цитоплазматической тирозинкиназой Janus 2 (JAK2) (42).
Присоединение СТГ приводит параллельные трансмембранные домены рецепторов в перекрестную ориентацию, что вызывает разделение нижней части трансмембранных спиралей (см. рис. 2, А). Поскольку тиро-зинкиназа JAK2 связана с мотивом Box1, расположенным в непосредственной близости к внутренней стороне мембраны, активация рецептора приводит к разделению двух ассоциированных JAK2 и, в частности, к удалению ингибирующего псевдокиназного домена (43). Происходит трансактивация двух киназных доменов и инициируется фосфорилирование по тирозину цитоплазматического домена обоих рецепторов и нижележащих эффекторов, таких как STAT1, STAT3 и STAT5 (сигнальных трансдукторов и активаторов транскрипции), представляющих собой группу транскрипционных факторов, опосредующих большинство геномных эффектов СТГ (см. рис. 2, Б). Фосфорилирование приводит к образованию димеров STAT и их перемещению в ядро, где они регулируют экспрессию гена-мишени. Терминация сигналинга происходит с помощью белков семейства SOCS (suppressor of cytokine signaling) — супрессоров сигнализации цитокинов, которые за счет наличия в них SH2 домена конкурируют за сайты связывания STAT с рецептором и инактивируют JAK2. Кроме того, этот сигнальный каскад может быть инактивирован с помощью ряда про-теинтирозинфосфатаз, которые катализируют дефосфорилирование рецептора и его субстратов по остаткам фосфотирозина (37).
А Б
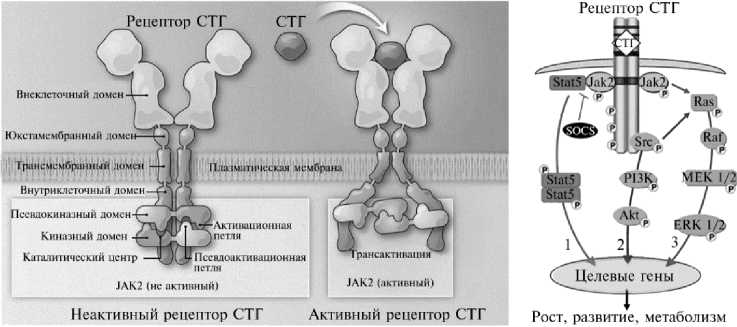
Рис. 2. Модель активации рецептора соматотропного гормона (СТГ) (А) и внутриклеточной сигнализации, индуцируемой рецепторами СТГ (Б) : JAK2 — тирозинкиназа Janus 2, STAT5 — сигнальный трансдуктор и активатор транскрипции, SOCS — супрессор сигнализации цитокинов, Ras — мембраносвязанные белки, участвующие первыми в передаче сигнального каскада RAS-RAF-MEK-ERK пути, Src — протоонкоген-тирозинкиназа, РI3K — фосфатидилинозитол-3, Akt — протеинкиназа B (адаптировано по 38 и 43).
Влияние СТГ на клетки-мишени реализуется и через другие внутриклеточные сигнальные пути (см рис. 2, Б) (44). Связывание СТГ со своими рецепторами активирует киназы семейства Src независимо от JAK2 (45). Этот процесс приводит к активации белка RAS (rat sarcoma virus) и инициации сигнального каскада, ассоциированного с MAPK (митоген-активируемая протеинкиназа, mitogen-activated protein kinase) и контролирующего пролиферацию, дифференцировку, апоптоз клеток и другие про- цессы (RAS-RAF-MEK-ERK путь) (42). Описаны и другие сигнальные пути, активируемые СТГ и включающие активацию фосфатидилинозитол-3 киназы (phosphatidylinositol 3-kinases, РI3K), протеинкиназы В/Akt и про-теинкиназы С (46-48).
До сих пор не известно, активирует ли СТГ свой основной сигнальный путь Jak2-STAT в клетках домашней курицы, однако было продемонстрировано участие сигнальных каскадов, ассоциированных с ERK и протеинкиназой Akt, в опосредовании действия этого гормона у кур (49, 50).
Соматотропный гормон и репродуктивная функция кур. К настоящему времени установлено, что СТГ играет роль позитивного модулятора воспроизводительной функции самок млекопитающих, влияя на рост, развитие и резистентность к апоптозу различных органных структур репродуктивной системы (1, 51-53). В то же время многие клетки этой системы служат местом внегипофизарной экспрессии СТГ (9, 54, 55). Репродуктивная функция кур также представляет мишень для действия СТГ, который служит не только эндокринным, но и паракринным (аутокринным) регулятором процессов, связанных с ней (56).
Экспрессия СТГ и его рецепторов в репродуктивных органах кур. В яичнике домашней курицы обнаружена продукция СТГ, что свидетельствует о способности последнего на локальном уровне оказывать влияние на овариальную функцию (56-58). Матричная РНК СТГ была выявлена в строме яичника курицы, начиная с 10-недельного возраста, но в значительно меньшей концентрации, чем в гипофизе. Экспрессию этой мРНК наблюдали в малых фолликулах диаметром 1-4 мм после их формирования в возрасте 14 нед и во всех более крупных фолликулах диаметром 4-30 мм, развивающихся после 16-недельного возраста. Иммунореактивность к СТГ также проявлялась в строме яичника с 10-недельного возраста и во всех фолликулах (1-4 мм и 4-30 мм), подтверждая экспрессию соответствующего белка, но была более интенсивной в слое гранулезы, чем в слое теки. По мере созревания фолликулов эта иммунореактивность в гранулезном слое повышалась, а в текальном слое значительно снижалась (56). Сходные различия между клетками гранулезы и теки были обнаружены в уровне экспрессии мРНК СТГ (58). Кроме того, в фолликулярной стенке выявлено содержание девяти изоформ белка СТГ, соотношение которых изменялось с развитием фолликулов, что, вероятно, связано с механизмом модуляции активности гормона в яичнике (58).
Яйцевод кур также служит внегипофизарным участком экспрессии гена СТГ (10, 57, 59). С помощью метода ОТ-ПЦР мРНК СТГ была обнаружена во всех функциональных частях яйцевода, причем ее концентрация повышалась при переходе от белковой части к влагалищу (57). Кроме того, методом ИФА была определена иммунореактивность к СТГ у белков, выделенных из всех частей яйцевода (10). По всей его длине содержание СТГ было постоянным, постепенно снижаясь с возрастом кур. В возрасте 48 нед концентрация СТГ в тканях яйцевода составляла всего 25 % от таковой у 13-недельных кур. Однако вследствие увеличения массы яйцевода с возрастом (более чем в 5 раз между 13 и 48 нед) общая продукция СТГ также возрастала. При этом концентрация СТГ в расчете на 1 мг белка не отличалась от этого показателя в других внегипофизарных тканях (семенниках и фабрициевой сумке) взрослых кур. Следовательно, уровень внеги-пофизарной выработки СТГ сопоставим с количеством гормона, вырабатываемым меньшим по размеру гипофизом. С помощью электрофореза в полиакриламидном геле и Вестерн-блоттинга в яйцеводе, как и в яичнике, было обнаружено несколько структурных изоформ СТГ (10).
Ткани репродуктивных органов служат не только внегипофизар-ным источником СТГ, но также и мишенью для этого гормона. Экспрессия гена рецептора СТГ наблюдалась в яичнике цыплят-бройлеров в возрасте от 4 до 16 нед (60). Наличие мРНК и иммунореактивности к рецептору СТГ было выявлено в строме развивающегося яичника и в стенках фолликулов разных размеров у половозрелых кур, причем проявление соответствующей мРНК и белка оказалось более интенсивным в слое гранулезы, чем в слое теки, как и в случае самого гормона (56). С помощью радиорецепторного анализа было показано, что с ростом преовуляторных фолликулов у кур-несушек число СТГ-связывающих участков в клетках гранулезы увеличивается, а в клетках теки падает (61). В культивируемых клетках гранулезы кур было продемонстрировано присутствие белка СТГ и его рецептора, что подтверждает возможность активации последнего локально продуцируемым гормоном (58).
В яйцеводе кур также была обнаружена экспрессия соматотропного рецептора. Наличие рецепторов СТГ и их мРНК было выявлено в воронке яйцевода, его белковой части, перешейке, маточном отделе и во влагалище (10, 62). Иммунореактивность к рецептору СТГ в основном наблюдалась в слизистой оболочке и была самой низкой в воронке яйцевода (62).
Следует отметить, что СТГ снижает содержание мРНК своих рецепторов в печени кур (63). Тем не менее до сих пор не известно, какое влияние будет оказывать этот гормон, поступающий из кровеносной системы или синтезируемый локально, на экспрессию соматотропных рецепторов в репродуктивных органах.
Физиологическое значение СТГ для функционирования репродуктивной системы. Как известно, содержание СТГ в крови зависит от возраста, и его снижение может быть причиной некоторых функциональных нарушений. Однако целесообразность введения этого гормона пожилым людям или животным до сих пор остается дискуссионным вопросом (64). Было продемонстрировано, что кратковременное воздействие СТГ у пациентов старшего возраста с пониженным овариальным резервом повышает результативность гиперстимуляции яичников, а его длительное воздействие у постаревших грызунов оказывает благотворное влияние на некоторые органы и компоненты метаболической системы (19, 65). Вместе с тем показано, что ослабление или блокада внутриклеточной сигнализации СТГ связаны с удлинением продолжительности жизни особей разных видов (66, 67). При этом многие специалисты рассматривают возрастное снижение концентрации этого гормона в крови в качестве защитного механизма, уменьшающего метаболическую активность клеток и повышающего их резистентность к окислительному стрессу, служащему одной из основных причин старения, в том числе репродуктивного (64).
У молодых кур начало периода яйцекладки сопровождается повышением концентрации СТГ в крови (68), а с последующим прекращением яйцекладки наблюдается ослабление его продукции (69). В то же время у репродуктивно постаревших кур-несушек повышенное содержание СТГ в плазме крови было связано с сокращением цикла яйцекладки (70). Таким образом, влияние СТГ на воспроизводительную функцию может носить двойственный характер и зависеть от возраста, физиологического состояния и репродуктивного статуса птиц. Следует подчеркнуть, что на уровне организма конечные эффекты СТГ будут определяться его взаимодействием с другими гормонами (репродуктивными и метаболическими), а также с локальными паракринными факторами, участвующими в регуляции функционирования репродуктивной системы (1, 57).
В крови кур-несушек наблюдаются суточные колебания концентрации СТГ, ассоциированные с овуляторным циклом. Ее максимальный рост отмечался через 2 ч после овуляции, после чего содержание СТГ оставалось повышенным еще в течение 4 ч, что, вероятно, связано с метаболическими потребностями для синтеза желтка (71). Кроме того, продукция СТГ гранулезным слоем увеличивалась в процессе фолликулогенеза, а концентрация его рецепторов в клетках гранулезы была самой высокой на завершающей стадии развития самого большого желтого фолликула (56, 61). Это дает основания полагать, что СТГ может играть у кур значительную роль в регуляции созревания фолликулов и их подготовки к овуляции.
Экспрессия рецепторов СТГ была выше в белковой части, перешейке и матке по сравнению с воронкой яйцевода кур (62). Как известно, эти сегменты яйцевода характеризуются высокой метаболической активностью, связанной с образованием компонентов яйца (25-30 г белка и 56 г скорлупы). К тому же, СТГ-иммунореактивность отмечалась только в слизистой оболочке яйцевода, а не в строме, состоящей из мышц и соединительной ткани (72). Эти данные могут указывать на участие СТГ в контроле производства яичных компонентов.
Влияние СТГ на репродуктивные ткани при введении птицам in vivo. Ряд исследований подтверждает важную роль СТГ в контроле репродуктивной функции у самок птиц. Введение этого гормона курам-несушкам приводило к увеличению числа мелких фолликулов в яичнике (57). Инъекции молодкам рекомбинантного куриного СТГ обусловливали увеличение массы яичника в несколько раз за 1 нед до половой зрелости. У большинства обработанных кур в отличие от контрольной группы в яичнике присутствовали желтые иерархические фолликулы, что свидетельствует об участии СТГ в селекции малых фолликулов в преовуляторную иерархию (57, 73).
Введение СТГ курам-молодкам во время полового созревания вызывало повышение содержания в яичнике прогестерона и эстрадиола (72). Эта обработка также стимулировала пролиферацию и подавляла апоптоз клеток в строме яичника и в белых и малых желточных фолликулах. Таким образом, СТГ может участвовать в регуляции роста, развития и стероидогенной активности преиерархических фолликулов кур.
Было установлено, что СТГ участвует в формировании яичного белка и скорлупы. Инъекции гормона в течение 3 нед курам-несушкам в конце периода яйцекладки не влияли на яйценоскость птиц, но значительно улучшали качество скорлупы (74). Более позднее исследование показало, что одновременное введение СТГ и тестостерона в позднюю фазу яйцекладки обусловливает повышение яйценоскости и улучшает показатели качества яиц, а именно массу яиц, высоту плотного слоя белка и плотность скорлупы (75). В то же время обработка кур СТГ в период полового созревания приводила к значительному увеличению экспрессии мРНК овальбумина — основного компонента яичного белка, а также овокаликсина-32 и овокаликсина-36, входящих в состав матрикса яичной скорлупы (59).
Действие СТГ на яйцевод птиц, по-видимому, также связано с регуляцией апоптотической гибели клеток, поскольку инъекции этого гормона в течение нескольких недель во время полового созревания кур вызывали ингибирование клеточного апоптоза и снижение экспрессии и активности маркеров апоптоза — каспаз 2 и 3 в белковом отделе яйцевода.
Вместе с тем СТГ не влиял на экспрессию генов антиапоптотических белков, таких как Bcl-2 или сурвивин (57, 59). В целом, эти данные позволяют рассматривать СТГ как фактор выживания в яйцеводе кур.
Кроме того, инъекции СТГ в период паузы в яйцекладке, вызванной голоданием, приводили к повышению концентрации половых стероидных гормонов в крови и тканях яйцевода (76). При этом выявлены изменения экспрессии рецепторов стероидных гормонов и отдельных яичных белков в различных частях яйцевода. Следовательно, СТГ может играть значительную роль в определении скорости регрессии и обновления яйцевода во время линьки, а также регулировать его секреторную активность.
Влияние СТГ in vitro на функциональную активность фолликулярных клеток. В исследованиях in vitro были получены довольно противоречивые данные о влиянии СТГ на стероидогенную активность структурных компонентов яичника кур. Гормон стимулировал секрецию эстрадиола целыми преиерархическими фолликулами, но ингибировал секрецию эстрадиола и повышал продукцию прогестерона желтыми иерархическими фолликулами в период полового созревания птиц (77, 78). Во время пика яйцекладки воздействие экзогенного и локально продуцируемого СТГ на клетки гранулезы второго по величине преовуляторного фолликула (F2) дозозависимо приводило к увеличению синтеза прогестерона, что было обусловлено усилением экспрессии цитохрома P450scc, фермента отщепления боковой цепи холестерина (79). В то же время A. Hrabia с соавт. (78) не удалось обнаружить какого-либо влияния СТГ на старте яйцекладки ни на секрецию прогестерона эксплантатами гранулезного слоя, ни на секрецию эстрадиола фрагментами текального слоя трех самых больших преовуляторных фолликулов (F3-F1). СТГ снижал ЛГ-стимулированную секрецию эстрадиола слоем теки фолликулов F3-F1, выделенных за 22 ч до овуляции.
В более позднем исследовании было показано, что влияние СТГ на стероидогенную активность фолликулярных слоев зависит от их паракринного взаимодействия, степени зрелости преовуляторного фолликула и возраста/репродуктивного статуса кур-несушек. В отсутствие текального слоя СТГ повышал секрецию прогестерона гранулезным слоем фолликулов F1 и F2 у молодых кур на пике яйцекладки и подавлял эту секрецию в случае фолликула F1 у возрастных кур с пониженной яйценоскостью (80). В присутствии слоя теки СТГ стимулировал продукцию прогестерона слоем гранулезы фолликула F1 и у молодых, и у репродуктивно постаревших кур-несушек. Кроме того, было обнаружено, что в случае индивидуального культивирования эксплантатов теки СТГ существенно не влияет на выработку тестостерона при использовании обоих фолликулов F1 и F2 у молодых кур с высокой яйценоскостью и снижает ее в 2 раза в фолликулах F1 у возрастных кур в конце периода яйцекладки (81). Напротив, при совместном культивировании эксплантатов теки и гранулезы СТГ увеличивал секрецию тестостерона текальным слоем фолликулов F1 и снижал эту секрецию текальным слоем фолликулов F2 как у молодых, так и у старых кур.
Было продемонстрировано, что инкубация клеток гранулезы из преиерархических фолликулов с рекомбинантным куриным СТГ или кондиционированной средой, содержащей преимущественно овариальную изоформу СТГ с молекулярной массой 15 кДа, приводит к дозозависимому повышению клеточной пролиферации (79). Причем и экзогенный, и локально продуцируемый СТГ индуцировали в гранулезных клетках фосфорилирование киназы Erk1/2, которая ассоциирована с сигнальным пу- тем, способствующим выживанию и пролиферации клеток. Кроме того, выявлено стимулирующее влияние СТГ in vitro на пролиферативную активность клеток гранулезы и теки из самого зрелого преовуляторного фолликула кур-несушек (82). В этих условиях гормон также понижал экспрессию проапоптотического белка Bax в гранулезных клетках и повышал эту экспрессию в текальных клетках.
Таким образом, имеющиеся данные предполагают участие СТГ в регуляции роста и развития фолликулов у домашней курицы посредством модуляции стероидогенной и пролиферативной активности фолликулярных клеток, а также их резистентности к апоптозу. При этом характер гормонального влияния зависит от возраста птицы, стадии созревания фолликулов, типа фолликулярных клеток и их дистантного взаимодействия.
Инсулиноподобные факторы роста как возможные медиаторы действия СТГ на репродуктивную систему кур. Некоторые биологические эффекты СТГ на клетки-мишени опосредованы инсулиноподобными факторами роста (ИФР), которые синтезируются во многих тканях в ответ на стимуляцию СТГ (83). В последние десятилетия накопилось достаточно доказательств того, что система ИФР (ИФР-1, ИФР-2, рецепторы ИФР, ИФР-связывающие белки) играет важную роль в регуляции функции яичников у млекопитающих (13, 53, 84).
В яичнике кур также были идентифицированы все члены семейства ИФР, которые принимают участие в регуляции стероидогенеза, пролиферации, дифференцировки клеток и селекции фолликулов (85, 86). Экспрессия мРНК ИФР-1 и ИФР-2 обнаружена в клетках яичника 4недельных цыплят (60) и преовуляторных фолликулов взрослых кур, причем эта экспрессия была выше в клетках теки, чем в клетках гранулезы (85). У птиц оба фактора, ИФР-1 и ИФР-2, связываются с одним и тем же рецептором ИФР-1Р (ИФР-рецептор 1-го типа). Белок и мРНК ИФР-1Р обнаружены в незрелом яичнике кур в возрасте 4 нед (60), а также в гранулезных и текальных клетках развивающихся фолликулов у взрослых кур (85, 87). При этом концентрация мРНК ИФР-1Р в клетках гранулезы выше, чем в клетках теки, и увеличивается с ростом фолликулов.
Таким образом, гранулезный слой представляет основное место действия ИФР в иерархических фолликулах, а клетки теки — основной источник ИФР, что подтверждает локальное паракринное/аутокринное действие ИФР в птичьем яичнике.
В исследованиях in vitro СТГ был способен индуцировать продукцию ИФР-1 клетками гранулезы преиерархических фолликулов (79), а также больших преовуляторных фолликулов (85). Полагают, что стимулирующее действие СТГ на секрецию эстрадиола преиерархическими фолликулами, а также на продукцию прогестерона клетками гранулезы преовуля-торных фолликулов может быть опосредовано ИФР-1 (77, 85). В то же время введение СТГ курам в период полового созревания приводило к значительному снижению экспрессии мРНК ИФР-1 в стенке желточных и больших желтых фолликулов, а также мРНК ИФР-2 в строме яичника и преовуляторных фолликулах (57). Напротив, эта экспрессия была повышена в печени, что указывает на тканеспецифический характер воздействия СТГ. Такие различия могли быть обусловлены паракринным взаимодействием между текальным и гранулезным слоями в целых фолликулах, которое имело место в экспериментах in vivo.
Инкубация клеток гранулезы из преиерархических фолликулов с ИФР-1, как и с СТГ, приводила к повышению их пролиферативной активности, причем иммунонейтрализация ИФР-1 полностью подавляла ро-1084
стостимулирующий эффект СТГ. Это позволяет предположить, что СТГ стимулировал пролиферацию клеток посредством локальной регуляции экспрессии гена ИФР-1 (79).
В яйцеводе перепелов и кур также были обнаружены компоненты системы ИФР (ИФР-1, ИФР-1Р и ИФР-связывающий белок-2) и наблюдалось паракринное/аутокринное воздействие ИФР-1, что указывает на вероятность опосредования последним некоторых эффектов СТГ (88, 89).
Итак, имеющаяся в настоящее время информация свидетельствует об участии соматотропного гормона в эндокринном и паракринном/ауто-кринном контроле функции репродуктивных органов у домашней курицы. Характер изменения содержания СТГ в крови, а также экспрессии соматотропных рецепторов и продукции СТГ в клетках яичника и яйцевода в процессе их онтогенетического развития указывает на значительную роль этого гормона в регуляции созревания фолликулов, их подготовки к овуляции и образования яичных компонентов. Исследования, связанные с введением СТГ птицам in vivo и его воздействием на овариальные и ови-дуктальные клетки in vitro, выявили наличие гормонального влияния на рост и развитие фолликулов у домашней курицы, которое реализуется посредством модуляции стероидогенной и пролиферативной активности фолликулярных клеток и их резистентности к апоптозу. Эти исследования показали, что соматотропный гормон может выступать как фактор выживания овидуктальных клеток, определяя во время линьки скорость регрессии и обновления яйцевода, а также регулировать секреторную активность последнего. В то же время большая часть информации о механизмах действия СТГ на клетки репродуктивного тракта самок получена на млекопитающих и требует подтверждения у птиц. Дальнейшие исследования должны быть направлены на изучение внутриклеточных сигнальных путей, активируемых СТГ в овариальных и овидуктальных клетках кур, возможных паракринных посредников и факторов модуляции прямого воздействия гормона на клетки.


