Роль стекловидного тела в патогенезе развития диабетического витреопапиллярного тракционного синдрома
Автор: Бабаева Д.Б., Шишкин М.М.
Журнал: Вестник Национального медико-хирургического центра им. Н.И. Пирогова @vestnik-pirogov-center
Рубрика: Оригинальные статьи
Статья в выпуске: 4S т.17, 2022 года.
Бесплатный доступ
Целью данной работы стало изучение роли стекловидного тела в патогенезе развития диабетического витреопапиллярного тракционного синдрома. Материал и методы: В исследование было включено 70 пациентов с витреопапиллярным тракционным синдромом на фоне пролиферативной диабетической ретинопатии. В группу входили пациенты как с начальными его проявлениями без заметного фиброзного перерождения, а также пациенты с наличием выраженного фиброваскулярного тяжа, фиксированного к диску зрительного нерва. Всем пациентам были выполнены стандартные офтальмологические исследования, а также оптическая когерентная томография, кинетическое В-сканирование, компьютерная периметрия и флюоресцентная ангиография. Всем была проведена витреоретинальная хирургия, целью которой было устранение тракционного компонента со стороны стекловидного тела. Результаты исследования: Выполнение В-сканирования витреальной полости в режиме кинетической эхографии позволило нам отметить не только наличие или отсутствие ЗОСТ, но и качественно регистрировать в режиме реального времени изменение подвижности СТ. По результатам ОКТ во всех наблюдениях определяли наличие витреопапиллярной фиксации на фоне перипапиллярной задней отслойки стекловидного тела. У пациентов с наличием фиброваскулярной ткани от ДЗН регистрировали выраженное выстояние ткани зрительного нерва в витреальную полость. На данных флюоресцентной ангиографии отмечали ликедж из сосудов фиброваскулярного стебля, фиксированного к диску зрительного нерва. Анализ результатов периметрии показал, что у всех пациентов определялись центральные и парацентральные скотомы без заметной тенденции к уменьшению их суммарной величины при дальнейшем наблюдении. Заключение: Результаты собственных наблюдений свидетельствуют о том, что биомеханическое воздействие стекловидного тела на зрительный нерв (нарастание тракций) влияет на прогрессирование ВПТС и является одной из причин ухудшения зрительных функций у данной категории пациентов.
Витреопапиллярный тракционный синдром, пролиферативная диабетическая ретинопатия, витреоретинальная хирургия
Короткий адрес: https://sciup.org/140296432
IDR: 140296432 | DOI: 10.25881/20728255_2022_17_4_S1_67
Текст научной статьи Роль стекловидного тела в патогенезе развития диабетического витреопапиллярного тракционного синдрома
Значение стекловидного тела (СТ) — анатомической структуры, непосредственно контактирующей с сетчаткой, в патофизиологии пролиферативной диабетической ретинопатии (ПДР) остается не до конца изученным. В литературе большинство авторов трактовали диабетические изменения СТ как вторичные, развивающиеся по мере прогрессирования патологических процессов в сетчатке. Витреопапиллярному тракционному синдрому (ВПТС) посвящено малое количество публикаций [2; 8], в основном в них сообщается о том, что тракции со стороны CТ могут являться причиной отёка зрительного нерва и перипапиллярных геморрагий [4; 7]. Патофизиология диабетического ВПТС до сих пор остается неясной. Одними из основных причин снижения зрения у этих пациентов являются необратимое постепенно прогрессирующее повреждение зрительного нерва и вторичное поражение макулярной области. ВПТС среди пациентов с сахарным диабетом встречается часто, но диагностируется чаще всего уже на далекозашедших стадиях, несмотря на наличие большого арсенала диагностических методов. Поздняя диагностика обусловлена отсутствием кровоизлияний в витреальную полость, что обычно является причиной обращения пациентов с другими проявлениями ПДР к офтальмологу. Несомненно, наиболее оптимальным по срокам и перспективным по функциональным результатам является методика раннего оперативного лечения, направленная на устранение тракционного компонента со стороны СТ. Развитие взглядов на патогенез ВПТС у пациентов с диабетической ретинопатией позволит обосновать своевременное выполнение ВРХ данной категории пациентов.
Цель : изучить роль стекловидного тела в патогенезе развития диабетического ВПТС.

Материал и методы
Под нашим наблюдением находилось 70 пациентов с клиническими проявлениями ВПТС на фоне ПДР. В группу входили пациенты как с начальными его проявлениями без заметного фиброзного перерождения, а также пациенты с наличием выраженного фиброваскулярного тяжа, фиксированного к диску зрительного нерва (ДЗН). Возрастной диапазон больных находился в пределах 19–77 лет. МКОЗ до витреоретинальной хирургии (ВРХ) у пациентов была в пределах от 0,001 до 0,4. Показатели зрительных функций оценивали после восстановления прозрачности оптических сред в сроки от 4 до 52 недель после ВРХ.
В ходе предоперационной подготовки выполняли стандартные офтальмологические методы исследования. Периметрию выполняли на периметре Octopus по программе Standart / WhiteDynamic. Оптическую когерентную томографию (ОКТ) и флюоресцентную ангиографию (ФАГ) выполняли в тех случаях, когда оптические среды были достаточно прозрачны. Всем пациентам выполняли В-сканирование в кинетическом режиме. У 7 пациентов формирование и прогрессирование ВПТС было прослежено до ВРХ в динамике на протяжении 6–9 месяцев.
Всем было проведено оперативное лечение (ВРХ), целью которого было устранение тракционного компонента со стороны СТ. Оперативное лечение было проведено с использованием широкоугольной системы BIOM с применением трехпортового доступа и использованием инструментов 25G. При этом исключали обязательное полное иссечение остающейся препапиллярной части ФВС, это минимизировало риск повреждения нервной ткани. По данным Pendergast с соавторами [3], при полном иссечении ФВС повреждаются аксоны, образующие волокна зрительного нерва, что в свою очередь подтверждает их втяжение в основание фиброваскулярного тяжа. 15 пациентам 1 этапом было выполнено интравитреальное введение анти-VEGF препарата за 7–10 дней до ВРХ.
Результаты и обсуждение
В отдалённом периоде наблюдения МКОЗ прооперированных глаз повысилась у 94% пациентов в пределах от 0,05 до 0,5, у остальных осталась без изменений. Наиболее высокие показатели МКОЗ были зарегистрированы у пациентов (n = 10), у которых клинические проявления ВПТС до ВРХ были выражены умеренно. Анализ результатов периметрии показал, что у всех пациентов определялись центральные и парацентральные скотомы без заметной тенденции к уменьшению их суммарной величины при дальнейшем наблюдении.
Известно, что данные ультразвукового В-сканиро-вания, традиционно применяемого при обследовании пациентов с ПДР, позволяют акцентировать внимание на таких манифестных данных, как наличие частичной ЗОСТ, тракционной отслойки сетчатки и выраженных изменениях СТ. Выполнение В-сканирования витреальной полости в режиме кинетической эхографии позволило нам отметить не только наличие или отсутствие ЗОСТ, но и качественно регистрировать в режиме реального времени изменение подвижности СТ. Нарастающая ригидность его структур нами была зарегистрирована в динамике у 5 пациентов, которые находились под нашим наблюдением в сроки до 6 месяцев до операции. При этом у них за это время произошло заметное увеличение размеров фиброваскулярного стебля, с одновременным прогрессированием ЗОСТ. Это может свидетельствовать о нарастании тракционного воздействия со стороны СТ на зрительный нерв. Похожую точку зрения высказывают Kelly A. Walton et al. (2002), которые, анализируя результаты кинетической эхографии, подтвердили биомеханическую роль СТ в развитии ретинальных разрывов, кистовидных макулярных отеков и макулярных разрывов [6]. Сопоставление результатов эхографии с данными ФАГ и ОКТ позволяет исследователю получить наиболее полное представление о сложившихся взаимоотношениях СТ и сетчатки.
По результатам ОКТ во всех наблюдениях определяли наличие витреопапиллярной фиксации на фоне перипапиллярной ЗОСТ (Рис. 1). У пациентов с наличием фиброваскулярной ткани от ДЗН регистрировали выраженное выстояние ткани зрительного нерва в витреаль-ную полость. В 15 наблюдениях наряду с витреопапил-лярной фиксацией имело место тракционное смещение макулы в сторону зрительного нерва.
В тех случаях, когда ФАГ удавалось выполнить до операции всегда отмечали ликедж из сосудов фиброваскулярного стебля, фиксированного к ДЗН. После ВРХ в сроки от 3 месяцев и более во всех этих случаях по данным повторных ФАГ регистрировали постепенное уменьшение ликеджа красителя из остатков стебля на поверхности ДЗН. Это также подтверждает роль биомеханического фактора в нарушении гематоофтальмического барьера.
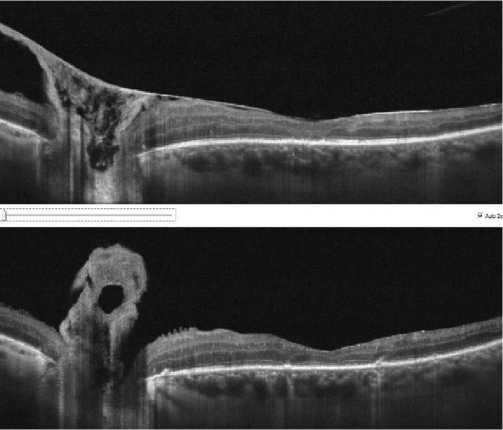
Рис. 1. Оптическая когерентная томограмма макулярной зоны со срезом через диск зрительного нерва пациента Е-ва до (а) и после (б) выполнения витреоретинальной хирургии.

Во всех этих случаях регистрировали постепенное уменьшение объёма остатков фиброваскулярного стебля на поверхности ДЗН с облитерацией сосудов в этом стебле.
Результаты наших предварительных наблюдений позволяют с определенной уверенностью говорить о том, что нарастающие тракции на ДЗН со стороны претерпевающего изменения цилиопапиллярного канала могут стимулировать локальный пролиферативный ответ. Мембраноподобная структура этого канала [1] является остовом для формирования фиброваскулярного стебля. Сокращение пролиферативной ткани усиливает тракционное воздействие со стороны формирующегося стебля на ДЗН, что, в свою очередь, усиливает локальный пролиферативный ответ.
Мы предполагаем следующий механизм развития патологических процессов: нарушение микроциркуляции в области диска зрительного нерва у пациентов с ДРП является первичным и пусковым моментом в патофизиологии ВПТС. На фоне локальной ишемии в области ДЗН начинается локальный пролиферативный процесс. Особенности топографической анатомии этой зоны, наличие оптикоциллиарного канала обуславливают продолжение пролиферации по ходу канала. Формирование фиброваскулярного стебля, его сокращение усиливает пролиферативный ответ, вызывает тракционное воздействие на ткань ДЗН, таким образом возникает порочный круг: пролиферация вызывает тракции, последние активируют пролиферативный ответ.
Современные методы исследования не позволяют измерить возникающие при этом тракционные силы, опосредованно о их наличии и нарастании можно предполагать, анализируя серии кинетических эхограмм и ОКТ, выполненных в разное время. Также подтверждением этому свидетельствуют интраоперационные наблюдения: при иссечении фиброваскулярного стебля интравитреальными ножницами или витреофагом края разреза расходятся. Такой взгляд на патофизиологию ВПТС у пациентов с ПДР акцентирует внимание на значении биомеханического фактора в потенцировании фиброваскулярной пролиферации. Похожую точку зрения высказывал Sebag J. в 2004 году [5].
Причиной низких функциональных результатов после успешной ВРХ может быть повреждение волокон зрительного нерва вследствие их затягивания в фиброваскулярный стебель, с нарушением аксонального транспорта и развитием его атрофии, а также ишемия головки зрительного нерва вследствие уменьшения калибра питающих сосудов, обусловленного тракциями [2].
Результаты наших операций, основной задачей которых было устранение биомеханического (тракционного) воздействия СТ на ДЗН, служат подтверждением этому: во всех случаях остаток стебля фиксированного к зрительному нерву не явился центром репролиферации, со временем по прошествии 3–5 месяцев после ВРХ нами зарегистрировано уменьшение его объема, полное за-пустевание сосудов в нём.
Заключение
Результаты собственных наблюдений свидетельствуют о том, что биомеханическое воздействие СТ на зрительный нерв (нарастание тракций) влияет на прогрессирование ВПТС и является одной из причин ухудшения зрительных функций у данной категории пациентов. Анатомо-топографические особенности этой зоны (наличие оптикоциллиарного канала) способствуют формированию витреопапиллярных тракций у пациентов с ПДР. Также мы можем говорить о том, что развитие патологических изменений при ПДР обусловлено не только действием системных метаболических нарушений, но и воздействием со стороны претерпевающего изменения СТ. Ведущим локальным повреждающим фактором являются витреоретинальные тракции, инициирующие развитие и прогрессирование ВПТС. Начальные проявления ВПТС могут развиваться без явных клинических проявлений ЗОСТ и выявляться только по данным ОКТ. Устранение ВПТС в ходе ВРХ останавливает дальнейшее прогрессирование пролиферативного процесса в области зрительного нерва. Оперативное вмешательство у пациентов, выполненное на ранней стадии диабетического ВПТС уменьшает риск интра- и послеоперационных осложнений, сокращает время оперативного вмешательства, а также дает возможность получить более высокие зрительные функции в послеоперационном периоде.
Авторы заявляют об отсутствии конфликта интересов (The authors declare no conflict of interest).
Список литературы Роль стекловидного тела в патогенезе развития диабетического витреопапиллярного тракционного синдрома
- Беликова С.В. Экспериментальное обоснование способа контрастирования структур стекловидного тела с использованием суспензии "Витреоконтраст". Автореферат диссертации к.м.н., 2012, с.90.
- Kroll P., Wiegand W., Schmidt J.C. (1999): Vitreopapillary traction in proliferative diabetic vitreoretinopathy. Br. J. Ophthalmol. 1999; v 83: p. 261-264.
- Pendergast SD, Martin DF, Proia AD, Jaffe GJ, McCuen BW II. Removal of optic disc stalks during diabetic vitrectomy. Retina. 1995; 15 p.25-28.
- Schepens C.L. Clinical aspects of pathologic changes in the vitreous body. Am.J.Ophthalmol. 1954; v 38, p. 8-21.
- Sebag J. Anomalous posterior vitreous detachment: a unifying concept in vitreoretinal disease. Graefes Arch. Clin.Exp.Ophthalmol. 2004 Aug; v 242(8), p. 690-698.
- Walton, K.A. Age-Related Changes in Vitreous Mobility as Measured by Video B Scan Ultrasound / K.A. Walton, C.H. Meyer, C.J. Harkrider et al. // Experim. Eye Research. - 2002. - Vol. 74, N. 2. - P. 173-180.
- Wisotsky B.J., Magat-Gordon C.B., Puklin J.E. Vitreopapillary traction as a cause of elevated optic nerve head. Am J Ophthalmol. 1998 v 126 p. 137-139.
- Юлдашева Н.М. Пролиферативная дибаетическая ретинопатия: новые аспекты патогенеза, обоснование системы щадящей витреоретинальной хирургии и комплексной фармакотерапии: Автореферат диссертации, 2014, с. 49-51.


