Роль трофобластического P1-гликопротеина человека в регуляции фенотипического созревания NK- и NKT-клеток
Автор: Заморина С.А., Раев М.Б.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Медико-биологические науки
Статья в выпуске: 4, 2015 года.
Бесплатный доступ
Изучено влияние физиологических концентраций трофобластического Р 1-гликопротеина человека (ТБГ) на экспрессию маркеров натуральных киллеров (NK-) и Т-клеток с функциями натуральных киллеров (NKT-) в системе in vitro на модели периферических клеток женщин. В работе использовали препарат ТБГ, полученный по авторской методике, который идентифицировали методом LS/MC. Препарат содержал несколько молекулярных форм белка: ТБГ-1, ТБГ-3, ТБГ-7, ТБГ-9, а также некоторые изоформы и прекурсоры, определяемые in vivo.В целом, полученный препарат максимально близок к изоформному составу ТБГ, обнаруживаемому в сыворотке беременных. Установлено, что ТБГ в высокой концентрации, экстраполируемой со триместра беременности (100 мкг/мл) угнетал экспрессию CD16/56 на NK-клетках, ассоциированную с цитолитической активностью этих клеток. Показано, что ТБГ в низких концентрациях (1 и 10 мкг/мл, экстраполировали с I триместра беременности) усиливал экспрессию CD16/56 на NKT-клетках, связанную с цитокинпродуцирующей активностью. В целом, полученные результаты демонстрируют новые иммуномодулирующие эффекты ТБГ.
Трофобластический р1-гликопротеин человека (тбг), nk-клетки, nkt-клетки, периферическая кровь
Короткий адрес: https://sciup.org/147204746
IDR: 147204746 | УДК: 557.175.6
Текст научной статьи Роль трофобластического P1-гликопротеина человека в регуляции фенотипического созревания NK- и NKT-клеток
Трофобластический pi-гликопротеин (ТБГ) является онкофетальным белком. который продуцируется во время беременности клетками цито- и синцитиотрофобласта. ТБГ играет значимую роль в эмбриональном развитии, инвазии трофобласта и плацентарном ангиогенезе [Посисеева, Назаров, Татаринов, 2004; Терентьев, Молдогазиева, Комаров. 2009]. Известно, что ТБГ обладает выражен-
(С Заморина С. А , Раев М. Б., 2015
ными иммуномодулирующими эффектами [Заморина, Раев, 2015а; Martinez el al , 2013; Wu et al., 2008]. Однако, изучение эффектов ТБГ затруднено в силу отсутствия в открытом доступе препарата этого белка. Для исследований доступны только рекомбинантные формы ТБГ, которые имеют свои недостатки (структурные отличия, неполный фолдинг, неравноценная посттрансляционная модификация и т.д.). В лаборатории экологической иммунологии (ФГБУН ИЭГМ УРО РАН, г. Пермь) разработана и запатентована авторская технология выделения и очистки ТБГ [Раев, 2008]. Получаемый препарат максимально близок к изоформ ному составу ТБГ, обнаруживаемого в сыворотке беременных, Известно, что in iTi t? ТБГ представлен целым белковым подсемейством, состоящим из более чем 30 белков, которое в международных базах данных называется PSG (pregnancy-specific glycoprotein) [Терентьев, Молдогазиева, Комаров, 2009], У человека доминирующим продуктом экспрессии является PSGL который и был идентифицирован в 1970 г как ТБГ [Татаринов, Масюке-вич, 1970].
В последнее время большое внимание уделяется исследованию функций клеток врожденного иммунитета. Натуральные киллеры (NK) являются клетками врожденной защиты, которые без предварительной иммунизации или активации могут распознавать и лизировать клетки-мишени. Все NK-клетки периферической крови делятся на две субпопуляции по уровням экспрессии молекул CD56 и CD 16. Около 90% NK-клеток незначительно экспрессируют CD56 (dim) и одновременно являются позитивными для CD 16 (CD56dirnCD16+). CD 16 представляет собой низкоаффинный рецептор для Fc-фрагмента IgGl и IgG3 (Fey RIII) и участвует в обеспечении реакции антителозависимой клеточной цитотоксичности. Оставшиеся 10% NK-клеток экспрессируют высокие уровни CD 56 (bright) и нс экспрессируют CD 16 (CD56bngtllCD16') [Trundlcy, Moffct, 2004]. Эти субпопуляции различаются функционально: так, CD56dUT1 NK-клетки обладают выраженной цитотоксичностью, а СО56ь"йШ-клетки являются основными цитокин-продупирующими NK-клетками [Cooper et aL 2001].
Натуральные киллерные Т-клетки (NKT) являются отдельной субпопуляцией Т-лимофцитов. Реализуя функции, свойственные NK-клеткам, они одновременно являются мощными продуцентами цитокинов [Collucci, Caligiuri, Di Santo, 2003]. В силу этого факта NKT-клстки принимают участие в отторжении опухоли, предупреждении аутоиммунных реакций, защите от паразитарных или бактериальных инфекций. NKT-клетки способны распознавать антигены в комплексе с CD Id или молекулой главного комплекса гистосовместимости класса G (HLA-G), представленными на клетках плаценты, что может привести к аборту, а при повышении процента CD3^CD16^ клеток в I тримест ре беременности увеличивается риск развития гес-тоза [Борзова и др., 2005]. Очевидно, именно поэтому в период физиологически протекающей беременности функции как NKT-, так и NK- клеток периферического пула, су премированы [Mahmoud et al., 2004; Clark et al., 2008]. Кроме того, во время беременности число NK-клеток существенно снижается [Watanabe, Iwatani. Keneda. 1997].
Учитывая важную роль NK- и NKT-клеток при беременности как эффекторов неспецифической резистентности организма, целью работы являлось изучение иммуномодулирующих эффектов ТБГ на экспрессию CD 16/56 этими клетками б системе in vitro.
Материалы и методы
Получение ТБГ. ТБГ получали методом хроматографии с использованием биоспецифического сорбента с последующим освобождением от иммуноглобулиновой контаминации на колонке Hi-Trap™ Proten G HP («Amersliam Biosciences», Швеция) [Раев, 2008]. В качестве биоспецифического сорбента использовали сефарозу CL 4В, гранулы которой конъюгировали с моноклональными антителами к ТБГ, продуцируемыми гибридомой ВАРЗ («Genoуас», Германия). Предварительно отцентрифугированную при 25000 g сыворотку крови беременных женщин со сроками беременности свыше 36 недель смешивали с сорбентом и инкубировали в течение 36-48 ч. при +4°C. Сорбент переносили в колонку, отмывали фосфатносолевым буфером с pH 7.25 до нулевых значений оптической плотности. Элюцию осуществляли 0.1М глицин-НС! буфером с pH 2.6. Фракции, содержащие белок, объединяли и немедленно подвергали концентрирующей дна фильтрации против физиологического раствора, после чего проводили негативную хроматографию на колонке HiTrap™ Proten G HP.
Содержание ТБГ в препарате, получаемом в ходе выделения и очистки, определяли при помощи иммуноферментного анализа наборами ТБГ-ИФА-Бест («Вектор-Бест», Россия).
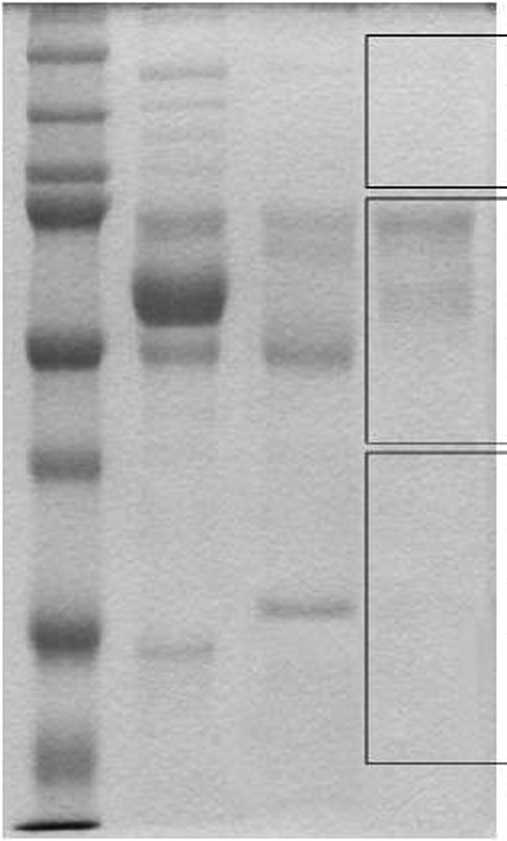
Данные электрофореза в 10%-ном полиакриламидном геле по Л эм мли представлены на рис. 1; молекулярная масса полученного препарата определяется в диапазоне от 50 до 75 kD, что соответствует известным данным [Терентьев, Молдогазиева, Комаров, 2009], Широкий диапазон молекулярной массы объясняется как гетерогенностью ТБГ, так и его способностью образовывать олигомерные формы в результате агрегации. Для точной идентификации полученной серии препарата ТБГ оценивали его состав методом LC/MS (комбинация жидкостного хроматографа с масс-спектрометром). Исследование было проведено в Израильском технологическом институте (Smoler Proteomics Center, руководитель профессор А. Эдмон, «Techтоп», Хайфа, Израиль) на приборе
LTQ-Orbitrap («Thermo Fisher». США). На рис. 1 представлены данные LC/MS для трех исследуемых диапазонов, отмеченных на электрофоре-грамме, из которых следует, что препарат содер жит несколько молекулярных форм белка: ТБГ-L ТБГ-3, ТБГ-7, ТБГ-9, а также некоторые изо(]юр-мы и прекурсоры, определяемые in vivo.
а) 250
15 RD
12 3 4
L °) Верхний диапазон (upper area): pregnancy specific beta-1 -glycoprotein 3 j\ [Homo sapiens]; pregnancy: specific beta-1-glycoprotein 3, isoform CRA_a __j 2 [Homo sapiens];pregnancy specific beta-1 -glycoprotein 1 [Homo sapiens];
pregnancy: specific beta-1-glycoprotein 9, isoform CRA J"[Homo sapiens]; pregnancy: specific beta1 glycoprotein 9, isoform CRA_a [Homo sapiens].
Средний диапазон (middle area): pregnancy specific beta-1-glycoprotein I -* \ [Homo sapiens]; pregnancy-specific beta-1 -glycoprotein 9precursor (PSBG-/ 9fi PSG9 [Homo sapiens] pregnancy specific beta-1-glycoprotein 9 [Homo "V sapiens]; pregnancy specific beta-1 -glycoprotein 3 [Homo sapiens];
pregnancy: specific beta-1-glycoprotein 3, isoform CRA _a (Homo sapiens);
pregnancy*specific beta-1 -glycoprotein 7 [Homo sapiens]; PSG7_HUMAN, partial CDS [Homo sapiens); pregnancy-specific beta-1 glycoprotein 7 [Homo sapiens]; pregnancy specific beta-1 -glycoprotein 7, isoform CRA a J [Homo sapiens]
Нижний диапазон (middle area): pregnancy specific beta-1-glycoprotein 3 -\/ [Homo sapiens]; pregnancy specific beta-1-glycoprotein 3. isoform CRA_a [Homo sapiens]; pregnancy: specific beta-1-glycoprotein 1 [Homo sapiens); pregnancy specific beta-1 -gly coprotein 9, isoform CRAJfHomo sapiens); pregnancy specific beta-1 glycoprotein 9, isoform CRA a [Homo sapiens).
Рис. 1. Идентификация полученного препарата ТБГ:
а) электрофоретическое разделение препарата ТБГ в 10%-ном полиакриламидном геле по Лэммли: 1 -маркеры; 2 - пулированная сыворотка крови беременных женщин; 3 - препарат после сульфат-аммонийного фракционирования и диализующей ультрафильтрации; 4 - препарат после аффинной хроматографии, б) идентифицированные белки семейства PSG в полученном препарате ТБГ по данными LC/MS (название белка по базе http;//www.uniprot,org/)
В работе использовали физиологические концентрации ТБГ, соответствующие его уровню в периферической крови матери в период беременности - 1. 10 и 100 мкг/мл. Уровень ТБГ растет с минимальных значений (1-10 мкг/мл) в первые недели беременности, достигая максимума на 33-36 неделе (100-200 мкг/мл) [Посисеева, Назаров. Татаринов. 2004].
Объекты исследования. В работе использовали фракционированные мононуклеары периферической крови (МПК) практически здоровых доноров, которыми являлись небеременные женщины репродуктивного возраста (п=21). МПК получали центрифугированием в градиенте плотности фи-колл-верографина (1.077 г/см3) («Sigma», США. «Спофа». Чехия, соответственно), после чего клетки отмывали и подвергали воздействию ТБГ (1. 10 и 100 мкг/мл).
Иммунологические методы. После суточной инкубации МПК с ТБГ (полная питательная среда. 5% СО2. 37°С) оценивали фенотип лим(|юцитов. определяя содержание NK-клеток с фенотипом СОЗ CD16+CD56+ и NKT-клеток с фенотипом CD3+CD16+CD56+ (CD3-FITC/CD 16.56-РЕ), согласно методике производителя антител («Beck man Coulter», США). Результаты учитывали на проточном цитофлуориметре FACSCalibur («Becton Dickinson». США).
Статистическая обработка данных проводилась с помощью парного r-критерия Стьюдента.
Результаты и их обсуждение
Известно, что СО56/16-позитивные NK-клетки обладают выраженной цитотоксичностью и принимают активное участие в деструкции аллотранс-плантантов. именно поэтому их уровень в периферической крови беременных существенно снижен [Seshadri. Sunkara, 2014].
Установлено, что суточная инкубация клеточных культур с ТБГ в низких концентрациях (1 и 10 мкг/мл) нс влияет на экспрессию CD 16 CD56 r NK-клетками (рис. 2). Однако в высокой концентрации (100 мкг/мл) ТБГ угнетает уровень CD16+CD56* NK-клеток (рис. 2. 3). Известно, что NK-клетки с фенотипом CD16+ являются наиболее зрелыми и обладают высокой цитолитической активностью [Mitlag el al., 2005]. Кроме того, повышение процента клеток CD56+ в периферической крови связано с ранним прерыванием кариотипически нормальной беременности [Coulam el al., 1995].
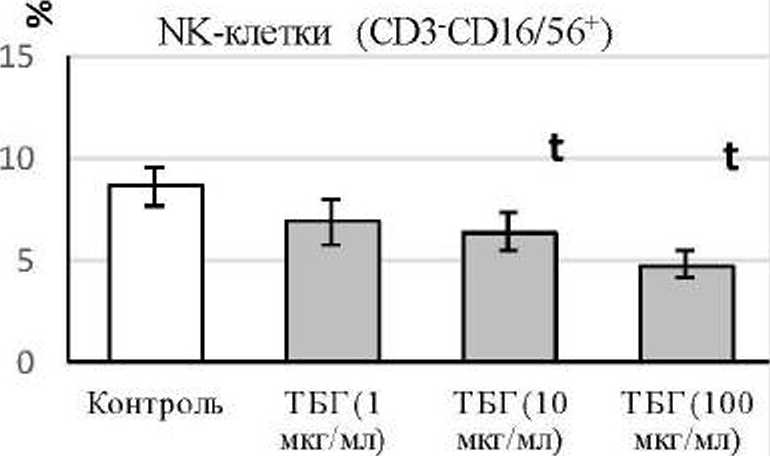
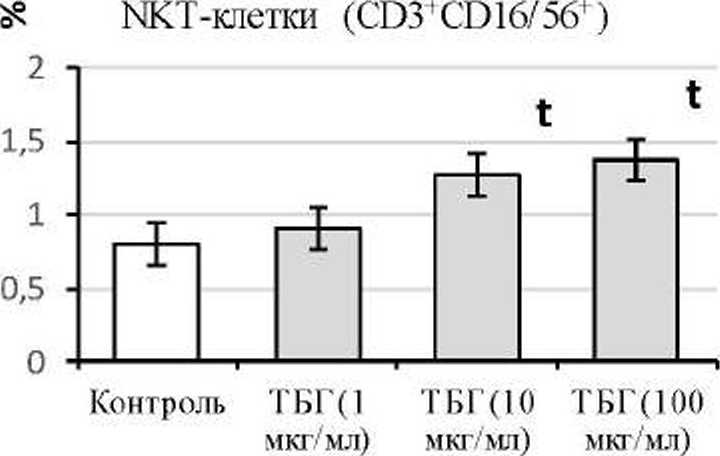
Рис. 2. Влияние ТБГ на экспрессию CD 16/56 NK- и NKT-клетками (п=8)
Возможно, депрессивный эффект ТБГ опосредован интерлейкином (1L)-1O, который снижает функциональную активность NK-клеток, а ТБГ стимулирует продукцию этого цитокина | Wu et al.. 2008; Заморина, Раев, 2015б|.
Таким образом, угнетающее действие ТБГ в отношении экспрессии CD16 CD56+ NK-клетками может иметь значение в протекции полуаллогенно-го плода от атаки цитотоксических NK клеток. Кроме того, известно, что ТБГ оказывает эффекты в тесной функциональной связке с TGF-p. непосредственно активируя продукцию этого цитокина [Ballesteros et al.. 2015]. Известно, что клетки тро-фобласта устойчивы к лизису цитотоксическими Т-лимфоцитами и NK-клетками. но не резистентны к лизису активированными NK (LAK-клетки). TGF-Р, в свою очередь, подавляет активацию NK-клеток и их превращение в LAK-клетки. Именно TGF-p, в свою очередь, способствует трансформации периферических CD 16'CD9NK-клеток в децидуальные CD16 CD9TiNK-K.ierKH [Keskin et al., 2007]. Важно отметить, что CD9 (тетраспонин) рассматривается как потенциальный рецептор для ТБГ [На et al., 2005], он присутствует на Т-лимфоцитах, но слабо экспрессируется на периферических NK-клетках. В то же время именно его экспрессия характеризует трансформацию клетки в dNK. Довольно интересно, что CD9 может в небольшом проценте коэкспрессироваться с CD56 на периферических NK-клетках [Sanchez-Rodriguez et al., 2011]. В целом ТБГ. вероятно, воздействует на эти процессы через вовлечение TGF-p. что в итоге приводит к трансформации NK-клеток в децидуальные CD16CD9uNK.
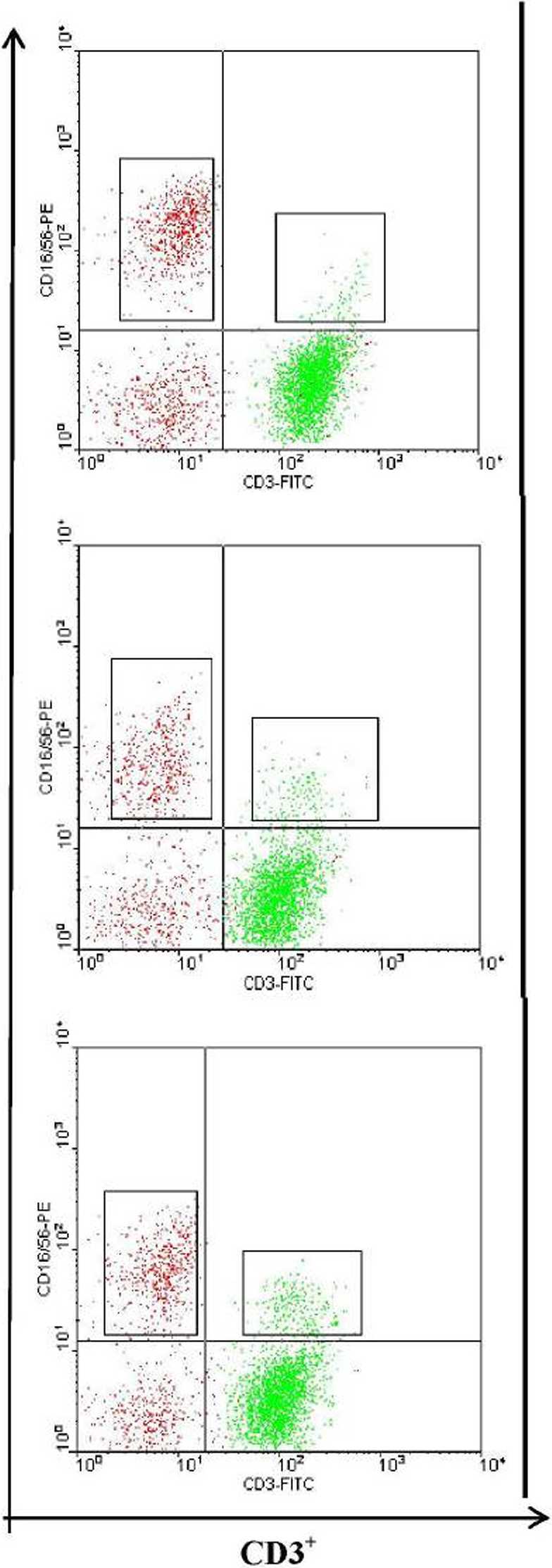
Рис. 3. Влияние ТБГ на экспрессию CD 16/56 NK- и NKT-клетками на примере одного эксперимента.
В правом верхнем квадранте указан процент CD3+CD16/56+ - в гейте лимфоцитов, в левом верхнем - CD3-CD16/56+. По оси X - интенсивность флуоресценции по каналу FL1 (окрашивание PITC); по оси у - интенсивность флуоресценции по каналу FL2 (окрашивание РЕ)
NКТ-клетки являются отдельной субпопуляцией Т-лимфоцитов. Реализуя функции, свойствен- ные NK-клеткам, они одновременно являются мощными продуцентами цитокинов. Кроме того. NKT-клетки составляют субпопуляцию регуляторных Т-лимфоцитов, которые наряду’ с дендритными клетками играют ведущую роль в Т111/Т112 девиации и формировании периферической толерантности [Boyson et aL 2002]. Известно, что NKT-клетки периферической крови имеют большое значение в период имплантации, индуцируя цитокиновое окружение ТЬ2-типа [Boyson et aL 2002].
Установлено. что ТБГ в низкой концентрации (1 мкг/мл) не влиял на уровень СВ16+СО5бД4КТ-клеток (рис. 2.. 3) . В то же время, в концентрациях 10 и 100 мкг/мл ТБГ увеличивает процент CD 16+CD 56 ДчГКТ-клеток. Важно отметить, что повышение процента CD3 CD 16 клеток в ранние сроки беременности, когда уровень ТБГ еще невысок. может увеличивать риск развития гестоза [Борзова и др.. 2005]. Однако такой зависимости для П-Ш триместра не обнаружено.
Таким образом, ТБГ в высоких концентрациях, экстраполированных с II-III триместра беременности. способствует фенотипическому созреванию NKT-клеток, ассоциированному с усилением их цитокин-проду циру ющей активности. Вероятно, выявленные эффекты ТБГ в отношении CD 16 CD 56 NKT-клеток являются одним из возможных механизмов участия ТБГ в поддержании баланса цитокинов и формировании периферической толерантности при беременности.
В целом полученные результаты демонстрируют новые иммуномодулирующие эффекты ТБГ. Известно, что у женщин с такими аутоиммунными заболеваниями, как ревматоидный артрит или рассеянный склероз, отмечается улучшение состояния во время беременности, а повышенные уровни сывороточного ТБГ коррелировали с улучшением состояния [Терентьев, Молдогазиева, Комаров. 2009]. Дальнейшее изучение влияния роли ТБГ в формировании иммунной толерантности откроет возможности его применения в качестве перспективного средства для лечения аутоиммунных заболеваний.
Список литературы Роль трофобластического P1-гликопротеина человека в регуляции фенотипического созревания NK- и NKT-клеток
- Борзова Н.Ю. и др. Способ прогнозирования гестоза легкой степени тяжести с ранних сроков беременности. Патент РФ № 2265221 от 27.11.05
- Заморина С.А., Раев М.Б. Роль трофобластического Р1-гликопротеина человека в регуляции факторов, ассоциированных с иммунологической толерантностью//Доклады Академии наук. 2015а. Т. 6(2). C. 232-235
- Заморина С.А., Раев М.Б. Изучение иммуномодулирующих эффектов трофобластического Р1 гликопротеина человека//Физиология человека. 2015б. Т. 41(1). P. 117-123
- Посисеева Л.В., Назаров С.Б., Татаринов Ю.С. Трофобласт-специфический бета-гликопротеин в акушерстве и гинекологии. Иваново: Иваново, 2004. 240 с
- Раев М.Б. Способ выделения и очистки трофобластического Р-1-гликопротеина. Патент РФ № 2367449 от 21.02.2008
- Татаринов Ю.С., Масюкевич В.Н. Иммунохимическая идентификация нового Р 1-глобулина в сыворотке крови беременных женщин//Бюллетень экспериментальной биологии и медицины. 1970. Т. 69, № 6. С. 66-68
- Терентьев А.А., Молдогазиева Н.Т., Комаров О.С. Изучение трофобластического бета-глобулина человека -некоторые итоги и перспективы//Международный журнал прикладных и фундаментальных исследований. 2009. № 6. С. 3033
- Ballesteros A. et al. Induction and activation of latent transforming growth factor-p1 are carried out by two distinct domains of pregnancy-specific glycoprotein 1 (PSG1)//J Biol. Chem. 2015. Vol. 290, № 7. P. 4422-4431
- Boyson J.E. et al. CD1d and invariant NKT cells at the human maternal-fetal interface//Proc. Natl. Acad. Sci. USA. 2002. Vol. 99. P. 13741-13746
- Clark D.A. et al. CD200-dependent and nonCD200-dependant pathways of NK cell suppression by human IVIG//J. Assist. Reprod. Genet. 2008. Vol. 25. P. 67-72
- Collucci F., Caligiuri M.A., Di Santo J.P. What does it take to make a natural killer?//Nature Rev. Immunol. 2003. Vol. 3. P. 413-425
- Cooper M.A. et al. Human natural killer cells: a unique innate immunoregulatory role for the CD56brigth subset//Blood. 2001. Vol. 97. P. 4651
- Coulam C.B. et al. Systemic CD56+ cells can predict pregnancy outcome//Am. J. Reprod. Immunol. 1995. Vol. 33. P. 40-46
- Ha C.T. et al. Binding of pregnancy-specific glyco-protein 17 to CD9 on macrophages induces secretion of IL-10, IL-6, PGE2, and TGF-P1//J. Leukoc. Biol. 2005. Vol. 77, № 6. P. 948-957
- Keskin D.B. et al. TGF-beta promotes conversion of CD16+ peripheral blood NK cells into CD16-NK cells with similarities to decidual NK cells//Proc. Natl. Acad. Sci. USA. 2007. Vol. 104, № 9. P. 3378-3383
- Mahmoud F. et al. Effect of IgG therapy on lymphocyte subpopulations in the peripheral blood of Kuwaiti women experiencing recurrent pregnancy loss//Gynecol. Obstet. Invest. 2004. Vol. 58(2). P. 77-83
- Martinez F.F. et al. The role of pregnancy-specific glycoprotein 1a (PSG1a) in regulating the innate and adaptive immune response//Am. J. Reprod. Immunol. 2013. Vol. 69, № 4. P. 383-394.
- Mittag A., Lenz D.V., Gerstner A.O. et al. Polychromatic (eight-color) slide-based Cytometry for the phenotyping of leukocyte, NK, and NKT subsets//Cytometry. 2005. Vol. 65, № 2. P. 103-115
- Sanchez-Rodriguez E.N. et al. Persistence of decidual NK cells and KIR genotypes in healthy pregnant and preeclamptic women: a case-control study in the third trimester of gestation//Reprod Biol. Endocrinol. 2011. Vol. 9, № 9 DOI: 10.1186/14777827-9-8
- Seshadri S., Sunkara S.K. Natural killer cells in female infertility and recurrent miscarriage: a systematic review and meta-analysis//Hum. Reprod. 2014. Vol. 20, № 3. Р. 429-438
- Watanabe M., Iwatani Y., Keneda T. Changes in T, B and NK lymphocytes subsets during and after normal pregnancy//Am. J. Reprod. Immunol. 1997. Vol. 37. P. 368-377
- Wu J.A. et al. Murine pregnancy-specific glycoprotein 23 induces the proangiogenic factors transform-ing-growth factor beta 1 and vascular endothelial growth factor a in cell types involved in vascular remodeling in pregnancy//Biol. Reprod. 2008. Vol. 79, № 6. Р. 1054-1061


