Роль убиквитин-протеасомной системы в патогенезе рака желудка
Автор: Иванова Э.В., Кондакова И.В., Черемисина О.В., Афанасьев С.Г.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Обзоры
Статья в выпуске: 5 (65), 2014 года.
Бесплатный доступ
Представлены данные об участии убиквитин-протеасомной системы в патогенезе рака желудка. Показана роль протеасомной системы в регуляции клеточного цикла, неоагиогенеза и метастазирования опухоли. Рассматриваются аспекты участия убиквитин-протеасомной протеолитической системы в патогенезе усиленного распада мышечных белков при раковой кахексии. Обсуждается роль протеасомной системы в развитии рака желудка, индуцированного H. Pylori. При метастатическом раке желудка перспективным направлением исследований является клиническая оценка эффективности селективного ингибитора протеасом - таргетного препарата бортезомиб.
Протеасомы, убиквитин, рак желудка
Короткий адрес: https://sciup.org/14056466
IDR: 14056466 | УДК: 616.33-006.6-092:577.152.34
Текст обзорной статьи Роль убиквитин-протеасомной системы в патогенезе рака желудка
26S-протеасомы необходимы для развития иммунного ответа и формирования комплексов гистосовместимости I класса [9].
Характеристика убиквитин-протеасомной системы
В последнее время пристальное внимание исследователей сосредоточено на убиквитин-зависимой протеасомной деградации белков, которая является конечным этапом внутриклеточного протеолиза [1, 7]. Деградация подавляющего большинства (80–90 %) внутриклеточных белков осуществляется протеасомами, которые представляют собой мультисубъединичные структуры, содержащие внутриклеточную полость, где расположено несколько пептидазных центров [1]. Четвертичная структура коровой 20S-протеасомы состоит из α- и β-субъединиц, которые образуют по 2 гептамерных кольца, сложенных стопкой. Внешние кольца содержат только α-субъединицы, а внутренние два кольца – только β-субъединицы. Пространственная структура всех протеасомных субъединиц одина- кова, что следует из высокой гомологии аминокислотной последовательности α- и β-субъединиц. Внутреннее пространство протеасомы разделено на три компартмента: две внешние полости и одна внутренняя протеолитическая полость [8]. Известно, что протеасомы обладают трипсино-, химотрипсино- и каспазоподобной активностями, а также способностью гидролизовать пептидные связи после аминокислот с разветвленным радикалом [12].
Субъединица β1 обладает каспазоподобной активностью (гидролизует пептидную связь после отрицательно заряженных аминокислотных остатков), субъединица β2 – трипсиноподобной активностью, т.е. гидролизует пептидную связь преимущественно после положительно заряженных аминокислотных остатков, тогда как β5 – химотрипсиноподобной активностью, т.е. гидролизует пептидную связь после объемных гидрофобных радикалов аминокислотных остатков [8].
Основным регуляторным компонентом 26S-протеасомы является 19S регуляторная частица. Она отвечает за узнавание полиубиквитинирован-ных белков и, таким образом, обеспечивает селективность деградации субстрата. 19S регуляторная частица вовлечена в открытие поры коровой 20S-протеасомы, разворачивание субстрата и продвижение его в протеолитическую полость [7].
По набору протеолитически активных субъединиц 26S-протеасомы млекопитающих можно разделить на 2 группы: конститутивные и иммунные [15]. Иммунные протеасомы содержат γ-интерферониндуцируемые каталитические субъединицы LMP7 (β5i), LMP2(β1i) и MECL1 (β2i) вместо каталитических субъединиц X (β5), Y (β1) и Z (β2) конститутивных протеасом и выполняют несколько функций в иммунном ответе, в основном презентацию комплекса гистосовместимости I класса. Считается, что в отличие от конститутивной иммунопротеасома генерирует пептиды, которые в последующем используются в презентации антигенов [14].
Отбор субстратов для протеолиза обеспечивается тем, что вход в 20S-протеасому обычно закрыт, и проникнуть в нее могут только белки, несущие специальную «метку». В качестве «метки» выступает полиубиквитиновая цепь (полиUb), состоящая как минимум из четырех мономеров убиквитина (Ub), присоединение убиквитина к белку-субстрату осуществляет убиквитин-лигаза Е3, которая осуществляет несколько циклов убиквитинирования. При входе в канал протеасомы полипептидная цепь белка разворачивается и протягивается через него, гидролизуясь до коротких пептидов, которые выходят на противоположном полюсе протеасомы. Сам убиквитин внутрь протеасомы не заходит, а после протеолиза маркированной им молекулы освобождается и метит другую мишень. Протеасома может регулировать не только количество, но и функции белков: в некоторых случаях белок не гидролизуется до коротких пептидов, а подвергается ограниченному протеолизу (процессингу), в результате которого функции белка могут существенным образом изменяться (рис. 1). Внушительное число ключевых регуляторных белков клетки элиминируется или процессируется протеасомой. Среди них циклины, ингибиторы циклин-зависимых киназ, фосфатазы, киназы, факторы транскрипции и трансляции. Такая важная биологическая роль протеасомной системы подразумевает, что она неминуемо должна быть вовлечена в патофизиологические процессы, результатом которых является развитие аутоиммунных, воспалительных, вирусных, нейродегенеративных и онкологических заболеваний [8].
Протеасомы ответственны за избирательную деградацию белков в клетке и, таким образом, играют ключевую роль в таких клеточных процессах, как регуляция апоптоза, пролиферации и клеточного цикла, противоопухолевой иммунной системы, неоангиогенеза, прогрессирования и метастазирования опухоли [13]. В исследованиях последних лет большое внимание уделяется изучению активности и субъединичного состава протеасом в опухолях различных локализаций. Выявлено, что при раке молочной железы, эндометрия, плоскоклеточном раке головы и шеи химотрипсинподобная активность протеасом в опухолевых клетках значительно выше, чем в клетках условно-нормальной ткани [4, 5, 11].
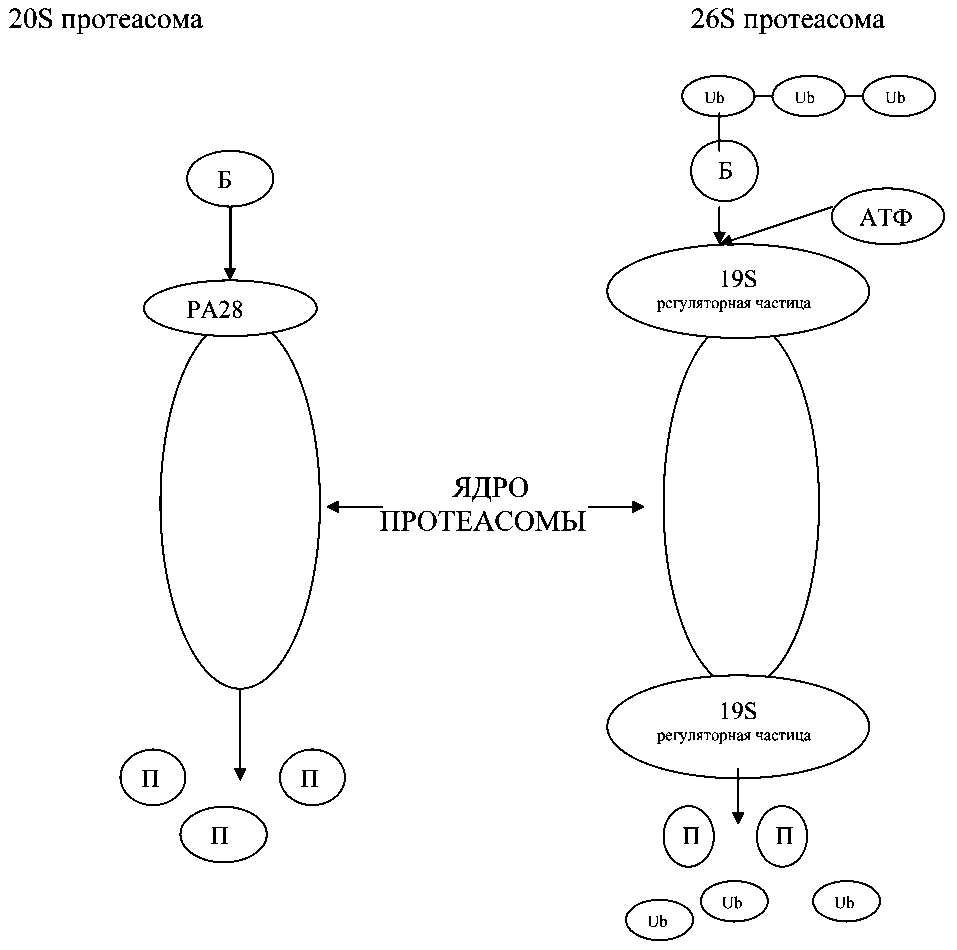
Рис. 1. Схема протеолиза в протеасомах: Б – белок; П – пептид; Ub – молекула убиквитина
Заключение


