Роль удаленного мониторинга в выявлении дислокации дефибрилляционного электрода: клинический случай
Автор: Амирасланов А. Ю., Дедух Е. В., Артюхина Е. А.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические случаи
Статья в выпуске: 2 т.38, 2023 года.
Бесплатный доступ
Системы удаленного мониторинга (УМ) работы имплантированных антиаритмических устройств становятся распространенным методом контроля функционирования с возможностью регистрации аритмии и передачи данных врачу, наряду с плановыми проверками в медицинских учреждениях. Важно информировать пациентов о возможных внеочередных посещениях клиники и необходимости телефонной связи с врачом. В представленном ниже клиническом случае пациент, не ощутив шокового разряда имплантированного кардиовертера-дефибриллятора (ИКД), не связался с клиникой. Полученное врачом оповещение и последующий анализ данных УМ устройства позволили выявить и своевременно устранить дислокацию дефибрилляционного электрода в условиях стационара.
Удаленный мониторинг, имплантируемый кардиовертер-дефибриллятор, желудочковая тахикардия, фибрилляция предсердий
Короткий адрес: https://sciup.org/149142838
IDR: 149142838 | УДК: 616.12-008.313/.318-089.819.843:004.891 | DOI: 10.29001/2073-8552-2023-38-2-235-240
Текст научной статьи Роль удаленного мониторинга в выявлении дислокации дефибрилляционного электрода: клинический случай
С момента своего появления в 1980 г. имплантируемый кардиовертер-дефибриллятор (ИКД) зарекомендовал себя как эффективная стратегия профилактики внезапной сердечной смерти (ВСС) у пациентов с опасными для жизни желудочковыми аритмиями (ЖА). Рандомизированные клинические исследования показали снижение смертности от аритмий на 50–70% как при первичной, так и при вторичной профилактике. По этой причине в течение последних десятилетий имплантация ИКД относится к классу показаний I у пациентов с риском ЖА и ВСС [1].
Согласно рекомендациям Европейского общества кардиологов (2021), плановый амбулаторный контроль пациентов с ИКД назначается каждые 3–6 мес. [2]. Сроки между проверками могут сокращаться в случае выявления таких настораживающих врача событий, как признаки истощения батареи, изменения параметров электродов, частые эпизоды тахиаритмии и любые программные изменения настроек устройства, требующие оценки эффективности лечения пациента в ближайшие сроки [3].
Впервые система удаленного мониторинга (УМ) работы имплантированных антиаритмических устройств у пациентов была представлена в 2001 г. УМ ИКД позволяет передавать информацию, хранящуюся в устройстве, дистанционно из дома пациента в сервисный центр, где данные обрабатываются и становятся доступными для лечащего врача. Указанные данные включают в себя информацию о функционировании имплантированной системы: статусе батареи, сопротивлении электродов, эпизодах тахиаритмий в виде внутрисердечных электрограмм (ЭГМ), графиков и таблиц [4, 5]. Периодичность передачи информации настраивается врачом на защищенном паролем сайте [3]. Получаемые оповещения можно разделить на базовые/плановые и тревожные, которые могут приходить в виде уведомлений на телефон врача. В случае получения шоковых разрядов, особенно первых, или предупреждающих звуковых сигналов ИКД, пациенту необходимо активно связаться с клиникой и быть готовым к внеплановой проверке устройства.
Благодаря УМ, контроль состояния пациента перестал ограничиваться процедурами амбулаторного осмотра в клинике. Клинические решения, принимаемые на основе данных УМ, более чем в 95% случаев коррелируют с решениями, принятыми в ходе стандартного амбулаторного контроля [6]. Выявленные с помощью УМ осложнения у пациентов с ИКД чаще всего связаны с нарушением детекции желудочковой тахикардии (ЖТ), антитахиарит-мической стимуляцией (АТС) или немотивированными шоками при отсутствии истинных ЖА, переломами и дислокацией электродов [7]. Такие осложнения опасны для жизни пациента, требуют своевременной диагностики и оказания оптимальной медицинской помощи. Представленный клинический случай демонстрирует диагностику дислокации дефибрилляционного электрода с помощью данных, полученных с помощью УМ.
Клинический случай
Пациент А., 63 лет, поступил в отделение хирургического лечения сложных нарушений ритма сердца для имплантации однокамерного ИКД в плановом порядке.
Основной клинический диагноз: дилатационная кардиомиопатия. Нарушения ритма и проводимости сердца: постоянная форма фибрилляции-трепетания предсердий (нормо-бради форма), неустойчивые пароксизмы желудочковой тахикардии, CHA2DS2VASc-4 балла. Осложнения: хроническая сердечная недостаточность, НК 2б (со снижением фракции выброса левого желудочка (ЛЖ) до 24%), III функциональный класс по NYHA. Гипертоническая болезнь III ст., 3-я степень артериальной гипертонии (АГ), риск сердечно-сосудистых осложнений (ССО) 4. Сахарный диабет, 2-й тип. Анамнез фибрилляции предсердий (ФП) более 5 лет.
По данным холтеровского мониторирования электрокардиограммы, основной ритм сердца – ФП со среднесуточной частотой желудочковых сокращений 60 в мин, устойчивые эпизоды брадикардии до 35 в мин с максимальной паузой ритма 4,1 с (преходящий синдром Фредерика) в дневное время, частые эпизоды неустойчивой ЖТ. Ширина QRS комплекса – 80 мс. Отмечались приступы синкопе. Проведенная коронароангиография гемодинамически значимых стенозов не выявила. Данные эхокардиографии: фракция выброса ЛЖ – 32% по Simpson, левое предсердие – 51 × 76 мм, конечный диастолический объем ЛЖ – 175 мл, конечный систолический объем ЛЖ – 106 мл, акинезия базального и среднего перегородочных сегментов ЛЖ.
Пациенту имплантирован однокамерный кардиовертер-дефибриллятор. Дефибрилляционный электрод с предсердной детекцией имеет 3 канала записи ЭГМ: предсердный канал – проксимальный, шоковый – средний, желудочковый канал – дистальный. Настройка ИКД: режим VVI 50 в мин, предсердный сигнал – 1,4 мВ, желудочковый сигнал – 13,7 мВ, порог стимуляции – 0,8 В, сопротивление – 550 Ом (шоковый – 48 Ом). Установленные параметры: амплитуда стимула – 3,5 В, автоматическая чувствительность, длительность импульса – 0,4 мс, терапия в двух диапазонах: ЖТ – цикл 330 мс и выше, фибрилляция желудочков – цикл 300 мс и выше. Терапия представлена АТС (режимы Burst и Ramp) и дефибрилляцией разрядом 40 Дж. Пациенту рекомендована плановая проверка ИКД через 1 мес. после операции.
При анализе данных УМ в течение трех недель после имплантации кардиовертера-дефибриллятора нарушений выявлено не было. На ЭГМ в течение более 90% времени регистрировалась стимуляция желудочков в режиме VVI с частотой 50 в мин, адекватная детекция ФП по предсердному каналу (рис. 1). Однако через 3 нед. после операции получено уведомление на телефон о нанесении шокового разряда ИКД. У пациента развился приступ тахикардии с циклом 324 мс (в зоне ЖТ) и длительностью 4 мин. Выполнено 16 АТС без эффекта и 1 шоковый разряд 40 Дж.
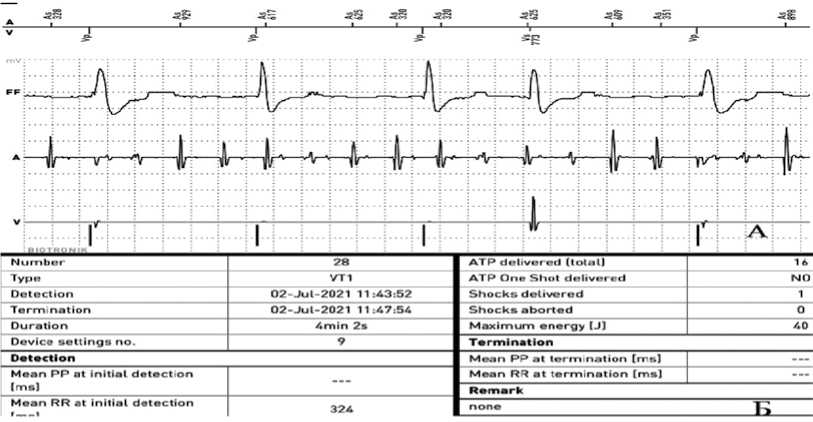
Рис. 1. А: нормальная работа имплантированного кардиовертера-дефибриллятора, предшествующая тахикардии. На предсердном канале регистрируется фибрилляция предсердий
Примечание: FF – электрограмма (ЭГМ) с шокового канала, А – ЭГМ с предсердного канала, V – ЭГМ с желудочкового (дистального) канала.
Fig. 1. A: standard ICD functioning preceding tachycardia. Atrial fibrillation is recorded in the atrial canal
Note: FF – shock channel electrogram (EGM), A – atrial EGM, V – ventricular EGM (pacing lead).
По данным ЭГМ, на предсердном и шоковом каналах зарегистрирован «шум» и снижение амплитуды сигнала (рис. 2А), на дистальном (желудочковом) канале частота событий более 330 мс воспринята как ЖТ. Далее с предсердного канала происходит исчезновение сигнала, на шоковом – регистрация «шума», а на желудочковом – снижение амплитуды сигнала (рис. 2Б). Неоднократное проведение АТС в режимах Burst и Ramp не оказало эффекта. Постепенно амплитуда сигнала снизилась до минимальной, все еще необходимой для детекции тахикардии. ИКД произведен шоковый разряд 40 Дж с последующим исчезновением дистального сигнала, начата неэффективная стимуляция желудочков с базовой частотой (рис. 2В). Эпизод тахикардии расценен устройством как купированный. Исходя из анализа данных УМ, предположена дислокация электрода.
После связи с пациентом по телефону назначен внеплановый визит. При осмотре выяснено, что пациент получил травму грудной клетки, время получения которой хронологически совпадало с принятым через УМ предупреждающим уведомлением. Однако активно с клиникой пациент не связался, шоковый разряд ИКД на фоне полученной травмы не ощутил. Из-за удаленности региона проживания пациент прибыл на внеплановое тестирование через 3 дня.
Во время осмотра на кардиомониторе регистрировалась ФП с частотой желудочковых сокращений 40 в мин. При проверке ИКД выявлена неэффективная стимуляция желудочков на максимальных параметрах амплитуды стимула. По дороге в центр у пациента отмечались несколько эпизодов синкопе. Рентгенографически подтверждена дислокация электрода в полость правого предсердия (рис. 3А).
Детальный анализ данных на сохраненных ЭГМ после шокового разряда позволил выявить зарегистрированные эпизоды неустойчивой наджелудочковой и ЖТ на дистальном канале, что связано с колебаниями дислоцированного электрода в правом предсердии. При контакте с миокардом ИКД воспринимал ФП. Восприятие одной или другой тахикардии определялось текущим показателем стабильности R-R интервала. Временно отключены «шоковая» терапия и АТС.
Пациенту выполнена операция – репозиция желудочкового электрода (рис. 3Б). Электрод был позиционирован в верхушку правого желудочка с удовлетворительными параметрами. Настройки ИКД остались прежними, кроме увеличения базовой частоты с 50 до 60 стимулов в мин. На третьи сут после операции пациент был выписан домой в удовлетворительном состоянии.
Обсуждение
Системы УМ созданы для удаленного динамического наблюдения за адекватной работой имплантированных устройств. При периодическом анализе данных УМ выявляются случаи, требующие внеплановых визитов пациента в стационар. Степень срочности этих визитов зависит от характера осложнения. Исследование TRUST с участием 1339 человек продемонстрировало, что удаленный домашний мониторинг с автоматическим ежедневным наблюдением за ИКД является безопасным и эффективным, позволяет быстро оценить врачом состояние значимых событий.
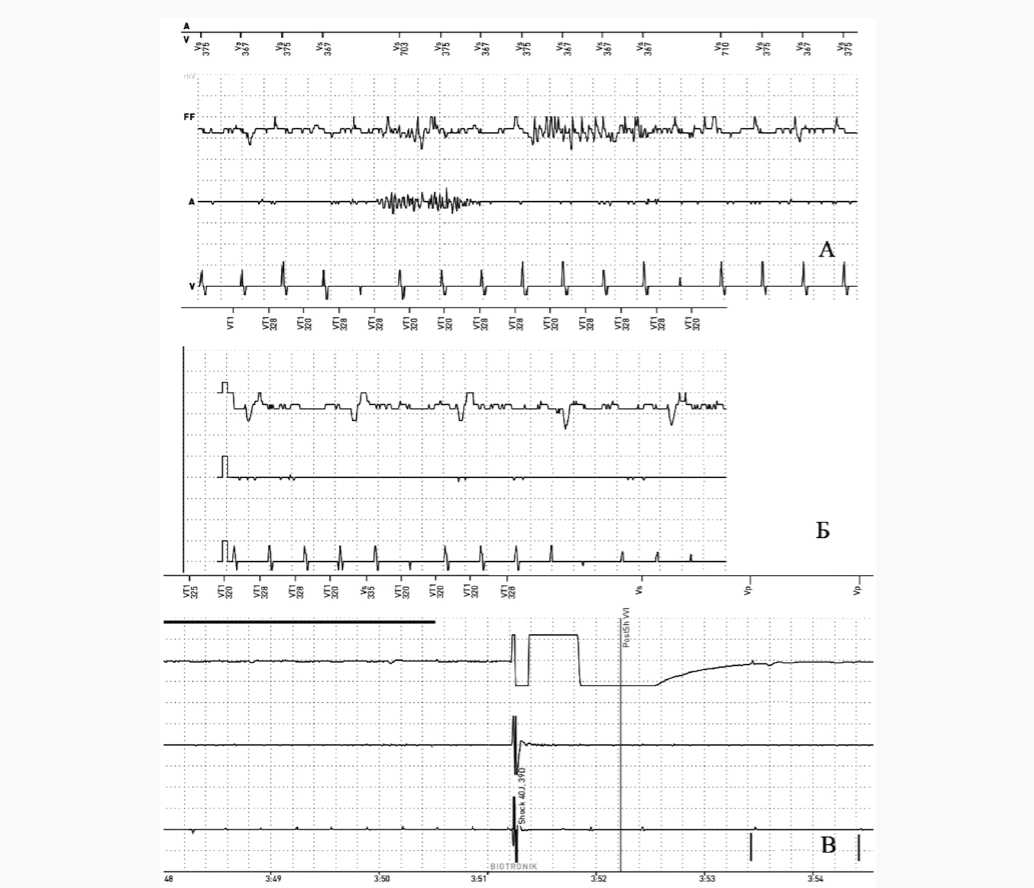
Рис. 2. Электрограмма А: «шум» на предсердном и шоковом каналах, снижение амплитуды сигнала. Б: тахикардия попадает в диапазон желудочковой тахикардии, снижается амплитуда желудочкового сигнала. В: нанесение шокового разряда 40 Дж, неэффективная стимуляция желудочков с базовой частотой, отсутствие сигнала
Fig. 2. Electrogram А: «noise» on the atrial and shock channels, signal amplitude reduction. B: tachycardia falls within the range of ventricular tachycardia, the amplitude of the ventricular signal decreases. C: applying a shock discharge of 40 J, ineffective ventricular pacing at a base rate, no signal
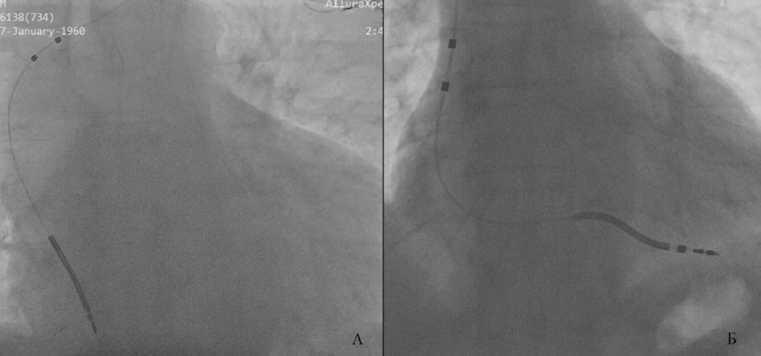
Рис. 3. А: дислокация электрода. Б: после репозиции электрода Fig. 3. А: lead dislocation. B: after the lead reposition
Среднее количество плановых и внеплановых визитов в клинику и стационар составило 2,1 пациенто-год в группе УМ по сравнению с 3,8 пациенто-год в традиционной группе (р < 0,001). Следовательно, общее количество посещений медицинского учреждения в группе УM за 12 мес. сократилось на 45% [8].
В исследовании COMPAS с участием 538 пациентов выявлено, что при использовании УМ в 3 раза снижается число госпитализаций пациентов по поводу предсердных тахиаритмий и в 4 раза - частота инсультов ( p < 0,05) по сравнению с результатами планового амбулаторного контроля [9]. Возможности УМ показали свою значимость в клинической практике в период пандемии COVID-19 [10]. Применение УМ значимо сокращает число плановых визитов пациентов в стационар и уменьшает время выявления осложнений во время пандемии [11].
В работе О.С. Труновой и соавт. отмечено, что качество жизни пациентов с возможностью телеметрического контроля работы ИКД оказалось значимо выше практически по всем шкалам опросника SF-36, чем в группе пациентов без УМ [12]. По данным Е.В Дамриной и соавт., использование УМ для амбулаторного ведения пациентов с ИКД не отличается по эффективности выявления аритмий и дисфункции электродов в сравнении с плановым тестированием в клинике. При этом авторы отмечают, что УМ позволяет в более ранние сроки предоставить врачу ЭГМ при аритмии в отличие от плановых тестирований в клинике, что дает возможность удаленно принять решение о дальнейшей тактике ведения больного [13].
Дислокация электрода ИКД особенно опасна для пациентов с клинически значимой брадикардией и устой- чивыми желудочковыми аритмиями [6, 7]. При сопутствующих персистирующих предсердных тахикардиях возможна ложная детекция ЖТ, которая может привести к необоснованному нанесению шоков и АТС [7, 14]. J.A.B. Zaman и соавт. в своем исследовании указывают на положительную прогностическую значимость снижения амплитуды желудочкового сигнала и повышения порога стимуляции в диагностике дислокации дефибрилляци-онных электродов. При оценке данных ЭГМ и статистики ИКД установлено, что у 20 из 21 пациентов дислокация электродов выявлена в среднем за 11 дней до рентгенологического подтверждения диагноза [15].
В представленном клиническом случае регистрировалось снижение амплитуды желудочкового сигнала и неэффективная стимуляция желудочков. С момента выявления дислокации электрода по данным УМ до хирургического вмешательства прошло 4 дня.
Заключение
УМ ИКД позволяет вовремя выявлять осложнения у пациентов, в том числе и дислокацию электродов. В каждом отдельном случае при анализе полученных данных требуется индивидуальный подход. Врач имеет возможность настраивать частоту получения и виды тревожных сообщений, а также видеть самое важное в первую очередь. Представленный выше последовательный анализ изменений ЭГМ, полученных с помощью УМ, позволил предположить дислокацию дефибрилляционного электрода. Своевременное выявление и устранение осложнения защитили пациента с ИКД от приступов потери сознания и необоснованных шоковых разрядов.
Список литературы Роль удаленного мониторинга в выявлении дислокации дефибрилляционного электрода: клинический случай
- Van Dijk V.F., Boersma L.V. The subcutaneous implantable cardioverter defibrillator in 2019 and beyond. Trends Cardiovasc. Med. 2020;30(6):378-384. https://doi.org/10.1016/j.tcm.2019.09.006.
- Glikson M., Nielsen C., Kronborg M., Michowitz Y., Auricchio A., Barbash I.M. et al. 2021 ESC Guidelines on cardiac pacing and cardiac resynchronization therapy. Eur. Heart J. 2021;42(35):3427-3520. https://doi.org/10.1093/eurheartj/ehab364.
- Лебедева В.К., Любимцева Т.А., Лебедев Д.С. Удаленный мониторинг в наблюдении за пациентами с электрокардиостимуляторами, имплантируемыми кардиовертерами-дефибрилляторами и устройствами сердечной ресинхронизирующей терапии. Вестник аритмологии. 2017;(88):57-61.
- Burri H., Senouf D. Remote monitoring and follow-up of pacemakers and implantable cardioverter defibrillators. Europace. 2009;11(6):701-709. https://doi.org/10.1093/europace/eup110.
- Health Quality Ontario. Remote Monitoring of Implantable Cardioverter-Defibrillators, Cardiac Resynchronization Therapy and Permanent Pacemakers: A Health Technology Assessment. Ont. Health Technol.Assess Ser. 2018;18(7):1-199.
- Lazarus A. Remote, wireless, ambulatory monitoring of implantable pacemakers, cardioverter defibrillators, and cardiac resynchronization therapy systems: analysis of a worldwide database. Pacing Clin. Electrophysiol. 2007;30(s1):S2-S12. https://doi.org/10.1111/j.1540-8159.2007.00595.x.
- Spencker S., Coban N., Koch L., Schirdewan A., Müller D. et al. Potential role of home monitoring to reduce inappropriate shocks in implantable cardioverter-defibrillator patients due to lead failure. Europace. 2009;11(4):483-488. https://doi.org/10.1093/europace/eun350.
- Varma N., Epstein A.E., Irimpen A., Schweikert R., Love C. et al. TRUST Investigators. Efficacy and safety of automatic remote monitoring for implantable cardioverter-defibrillator follow-up: the Lumos-T Safely Reduces Routine Office Device Follow-up (TRUST) trial. Circulation. 2010;122(4):325-332. https://doi.org/10.1161/CIRCULATIONAHA.110.937409.
- Mabo P., Victor F., Bazin P., Ahres S., Babuty D., Da Costa A. et al. A randomized trial of long-term remote monitoring of pacemaker recipients (the COMPAS trial). Eur. Heart J. 2012;33(9):1105-1111. https://doi.org/10.1093/eurheartj/ehr419.
- Costa R., Silva K.R.D., Saucedo S.C.M., Silva L.A., Crevelari E.S., Nascimento W.T.J. et al. Impact of the COVID-19 Pandemic on сardiac implantable electronic devices procedures in a Tertiary Referral Center. Arq. Bras. Cardiol. 2021;117(4):765-769. https://doi.org/10.36660/abc.20201378.
- Maines M., Zorzi A., Benetollo P.P., Guarrera G.M., Moz M., Manica A. et al. Short-term outcome associated with remote evaluation (telecardiology) of patients with cardiovascular diseases during the COVID-19 pandemic. Int. J. Cardiol. Heart Vasc. 2020;30:100625. https://doi.org/10.1016/j.ijcha.2020.100625.
- Трунова О.С., Дурманов С.С., Базылев В.В. Влияние удаленного мониторинга работы имплантируемого кардиовертера-дефибриллятора на качество жизни пациентов. Вестник аритмологии.2019;26(1):17-23. https://doi.org/10.25760/VA-2019-95-17-23.
- Дамрина Е.В., Илов Н.Н. Амбулаторное ведение больных с ИКД: тестирование в клинике или удаленный мониторинг? Сибирский журнал клинической и экспериментальной медицины. https://doi.org/;32(1):84-87.DOI: 10.29001/2073-8552-2017-32-1-84-87.
- Ricci R., Morichelli L., Santini M. Remote control of implanted devices through Home Monitoring technology improves detection and clinical management of atrial fibrillation. Europace. 2009;11(1):54-61. https://doi.org/10.1093/europace/eun303.
- Zaman J.A.B., Chua K., Sovari A.A., Gunderson B., Gang E.S., Ploux S.et al. Early diagnosis of defibrillation lead dislodgement. JACC Clin. Electrophysiol. 2018;4(8):1075-1088. https://doi.org/10.1016/j.jacep.2018.03.015.


