Роль внедрения цифровых производственных систем на фармацевтическом предприятии
Автор: Шинкевич А.И., Мухаматгалеева Л.Р., Бобков В.И.
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Машиностроение и машиноведение
Статья в выпуске: 6 т.23, 2021 года.
Бесплатный доступ
В связи с нарастающим мировым кризисом на фоне пандемии COVID-19, вопрос бесперебойного обеспечение населения лекарствами стал критически важным. В связи с этим внедрение систем управления информацией на фармацевтических предприятиях приобретает особую актуальность. Фармацевтическая промышленность в целом сталкивается с рядом уникальных проблем, включая тщательный контроль со стороны регулирующих органов, сложные методы тестирования и растущее финансовое давление по мере роста конкуренции на рынке. Промышленные предприятия-лидеры оцифровывают основные функции в рамках своих внутренних вертикальных операционных процессов, а также со своими партнерами по цепочке создания стоимости. Одной из систем управления информацией в лаборатории является информационная система LIMS (Laboratory information system). Одним из вызовов при выборе LIMS в фармацевтике является разнообразие лабораторий в компании - комбинаторная химия, скрининг, доклинический и клинический биоанализ, аналитическая химия, производственные НИОКР и контроль качества производства, нуждающиеся в уникальных потребностях и рабочих процессах. По мере развития бизнеса, информационных технологий и нормативно-правовой базы также возрастает роль LIMS в фармацевтической организации. Правильное внедрение данного механизма в работу фармацевтического предприятия поможет сохранить качество продукта, сократить и оптимизировать работу и удовлетворить конечного потребителя и государственные структуры.
Цифровизация, производственные системы, фармацевтические предприятия, информационные системы, laboratory information system
Короткий адрес: https://sciup.org/148323603
IDR: 148323603 | УДК: 658.5 | DOI: 10.37313/1990-5378-2021-23-6-62-66
Текст научной статьи Роль внедрения цифровых производственных систем на фармацевтическом предприятии
В фармацевтической индустрии качество продукта является важнейшей частью цепочки поставок, поэтому производственные компании внедряют информационные системы, специально разработанные для лабораторий, которые проводят проверки качества готовой продукции и материалов в процессе.
В связи с нарастающим мировым кризисом на фоне пандемии COVID-19, вопрос бесперебойного обеспечение населения лекарствами стал критически важным. Под угрозой находится вся ныне существующая в мире, и в России в частности, цепочка поставок фармацевтических препаратов.
Известно, что фармацевтическая отрасль сталкивается с более тщательной проверкой
Шинкевич Алексей Иванович, доктор технических наук, доктор экономических наук, профессор, заведующий кафедрой логистики и управления.
со стороны регулирующих органов, чем любая другая, за исключением, возможно, отрасли ядерной энергетики. Любое потенциальное решение должно удовлетворять интересы как внутренних, так и внешних аудиторов. Это включает гибкость для поддержки широко варьирующихся рабочих процессов проверки и утверждения как статических данных, таких как спецификации продукта или протоколы исследований, так и динамических данных, таких как результаты испытаний и размещение партий.
Перед подавляющим большинством фармацевтических компаний стоит задача стать более эффективными и маржинальными. Огромные прибыли от лекарств-блокбастеров из-за высокой конкуренции и удорожания активных фармацевтических форм уходят в прошлое, и фармацевтические компании сталкиваются с теми же проблемами, требующими рационализации, повышения эффективности и сосредоточения внимания на основных направлениях бизнеса, с которыми сталкивалась нефтехимическая промышленность в 1970-х и 1980-х годах. В связи с этим внедрение систем управления информацией на фармацевтических предприятиях приобретает особую актуальность.
ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ЦИФРОВИЗАЦИИ ФАРМАЦЕВТИЧЕСКИХ ПРОИЗВОДСТВЕННЫХ СИСТЕМ
Промышленные предприятия-лидеры оцифровывают основные функции в рамках своих внутренних вертикальных операционных процессов, а также со своими партнерами по цепочке создания стоимости. В целом вопросы цифровизации промышленных предприятий представлены в научных исследованиях под руководством Мешакина В.П., Шинкевича А.И. [1-3]. Проблемы развития фармацевтических производств находят отражение в научных трудах как зарубежных, так и отечественных ученых. Так, Yu F., Yu X., Sun Q. в своих исследованиях рассматривают вопросы развития фармацевтической политики Китая, целью которой является контроль за продуктами и лекарствами Китая, создание регулирующих систем для мониторинга процесса производства лекарственных средств – от этапа производства, распространения до контроля безопасности и использования лекарственных средств; особенности цепочек поставок фармацевтической продукции [4-6]. Вопросы конкурентоспособности фармацевтического промышленного предприятия проанализированы в исследованиях Измайлова А.А. [7], основные аспекты присоединения Китая к Всемирной торговой организации рассмотрены в трудах Губанова В.В. [8], проблемы зависимости государств от импорта фармацевтической продукции, зависимости потребления фармацевтической продукции от благосостояния населения проанализированы в научных трудах Астаховой Е.В. [9]. Особенности правовой регламентации осуществления цифровизации применительно к фармацевтическому комплексу России проанализированы в научных исследованиях Клунко Н. С. [10]. Им также выявлены основные направления положительного воздействия внедрения информационных систем на фармацевтическую отрасль, существующие проблемы её дальнейшего развития, а также возможные пути их решения.
Задачи принятия стратегических решений по вопросам развития отечественной фармацевтической и медицинской промышленности обусловлены такими проблемами, как нарастание отставания отечественной фармацевтической и медицинской промышленности в части технологического уровня производственных мощностей для организации выпуска конкурентоспособной продукции; недостаток государственного стимулирования предприятий отечественной фармацевтической и медицинской промышленности в части разработки и производства на территории Российской Федерации инновационных лекарственных препаратов и медицинских изделий, и отражены в нормативно-правовых документах [11].
ОСОБЕННОСТИ ЛАБОРАТОРНОЙ ИНФОРМАЦИОННОЙ СИСТЕМЫ LIMS
Одной из систем управления информацией в лаборатории является LIMS (Laboratory information system). Это информационная система, которая может планировать и отслеживать тестирование, и передавать результаты испытаний другим системам в цепочке поставок, таким как система планирования ресурсов предприятия (ERP) [12]. Система LIMS используется в основном как инструмент отчетности, в котором пользователи могут вводить информацию об испытательном образце, такую как, например, номер проверки, партию материала, дата, время, место и т. д. Отслеживание выборки может быть выполнено путем ввода номера образца в систему и ввода вручную или с помощью штрих-кодов. Когда образец вводится в систему, LIMS может печатать этикетку с уникальным номером образца.
Одним из вызовов при выборе LIMS в фармацевтике является разнообразие лабораторий в компании. Комбинаторная химия, скрининг, доклинический и клинический биоанализ, аналитическая химия, производственные НИОКР и контроль качества производства – все они имеют уникальные потребности и рабочие процессы. Тем не менее, конечные пользователи, которые ищут решение для своих бизнес-потребностей, часто сталкиваются с проблемой адаптации к уже имеющимся схемам, уже используемой в другой части компании. В некоторых случаях это может сработать, но чаще всего результатом является неудачная реализация и множество недовольных (и потенциально непродуктивных) пользователей. В целом отрасль быстро осознает, что один инструмент не может удовлетворить потребности этих разнообразных пользователей. Настоящие решения должны отвечать бизнес-потребностям конечных пользователей. Сложные методы испытаний с многоэтапными критериями приемки должны быть максимально автоматизированы. Тестирование фармацевтических продуктов в значительной степени ориентировано на партии, поэтому любое потенциальное решение для производственной области должно включать в себя возможности управления партиями. Доклинический и клинический биоанализ сильно зависит от протокола, поэтому решения для этих лабораторий должны разрабатываться с пониманием протокола исследования [13].
По мере развития бизнеса, информационных технологий и нормативно-правовой базы, также развивается LIMS, и, что более важно, их роль в фармацевтической организации (рисунок 1).
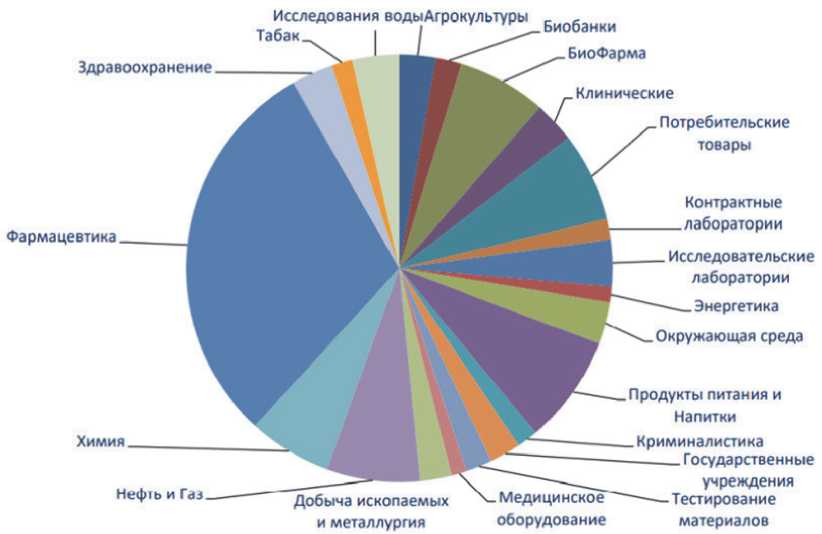
Рис. 1. Заказчики LIMS по отраслям [14]
Различают несколько видов LIMS:
Индивидуальные решения, которые в течение многих лет были очень популярны в фармацевтической промышленности. Многие из обозначенных здесь проблем были постоянными в фармацевтической промышленности в течение последних трех десятилетий, особенно нормативные ограничения и сложность проводимых испытаний. При отсутствии коммерческого продукта, который отвечал бы конкретным потребностям фармацевтического бизнес-процесса, и отсутствия давления, необходимого для ограничения объема или бюджета крупномасштабных ИТ-проектов, многие компании создавали собственные решения или заключали контракты с фирмами, занимающимися разработкой программного обеспечения, чтобы создали для них индивидуальные системы. Во многих отношениях все еще возможно, что индивидуализированная система могла бы удовлетворить потребности отдельной фармацевтической компании лучше, чем любое коммерческое предложение. Однако стоимость такой системы может быть непомерно высокой. Кроме того, проекты по разработке программного обеспечения отвлекают от основного бизнеса фармацевтической компании по разработке и маркетингу терапевтических средств.
«Общая» LIMS. Коммерчески доступные LIMS начали появляться в 1980-х годах. Некоторые из этих систем устойчивы и расширили свои возможности, чтобы охватить множество различных областей управления лабораторией, включая инвентаризацию оборудования и управление обучением. В ходе эволюции эти системы раз- рабатывались так, чтобы не зависеть от отрасли. Во многих случаях они также были разработаны так, чтобы быть в некоторой степени независимыми от платформы, поддерживая различные платформы баз данных и операционные системы. Из-за этого их часто называют «универсальными» LIMS. Типовые системы LIMS почти всегда ориентированы на образцы и ориентированы на лаборатории. Это означает, что центральным элементом, вокруг которого вращается система, является образец, а доступные действия и функции разработаны с точки зрения лаборатории. Образцы поступают в лабораторию; результаты вводятся напротив образцов; и каждый образец рассматривается и / или утверждается. Общие системы поставляются с базовыми функциональными возможностями, ориентированными на образцы, а также с руководствами, а иногда и с инструментами, позволяющими заказчику или консультантам по внедрению расширять базовые функциональные возможности универсальной системы для удовлетворения потребностей клиентов. Во многих отраслях можно успешно использовать универсальную LIMS без излишней настройки. Поскольку они разрабатывались в течение многих лет, существует несколько общих LIMS, которые оказались очень надежными, однако могут быть ограничения на функциональность, достижимую за счет настройки из-за устаревшей архитектуры и технологий, используемых для создания общей LIMS. Однако проблема заключается в развертывании общей системы LIMS в фармацевтической промышленности. Практически ни одна из многих фармацевтических лабораторий не ориентиро- вана на образцы. Лаборатории скрининга ориентированы на продукты или молекулы. Лаборатории доклинического и клинического биоанализа ориентированы на исследования и на субъектов / пациентов. Аналитическая разработка ориентирована на продукт, а контроль качества производства - на продукт / партию. В каждом из этих примеров общая LIMS потребует обширной настройки. Важно отметить используемое здесь определение настройки: любой написанный вручную код, предназначенный для изменения функциональности основного продукта. Независимо от того, включает ли LIMS язык сценариев или требует написания настраиваемых функций во внешнем инструменте или среде, любые письменные инструкции для включения или создания функциональности представляют собой настройку. Во многих случаях объем требуемой настройки может привести к созданию системы с такими дорогостоящими затратами на обслуживание, проверку и обновление, что разница в расходах между настраиваемой универсальной системой и полностью настраиваемой системой будет незначительной.
Готовые коммерческие решения. Из-за высокой стоимости развертывания либо систем, созданных на заказ, либо универсальных систем с высокой степенью индивидуализации в фармацевтической сфере, наблюдается быстро растущая тенденция к использованию программного обеспечения COTS (commercial off-the-shelf) везде, где это возможно. Хотя у них может быть более высокая начальная цена покупки, чем у общей системы, затраты на развертывание, обучение, проверку, обслуживание и обновления могут быть значительно снижены, что делает общую стоимость владения лишь долей стоимости индивидуального решения. Есть и другие существенные преимущества поиска решений COTS при оценке LIMS для фармацевтики. Чтобы создать приложение или решение для конкретной области, поставщик должен продемонстрировать полное понимание области и ее конкретных задач. В области фармацевтики это включает осведомленность о существующей и развивающейся нормативно-правовой базе, а также о новых разработках в области тестирования и контроля качества. Такой опыт может позволить поставщику гарантировать, что в будущих версиях его решения будут представлены новые функции и бизнес-логика, необходимые для обеспечения поддержки самых последних нормативных требований и отраслевых тенденций. При использовании решений COTS с высокоразвитой функциональностью часто приходится идти на компромисс между настройкой системы для согласования с существующими бизнес-процессами и настройкой существующих процессов для согласования с существующей функциональностью. Однако внутренний анализ, необходимый на этом этапе, может быть полезен для выявления устаревших процессов и оптимизации неэффективных. С точки зрения стандартизации COTS также может оказаться полезным установление стандартных практик для нескольких установок. Важно отметить, что даже так называемое решение COTS вряд ли действительно удовлетворит 100% требований фармацевтической лаборатории. Оценка отраслевых решений или решений для конкретных приложений — это попытка максимизировать уровень готовой функциональности и минимизировать объем необходимой настройки. После завершения оценки может потребоваться некоторое расширение системы, поэтому важно иметь полное представление о стратегии любого поставщика COTS по устранению функциональных пробелов. Должны быть доступны инструменты для расширения программного обеспечения; поставщик должен иметь возможность предоставить опытных аналитиков для помощи в развертывании; а технологическая платформа должна использовать современную архитектуру и открытые стандарты для облегчения необходимых расширений. Точно так же решение COTS не снимает бремени ответственности со стороны пользователя. Несмотря на то, что усилия по проверке могут быть значительно сокращены, все же потребуются некоторые усилия, чтобы обеспечить уверенность в том, что настроенная система функционирует в соответствии с ожиданиями. Также важно оценить уровни соответствия и гибкости, присущие решению COTS.
ЗАКЛЮЧЕНИЕ
Таким образом, цифровые технологии позволяют сократить сроки выполнения заказов, повысить эффективность использования активов и обеспечить максимальное качество продукции. В конечном итоге, каждое предприятие выбирает свою модель функционирования, основываясь на исходных данных и его специфики. Фармацевтическая промышленность в целом сталкивается с рядом уникальных проблем, включая тщательный контроль со стороны регулирующих органов, сложные методы тестирования и растущее финансовое давление по мере роста конкуренции на рынке. Компании требуют, чтобы качество было частью каждого звена в цепочке поставок независимо от того, является ли это сырьем на объекте поставщика или готовой продукции, поставленной клиенту. В нынешних условиях глобальной цифровизации для того, чтобы компания смогла достичь оптимальных результатов, жизненной необходимостью является внедрение автоматизированных систем контроля на каждом этапе цепочки создания продукта, одной из таких систем является LIMS. Правильное внедре- ние данного механизма в работу фармацевтического предприятия поможет сохранить качество продукта, сократить и оптимизировать работу и удовлетворить конечного потребителя и государственные структуры.
Список литературы Роль внедрения цифровых производственных систем на фармацевтическом предприятии
- Мешалкин В.П. Современные концепции интенсификации и оптимизации энергоресурсоэффектив-ности производств и цепей поставок нефтегазохи-мическогокомплекса // В сборнике Международного научно-технического Форума «Первые международные Косыгинские чтения», 2017. С. 59-65.
- Shinkevich A. I., Galimulina F. F., Polozhentseva Yu. S., Yarlychenko A. A., Barsegyan N. V. Computer analysis of energy and resource efficiency in the context of transformation of petrochemical supply chains // International Journal of Energy Economics and Policy. 2021. Vol. 11. Issue 3. Pp. 529-536.
- Шинкевич А.И. Информационные средства интеграции цепей поставок нефтехимических предприятий // Наука и бизнес: пути развития. 2019. № 3. С.31-34.
- Yu F. Pharmaceutical Policy in China // In book: Pharmaceutical Policy in Countries with Developing Healthcare Systems. 2017. Pp.169-191.
- Yu X., Li C., Shi Y., Yu M. Pharmaceutical supply chain in China: Current issues and implications for health system reform // Health Policy. 2010. Vol. 97. Pp. 8-15.
- Sun Q., Santoro M. A., Meng Q., Liu C., Eggleston K. Pharmaceutical policy in China // Health Affairs. 2008. Vol. 27. Pp. 1042-1050.
- Измайлов А.М. Методический подход к анализу конкурентоспособности фармацевтического промышленного предприятия // Бизнес в законе. Экономико-юридический журнал. 2015. № 3. С. 232-236.
- Губанова В.В. Воздействие присоединения к ВТО на фармацевтическую отрасль Китая // Сборник материалов LVI Международной научно-практической конференции «Актуальные вопросы экономических наук». 2017. С. 19-24.
- Астахова Е.В., Чжихуэй В. Торговые отношения России и Китая в рамках развития фармацевтической промышленности // Азимут научных исследований: экономика и управление. 2016. Т. 5. № 4 (17). С. 23-25.
- Klunko N. S. Digitalization in the Pharmaceutical Industry: Current State and Development Prospects // Business Inform. 2020. Vol. 5 (508). Pp. 329-335.
- О федеральной целевой программе «Развитие фармацевтической и медицинской промышленности Российской Федерации на период до 2020 года и дальнейшую перспективу» // Постановление Правительства РФ от 17 февраля 2011 г. № 91. URL: http:// base.garant.ru/12183677/ (дата обращения 24.10.2021).
- Routes to finance [Электронный ресурс]. URL: https://ru.routestofinance.com/laboratory-information-management-systems (дата обращения 24.10.2021).
- Сур С., Дяченко С., Верцимаха О., Чирик В. Опыт разработки ЛИМС для лабораторий по контролю качества лекарственных средств // Сборник статей «Лабораторные информационные системы», 2006. C. 200.
- Labware [Электронный ресурс]. URL: https://www. labware.ru/index.php/lw-lims-about-products (дата обращения 14.11.2021).


