Роль времени задержки лучевой терапии в химиолучевом лечении неоперабельного немелкоклеточного рака легкого III стадии
Автор: Соловьева Е.П., Асахин С.М., Вальков М.Ю.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 4 (70), 2015 года.
Бесплатный доступ
Одна треть больных немелкоклеточным раком легкого (НМРЛ) исходно имеет местнораспространенный процесс. Увеличение количества индукционных курсов химиотерапии (иХТ) и задержка старта лучевой терапии (ЛТ) могут привести к ухудшению выживаемости у этих пациентов. Цель. Оценить клиническую значимость времени начала ЛТ на общую выживаемость (ОВ) у больных НМРЛ III стадии, получавших иХТ. Материал и методы. В настоящем ретроспективном исследовании изучение ОВ проведено в подгруппах больных, ЛТ которым была проведена ранее или позднее, чем через 150 дней - Интервал между Началом ХТ и Окончанием ЛТ (ИНХОЛТ 150). Оценку ОВ осуществляли методом Каплана - Майера с определением различий между группами лог-ранговым методом, кумулятивную ОВ сравнивали с помощью метода c2. Коррекцию ОВ с учетом влияния различных исходных факторов осуществляли с помощью регрессии Кокса. Результаты. В анализ отобрано 49 больных НМРЛ III стадии, получивших ЛТ после иХТ. Двадцать пять пациентов ЛТ получили в срок до 150 дней со времени начала ХТ, 24 - более чем через 150 дней. В группе ИНХОЛТ >150 более высокой была доля пациентов с Т4 (р=0,029) и с B стадией (p=0,003); по остальным факторам прогноза распределение было равномерным. Медиана (Ме) ОВ в группе ИНХОЛТ >150 составила 19,9 мес (95 % доверительный интервал (ДИ) 16,8-23,2), в группе ИНХОЛТ ≤150 - 21,0 мес (95 % ДИ 14,9-27,2), c2=0,017, p=0,895. Ме ОВ составила 22,5 мес (ДИ 95 % 10,2-34,9), 18,9 мес (ДИ 95 % 16,9-20,9), 18,4 мес (ДИ 95 % 15,4-21,4) у получавших 2, 3-4, 5 и более курсов индукционной ХТ соответственно, c2=4,42, p=0,110. Отношение рисков (ОР) смерти у больных с большим интервалом до окончания ЛТ составило 1,041 (95 % ДИ 0,571-1,897), после коррекции по другим факторам - 1,485 (95 % ДИ 0,691-3,189). Заключение. В ретроспективном анализе задержка старта ЛТ после иХТ приводит к незначимому ухудшению выживаемости. Проведение более двух курсов ХТ нецелесообразно. Результаты требуют подтверждения в рандомизированном исследовании.
Неоперабельный немелкоклеточный местнораспространенный рак легкого iii стадии, лучевая терапия, химиотерапия
Короткий адрес: https://sciup.org/14056776
IDR: 14056776 | УДК: 616.24-006.6-08:615.849.1:615.28
Текст научной статьи Роль времени задержки лучевой терапии в химиолучевом лечении неоперабельного немелкоклеточного рака легкого III стадии
Рак легкого (РЛ), по данным мировой статистики, остается самым частым онкологическим заболеванием и ведущей причиной смерти [18]. В РФ ежегодно заболевает около 60 тыс. человек; на долю РЛ приходится 18 % всех случаев у мужчин и 4 % у женщин; это заболевание лидирует и в структуре смертности, составляя 17,4 % всех случаев рака [3]. Немелкоклеточный рак легкого (НМРЛ) выявляют более чем у 80 % первично больных, причем до 35 % всех впервые выявленных пациентов с РЛ при первичном обращении неоперабельны вследствие высокой местной распространенности процесса – IIIB, реже – IIIA стадии [9]. В этом случае используют нехирургическое лечение: лучевую терапию (ЛТ) и химиотерапию (ХТ). Из числа больных с впервые в жизни установленным диагнозом РЛ III стадию в РФ имеют 32,4 %, в Архангельской области – 27,0 % [8]. При этом специальным методам лечения по данным
популяционного анализа подвергаются лишь 42 % из них [1].
Общее время лечения и время старта ЛТ при неоперабельном местнораспространенном немелкоклеточном РЛ, согласно данным исследований, могут оказывать существенное влияние на выживаемость. Так, по данным исследования NCCTG [10], сокращение общего времени ЛТ при использовании нетрадиционных схем фракционирования приводило к улучшению выживаемости больных НМРЛ. Наоборот, увеличение времени ожидания до старта ЛТ после индукционной ХТ (иХТ) приводило к значимому увеличению размеров опухоли [13]. С другой стороны, увеличение промежутка времени между установлением диагноза до начала любого лечения (включая ЛТ) при НМРЛ не всегда приводит к ухудшению выживаемости [6].
Перед исследованиями, посвященными лечению НМРЛ, по нашим сведениям, ранее не стави- лась цель оценить роль времени начала ЛТ после иХТ. Однако при мелкоклеточном РЛ подобные исследования проводятся давно. Так, в метаанализе De D. Ruysscher et al. [12], включавшем 6 рандомизированных исследований по химиолучевому лечению мелкоклеточного рака легкого (МРЛ), проведено сравнение 5-летней выживаемости в зависимости от времени окончания ЛТ. Наиболее весомым для прогноза выживаемости оказалось время от старта любого лечения до дня окончания ЛТ – SER (Start Any Treatment before the End of Radiotherapy). При длительности этого промежутка менее 30 дней 5-летняя общая выживаемость (ОВ) превышала 20 %, что было значимо выше, чем при более позднем времени назначения ЛТ (ОР=0,62, ДИ 0,49–0,80, р=0,003). В регрессионной модели каждая новая неделя увеличения SER приводила к снижению 5-летней выживаемости на 1,8 %.
Цель исследования состояла в оценке клинической значимости времени начала лучевой терапии у больных НМРЛ III стадии, получавших иХТ, по критериям общей выживаемости.
Материал и методы
Ретроспективно прослежены данные о методах и исходах лечения больных неоперабельным местнораспространенным НМРЛ III стадии, получавших консервативное лечение в условиях ГБУ Архангельской области «Архангельский клинический онкологический диспансер» (АКОД). Рабочая гипотеза исследования заключалась в том, что смещение времени начала ЛТ в программе лечения, иными словами, увеличение длительности иХТ, может привести к ухудшению показателей выживаемости больных НМРЛ III стадии. Для ее проверки произведен отбор больных из базы данных областного канцер-регистра за период с 01.02.2000 по 12.02.2010 г.
Критерии отбора были следующими: возраст больных – старше 18 лет; общее состояние больного (performance status) по шкале Карновского – 100–70 % или функциональный статус по шкале Eastern Cooperative Oncology Group (ECOG) – 0–2; морфологически верифицированный НМРЛ III стадии (Т 4 N любая М 0 , Т 3–4 N 1 М 0 , Т любая N 2–3 М 0 ) [7]; проведение радикальной ЛТ до суммарной очаговой дозы не менее 50 Гр после индукционной платиносодержащей ХТ в стандартных дозовых режимах. В исследование не включали больных, получавших лучевую терапию в качестве первого метода лечения, а также имевших в анамнезе другие злокачественные опухоли, за исключением надлежащим образом излеченной базалиомы кожи, рака шейки матки in situ.
За указанный период в базе данных канцер-регистра Архангельской области было зарегистрировано 5 596 больных РЛ. Из них диагноз НМРЛ был верифицирован у 3 235 человек, III стадия установлена 1 062 пациентам. Отобрано 49 паци- ентов, соответствующих критериям включения/ невключения.
Химиотерапию большинству больных, согласно локальному стандарту, принятому на основании международных рекомендаций, проводили сочетанием препаратов платины и этопозида (EP) в стандартных дозовых режимах: этопозид 120 мг/м2 в/в в 1, 3, 5-й дни. Цисплатин 80 мг/м2 в/в в 1-й день. Интервал между курсами – 21 сут [4]. Чаще использовали модифицированную схему ЕР: этопозид 120 мг/м2 в/в в 1, 3, 5-й дни, карбоплатин AUC5 в/в в 1-й день. В исследование также были включены пациенты, получавшие платиносодержащие схемы, с использованием винорельбина, паклитаксела, доцетаксела, гемцитабина [2, 4]. Химиопрепараты вводились в полной дозе или с редукцией на 25 % после первого курса по показаниям [11]. Допускали удлинение интервалов между курсами ХТ до 4–5 нед, если они предпринимались для разрешения негативных явлений.
Дистанционную ЛТ проводили на гамма-терапевтических установках РОКУС-АМ (Равенство, СПб.) либо линейном ускорителе электронов Clinac 2100 C (Varian, USA). Облучение планировали до радикальной суммарной очаговой дозы (СОД) не менее 60 Гр либо ее эквивалента при использовании альтернативных схем фракционирования. Тем не менее в окончательный анализ были также включены больные, получившие ЛТ до СОД 50–59 Гр.
В облучаемый объем, согласно принятым в АКОД стандартам, исходно включали первичную опухоль и регионарные лимфатические узлы. Лимфатические узлы корня легкого и средостения со стороны поражения облучали даже в отсутствие признаков их поражения. По достижении дозы 40 Гр либо её эквивалента при нетрадиционном фракционировании объем облучения планово сокращали до размера исходной опухоли с отступами 2–3 см по вертикали и 1,5–2 см по горизонтали. Надключичные лимфатические узлы облучали только при наличии явных признаков метастатического поражения. Плановых перерывов в ЛТ не допускали.
При статистической обработке материала сравнивали показатели выживаемости больных в отобранной группе в зависимости от длительности временного промежутка между датами установления диагноза и начала лучевой терапии. Оценивали выживаемость в подгруппах больных, ЛТ которым была начата ранее и позднее, чем через 150 дней – Интервал между Началом ХТ и Окончанием ЛТ (ИНХОЛТ 150). Также сравнивали выживаемость больных в зависимости от количества полученных курсов ХТ: 2, 3–4, 5 и более. Основным критерием сравнительной оценки эффективности методов являлась общая выживаемость, которую рассчитывали как временной промежуток между датой установления диагноза РЛ и смертью от любой причины либо от рака.
таблица 1
распределение больных по исходным характеристикам
|
Характеристика |
ИНХОЛТ >150 |
ИНХОЛТ ≤150 |
|||
|
N |
% |
N |
% |
р |
|
|
Пол |
0,527 |
||||
|
Мужчины |
22 |
91,7 |
24 |
96,0 |
|
|
Женщины |
2 |
8,3 |
1 |
4,0 |
|
|
Возраст, лет |
0,827 |
||||
|
до 50 |
3 |
12,5 |
3 |
12,0 |
|
|
50–59 |
12 |
50,0 |
10 |
40,0 |
|
|
60–69 |
7 |
29,2 |
8 |
32,0 |
|
|
70 и старше |
2 |
8,3 |
4 |
16,0 |
|
|
Гистология |
0,682 |
||||
|
плоскоклеточный |
17 |
70,8 |
19 |
76,0 |
|
|
другой немелкоклеточный |
7 |
29,2 |
6 |
24,0 |
|
|
Эксплоративная торакотомия |
0,560 |
||||
|
торакотомия |
5 |
20,8 |
7 |
28,0 |
|
|
без торакотомии |
19 |
79,2 |
18 |
72,0 |
|
|
Статус по ECOG |
0,513 |
||||
|
ECOG 0 |
1 |
4,2 |
2 |
8,0 |
|
|
ECOG 1 |
22 |
91,7 |
23 |
92,0 |
|
|
ECOG 2 |
1 |
4,2 |
0 |
0 |
|
|
Сопутствующая патология |
0,263 |
||||
|
Чарлсон 0–2 |
18 |
75,0 |
15 |
60,0 |
|
|
Чарлсон 3 и более |
6 |
25,0 |
10 |
40,0 |
|
|
Критерий Т (TNM 6) |
0,029 |
||||
|
Т1 |
1 |
4,2 |
1 |
4,0 |
|
|
Т2 |
7 |
29,2 |
10 |
40,0 |
|
|
Т3 |
3 |
12,5 |
10 |
40,0 |
|
|
Т4 |
13 |
54,2 |
4 |
16,0 |
|
|
Поражение лимфоузлов (TNM 6) |
0,483 |
||||
|
N0 |
2 |
8,3 |
1 |
4,0 |
|
|
N1 |
2 |
8,3 |
6 |
24,0 |
|
|
N 2 |
15 |
62,5 |
13 |
52,0 |
|
|
N3 |
5 |
20,8 |
5 |
20,0 |
|
|
Подстадия |
0,003 |
||||
|
А |
6 |
25,0 |
17 |
68,0 |
|
|
В |
18 |
75,0 |
8 |
32,0 |
|
|
Клинико-анатомическая форма |
0,125 |
||||
|
центральный |
20 |
83,3 |
16 |
64,0 |
|
|
периферический |
4 |
16,7 |
9 |
36,0 |
|
Непрерывные характеристики (возраст, доза ЛТ) для удобства анализа ранжировали и представляли в виде порядковых переменных. Статистическую значимость различий в распределении по порядковым и качественным характеристикам определяли с помощью метода χ2. Статистическая значимость различий была установлена на уровне р<0,05. Все сравнения были двусторонними. Значения показателей выживаемости представляли в виде процентов с доверительными интервалами (ДИ). Оценку выживаемости больных осуществляли методом Каплана – Майера, показатели выживаемости представляли в виде медианы (Ме), 95 % ДИ. Различия в выживаемости между группами определяли лонг-ранговым методом. Цензурирование живых и выбывших из-под наблюдения больных проводили по дате последней проверки базы канцер-регистра либо по дате последней явки на контрольный осмотр соответственно. Коррекцию влияния исходных факторов на выживаемость осуществляли с помощью регрессионной модели пропорциональных рисков Кокса. Введение факторов в многофакторную регрессионную модель осуществляли методом последовательного ввода.
Результаты
Всего для анализа в наше исследование отобрано 49 больных НМРЛ III стадии, получивших ЛТ после индукционной ХТ. В группу ИНХОЛТ >150 включено 24 пациента, в группу ИНХОЛТ ≤150 – 25 пациентов (табл. 1). Группа ИНХОЛТ >150 исходно включала больных с более распростра-
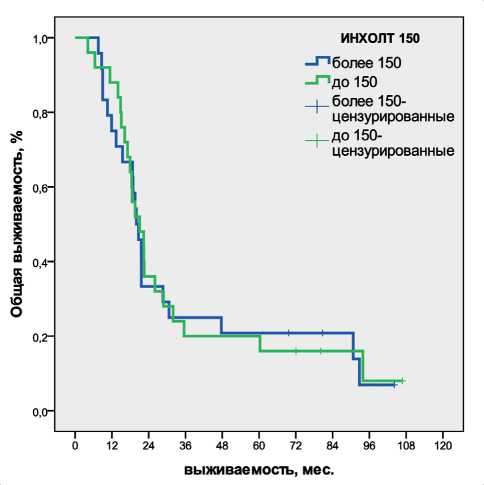
Рис. 1. Общая выживаемость
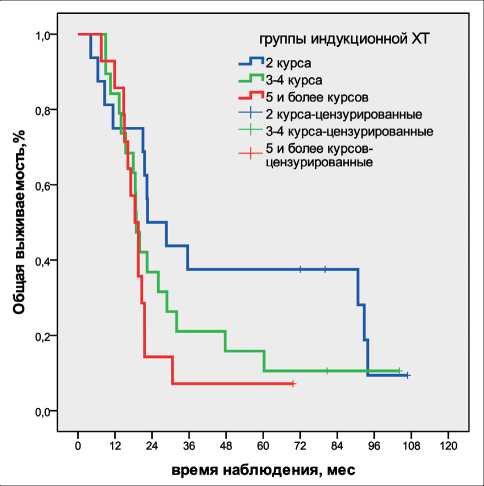
Рис. 2. Общая выживаемость в группах индукционной ХТ
ненными опухолями: более высокой была доля пациентов с Т4 (р=0,029) и с B стадией (p=0,003). По остальным критериям, включая возраст, пол больных, гистологический вариант опухоли, клинико-анатомический вариант и степень тяжести сопутствующей патологии, оценку общего состояния по ECOG, частоту пробной торакотомии, значимых различий в распределении не установлено.
Медиана времени наблюдения составила 84 мес. К моменту анализа погибли 43 из 49 больных (87,8 %); в обеих группах живы по 3 пациента: в группе ИНХОЛТ >150 – 12,5 %, в группе ИНХОЛТ ≤150 – 12,0 % пациентов. Медиана ОВ для всех больных составила 20,7 мес (95 % ДИ 17,6–23,7); по группам ИНХОЛТ >150 и ИНХОЛТ ≤150 составила 19,9 мес (95 % ДИ 16,8–23,2) и 21,0 мес (95 % ДИ 14,9–27,2), χ2=0,017, p=0,895 (рис. 1).
Кумулятивная выживаемость в течение 1, 3, 5 лет представлена в табл. 2. Более 5 лет были живы 20 % больных в обеих группах.
В группе ИНХОЛТ ≤150 пациенты получили от 2 до 4 курсов иХТ, медиана – 2 курса ХТ; в группе ИНХОЛТ >150 – от 2 до 10, медиана – 4 курса ХТ. Медиана выживаемости пациентов, получивших 2, 3–4, 5 и более курсов иХТ, составила 22,5 мес (ДИ 95 % 10,2–34,9), 18,9 мес (ДИ 95 % 16,9–20,9), 18,4 (ДИ 95 % 15,4–21,4) мес, χ2=4,42, p=0,110 (рис. 2).
В однофакторной регрессионной модели пролонгирование времени до начала ЛТ не было ассоциировано со значимым ухудшением прогноза – отношение рисков (ОР) – 1,041 (95 % ДИ 0,571–1,897), однако введение в модель подстадии и индекса тяжести сопутствующей патологии привело к некоторому изменению регрессионного коэффициента в сторону ухудшения прогноза – ОР 1,485 (95 % ДИ 0,691–3,189). В множественной регрессионной модели подстадия 3А была ассоциирована с тенденцией к снижению ОВ – ОР 1,950 (95 % ДИ 0,882–4,310), р=0,099.
Обсуждение
Время ожидания лучевой терапии после индукционной химиотерапии является важным прогностическим фактором, показавшим свою значимость в исследованиях по МКР. Целью представляемого исследования была оценка этого фактора на модели неоперабельного НМРЛ. В целом нам не удалось обнаружить влияния времени начала ЛТ после иХТ на общую выживаемость. Наиболее вероятной причиной этого было критически малое количество наблюдений в сравниваемых группах.
Общая тенденция ухудшения прогноза ОВ с увеличением времени ожидания ЛТ и увеличения количества курсов иХТ, выявленная в нашем исследовании, позволяет тем не менее утверждать, что раннее начало ЛТ в схемах последовательного химиолучевого лечения может привести к улучшению результатов лечения. Следует также отметить, что в настоящий анализ были включены только пациенты НМРЛ III стадии, получавшие индукционную ХТ. Ранее нами в ретроспективном анализе было показано преимущество в выживаемости у больных неоперабельным НМРЛ III стадии, если лечение начиналось с ЛТ [5].
Индукционная ХТ приводит к видимому снижению массы первичной опухоли. Но ХТ может включить процессы репопуляции в опухоли, и она начинает расти более быстрыми темпами, чем до начала лечения. Установлено, что при использовании ЛТ на нативной опухоли эффект таблица 2
Показатели 1-, 3-, 5-летней кумулятивной выживаемости больных неоперабельным нМрЛ III стадии в зависимости от интервала между началом хт и окончанием Лт (ИнхОЛт)
В исследовании S.Y . El Sharouni et al. [13] сравниваются КТ-сканы пациентов до и после иХТ с акцентом на время от последнего цикла иХТ до КТ перед проведением лучевой терапии. Таким образом, представилась возможность измерить рост опухолевого объёма и впоследствии определить время удвоения опухоли. Во время периода ожидания (до КТ перед началом лучевой терапии) все опухоли увеличились в размерах с диапазоном роста опухолевого объёма от 1,1 до 81,8, причём в общей сложности 41 % всех опухолей стал неизлечимым. Период удвоения опухоли колебался от 8,3 до 171 дня, в среднем 29 дней, что значительно меньше, чем в исследованиях по изучению роста нелеченных опухолей легкого [14, 15, 16, 20]. Этот феномен объясняют эффектом ускоренной репопуляции клоногенов опухоли или репопуляцией выживших опухолевых клоногенов [17]. Можно предполагать, что исходная ХТ, даже приводящая к заметному эффекту, может заметно снизить эффективность ЛТ за счет «включения» ускоренного роста опухоли. Поэтому применение ЛТ на более ранних сроках лечения может привести к улучшению контроля опухоли за счет предотвращения или снижения эффекта ускоренной репопуляции, что было, в частности, показано на модели локализованного мелкоклеточного рака легкого в метаанализе D. De Ruysscher [12].
Данные нашего исследования подтверждают важность этой концепции при НМРЛ, но в силу ограниченного числа наблюдений значимых различий между группами не было зарегистрировано. Ранее нами было показано, что специальное лечение при РЛ получают лишь 42 % больных [1]; если рассматривать популяцию больных НМРЛ III стадии, то эта пропорция даже меньше. В наш анализ вошло всего 4,6 % от всех зарегистрированных в базе данных канцер-регистра Архангельской области больных с такой распространенностью опухоли. Необходимо рандомизированное исследование с проспективным набором больных для окончательного подтверждения прогностической значимости раннего начала облучения у этой тяжелой категории пациентов.
В нашем исследовании также было обнаружено, что больные, получавшие большее число индукционных курсов химиотерапии за более длительный срок, значимо чаще имели стадию IIIВ с большей долей наблюдений T4. Однако в множественной регрессионной модели именно потенциально операбельная IIIА стадия была ассоциирована со значительной тенденцией к ухудшению прогноза ОВ, вероятно, за счет большей частоты тяжёлой сопутствующей патологии у этих больных. Коррекция на этот фактор в регрессионной модели привела к увеличению, хотя и незначимому, риска смерти у больных с более длительным периодом ожидания ЛТ.
Благодаря релевантным методам статистической обработки, в этом исследовании показано, что количество индукционных курсов ХТ не влияет или, скорее, влияет отрицательно на выживаемость данной тяжёлой категории больных и может быть уменьшено. С практической и экономической точек зрения и при прочих равных условиях количество курсов и ХТ должно быть сокращено до двух.
По нашим данным, подобное исследование, в котором поставлена такая цель, в России первое. Сокращение времени ожидания ЛТ и проведение ее в более ранние сроки [6] за счет уменьшения количества курсов ХТ определённо может привести к снижению частоты прогрессирования и улучшению показателей выживаемости.
Наше исследование имеет существенные недостатки. Ограниченное количество наблюдений не позволило набрать достаточную мощность, чтобы показать статистическую значимость различий между группами. Его ретроспективный характер привел к несущественным с клинической точки зрения, но статистически значимым неравномерностям в распределении по ряду исходных факторов. Этот недостаток во многом нивелирован введением регрессионной модели Кокса. По нашему мнению, необходимо проведение рандомизированного проспективного исследования, сравнивающего исходное химиолучевое лечение с таковым после индукционной химиотерапии.
Заключение
Показано, что задержка старта ЛТ, вероятно, имеет клиническое значение в ХЛТ НМРЛ III стадии. Увеличение количества индукционных курсов ХТ при этих опухолях более 2 нецелесообразно. Необходимо большее число наблюдений и проспективный анализ – сравнение одновременной ХЛТ и индукционной ХТ – ХЛТ с использованием современных методов ЛТ с оптимизацией пространственного распределения пучка.
Список литературы Роль времени задержки лучевой терапии в химиолучевом лечении неоперабельного немелкоклеточного рака легкого III стадии
- Вальков М.Ю., Скрипчак Ю.В., Соловьева Е.П., Вальков А.Ю., Асахин С.М. Методы лечения и исходы при местно-распространенном раке легкого III стадии: популяционный анализ//Вестник РНЦРР Минздрава России. 2012. Т. 3, № 12. С. 7-14. URL: http://vestnik.rncrr.ru/vestnik/v14/papers/valkov_v14.htm (дата обращения: 24.01.2015).
- Гарин А.М., Базин И.С. Справочное руководство по лекарственной терапии солидных опухолей. М., 2007. 300 с.
- Каприн А.Д., Старинский В.В., Петрова Г.В. Злокачественные новообразования в России в 2013 году (заболеваемость и смертность). М., 2015. 250 c.
- Руководство по химиотерапии опухолевых заболеваний/Под ред. Н.И. Переводчиковой. М., 2005. 704 с.
- Соловьева Е.П., Кононова Г.В., Вальков М.Ю. Выбор очередности метода консервативного лечения неоперабельного немелкоклеточного рака легкого III стадии: ретроспективный анализ выживаемости//Вестник РНЦРР Минздрава России. 2012. Т. 3, № 12. С. 7. URL: http://vestnik.rncrr.ru/vestnik/v12/papers/solo_v12.htm (дата обращения: 18.01.15).
- Соловьева Е.П., Асахин С.М., Вальков М.Ю. Клиническая значимость задержки старта специального лечения у больных неоперабельным немелкоклеточным раком легкого III стадии: результаты собственного исследования и литературный обзор//Сибирский онкологический журнал. 2014. № 3. С. 11-18.
- TNM: Классификация злокачественных опухолей. 6-е изд. СПб., 2003. 243 с.
- Чиссов В.И., Старинский В.В., Петрова Г.В. Состояние онкологической помощи населению России в 2009 году. М., 2010. 196 с.
- Alberg A.J., Brock M.W., Samet J.M. Epidemiology of lung cancer: looking to the future//J. Clin. Oncol. 2005. Vol. 23. Р. 3175-3185.
- Bonner J.A., McGinnis W.L., Stella P.J., Marschke Jr.F., Sloan J.A., Shaw E.G., Mailliard J.A., Creagan E.T., Ahuja R.K., Johnson P.A. The possible advantage of hyperfractionated thoracic radiotherapy in the treatment of locally advanced non-small cell lung carcinoma: results of a North Central Cancer Treatment Group Phase III Study//Cancer. 1998. Vol. 82. P. 1037-1048.
- Common Terminology Criteria for Adverse Events (CTCAE). Version 3.0.//U.S. Department of Health and Human Services. National Cancer Institute. 2006. P. 71.
- De Ruysscher D., Pijls-Johannesma M., Bentzen S.M., Minken A., Wanders R., Lutgens L., Hochstenbag M., Boersma L., Wouters B., Lammering G., Vansteenkiste J., Lambin P. Time between the first day of chemotherapy and the last day of chest radiation is the most important predictor of survival in limited-disease small-cell lung cancer//J. Clin. Oncol. 2006. Vol. 24. P. 1057-1063.
- El Sharouni S.Y., Kal H.B., Battermann J.J. Accelerated regrowth of non-small-cell lung tumours after induction chemotherapy//Br. J. Cancer. 2003. Vol. 89. P. 2184-2189.
- Filderman A.E., Shaw C., Matthay R.A. Lung cancer. Part I: etiology, pathology, natural history, manifestations, and diagnostic techniques//Invest. Radiol. 1986. Vol. 211. P. 80-90.
- Fujimura S., Suda S., Yamauchi A. . Tumor doubling time and PPD skin test reactivity in resectable lung cancer//J. Jpn. Lung Cancer Soc. 1979. Vol. 19. P. 135-142.
- Geddes D.M. The natural history of lung cancer: a review based on rates of tumour growth//Br. J. Dis. Chest. 1979. Vol. 73. P. 1-17.
- Jeremic B., Koning C. Induction Chemotherapy Before Chemoradiation in Locally Advanced Non-Small-Cell Lung Cancer: Failure After Failure, Again and Again//J. Clin. Oncol. 2008. Vol. 26. P. e1-e2.
- Siegel R., Naishadham D., Jemal A. Cancer statistics, 2012//CACancerJ Clin. 2012. Vol. 62. P. 10-29. URL: http://onlinelibrary.wiley.com/doi/10.3322/caac.20138/pdf (дата обращения: 10.01.2015).
- Tannock I.F. Combined modality treatment with radiotherapy and chemotherapy//Radiother Oncol. 1989. Vol. 16. P. 83-101.
- Usuda K., Saito Y., Sagawa M., Sato M., Kanma K., Takahashi S., Endo C., Chen Y., Sakurada A., Fijimura S. Tumor doubling time and prognostic assessment of patients with primary lung Cancer//Cancer. 1994. Vol. 74. P. 2239-2244.


