Рост и антифунгальная активность стрептомицетов на фоне повышенной кислотности среды
Автор: Рябова О.В., Широких И.Г.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Антифунгальные свойства веществ биологического происхождения
Статья в выпуске: 3 т.49, 2014 года.
Бесплатный доступ
Кислотность почвы - один из наиболее важных физико-химических факторов, оказывающих влияние на обитающие в ней организмы. Наряду с прямым угнетением роста растений, повышенная кислотность создает селективное преимущество для развития микроскопических грибов, более устойчивых к кислотности, чем большинство бактерий. В нашей работе изучено влияние кислотности питательной среды на рост и антифунгальную активность трех культур стрептомицетов (Streptomyces hygroscopicus A-4, S. felleus A-3 и Streptomyces sp. A-24), выделенных из ризосферы растений овса сорта Аргамак на кислой дерново-подзолистой почве. Установлено, что оптимум скорости роста штаммов S. hygroscopicus А-4 и Streptomyces sp. А-24 лежит в интервале рН 5,5-6,5, тогда как S. felleus A-3 наиболее активно развивается в области более высоких значений водородного показателя (рН > 7). Антифунгальная активность S. hygroscopicus А-4 проявляется в широком диапазоне рН - от 4,0 до 10,0 (с максимумом при рН 4,5), штаммы Streptomyces sp. А-24 и S. felleus A-3 подавляют рост грибов соответственно в интервалах рН 5,0-10,0 и 7,0-10,0. По признаку повышенной антифунгальной активности для производства средств защиты растений отобран штамм S. hygroscopicus A-4, биологическая эффективность которого в отношении фитопатогенных грибов исследована в отдельном эксперименте с растениями озимой ржи ( Secale cereale L.) сорта Вятка 2 и клевера лугового ( Trifolium pratense L.) сорта Трио. Штамм способен расти и подавлять рост грибов Fusarium sporotrichiella, F. oxysporum, F. avenaceum, Bipolaris sorokiniana, Alternaria sp. в условиях повышенной кислотности питательной среды и стерильной почвы (рН 4,0), а также в ризосфере и ризоплане растений, выращенных при повышенной почвенной кислотности (рН 4,5), снижая их заболеваемость и гибель от фитопатогенов. При этом доказано отсутствие токсического эффекта S. hygroscopicus А-4 на растения.
Стрептомицеты, ризосфера, кислые почвы, антифунгальная активность, биоконтроль
Короткий адрес: https://sciup.org/142133502
IDR: 142133502 | УДК: 632.4:632.937.15:579.64
Текст научной статьи Рост и антифунгальная активность стрептомицетов на фоне повышенной кислотности среды
Кислотность почвенного раствора — один из наиболее важных физико-химических факторов, оказывающих влияние на обитающие в почве организмы. В Российской Федерации до 35 % пахотных угодий, а в некоторых федеральных округах — до 70 % занимают кислые почвы (11). Наряду с прямым угнетением роста растений вследствие ионной токсикации, повышенная кислотность оказывает опосредованное негативное воздействие, создавая селективное преимущество для развития микроскопических грибов, более устойчивых к кислотности, чем большинство бактерий (12).
В условиях эдафического стресса, обусловленного повышенной кислотностью почвы и токсичностью ионов алюминия, даже некоторые са-протрофные формы микромицетов становятся вредоносными для расте-100
ний, снижая их урожайность. Вредоносность грибов в посевах, как правило, контролируется химическими препаратами, но чрезмерное использование последних ведет к загрязнению окружающей среды и небезопасно для человека (13). Кроме того, эффективность химических фунгицидов снижается из-за развития резистентности к ним у возбудителей (14). Использование антагонистически активных микроорганизмов, в частности стрептомицетов, в качестве альтернативного метода контроля имеет ряд преимуществ, важнейшие из которых — высокая избирательность действия в отношении фитопатогенов и сохранение благополучного состояния окружающей среды (9, 15).
Оптимум развития у подавляющего большинства стрептомицетов, как и у немицелиальных бактерий, приходится на нейтральные значения рН (1). Вместе с тем известно о существовании ацидофильных форм (1618), которые способны продуцировать антифунгальные антибиотики (19) и кислотоустойчивые экзогидролазы (20).
Целью нашей работы было изучение влияния повышенной кислотности среды на скорость роста и антифунгальную активность у трех штаммов стрептомицетов, а также оценка возможности использования отобранных штаммов для контроля численности фитопатогенных грибов в почвах с повышенной кислотностью.
Методика . Объектами исследования служили штаммы Streptomyces hygroscopicus A-4, S . felleus A-3 и Streptomyces sp. A-24, выделенные из ризосферы овса ( Avena sativa L., сорт Аргамак), который выращивали на кислой (рНка 4,5) дерново-подзолистой почве.
Водорастворимые метаболиты стрептомицетов получали при выращивании культур в жидких средах с содержанием глюкозы — 2,0; сахарозы — 2,0; пептона — 1,0; дрожжевого экстракта — 1,0; К2НРО4 — 0,5; NaCl — 0,1; MgSO4 — 0,2; (NH4)2SO4 — 0,5; CaCl2 — 0,02; FeCl3 — 0,01 г/л. Значения рН были следующими: 4,0; 4,5; 5,0; 6,0; 7,0; 8,0; 9,0; 10,0. Культивирование проводили при 27 ° C на качалке (180 об/мин).
При получении споровой суспензии S . hygroscopicus А-4 выращивали на плотной среде Гаузе 1 (21) при 27 ° C в течение 7 сут, после чего споры смывали стерильной водой с добавлением Twin 80 в соотношении 10:1. Споровые суспензии Alternaria sp., Fusarium avenaceum , F . oxysporum и Bipolaris sorokiniana получали смывом с поверхности агаризованной среды Чапека-Докса (22) после культивирования грибов при 22 ° C в течение 5 сут.
Для оценки влияния кислотности среды на кинетику роста акти-номицетов измеряли радиальную скорость роста (Kr) колоний исследуемых штаммов на плотной среде Гаузе 1 с различными значениями рН (4,0; 4,5; 5,0; 6,0; 7,0; 8,0; 9,0; 10,0), которые устанавливали с помощью 0,01 н. растворов КОН и HCl. Актиномицеты выращивали при 27 ° C в течение 10 сут. Cкорость роста рассчитывали по формуле:
Kr = (D2 - D1)/(t2 - t1), где Kr — скорость роста колоний актиномицетов, мкм/ч; D1 и D2 — диаметр колоний, мкм; t1 и t2 — время инкубации, ч.
Влияние кислотности среды на антифунгальную активность водорастворимых метаболитов изучали методом лунок на плотной среде Чапека-Докса. В качестве тест-культуры использовали фитопатогенный гриб Fusarium avenaceum. Об антифунгальной активности штамма судили по диаметру зон ингибирования роста гриба. Антифунгальное действие S. hygroscopicus А-4 в почве в зависимости от кислотности оценивали в чашках Петри, заполненных стерильной и увлажненной до 80 % от полной влаго-емкости дерново-подзолистой почвой с рНка 4,0 и 6,5. Эксперимент включал следующие варианты: инокуляция почвы микромицетом Alter-naria sp. (1,1x103 спор/г почвы); совместная инокуляция почвы Alternaria sp. (1,1x103 спор/г почвы) и S. hygroscopicus А-4 (3,7x106 спор/г почвы). Чашки с почвой инкубировали в термостате при 27 °C в течение 60 сут.
Для наблюдения за динамикой численности (КОЕ) у гриба и стрептоми-цета из чашек периодически отбирали по 1 г почвы и делали посев из разведений почвенных суспензий на питательные среды: Чапека со стрептомицином (100 мкг/мл) и Гаузе 1 с нистатином (50 мкг/мл). Одновременно с анализом общей численности грибных пропагул проводили учет длины грибного мицелия методом прямой люминесцентной микроскопии (Leica DM2500, «Leica Camera AG», Германия), просматривая в каждом варианте по три препарата (100 полей зрения на препарат). Препараты готовили по общепринятой методике (23). Для окраски использовали 0,01 % раствор калькофлуора белого.
В отдельном эксперименте с растениями озимой ржи ( Secale ce-reale L., сорт Вятка 2) и клевера лугового ( Trifolium pratense L., сорт Трио) изучали биологическую эффективность S . hygroscopicus А-4 в отношении фитопатогенных грибов F . avenaceum , F . oxysporum и B . sorokiniana . Пророщенные в стерильных условиях семена растений инокулировали суспензией спор S . hygroscopicus А-4 (106-107/г семян), суспензии спор грибов вносили непосредственно в почву (102-104/г почвы). Растения выращивали при 25/18 ° C (день/ночь) и фотопериоде 16 ч в стеклянных пробирках, на треть заполненных кислой дерново-подзолистой почвой (рНКС1 4,5). Схема опыта включала следующие варианты: 1-й — неинокулированные растения (контроль); 2-й — растения, обработанные стрептомицетом; 3-й — растения, обработанные стрептомицетом на инфекционном фоне; 4-й — необработанные растения на инфекционном фоне. По окончании опыта учитывали морфометрические показатели и показатели заболеваемости и гибели растений.
Статистическую обработку полученных результатов проводили стан дартными методами с применением graphics Plus.
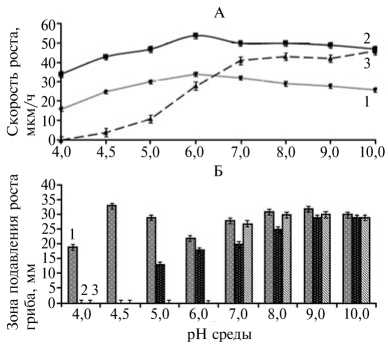
Рис. 1. Радиальная скорость роста (А) и анти-фунгальная активность (Б) у различных штаммов стрептомицетов в зависимости от pH питательной среды: 1 — Streptomyces hygroscopicus штамм A-4, 2 — Streptomyces sp. штамм A-24, 3 — S . felleus штамм A-3 (лабораторный опыт).
В зависимости от кислотности
программ Microsoft Excel и Stat-
Резуёътаты. Определение радиальной скорости роста стрептомицетов выявило толерантность изученных штаммов к кислотности среды в достаточно широком интервале значений рН (рис. 1, А). В соответствии с существующей системой экологической классификации спо-роактиномицетов (24), штаммы Streptomyces sp. А-24 и S. hygroscopicus А-4 следует отнести к нейтротоле-рантным ацидофильным культурам с оптимумом роста (соответственно Kr 54 и 34 мкм/ч) в интервале значений рН 5,5-6,5, тогда как изолят S. felleus A-3 с оптимумом роста (Kr = 46 мкм/ч) в области более высоких значений водородного показателя (рН > 7,0) можно считать нейтротолерантным алкалифильным. среды изменялась и антагонистиче- ская активность исследуемых штаммов по отношению к фитопатогенному грибу F. avenacium (см. рис. 1, Б). Наиболее активно антифунгальные метаболиты во всем интервале заданных значений pH продуцировал штамм S. hygroscopicus А-4, но максимум его метаболической активности (диаметр зоны ингибирования 33,0±1,2 мм) отмечали в кислой среде (рН 4,5). Ан-тифунгальная активность штамма Streptomyces sp. А-24 постепенно возрастала (от 13 до 29 мм) в интервале рН от 5,0 до 9,0, а у штамма S. felleus A3 она проявилась только в области нейтральных и повышенных значений рН (> 7) и оставалась практически неизменной (27-30 мм).
Несмотря на то, что изучаемые штаммы были выделены из ризосферы одного сорта овса, выращенного на дерново-подзолистой почве с низким значением рН, их приспособленность к кислотности среды существенно различалась. Это вполне объяснимо, если рассматривать почву как гетерогенную среду, состоящую из микрозон с различными физикохимическими условиями (14). Кроме того, в ризосфере в ответ на кислотный стресс под влиянием корневых выделений может происходить локальное подщелачивание (15, 16), благодаря чему создаются условия для развития нейтрофильных форм микроорганизмов и, как следствие, возрастает вероятность их выделения из соответствующего микролокуса. Об изоляции нейтрофильных и нейтротолерантных форм актиномицетов из ризосферы растений, произрастающих на кислых почвах Китая и Таиланда, сообщали и другие авторы (17, 25).
Время, сут
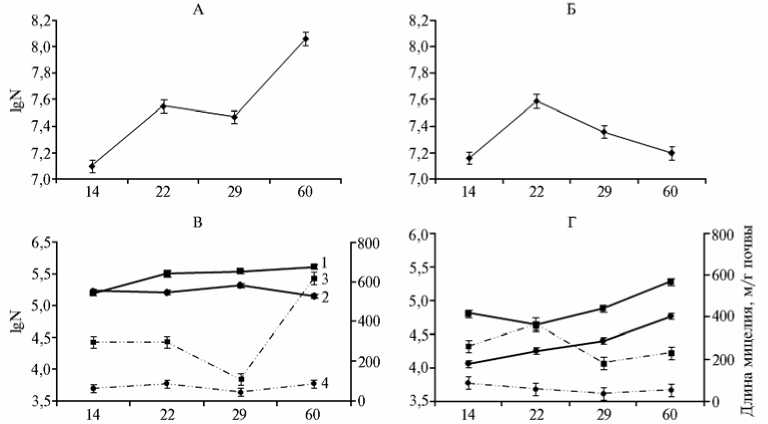
Рис. 2. Динамика популяций стрептомицета Streptomyces hygroscopicus A-4 (А, Б) и фитопатоген-ного гриба Alternaria sp. (В, Г) в дерново-подзолистых почвах на кислом (А, В) и нейтральном (Б, Г) фоне: 1 и 2 — изменение числа пропагул (N, КОЕ/г почвы), 3 и 4 — длина мицелия; 1 и 3 — варианты без внесения в почву стрептомицета, 2 и 4 — варианты с внесением стрептомицета (лабораторный опыт).
На следующем этапе работы мы изучали длительность выживания и сохранения численности S. hygroscopicus А-4, а также его метаболическую активность при внесении в почву с рН 4,0 и 6,5. Плотность интродуцированной популяции S. hygroscopicus А-4 на протяжении 2 мес была примерно одинаковой (107 КОЕ/г) в обоих вариантах опыта, а в конце наблюдения (60-е сут) в почве с рН 4,0 она увеличилась на порядок (108 КОЕ/г) (рис. 2, А, Б). Было установлено, что штамм А-4 способен не только приживаться в почве в условиях кислотного стресса, но и подав- лять развитие фитопатогенного гриба Alternaria sp. — возбудителя альтер-нариоза картофеля и томатов. В присутствии стрептомицета как в нейтральной, так и в кислой почве наблюдалось снижение численности фитопатогена (см. рис. 2 В, Г). Число пропагул гриба в 1 г почвы с повышенной кислотностью составило (1,4-2,1)х105 и превышало таковое в нейтральной почве — (1,2-6,0)х104. В обоих случаях в результате интродукции стрептомицета количество КОЕ патогена снизилось в 1,6-5,4 раза.
Актиномицет не только снижал число пропагул Alternaria sp. в почвах с разной кислотностью, но и угнетал рост мицелия гриба. Под воздействием S . hygroscopicus А-4 длина мицелия снизилась в 2,4-6,9 раз. В конце периода наблюдений угнетение роста грибного мицелия в почве с низким значением рН было более значительным (см. рис. 2, В), чем в нейтральной почве (см. рис. 2, Г).
Антифунгальная активность S . hygroscopicus А-4 проявлялась и в стерильной почве, и в прикорневой зоне растений, выращенных в почве с рНК с1 4,5. Наблюдение за динамикой численности трех фитопатогенных грибов F . avenaceum , F . oxysporum и B . sorokiniana в ризосфере растений озимой ржи показало, что в вариантах с инокуляцией семян S . hygroscopicus А-4 численность грибных пропагул была на 1-2 порядка ниже, чем в прикорневой зоне растений, выращенных из семян, не обработанных спорами стрептомицета (рис. 3). При этом в варианте с обработкой численность популяции S . hygroscopicus А-4 в прикорневой зоне достигала 107 КОЕ/г.
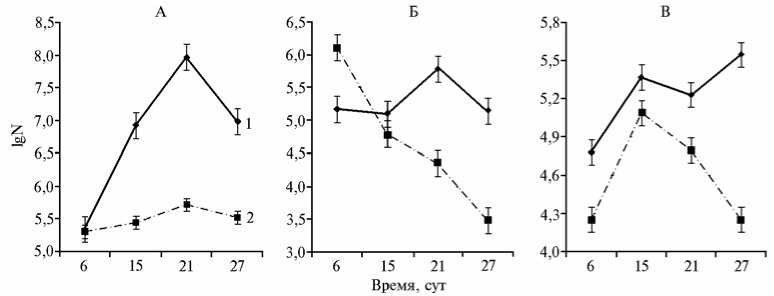
Рис. 3. Динамика численности (N, КОЕ/г почвы) фитопатогенных грибов Fusarium avenaceum (A) , F . oxysporum (Б) и Bipolaris sorokiniana (В) в ризосфере растений озимой ржи ( Secale ce-reale L.) сорта Вятка 2, выращенных in vitro на кислой дерново-подзолистой почве: 1 — контроль, 2 — обработка семян Streptomyces hygroscopicus A-4.
1. Поражение растений озимой ржи ( Secale cereale L.) сорта Вятка 2 и клевера лугового ( Trifolium pratense L.) сорта Трио, выращенных in vitro, фитопа-тогенными грибами при обработке семян штаммом Streptomyces hygroscopicus А-4
|
Культура |
Вариант |
Распространенность болезни, % |
Гибель растений, % |
|
Озимая рожь |
Контроль |
F u s a r i u m a v e n a c e u m 100 |
100 |
|
Опыт |
36 |
21 |
|
|
Контроль |
F . o x y s p o r u m 58 |
17 |
|
|
Опыт |
50 |
50 |
|
|
Контроль |
B i p o l a r i s s o r o k i n i a n a 79 |
14 |
|
|
Опыт |
20 |
0 |
|
|
Клевер луговой |
Контроль |
100 |
9 |
|
Опыт |
38 |
0 |
П р и м е ч а н и е. Описание вариантов опыта см. в разделе «Методика».
Присутствие S . hygroscopicus А-4 в прикорневой зоне благоприятно отразилось на фитосанитарном состоянии растений. Так, в зависимости от вида гриба и растения-хозяина распространенность болезни снижалась на 8-64 %, а гибель растений — на 9-79 % (табл. 1). Угнетения роста растений в результате инокуляции S. hygroscopicus А-4 не выявили. Напротив, в условиях повышенной почвенной кислотности наблюдалось увеличение длины корней на 22-60 % по сравнению с контролем (табл. 2).
-
2. Морфометрические показатели растений у озимой ржи ( Secale cereale L.) сорта Вятка 2, выращенных in vitro, при обработке семян штаммом Streptomyces hygroscopicus А-4 и поражении различными фитопатогенными грибами
-
6. G e t h a K., Vikineswary S. Antagonistic effects of Streptomyces violaceusniger strain G10 on Fusarium oxysporum f. sp. cubense race 4: Indirect evidence for the role of anti-biosis in the antagonistic process. J. Ind. Microbiol. Biotechnol., 2002, 28(6): 303-310.
-
7. Joo G.-J. Production of an antifungal substance for biological control of Phytophthora capsici causing phytophthora blight in red-peppers by Streptomyces halstedii . Biotechnol. Lett., 2005, 27: 201-205.
-
8. Chung W.C., Huang J.W., Huang H.C. Formulation of a soil biofungicide for con-trol of damping-off of Chinese cabbage ( Brassica chinensis ) caused by Rhizoctonia solani . Biol. Contr., 2005, 32: 287-294.
-
9. Prabavathy V.R., Mathivanan N., Murugesan K. Control of blast and sheath blight diseases of rice using antifungal metabolites produced by Streptomyces sp. PM5. Biol. Contr., 2006, 39: 313-319.
-
10. Гайда0ева И.И. Культивирование 0тамма Streptomyces lateritius 19/97M: перспекти-âû ñîçäàíèÿ áèîïðåïàðàòà äëÿ ñòèìóëÿöèè ðîñòà è çàùèòû ðàñòåíèé îò áîëåçíåé. Àâòî-ðåô. êàíä. äèñ. Ì., 2011.
-
11. Øèëüíèêîâ È.À., Àêàíîâà Í.È., Çåëåíîâ Í.À. Âîïðîñû èçâåñòêîâàíèÿ êèñ-ëûõ ïî÷â. ÕÕI âåê: èòîãè ïðîøëîãî è ïðîáëåìû íàñòîÿùåãî, 2011, 1: 15-21.
-
12. Øèðîêèõ È.Ã., Øèðîêèõ À.À. Ìèêðîáíûå ñîîáùåñòâà êèñëûõ ïî÷â Êèðîâñêîé îáëàñòè. Êèðîâ, 2004.
-
13. Barlett D.W., Clough J.M., Godwin J.R., Hall A.A., Hamer M., Parr-Dobrzanski B. The strobilurin fungicides. Pest. Manag. Sci., 2002, 58: 649-662.
-
14. Rosenberger D.A., Meyer F.W. Post-harvest fungicides for apples: development of resistance to benomyl vinclozolin and iprodione. Plant Dis., 1981, 65: 1010-1013.
-
15. Yamaguchi I. Pesticides of microbial origin and applications of molecular biology. In: Crop protection agents from nature: natural products and analogues /L.G. Copping (ed.). Cambridge, UK, 1996: 27-49.
-
16. Williams S.T., Davies F.L., Mayfield C.I., Khan M.R. Studies on the ecology of actinomycetes in soil II. The pH requirements of streptomycetes from two acid soils. Soil. Biol. Biochem., 1971, 3(3): 187-192.
-
17. Xu Ñ., Wang L., Cui Q., Huang Y., Liu Z., Zheng G., Goodfellow M. Neu-trotolerant acidophilic Streptomyces species isolated from acidic soils in China: Streptomyces guanduensis sp. nov., Streptomyces paucisporeus sp. nov., Streptomyces rubidus sp. nov. and Streptomyces yanglinensis sp. nov. Int. J. Syst. Evol. Microbiol., 2006, 56: 1109-1115.
-
18. Wang L., Huang Y., Liu Z., Goodfellow M., Rodriguez C. Streptacidzphz'lus oryzae sp. nov., an actinomycete isolated from rice-field soil in Thailand. Int. J. Syst. Evol. Microbiol., 2006, 56: 1257-1261.
-
19. Williams S.T., Khan M.R. Antibiotics — a soil microbiologist ׳ s viewpoint. Postery Hig Med. Dosw., 1974, 28: 395-408.
-
20. Williams S.T., Robinson C.S. The role of streptomycetes in decomposition of chitin in acidic soils. J. Gen. Microbiol., 1981, 127: 55-63.
-
21. Ãàóçå Ã.Ô., Ïðåîáðàæåíñêàÿ Ò.Ï., Ñâåøíèêîâà Ì.À., Òåðåõîâà Ë.Ï., Ìàêñèìîâà Ò.Ñ. Îïðåäåëèòåëü àêòèíîìèöåòîâ. Ì., 1983.
-
22. Ïðàêòèêóì ïî ìèêðîáèîëîãèè /Ïîä ðåä. À.È. Íåòðóñîâà. Ì., 2005.
-
23. Ìåòîäû ïî÷âåííîé ìèêðîáèîëîãèè è áèîõèìèè /Ïîä ðåä. Ä.Ã. Çâÿãèíöåâà. Ì., 1991.
-
24. Lonsdale J.T. Aspects of the biology of acidophilic actinomycetes. PhD thesis. Newcastle upon Tyne, 1985.
-
25. Khamna S., Yokota A., Peberdy J.F., Lumyong S. Antifungal activity of Streptomyces spp. isolated from rhizosphere of Thai medicinal plants. Int. J. Integr. Biol., 2009, 6(3): 143-147.
Поступила в редакцию 11 декабря 2012 года
|
Вариант |
Масса, мг |
Высота надземной |
Длина корней, мм |
|
надземная часть корни |
части, мм |
||
F u s a r i u m a v e n a c e u m
Таким образом, в популяциях ризосферных актиномицетов, выделенных из дерново-подзолистых почв, встречаются виды, способные расти и подавлять развитие фитопатогенных грибов в условиях низких значений рН. В частности, штамм Streptomyces hygroscopicus А-4 обладает высоким потенциалом антифунгального действия при кислой реакции среды. Об этом свидетельствует его высокая популяционная численность (107 КОЕ/г), длительно (на протяжении 60 сут) сохраняющаяся в почве и в ризосфере подвергнутых кислотному стрессу растений; высокая антифунгальная активность его водорастворимых метаболитов в широком диапазоне значений рН с оптимумом в зоне низких значений (рН 4,5); способность в почвах с высокой кислотностью снижать плотность популяций и длину мицелия таких фитопатогенных грибов, как Alternaria sp., Fusarium avenaceum , F . oxysporum и Bipolaris sorokiniana . При этом доказано отсутствие токсического эффекта S . hygroscopicus А-4 на растения. На основании полученных данных штамм Streptomyces hygroscopicus А-4 можно рассматривать как перспективный для использования в биологической защите растений, особенно в почвах с повышенной кислотностью.
Л И Т Е Р А Т У Р А
ГНУ Зональный НИИ сельского хозяйства Северо-Востока им. Н.В. Рудницкого Россельхозакадемии ,
GROWTH AND ANTIFUNGAL ACTIVITY OF STREPTOMYCETES INFLUENCED BY ACIDIC CONDITIONS
O.V. Ryabova, I.G. Shirokikh
Научные собрания
МЕЖДУНАРОДНАЯ НАУЧНО-ПРАКТИЧЕСКАЯ КОНФЕРЕНЦИЯ «НАУЧНО-ПРАКТИЧЕСКИЕ ОСНОВЫ ПОВЫШЕНИЯ ЭФФЕКТИВНОСТИ САДОВОДСТВА СРЕДНЕЙ ЗОНЫ РОССИИ В СОВРЕМЕННЫХ РЫНОЧНЫХ УСЛОВИЯХ»
(23-24 июля 2014 года, Липецкая обл.)
IV МЕЖДУНАРОДНАЯ НАУЧНО-ПРАКТИЧЕСКАЯ КОНФЕРЕНЦИЯ «СОВРЕМЕННЫЕ ТЕНДЕНЦИИ В СЕЛЕКЦИИ И СЕМЕНОВОДСТВЕ ОВОЩНЫХ КУЛЬТУР. ТРАДИЦИИ И ПЕРСПЕКТИВЫ»
(12 августа 2014 года, Московская обл.)
МЕЖДУНАРОДНАЯ НАУЧНО-ПРАКТИЧЕСКАЯ КОНФЕРЕНЦИЯ «МНОГОФУНКЦИОНАЛЬНОЕ АДАПТИВНОЕ КОРМОПРОИЗВОДСТВО» (28 августа 2014 года, Московская обл.)
VIII МЕЖДУНАРОДНАЯ НАУЧНО-ПРАКТИЧЕСКАЯ КОНФЕРЕНЦИЯ «БИОЛОГИЧЕСКАЯ ЗАЩИТА РАСТЕНИЙ - ОСНОВА СТАБИЛИЗАЦИИ АГРОЭКОСИСТЕМ»
(16-19 сентября 2014 года, г. Краснодар)
МЕЖДУНАРОДНАЯ НАУЧНО-ПРАКТИЧЕСКАЯ КОНФЕРЕНЦИЯ «ИННОВАЦИОННЫЕ АСПЕКТЫ АГРОЭКОЛОГИИ В ПОВЫШЕНИИ ПРОДУКТИВНОСТИ РАСТЕНИЙ И КАЧЕСТВА ПРОДУКЦИИ»
(16-17 сентября 2014 года, г. Москва)
НАУЧНАЯ ШКОЛА МОЛОДЫХ УЧЕНЫХ «ЭКОЛОГИЧЕСКАЯ ГЕНЕТИКА КУЛЬТУРНЫХ РАСТЕНИЙ»
(24-25 сентября 2014 года, г. Ставрополь)
МЕЖДУНАРОДНАЯ КОНФЕРЕНЦИЯ «МИРОВОЙ ГЕНОФОНД КУЛЬТУРНЫХ РАСТЕНИЙ КАК СТРАТЕГИЧЕСКАЯ ОСНОВА ПРЕОДОЛЕНИЯ ГЛОБАЛЬНОГО ПРОДОВОЛЬСТВЕННОГО КРИЗИСА», посвященная 120-летию ВИР
(27 октября 2014 года, г. Санкт-Петербург)
МЕЖДУНАРОДНАЯ НАУЧНАЯ КОНФЕРЕНЦИЯ «ПРОБЛЕМЫ ЭВОЛЮЦИИ И СИСТЕМАТИКИ КУЛЬТУРНЫХ РАСТЕНИЙ» , посвященная 125-летию со дня рождения Е.Н. Синской
(10 декабря 2014 года, г. Санкт-Петербург)
Ìåðîïðèÿòèÿ âêëþ÷åíû â ïëàí Îòäåëà êîîðäèíàöèè äåÿòåëüíîñòè ó÷ðåæäåíèé â ñôåðå ðàñ-òåíèåâîäñòâà Óïðàâëåíèÿ êîîðäèíàöèè è îáåñïå÷åíèÿ äåÿòåëüíîñòè îðãàíèçàöèé â ñôåðå ñåëüñêîõîçÿéñòâåííûõ íàóê Ôåäåðàëüíîãî àãåíòñòâà íàó÷íûõ îðãàíèçàöèé.


