Рост проростков гречихи обыкновенной (Fagopyrum esculentum Moench) и накопление первичных и вторичных метаболитов при различных условиях минерального питания
Автор: Цыпурская Е.В., Казанцева В.В., Фесенко А.Н., Загоскина Н.В.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Физиология адаптации
Статья в выпуске: 5 т.54, 2019 года.
Бесплатный доступ
Гречиха обыкновенная ( Fagopyrum esculentum Moench) - важная сельскохозяйственная культура. Помимо уникальных пищевых характеристик, для нее характерно образование различных фенольных соединений, в том числе рутина, широко применяемого в медицине. Поскольку фенольные соединения обладают высокой биологической и антиоксидантной активностью, в том числе рассматриваются как потенциальные компоненты функционального питания, изучение их накопления на начальных этапах онтогенеза растений представляет практический интерес. В представленной работе мы показали регуляторное действие макро- и микроэлементов на рост растений и накопление первичных и вторичных метаболитов у гречихи. Впервые охарактеризовано образование первичных и вторичных метаболитов в надземных органах нового и перспективного российского сорта гречихи обыкновенной Даша, внесенного в Государственный реестр селекционных достижений, допущенных к использованию в Российской Федерации, в 2018 году. Целью работы было изучение начальных этапов онтогенеза проростков гречихи обыкновенной, включая оценку их морфофизиологических характеристик в условиях различной обеспеченности элементами минерального питания, а также накопления в семядольных листьях фотосинтетических пигментов, сахаров и фенольных соединений. Объектом исследования служили проростки гречихи обыкновенной сортов Девятка и Даша селекции ВНИИ зернобобовых культур (г. Орел), внесенных в Государственный реестр селекционных достижений, допущенных к использованию в Российской Федерации, соответственно в 2004 и 2018 году. Растения выращивали в лабораторных условиях рулонным способом на воде (контроль) и питательной среде Хогланда-Арнона (опыт) при 24 °C и 16-часовом освещении. Определяли высоту гипокотилей, длину корней и массу семядольных листьев проростков. Оводненность растительного материала анализировали после его высушивания до постоянной массы при температуре 70 °C. Спектрофотометрическим методом определяли количество хлорофиллов a и b (при λ = 665 нм и λ = 649 нм), каротиноидов (λ = 440 нм), сахаров (λ = 490 нм), суммы растворимых фенольных соединений (λ = 725 нм), флавоноидов (λ = 415 нм) и фенилпропаноидов (λ = 330 нм) в этанольных экстрактах, полученных из семядольных листьев проростков разного возраста. Выращивание гречихи на питательной среде Хогланда-Арнона способствовало более быстрому росту надземных органов по сравнению с выращиванием на воде. Рост подземных органов в обоих случаях был одинаковым. Выявлены различия в накоплении фотосинтетических пигментов (хлорофилла a и b, каротиноидов) и сахаров в семядольных листьях у проростков: в опытных вариантах в большинстве случаев эти показатели были выше, чем в контрольных. Накопления фенольных соединений не столь явно зависело от условий минерального питания. Исключением было содержание фенилпропаноидов, которое в семядольных листьях проростков, выращенных на питательной среде, изменялось в большей степени по сравнению с контролем и достигало высоких значений в конце периода исследования. Следует также отметить, что при выращивании проростков гречихи сорта Даша на питательной среде в их семядольных листьях на поздних этапах онтогенеза отмечалось более значительное накопление пигментов (на 20 %, р ≤ 0,05), сахаров (на 33 %, р ≤ 0,05) и фенольных соединений (на 35 %, р ≤ 0,05) по сравнению с сортом Девятка. Таким образом, количество минеральных элементов имеет важное значение для начальных этапов онтогенеза растений гречихи обыкновенной. Более быстрый рост проростков и накопление первичных и вторичных метаболитов в их листьях характерны для опытных вариантов по сравнению с контролем. Использование различных условий минерального питания дает возможность регулировать рост и развитие растений, а также накопление в них различных метаболитов.
Гречиха, проростки, онтогенез, минеральное питание, пигменты, сахара, фенольные соединения, фенилпропаноиды, флавоноиды
Короткий адрес: https://sciup.org/142226263
IDR: 142226263 | УДК: 633.12:581.1:631.811 | DOI: 10.15389/agrobiology.2019.5.946rus
Текст научной статьи Рост проростков гречихи обыкновенной (Fagopyrum esculentum Moench) и накопление первичных и вторичных метаболитов при различных условиях минерального питания
Формирование и развитие проростков представляет собой важный этап онтогенетического развития растений, зависящий от эндогенного запаса метаболитов семян и их превращений, а также воздействия экзогенных факторов окружающей среды, включая влажность почвы, температуру, свет, 946
минеральное питание (1, 2). Для этого периода характерен переход от гетеротрофного типа питания к автотрофному, изменение структурной организации клеток и тканей, энергетических процессов (дыхание, фотосинтез), состояния гормональной, антиоксидантной и других систем (3-5).
К важным регуляторам жизнеспособности растений относятся фенольные соединения — одни из наиболее распространенных вторичных метаболитов, которые присутствуют во всех клетках и тканях (6, 7). Их содержание зависит от видовой принадлежности растений, стадии онтогенеза, условий произрастания и минерального питания (8-10). Функциональная роль фенольных соединений чрезвычайно разнообразна и связана с процессами фотосинтеза, дыхания, роста и развития растений, а также c устойчивостью к стрессовым воздействиям (6, 11, 12).
Гречиху обыкновенную ( Fagopyrum esculentum Moench) причисляют к главным продовольственным культурам, она возделывается во многих странах мира и успешно используется в различных отраслях промышленности. Для гречихи характерно значительное накопление фенольных соединений, в том числе рутина — вещества с высокой капилляроукрепляющей активностью (13, 14). Наибольшее содержание этих вторичных метаболитов отмечено в надземных органах растений, особенно в листьях и цветках (15, 16). Сообщалось об образовании фенольных соединений в проростках, где их количество было меньше, а состав менее разнообразен по сравнению со взрослыми растениями (17, 18). Поскольку фенольные соединения обладают высокой биологической и антиоксидантной активностью, в том числе как потенциальные компоненты функционального питания (13), изучение их накопления на начальных этапах онтогенеза растений представляет практический интерес.
В настоящей работе, сравнив ряд морфологических, физиологических и биохимических показателей у двух сортов гречихи (Девятка и Даша) в условиях различного минерального питания, мы выявили регуляторное действие макро- и микроэлементов на процессы раннего онтогенеза и накопления первичных и вторичных метаболитов в надземных органах при определенной сортовой специфичности реакции растений. У нового перспективного сорта Даша, который в 2018 году внесен в Государственный реестр селекционных достижений, допущенных к применению в Российской Федерации, эти процессы охарактеризованы впервые.
Нашей целью была оценка особенностей начальных этапов онтогенеза, морфофизиологических характеристик и накопления в семядольных листьях фотосинтетических пигментов, сахаров и фенольных соединений у проростков гречихи обыкновенной в зависимости от обеспеченности элементами минерального питания.
Методика . Изученные сорта гречихи обыкновенной Девятка и Даша (19, 20) получены во Всероссийском НИИ зернобобовых культур и внесены соответственно в 2004 и 2018 году в Государственный реестр селекционных достижений, допущенных к использованию в Российской Федерации.
Проростки выращивали методом рулонной культуры (10). Для этого семена помещали в чашки Петри на фильтровальную бумагу, смоченную водой (контроль) или питательной средой Хогланда-Арнона (опыт) (21). После выдерживания в темноте в течение 24 ч их помещали в рулоны из фильтровальной бумаги (15 шт. в один рулон), которые ставили в пластиковые стаканы (по 7 рулонов в один стакан) с водой или питательной средой и выращивали в камере фитотрона ИФР РАН при 24 °С и 16часовом фотопериоде (5000 лк). Для исследования брали проростки, нахо- дящиеся на одной фазе онтогенетического развития: при выращивании на воде это были 11-е, 14-е и 18-е сут роста, при выращивании на питательной среде — 6-е, 11-е и 14-е сут (соответственно фазы 1-я, 2-я и 3-я). Критерием служили форма и размеры семядольных листьев, которые использовали для биохимических исследований.
Оценивали морфофизиологические параметры проростков — высоту надземной части и длину корней, а также массу семядольных листьев. Оводненность тканей определяли после высушивания растительного материала при 70 °С в термостате до постоянной массы (10).
Для извлечения пигментов листья проростков гомогенизировали в 96 % этаноле в темноте. Гомогенат центрифугировали (СМ-50, «ELMI Ltd.», Латвия) в течение 5 мин при 13000 об/мин. В надосадочной жидкости спектрофотометрическим методом (СФ-46, «ЛОМО», Россия) определяли количество хлорофиллов a и b (соответственно X = 665 нм и X = 649 нм), а также каротиноидов (X = 440 нм). Их содержание рассчитывали стандартным методом (22).
Сахара извлекали из растительного материала посредством экстракции 96 % этанолом (23). В надосадочной жидкости, полученной после центрифугирования гомогената (2 мин, 16000 об/мин), определяли суммарное содержание сахаров спектрофотометрическим методом по реакции с фенолом и серной кислотой (поглощение при X = 490 нм) (24). Калибровочную кривую строили по сахарозе.
Для экстракции фенольных соединений растительный материал гомогенизировали в 96 % этаноле и выдерживали при 45 °С в течение 45 мин (10, 24). Гомогенат центрифугировали (2 мин, 16000 об/мин). Надосадочную жидкость использовали для определения различных классов фенольных соединений спектрофотометрическим методом. Содержание суммы растворимых фенольных соединений оценивали с реактивом Фолина-Дениса (X = 725 нм), содержание флавоноидов — с 1 % водным раствором хлористого алюминия (X = 430 нм). Количество фенилпропаноидов определяли методом прямой спектрофотометрии растворов при X = 330 нм. Калибровочные кривые для расчета суммы фенольных соединений и флавоноидов строили по рутину, для расчета содержания фенилпропаноидов — по кофейной кислоте. В экспериментах использовали 3-кратные биологические и 2-кратные аналитические повторности измерений.
Дисперсионный анализ (ANOVA) проводили в программах SigmaPlot 12.3 и Microsoft Excel. В таблице и на графиках представлены средние арифметические значения полученных величин (M) и их стандартные ошибки (±SEM). Надстрочные символы обозначают достоверность различий средних значений по тесту Тьюки при р < 0,05.
Результаты . Важным показателем роста и развития растений служат их морфофизиологические характеристики, которые зависят от стадии онтогенеза, видовых и сортовых особенностей, а также действия внешних факторов, в том числе минерального питания (2, 4, 8).
Сорта гречихи Девятка и Даша — среднеспелые, высокоурожайные, устойчивые к полеганию (25, 26). При выведении сорта Даша отбор проводился на высокую озерненность и фотосинтетическую активность (20). Для этого сорта характерна более выраженная устойчивость к засухе, поражению аскохитозом и ложной мучнистой росой по сравнению с сортом Девятка (26). Следовательно, можно предположить некоторые различия в морфофизиологических характеристиках названных сортов, в том числе на ранних этапах онтогенеза, начиная с формирования и развития семядоль- ных листьев.
При выращивании в водной культуре (контроль) длина корней у проростков обоих сортов была практически одинаковой и увеличивалась в течение всего периода исследований (табл. 1). К 3-й фазе она возрастала на 57-60 % по сравнению с 1-й фазой. Это свидетельствует о значительном сходстве начальных этапов роста подземных органов у проростков двух сортов гречихи (1).
Формирование и развитие надземных органов обеспечивается как эндогенным запасом метаболитов в семенах, так и образованием новых метаболитов за счет процессов фотосинтеза (2, 27). В наших опытах высота гипокотилей у проростков сорта Девятка во все фазы онтогенеза достоверно превышала таковую у сорта Даша (в среднем на 16 %, р ≤ 0,05). У обоих сортов ее увеличение отмечалось при переходе ко 2-й фазе (на 40 % по сравнению с 1-й фазой), в дальнейшем высота гипокотилей не изменялась.
Полученные данные согласуются с показателями массы гипокотилей, которая у проростков сорта Девятка была достоверно (р ≤ 0,05) выше, чем у сорта Даша. При этом у сорта Девятка в первые две фазы онтогенеза она не изменялась, а к 3-й фазе увеличивалась на 19 % (р ≤ 0,05). У проростков сорта Даша масса гипокотилей не изменялась в течение всего периода роста. Эти результаты свидетельствуют о более быстром росте и накоплении биомассы в надземных органах у проростков традиционного сорта (Девятка) по сравнению с сортом следующего поколения (Даша).
Формирование и развитие листьев обеспечивает переход растений к автотрофному типу питания (1, 28). На всех этапах онтогенеза масса семядольных листьев у проростков обоих сортов гречихи была небольшой и практически равной. Единственным исключением оказались проростки сорта Девятка, у которых на 3-й фазе масса семядольных листьев была на 33 % выше (р ≤ 0,05) (см. табл. 1).
1. Морфофизиологическая характеристика проростков у двух сортов гречихи обыкновенной ( Fagopyrum esculentum Moench), выращенных в разных условиях, в зависимости от возраста ( M ±SEM, лабораторный опыт)
|
Фаза онтогенеза |
Длина корня, см |
Гипокотиль |
Масса семядольных листьев, г |
Оводненность семядольных листьев, % |
|
|
высота, см |
масса, г |
||||
|
Контроль |
(вода) |
||||
|
Сорт Девятка |
|||||
|
1-я |
7,08±0,30с |
9,85±0,41d |
0,13±0,02d |
0,04±0,004d |
89,53±1,62а |
|
2-я |
11,67±0,44b |
14,07±0,31b |
0,14±0,02d |
0,04±0,009d |
91,07±0,37а |
|
3-я |
12,04±0,80а |
14,32±1,12b |
0,16±0,02c |
0,06±0,006c |
91,05±0,16а |
|
Сорт Даша |
|||||
|
1-я |
7,42±0,32с |
8,27±0,46e |
0,11±0,01e |
0,04±0,003d |
88,77±0,69а |
|
2-я |
11,85±0,44b |
11,74±0,31c |
0,11±0,01e |
0,04±0,005d |
91,24±0,17а |
|
3-я |
13,00±1,00а |
11,97±1,07c |
0,12±0,01e |
0,04±0,004d |
91,43±1,45а |
|
Пита |
т е л ь н ая с р ед а Х о г л а нд а - Ар н о н а (опыт) |
||||
|
Сорт Девятка |
|||||
|
1-я |
7,62±0,44с |
9,11±0,87d |
0,15±0,01c |
0,06±0,006c |
88,28±0,11а |
|
2-я |
8,20±0,50с |
14,69±0,91b |
0,21±0,02b |
0,06±0,010c |
91,96±0,29а |
|
3-я |
11,02±0,26b |
17,97±0,21a |
0,27±0,02a |
0,08±0,013a |
93,50±0,60а |
|
Сорт Даша |
|||||
|
1-я |
7,72±0,38с |
4,75±0,50f |
0,14±0,02d |
0,05±0,005c |
88,79±0,50а |
|
2-я |
8,26±0,44с |
13,69±0,29b |
0,21±0,01b |
0,07±0,007b |
91,93±0,27а |
|
3-я |
11,24±0,32b |
17,21±0,59a |
0,27±0,02a |
0,07±0,013b |
95,48±1,58а |
|
П р и м е ч а н и е. Достоверные различия |
средних значений при р ≤ 0,05 отмечены неодинаковыми ла- |
||||
|
тинскими буквами. |
|||||
На питательной среде Хогланда-Арнона (опыт), то есть в условиях обеспеченности макро- и микроэлементами, развитие проростков ускорялось по сравнению с контролем. Так, 6-суточные проростки в опытных вариантах по морфофизиологическим характеристикам соответствовали 11-суточным проросткам в контроле, 11-суточные — 14-суточным,
14-суточные — 18-суточным.
Длина корня у проростков двух сортов не различалась на всех этапах исследования. При этом во 2-ю и 3-ю фазы она была меньше, чем в контроле (см. табл. 1). Прирост корня за весь период составил 30 %, то есть наличие макро- и микроэлементов в среде замедляло развитие подземных органов.
Высота гипокотилей у проростков сорта Девятка в 1-ю и 2-ю фазы онтогенеза была равной в опытном и контрольном вариантах, а в 3-ю фазу оказалась больше в опыте. У сорта Даша опытный вариант всегда достоверно (р ≤ 0,05) отличался от контроля, причем в 1-ю фазу значения были ниже, во 2-ю и 3-ю фазы — выше. Следует также отметить, что высота гипокотилей у проростков сорта Девятка в 1-ю фазу была на 50 % ниже, чем у проростков сорта Даша, а в дальнейшем — практически равной. При этом ее общее увеличение за весь период исследования у сорта Девятка составило 50 %, у сорта Даша — 72 %. Что касается массы гипокотилей, то она была почти одинаковой у обоих сортов и в течение периода роста проростков увеличивалась на 44 %. Ее значения во все фазы онтогенеза в опытном варианте превышали контроль.
Определение массы семядольных листьев у проростков двух сортов гречихи не выявило значительных различий между ними. В процессе онтогенеза она увеличилась у сорта Девятка на 25 %, у сорта Даша — на 28 %. В целом почти все показатели надземных органов у проростков в опытных вариантах, особенно на завершающем этапе исследования (3-я фаза), оказались достоверно (р ≤ 0,05) выше контрольных, что свидетельствует о стимулирующем действии питательного раствора.
Содержание воды в тканях — важный показатель при оценке физиологического состояния растений (1). Оводненность семядольных листьев у проростков двух сортов гречихи была одинаковой и повышалась в процессе онтогенетического развития (см. табл. 1). Наибольшие значения были отмечены в завершающую фазу роста. Обеспеченность проростков гречихи минеральным питанием не влияла на этот показатель.
2. Содержание пигментов в семядольных листьях у проростков двух сортов гречихи обыкновенной ( Fagopyrum esculentum Moench), выращенных в разных условиях, в зависимости от возраста ( M ±SD)
|
Фаза |
Хлорофиллы, мг/г сухой массы |
Хлорофиллы, а/b |
Каротиноиды, |
|
онтогенеза |
а 1 b 1 а + b |
мг/г сухой массы |
|
Ко нтр оль (вода) Сорт Девятка |
|||||
|
1-я |
5,29±0,28d |
1,24±0,12e |
6,53±0,40d |
4,26 |
0,81±0,04d |
|
2-я |
6,19±0,05c |
1,51±0,04d |
7,70±0,09с |
4,09 |
0,98±0,03c |
|
3-я |
5,67±0,87cd |
1,48±0,26d |
7,15±1,13с Сорт Даша |
3,83 |
0,49±0,05f |
|
1-я |
5,14±0,18d |
1,30±0,11e |
6,44±0,29d |
3,95 |
0,71±0,10e |
|
2-я |
5,25±0,42d |
1,38±0,12de |
6,63±0,54d |
3,80 |
0,96±0,09c |
|
3-я |
5,14±0,68d |
1,39±0,04de Питат |
6,53±0,72d ельная среда Сорт Девятка |
3,70 (опыт) |
0,52±0,19f |
|
1-я |
2,28±0,02f |
3,51±0,05a |
5,79±0,07e |
0,01 |
|
|
2-я |
5,44±0,18d |
1,49±0,16d |
6,93±0,34d |
3,65 |
0,50±0,04f |
|
3-я |
7,25±0,03b |
1,90±0,15c |
9,15±0,18в Сорт Даша |
3,81 |
1,23±0,01b |
|
1-я |
3,19±0,09e |
3,78±0,26a |
6,97±0,35d |
0,84 |
|
|
2-я |
6,22±0,53c |
1,65±0,12d |
7,87±0,65с |
3,76 |
0,65±0,08e |
|
3-я |
9,09±0,61a |
2,39±0,17b |
11,48±0,70а |
3,80 |
1,45±0,04a |
П р и м еч а ни е. Достоверные различия средних значений при р ≤ 0,05 отмечены неодинаковыми латинскими буквами. Прочерки означают, то каротиноиды выявляли, начина со 2-й фазы онтогенеза.
Фотосинтез растений — главный биологический процесс, обеспечивающий жизнь всех организмов на планете (27). Для оценки его эффек- тивности используют такие показатели, как содержание хлорофиллов a и b в листьях и их соотношение (28). В контрольных условиях нашего опыта были выявлены различия в накоплении хлорофиллов a и b в семядольных листьях по мере роста проростков обоих сортов гречихи (табл. 2). У сорта Девятка содержание хлорофилла a в 1-ю фазу оказалось наименьшим, во 2-ю фазу достоверно повышалось на 17 % (р ≤ 0,05), а к 3-й фазе снижалось на 10 %, но превышало показатель в 1-ю фазу. Аналогичная, но менее выраженная тенденция проявлялась и в отношении хлорофилла b. В семядольных листьях у проростков сорта Даша содержание хлорофиллов a и b в течение всего периода исследования не изменялось и было практически равным таковому у проростков сорта Девятка в 1-ю фазу.
При оценке фотосинтетической продуктивности растительных тканей важно учитывать отношение хлорофиллов a/b, которое при оптимальных условиях роста приближается к 3 (27, 28). Для семядольных листьев проростков обоих сортов гречихи в контроле отмечали более высокие показатели отношения хлорофиллов a/b, причем в большей степени это было характерно для 1-й и 2-й фаз (см. табл. 2).
Пигментная система растений, помимо хлорофиллов, содержит каротиноиды, которые участвуют в функционировании реакционных центров и светособирающих комплексов фотосистем хлоропластов, поглощают свет в синей области спектра, защищают фотосинтетический аппарат от фотодеструкции, а также выполняют другие защитные функции (29, 30). У обоих сортов гречихи наблюдались одинаковые тенденции в накоплении каротиноидов: высокое содержание в 1-ю фазу, последующее увеличение во 2-ю фазу (примерно на 20 %) и значительное снижение в 3-ю фазу (почти в 2 раза). Следовательно, начальные этапы формирования и развития семядольных листьев у проростков гречихи при низком уровне минерального питания характеризуются значительным накоплением каротиноидов, что может свидетельствовать об их важной роли в этот период онтогенетического развития (31).
Изучение накопления пигментов в семядольных листьях у проростков гречихи, выращенных на питательной среде, выявило несколько иные тенденции. Содержание хлорофиллов a и b в них достоверно (р < 0,05) повышалось в течение всего периода наблюдений, что не было характерно для контрольных вариантов (см. табл. 2). В 1-ю фазу количество хлорофилла a в семядольных листьях у проростков сортов Девятка и Даша было минимальным (соответственно в 2,3 и 1,6 раза ниже, чем в контроле, р ≤ 0,05). Содержание хлорофилла b в эту фазу оказалось наибольшим и превышало контрольный показатель почти в 3 раза (р ≤ 0,05). Последующее развитие семядольных листьев (2-я и 3-я фазы) сопровождалось значительным (р ≤ 0,05) повышением в них содержания хлорофиллов a и b, что в большей степени проявлялось у сорта Даша. При его селекции проводился отбор на фотосинтетическую продуктивность растений (27), и эта особенность проявлялась уже на ранних этапах их развития. Следует также отметить, что суммарное содержание хлорофиллов a и b в семядольных листьях в опытных вариантах за весь период исследования достоверно (р ≤ 0,05) повысилось: у сорта Девятка на 58 %, у сорта Даша — на 64 %.
Что касается отношения хлорофиллов a/b в семядольных листьях, то в 1-ю фазу оно было низким (0,06 и 0,80 соответственно у сорта Девятка и сорта Даша), а во 2-ю и 3-ю фазы значительно повышалось и становилось практически равным у обоих сортов (в среднем 3,76). Эти показатели соответствовали контрольным, то есть наблюдалось значительное сходство в формировании фотосинтетического аппарата в семядольных ния хлоропластов — важных источников энергии
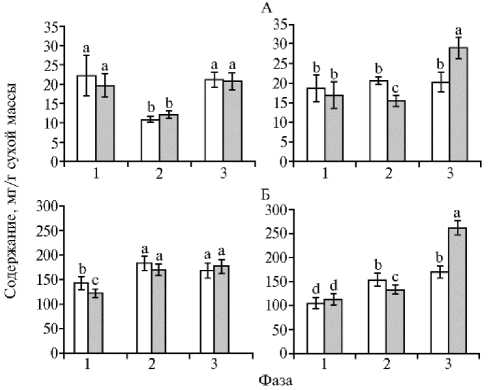
Рис. 1. Содержание сахаров (А) и фенольных соединений (Б) в семядольных листьях у проростков гречихи обыкновенной ( Fagopyrum esculentum Moench) сортов Девятка (белые столбики) и Даша (серые столбики) , выращенных на воде (слева) и питательной среде Хогланда-Арнона (справа) , в разные фазы онтогенеза. Достоверные различия средних значений при р ≤ 0,05 отмечены неодинаковыми латинскими буквами над барами.
листьях гречихи в более поздние фазы онтогенеза, которое не зависело от минерального питания проростков (см. табл. 2).
В опытных вариантах накопление каротиноидов в семядольных листьях было практически равным у проростков обоих сортов гречихи (см. табл. 2). Его отмечали, начиная со 2-й фазы, но оно было ниже, чем в контроле, а к 3-й фазе увеличивалось почти в 2,5 раза (р ≤ 0,05) и значительно превышало контроль.
В целом, наличие питательных элементов способствовало более эффективному образованию хлорофиллов и каротиноидов, что было следствием быстрого роста растений, развития семядольных листьев и формирова-метаболитов (27, 28).
Известно, что на начальных этапах онтогенеза растения испытывают существенную потребность в энергии и метаболитах для роста и накопления биомассы (1, 2). Растворимые сахара становятся для них основной транспортной формой ассимилятов и могут служить исходными субстратами для многих процессов метаболизма, а также образования структурных элементов клеток и тканей, что необходимо для развития проростков (32).
Накопления растворимых сахаров в семядольных листьях в контрольных вариантах было практически рав ным у проростков двух сортов гречихи в течение трех фаз онтогенеза (рис. 1, А). В 1-ю фазу количество сахаров было высоким, во 2-ю фазу — достоверно (р ≤ 0,05) снижалось (на 51 %), в 3-ю фазу — повышалось (р ≤ 0,05), достигая исходных значений. Эти различия были обусловлены обеспеченностью исходными субстратами для образования растворимых сахаров, а именно запасными веществами в семенах гречихи (1-я фаза), их последующим истощением и активным ростом проростков (2-я фаза) и, наконец, фотосинтезом (3-я фаза), приводящим к повышению количества метаболитов и накоплению растворимых сахаров (23, 32).
Для накопления растворимых сахаров в семядольных листьях проростков, выращенных на питательной среде, наблюдалась иная тенденция (см. рис. 1, А). У сорта Девятка на всех этапах исследования содержание растворимых сахаров было одинаковым и достаточно приближенным к значениям в контроле в 1-ю и 3-ю фазы. У сорта Даша в 1-ю фазу оно оказалось равным таковому у сорта Девятка, во 2-ю фазу — снижалось на 25 % (р ≤ 0,05), в 3-ю — фазу возрастало на 47 % (р ≤ 0,05). Такая закономерность характерна только для сорта Даша, который был создан селекционерами посредством отбора по интенсивности фотосинтетической активности (20, 26).
Фенольные соединения — одни из важнейших метаболитов растений, роль которых, как и химическая структура, чрезвычайно разнообразна (6, 7). При выращивании в контрольных условиях в 1-ю фазу у сорта Девятка количество фенольных соединений в семядольных листьях было на 13 % выше, чем у сорта Даша (см. рис. 1, Б). Во 2-ю и 3-ю фазы накопление фенольных соединений достоверно (р ≤ 0,05) увеличивалось у сортов Девятка и Даша соответственно на 22 и 28 % и становилось одинаковым. В определенной степени это могло быть следствием равной фотосинтетической активности семядольных листьев в указанный период онтогенеза, о чем свидетельствует содержание в них фотосинтетических пигментов (см. табл. 2). Известно, что хлоропласты — одно из основных мест биосинтеза фенольных соединений в клетках зеленых растений (33).
При выращивании на питательной среде у проростков обоих сортов гречихи суммарное содержание фенольных соединений в семядольных листьях в большинстве случаев было достоверно (р ≤ 0,05) ниже, чем в контроле (см. рис. 1, Б). При этом у сорта Девятка наименьшее значение показателя отмечали в 1-ю фазу, ко 2-й фазе оно повышалось на 32 % (р ≤ 0,05) и оставалось таким до 3-й фазы, как и в контрольном варианте. У сорта Даша в 1-ю фазу количество фенольных соединений также было самым низким и не отличалось от показателя у сорта Девятка. Ко 2-й фазе оно достоверно повышалось на 15 % (р ≤ 0,05), а к 3-й фазе уве- значения.
личивалось в 2 раза и достигало максимального
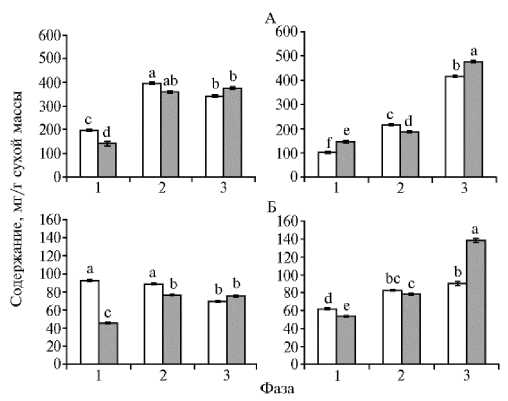
Рис. 2. Содержание фенилпропаноидов (А) и флавоноидов (Б) в семядольных листьях у проростков гречихи обыкновенной ( Fagopyrum esculentum Moench) сортов Девятка (белые столбики) и Даша (серые столбики) , выращенных на воде (слева) и питательной среде Хогланда-Арнона (справа) , в разные фазы онтогенеза. Достоверные различия средних значений при р ≤ 0,05 отмечены неодинаковыми латинскими буквами над барами.
Как уже отмечалось, фенольные соединения в растениях чрезвычайно разнообразны по структуре и представлены различными классами (7). К наиболее простым из них относятся фенилпропаноиды (6). В семядольных листьях у проростков гречихи, выращенных в контрольных условиях, в 1-ю фазу содержание фенил-пропаноидов было наименьшим, что в большей степени проявлялось у сорта Даша (рис. 2, А). Ко 2-й фазе оно достоверно (р ≤ 0,05) возрастало (у сортов Девятка и Даша соответственно на 50 и 60 %), а в дальнейшем (3-я фаза) уменьша- лось у сорта Девятка на 14 % (р ≤ 0,05) и не изменялось у сорта Даша. Результатом этого стало одинаковое содержание фенилпропаноидов в семядольных листьях у проростков обоих сортов гречихи в конце периода ис- следования.
При достаточном минеральном питании накопление фенилпро-паноидов в семядольных листьях в 1-ю фазу и особенно во 2-ю фазу оказалось ниже по сравнению с контролем, а в 3-ю фазу превышало его (см.
рис. 2, А). В 1-ю фазу этот показатель был самым низким, что в большей степени проявлялось у сорта Девятка. Ко 2-й фазе он достоверно (р ≤ 0,05) повышался (у сорта Девятка и Даша соответственно на 53 и 22 %). Наибольшие изменения в содержании фенилпропаноидов отмечали в 3-ю фазу, когда их значения резко возрастали (в среднем на 50 %, р ≤ 0,05) и становились достаточно близкими к таковым в контрольных вариантах.
Известно, что для гречихи характерно образование флавоноидов — наиболее распространенных представителей фенольных соединений в надземных органах растений (6, 16). При выращивании проростков на воде в 1-ю фазу онтогенеза содержание флавоноидов в семядольных листьях у сорта Девятка почти в 2 раза превышало значение у сорта Даша (см. рис. 2, Б). Во 2-ю фазу оно не изменялось, а в 3-ю фазу снижалось на 22 % (р ≤ 0,05). У сорта Даша наблюдалась иная тенденция: содержание флавоноидов повышалось ко 2-й фазе на 41 % (р ≤ 0,05) и в дальнейшем не изменялось.
При выращивании проростков гречихи на питательной среде содержание флавоноидов в семядольных листьях у обоих сортов отличалось от контрольных значений (см. рис. 2, Б). При этом у сорта Девятка оно повышалось на 25 % (р ≤ 0,05) в 1-ю и 2-ю фазы, а затем не изменялось, тогда как у сорта Даша увеличение наблюдалось в течение всего периода исследования (1-ю и 2-ю фазы — на 32 %, 3-я фаза — на 43 %; р ≤ 0,05).
Все вышеизложенное свидетельствует о том, что условия минерального питания оказывают значительное влияние на начальные этапы онтогенеза растений гречихи обыкновенной. При выращивании на питательной среде Хогланда-Арнона скорость роста надземных органов и накопление пигментов (хлорофиллов а и b, а также каротиноидов) в семядольных листьях было выше по сравнению с контролем, что в большей степени проявлялось в конце периода исследования (3-я фаза онтогенеза). В литературе имеются данные о положительном влиянии минерального питания на прирост биомассы растений и содержание различных форм хлорофилла в листьях растений (22, 34, 35). Что касается отношения хлорофиллы a/b, то этот показатель не зависел от условий минерального питания.
Сахара — промежуточный продукт фотосинтеза (28). Между их накоплением и содержанием хлорофиллов достаточно часто отмечалась положительная корреляция (28, 32). Однако в случае проростков двух сортов гречихи четко выраженной тенденции не наблюдалось. Суммарное содержание фенольных соединений в семядольных листьях в контроле было выше по сравнению с опытом. Следовательно, в условиях лучшей обеспеченности проростков гречихи минеральными элементами количество вторичных метаболитов фенольной природы в надземных органах снижалось, что может быть следствием их интенсивного роста. Об уменьшении накопления полифенолов при активация роста растений сообщалось в литературе (6, 9). В то же время содержание отдельных их классов (фенилпропаноидов и флавоноидов) в семядольных листьях у проростков сорта Даша, выращенных на питательной среде, как правило, повышалось, а у проростков сорта Девятка — снижалось, за исключением 3-й фазы роста, где прослеживалась противоположная тенденция. Изменения в биосинтезе определенных классов фенольных соединений в проростках гречихи обыкновенной при различных условиях минерального питания требуют дальнейших исследований.
Таким образом, начальные этапы онтогенетического развития проростков двух сортов гречихи обыкновенной определяются запасом пита-954
тельных веществ в семенах и наличием микро- и макроэлементов. Внесение последних ускоряет рост надземных органов (в среднем на 20-30 %), развитие семядольных листьев (на 25 % для сорта Девятка и на 42 % для сорта Даша) и повышает фотосинтетическую активность по сравнению с аналогичными показателями у проростков, при выращивании которых питательную среду заменяли на воду. Все это отражается на содержании пигментов, накоплении первичных (сахара) и вторичных (различные классы фенольных соединений) метаболитов. Следовательно, изменяя обеспеченность элементами минерального питания при выращивании растений, можно регулировать их рост и развитие, а также накопление метаболитов.
Список литературы Рост проростков гречихи обыкновенной (Fagopyrum esculentum Moench) и накопление первичных и вторичных метаболитов при различных условиях минерального питания
- Hopkins W.G., Hüner N.P.A. Introduction to plant physiology. 4rd Edition. John Wiley & Sons, Inc., NY, 2008.
- Bouman F., Boesewinkel F.D. The seed: structure and function. In: Seed development and germination /K. Jaime, G. Gad (eds.). CRC Press, 2017.
- Chauhan B.S., Johnson D.E. Influence of environmental factors on seed germination and seedling emergence of eclipta (Eclipta prostrata) in a tropical environment. Weed Science, 2008, 56(3): 383-388 ( ). DOI: 10.1614/WS-07-154.1
- Алиева З.М., Самедова Н.Х., Юсуфов А.Г. Реакция растений на стрессы на начальных этапах онтогенеза. Аридные экосистемы, 2013, 19(1): 54.
- Baxter A., Mittler R., Suzuki N. ROS as key players in plant stress signalling. Journal of Experimental Botany, 2013, 65(5): 1229-1240 ( ). DOI: 10.1093/jxb/ert375
- Запрометов М.Н. Фенольные соединения. Распространение, метаболизм и функции в растениях. М., 1993.
- Cheynier V., Comte G., Davies K.M., Lattanzio V., Martens S. Plant phenolics: recent advances on their biosynthesis, genetics, and ecophysiology. Plant Physiology and Biochemistry, 2013, 72: 1-20 ( ).
- DOI: 10.1016/j.plaphy.2013.05.009
- Nannipieri P., Badalucco L. Biological processes. In: Handbook of processes and modelling in the soil-plant system /D.K. Benbi, R. Nieder (eds.). Haworth, Binghamton, 2003.
- Волынец А.П. Фенольные соединения в жизнедеятельности растений. Минск, 2013.
- Казанцева В.В., Гончарук Е.А., Фесенко А.Н., Широкова А.В., Загоскина Н.В. Особенности образования фенольных соединений в проростках гречихи (Fagopyrum esculentum Moench) различных сортов. Сельскохозяйственная биология, 2015, 50(5): 611-619 ( ).
- DOI: 10.15389/agrobiology.2015.5.611rus
- Mierziak J., Kostyn K., Kulma A. Flavonoids as important molecules of plant interactions with the environment. molecules, 2014, 19(10): 16240-16265 ( ).
- DOI: 10.3390/molecules191016240
- Kumar V., Suman U., Rubal, Yadav S.K. Flavonoid secondary metabolite: biosynthesis and role in growth and development in plants. In: Recent trends and techniques in plant metabolic engineering /S. Yadav, V. Kumar, S. Singh (eds.). Springer, Singapore, 2018: 19-45 ( ).
- DOI: 10.1007/978-981-13-2251-8_2
- Kreft M. Buckwheat phenolic metabolites in health and disease. Nutrition Research Reviews, 2016, 29(1): 30-39 ( ).
- DOI: 10.1017/s0954422415000190
- Suzuki T., Morishita T., Kim S.J., Park S.U., Woo S.H., Noda T., Takigawa S. Physiological roles of rutin in the buckwheat plant. Japan Agricultural Research Quarterly: JARQ, 2015, 49(1): 37-43 ( ).
- DOI: 10.6090/jarq.49.37
- Высочина Г.И. Фенольные соединения в систематике и филогении семейства гречишных. Новосибирск, 2004.
- Campbell C.G. Buckwheat: Fagopyrum esculentum Moench. Research Ltd., Morden, Mantitoba, 1997.
- Koyama M., Nakamura C., Nakamura K. Changes in phenols contents from buckwheat sprouts during growth stage. Journal of Food Science and Technology, 2013, 50(1): 86-93 ( ).
- DOI: 10.1007/s13197-011-0316-1
- Nam T.G., Lee S.M., Park J.H., Kim D.O., Baek N.I., Eom S.H. Flavonoid analysis of buckwheat sprouts. Food Chemistry, 2015, 170: 97-101 ( ).
- DOI: 10.1016/j.foodchem.2014.08.067
- Сорт Девятка®. Режим доступа: https://vniizbk.ru/ru/2017-01-23-11-23-52.html. Дата об-ращения: 21.10.2019.
- Сорт Даша®. Режим доступа: https://vniizbk.ru/newvarieties.html#dasha. Дата обращения 21.10.2019.
- Hoagland D.R., Arnon D.I. The water-culture method for growing plants without soil. In: Circular. California agricultural experiment station. University of California, Davis Libraries, 1950.
- Шлык А.А. Определение хлорофиллов и каротиноидов в экстрактах зеленых листьев. В сб.: Биохимические методы в физиологии растений. М., 1971: 154-170.
- Olenichenko N.A., Zagoskina N.V., Astakhova N.V., Trunova T.I., Kuznetsov Y.V. Primary and secondary metabolism of winter wheat under cold hardening and treatment with antioxidants. Applied Biochemistry and Microbiology, 2008, 44(5): 589-594 ( ).
- DOI: 10.1134/S0003683808050141
- DuBois M., Gilles K.A., Hamilton J.K., Rebers P.T., Smith F. Colorimetric method for determination of sugars and related substances. Analytical Chemistry, 1956, 28(3): 350-356 ( ).
- DOI: 10.1021/ac60111a017
- Мартыненко Г.Е., Фесенко Н.В., Фесенко А.Н., Гуринович И.А. Создание холодостойкого детерминантного сорта гречихи Девятка. Вестник аграрной науки, 2010, 25(4): 85-87.
- Фесенко А.Н., Амелин А.В., Фесенко И.Н., Бирюкова О.В., Заикин В.В. Новый сорт гречихи Даша. Земледелие, 2018, 4: 36-38 ( ).
- DOI: 10.24411/0044-3913-2018-10411
- Мокроносов А.Т., Гавриленко В.Ф., Жигалова Т.В. Фотосинтез. Физиолого-экологические и биохимические аспекты. М., 2006.
- Андрианова Ю.Е., Тарчевский И.А. Хлорофилл и продуктивность растений. М., 2000.
- Nisar N., Li L., Lu S., Khin N.C., Pogson B.J. Carotenoid metabolism in plants. Molecular Plant, 2015, 8(1): 68-82 ( ).
- DOI: 10.1016/j.molp.2014.12.007
- Sun T., Yuan H., Cao H., Yazdani M., Tadmor Y., Li L. Carotenoid metabolism in plants: the role of plastids. Molecular Plant, 2018, 11(1): 58-74 ( ).
- DOI: 10.1016/j.molp.2017.09.010
- Stange C. Carotenoids in nature: biosynthesis, regulation and function. Springer International Publishing, Switzerland, 2016 ( ).
- DOI: 10.1007/978-3-319-39126-7
- Eveland A.L., Jackson D.P. Sugars, signaling and plant development. Journal of Experimental Botany, 2011, 63(9): 3367-3377 ( ).
- DOI: 10.1093/jxb/err379
- Zaprometov M.N., Nikolaeva T.N. Chloroplasts isolated from kidney bean leaves are capable of phenolic compound biosynthesis. Russian Journal of Plant Physiology, 2003, 50(5): 623-626 (doi: 10.1023/A:1025683922953).
- Нагорный В.Д., Арималала Р.Н. Влияние серы на содержание пигментов в листьях и накопление сухого вещества растениями картофеля в условиях вегетационного опыта. Вестник Российского университета дружбы народов. Серия: Агрономия и животноводство, 2016, 3: 7-14.
- Sharafzadeh S., Khosh-Khui M., Javidnia K. Effect of nutrients on essential oil components, pigments and total phenolic content of lemon balm (Melissa officinalis L.). Advances in Environmental Biology, 2011, 5(4): 639-647.


