Рост растений и функциональное разнообразие микробиоты почвы при выращивании технической конопли Cannabis sativa L. в модельном опыте в условиях повышенной температуры
Автор: Камалова А.Р., Данилова Н.В., Курынцева П.А., Галицкая П.Ю., Селивановская С.Ю.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Технические культуры и секвестрация
Статья в выпуске: 1 т.60, 2025 года.
Бесплатный доступ
Глобальное изменение климата Земли и вызванные им экологические, экономические и социальные риски связывают с накоплением в атмосфере парниковых газов, особенно СО2. В качестве эффективного способа снижения (секвестрации) содержания СО2 в воздухе рассматривается использование растений-суперпоглотителей СО2, из которых в последнее время наибольшее внимание привлекает техническая конопля Cannabis sativa L. Для этой культуры характерен быстрый рост, устойчивость к факторам окружающей среды, низкие затраты при культивировании и многоцелевое использование получаемой биомассы в качестве сырья для различных отраслей промышленности. В России в настоящее время отсутствуют программы и регламенты применения технической конопли для секвестрации СО2 атмосферы. При разработке таких программ следует учитывать способность растений изменять состав и функциональную активность почвенной микробиоты, что, в свою очередь, может повлиять на скорость роста растений, показатели почвенного плодородия, эмиссию СО2 почвенным покровом. Кроме того, важно определить, сохранится ли высокая эффективность секвестрации СО2 в экосистеме растения-почва-микроорганизмы в условиях глобального повышения температур и как при этом изменится состояние почвы и ее микробной компоненты. Для этих целей в модельном опыте в условиях вегетационного домика мы оценили воздействие температур (15 °С - характерна для вегетационного сезона в средней полосе России, тогда как 20 °С и 30 °С - повышенные температуры) на рост технической конопли и содержание хлорофилла, накопление углерода в почве под растениями, биоразнообразие и функциональную активность почвенной микробиоты, в частности на способность микроорганизмов разлагать углеродсодержащие субстраты, оцененное с помощью системы Biolog EcoPlates™. Все измерения, кроме количества углерода в почве, морфометрических характеристик растений конопли и содержания хлорофилла, выполняли в динамике - на 7-е, 28-е, 56-е и 98-е сут (в среднем продолжительность сезона вегетации в средней полосе России). Содержание углерода в почве под растениями определяли в 1-е и на 98-е сут, хлорофилла - на 28-е, 56-е и 98-е сут, морфометрические измерения выполняли на 98-е сут (окончание эксперимента). Исследования проводили с 14 марта по 19 июня в оранжерее ФГАОУ ВО К(II)ФУ (г. Казань) в 2023 году. Результаты исследования показали, что техническая конопля демонстрирует максимальный рост как надземной, так и подземной частей при температуре 30 °С, где высота растений составила 64,57 см, а корней - 25,27 см. В сравнении с температурой 20 °С, где наблюдались минимальные показатели (36,70 см и 14,36 см соответственно), рост при 30 °С оказался на 76 % выше (p 0,05). Установлено, что при одной и той же температуре образцы с почвой без конопли и с коноплей достоверно не различались по почвенной микробной биомассе: при 15 °С анализируемый показатель составил соответственно 0,92-0,64 и 0,96-0,62 мг/кг, при 20 °С - 1,92-0,84 и 1,74-1,03 мг/кг, при 30 °С - 3,58-2,06 и 3,08-2,24 мг/кг (p > 0,05). Повышение температуры приводит к увеличению микробной биомассы как при отсутствии, так и при наличии растений (3,58 и 3,08 мг/кг на 7-е сут, соответственно, р 0,05). Однако на 7-е сут повышение активности микроорганизмов отмечено в образцах с растениями, особенно при температуре 20 °С и 30 °С (1,23; 0,89; p общ. и Сорг. в почве изменялось в пределах ошибки и не зависело от присутствия растений или температуры (p > 0,05). Таким образом, показано, что у конопли при повышении температуры в период вегетации увеличивается длина надземных и подземных частей растения, что приводит к повышению эффективности секвестрации углерода атмосферы. При этом в почве изменяется количество микробной биомассы, а метаболическая активность микроорганизмов повышается уже на 7-е сут эксперимента. Представленная модельная система может использоваться для оценки эффективности секвестрации и состояния функциональных групп почвенного микробного сообщества при разработке программ выращивания технической конопли C. sativa в качестве растения-суперпоглотителя, в том числе при повышенных температурах, когда важно сохранить разнообразие почвенного микробиоты.
Секвестрация, растения-суперпоглотители, микробная биомасса, техническая конопля, углеродные субстраты, функциональная активность микроорганизмов
Короткий адрес: https://sciup.org/142244133
IDR: 142244133 | УДК: 633.522:581.1:631.46 | DOI: 10.15389/agrobiology.2025.1.110rus
Текст научной статьи Рост растений и функциональное разнообразие микробиоты почвы при выращивании технической конопли Cannabis sativa L. в модельном опыте в условиях повышенной температуры
Экологические, экономические и социальные риски происходящего глобального потепления климата Земли остаются цивилизационной угрозой для человечества и требуют принятия мер по смягчению последствий таких изменений (1).
Глобальное потепление связывают с воздействием антропогенных факторов, в частности с накоплением в атмосфере парниковых газов, особенно СО 2 (2, 3). Естественная трансформация СО 2 воздуха в углерод органического вещества почвы (секвестрация СО 2 ) осуществляется с участием растений, использующих углекислый газ в процессе фотосинтеза, и микроорганизмов. На этом основаны разрабатываемые технологии высадки растений — суперпоглотителей СО 2 для предотвращения климатических изменений, связанных с выбросами углекислого газа в атмосферу. В качестве наиболее эффективных поглотителей СО 2 рассматриваются бамбук (4), мискантус (5), просо прутковидное (6). Но наибольший интерес в последнее время привлекает техническая конопля Cannabis sativa L. (7, 8), что обусловлено биологическими особенностям этого растения (быстрый рост, устойчивость к условиям окружающей среды (7, 9), низкими затратами при выращивании (10) и широкими возможностями применения этой промышленной культуры (11) — от эффективной секвестрации СО 2 (12) и биоремедиации почв (8-13) до разработки новых строительных материалов (14), получения биотоплива (9, 10), использования в бумажной, текстильной промышленности, при производстве фармацевтических препаратов и функциональных продуктов питания (10, 15-18). Техническая конопля — один из лучших преобразователей CO 2 в биомассу растений (надземную и корневую), посевы этой культуры поглощают от 10 до 22 т CO 2 на гектар за сезон вегетации 160 сут (12-19). Для сравнения леса в среднем улавливают от 0,93 до 10 т CO 2 на гектар в год в зависимости от вида, возраста деревьев и климата региона (20).
При разработке технологии выращивания агрокультур важно учитывать взаимное влияние элементов системы растения—почва—микроорга-низмы и то, как оно изменяется в зависимости от внешних условий (21-23). Взаимодействия между растениями и микробным сообществом ризосферы, с одной стороны, влияют на рост, развитие и здоровье растений (24-26), с другой — могут модулировать численный состав и биоразнообразие почвенной микробиоты (27), эмиссию СО2 почвенным покровом (28), накопление углерода в почве (29, 30). При этом почвенные микроорганизмы чувствительны к составу органических субстратов (31-33), включая корневые экссудаты. Характерный для вида растения состав корневых экссудатов, которые служат для микроорганизмов источником органических кислот (лимонная, яблочная, янтарная, щавелевая, пировиноградная), углеводов (глюкоза, ксилоза, фруктоза, мальтоза, сахароза, рибоза), аминокислот, жирных кислот, белков, ферментов, витаминов (34, 35), способен изменять профили метаболической активности и структуру ризосферной микробиоты (36, 37).
Температура — один из факторов, влияющий как на рост растения, так и на формирование почвенной микробиоты (37, 38). Поскольку эффективная секвестрация обеспечивается только при значительном накоплении растительной биомассы культурой-суперпоглотителем СО 2 , важно определить, сохранит ли эта культура такую способность при повышении температуры в условиях глобального потепления и как при этом изменится состояние почвы и микробной компоненты экосистемы.
В России в настоящее время отсутствуют программы и регламенты использования технической конопли для секвестрации СО 2 атмосферы. Нами впервые изучено влияние повышенных температур на рост растений, содержание хлорофилла в листьях, накопление углерода, биоразнообразие и функциональную активность микробиоты в почве под технической коноплей в модельном вегетационном опыте.
Целью работы было создание модельной системы для оценки в условиях вегетационного домика влияния температуры, характерной для средней полосы России (15 ° С за сезон вегетации), и повышенных температур на развитие технической конопли, функциональные характеристики микробных сообществ почвы под растениями и накопление углерода почвы.
Методика. Для вегетационного эксперимента в теплице использовали серую лесную почву, отобранную с участка у с. Нармонка Лаишевского района (55.502299 ° N, 49.297227 ° E, Республика Татарстан). Ранее на этой почве конопля не произрастала. Семена технической конопли ( C. sativa ) сорта Надежда (элита, ГОСТ Р 52325-2005, урожай 2023 года), предоставленные ФГБНУ Федеральный научный центр лубяных культур, проращивали на вермикулите до стадии ростков (7 сут), по три ростка высаживали в ящики с 40 кг почвы (объем почвы, который требуется для обеспечения роста корневой системы технической конопли в течение полного цикла вегетации, определяли предварительно). Дизайн эксперимента включал контроль (почва без растений) и опыт (почва с растениями), для образцов во всех вариантах период наблюдений составил 98 сут, что примерно соответствует средней продолжительности сезона вегетации технической конопли. Использовали три температурных режима — 15 ° С, 20 ° С и 30 ° С, по три повторности для каждого режима в каждом варианте (П15, П20, П30 — опыт, почва с растениями; К15, К20, К30 — контроль, почва без растений).
Содержание общего (С общ. ) и органического (С орг. ) углерода измеряли на термоградиентном анализаторе углерода LECO RC 612 («LECO Instruments», США) согласно ISO 10694:1995 (39).
На 98-е сут определяли морфометрические показатели растений (длина корня, длина стебля), на 28-е, 56-е и 98-е сут — содержание хлорофилла в эпидерме листьев с использованием портативного флавоноид- и хлорофиллометра Dualex Scientific™ («FORCE-A», Франция). До начала измерений у каждого из трех исследуемых растений были помечены маркером три верхних листа, затем прибор располагали таким образом, чтобы эмиттер и сенсор контактировали с участком листа без центральной и крупных 112
боковых жилок. Результаты измерений содержания хлорофилла (мкг/см2) получали в режиме реального времени (0,5 с).
Почвенные образцы (по 50 г) отбирали на 1-е, 7-е, 14-е, 28-е, 42-е, 56-е, 70-е, 84-е и 98-е сут согласно рекомендациям (40). Микробную биомассу определяли на 7-е, 28-е и 98-е сут вегетационного опыта согласно ISO 14240-1:1997 (Part 1) с использованием газового хроматографа Nexis GC-2030 («Shimadzu», Япония) и программного обеспечения Lab Solution («Shimadzu», Япония) (41). Навеску почвы массой 1 г и 10 мг D-глюкозы в качестве легкодоступного субстрата помещали в хроматографическую виалу и инкубировали в течение 24 ч при температуре 20 ° С. Увеличение концентрации СО 2 (ppm) детектировали на капиллярной колонке Rt-Q-BOND 30 m с диаметром 0,53 мм и толщиной слоя фазы (100 % дивинилбензола) 20 мкм («Restek», США). Скорость потока гелия высокой чистоты (марка 6.0, 99.9999 %) — 10 мл/мин, объем пробы — 10 мкл, общее время измерения — 5 мин на образец.
Метаболическую активность почвенного микробного сообщества оценивали на 7-е, 28-е и 98-е сут с помощью системы Biolog EcoPlates™ с набором углеродосодержащих субстратов («Biolog, Inc.», США) по методике производителя. Из каждого контейнера отбирали 5 г почвы и готовили почвенные суспензии в соотношении 1:10 в стерильной водопроводной воде и встряхивали 30 мин при 160 об/мин. Разводили суспензии в соотношении 1:30 стерильной водой, тщательно взбалтывая перед использованием. Переносили 140 мкл разведенной суспензии в каждую лунку 96-луночного планшета Biolog Ecoplate. Закрывали планшет и инкубировали в термостате при 25 ° С в течение 120 ч. Оптическую плотность измеряли на планшетном фотометре Multiskan FC («Thermo Scientific», США) при X = 590 нм каждые 24 ч в течение 5 сут. В качестве показателя метаболической активности использовали значение индекса средней окрашенности ячеек AWCD (average well-color development), который рассчитывали по формуле
AWCD = £ (C i - R)/31, где C i — величина поглощения образца в лунке при X = 590 нм, R — поглощение в контроле. В случаях, когда C i - R < 0, AWCD считался равным нулю.
Также оценивали степень потребления отдельных групп субстратов SWCD (substrate well color development): полимеры — Tween 40, Tween 80, а -циклодекстрин, гликоген; карбоновые кислоты — у -гидроксимасляная кислота, а -кетомасляная кислота, D-галактуроновая кислота, D-глюкозаминовая кислота, итаконовая кислота, D-яблочная кислота, метиловый эфир пировиноградной кислоты; амины — фенилэтиламин, путресцин; фенолы — 2-гидроксибензойная кислота, 4-гидроксибензойная кислота; углеводы — D-целлобиоза, эритритол, D-галактоновая кислота, у -лактон, N-ацетил-D-глю-козамин, глюкоза-1-фосфат, в -метил-D-глюкозид, D,L- а -глицеролфосфат, а -D-лактоза, D-маннитол, D-ксилоза; аминокислоты — L-аргинин, L-аспарагин, глицил-L-глутаминовая кислота, L-фенилаланин, L-серин, L-треонин.
На основании данных AWCD рассчитывали индекс видового разнообразия Шеннона (альфа-разнообразие, Н), характеризующий разнообразие и выравненность в структуре сообщества (42, 43) согласно формуле
H = ∑ P i ½ lnP i , где P i = (C i - R)/ £ (C i - R), представляющий отношение разницы оптической плотности (ОП) для образца в лунке к общей разнице ОП по всему планшету (44, 45).
Кроме того, используя данные SWCD для почвенной микробиоты, сравнивали бета-разнообразие, позволяющее выявить сходство или различие видового состава. Анализ степени сходства микробных сообществ почв осуществляли на основе расчета индекса сходства Брэя-Кертиса. По полученной матрице сходства проводили ординацию образцов методом неметрического многомерного шкалирования (NMDS, non-metric multidimensional scaling) для выявления общих тенденций в распределении сообществ (46, 47).
Все измерения выполняли не менее чем в 3-кратной повторности. Для статистической обработки применяли программное обеспечение Microsoft Office Excel 2021. Все графические данные представлены в виде средних значений ( М) и их стандартной ошибки (±SEM). Достоверность различий между средними оценивали с помощью LSD-теста (тест Фишера) при p < 0,05.
Результаты. На 98-е сут вегетационного опыта мы определили длину корня и высоту растений технической конопли (рис. 1).
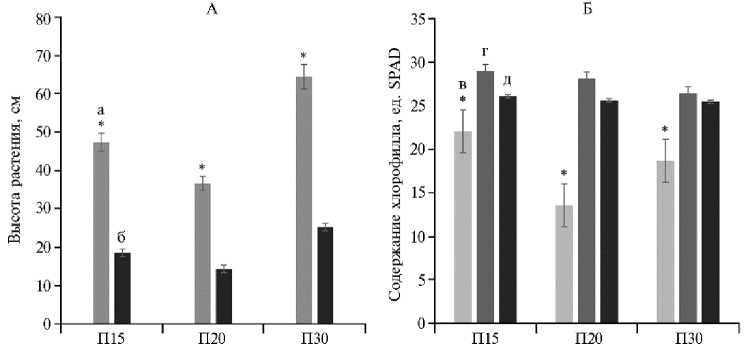
Рис. 1. Высота растений (а), длина корней (б) на 98-е сут (А, n = 9) и общее содержание хлорофилла в листьях на 28-е (в) , 56-е (г) и 98-е сут (д) (Б, n = 27) у технической конопли Cannabis sativa L. сорта Надежда в вегетационном опыте в зависимости от температуры инкубации (15 ° С, 20 ° С или 30 ° С, соответственно варианты П15, П20, П30) ( M ±SEM; вегетационный опыт в оранжерее, г. Казань, 2023 год).
* Различия растений по высоте (А) и содержанию хлорофилла в листьях (Б) в зависимости от температуры статистически значимы при p < 0,05.
Максимальным ростом стеблей и корней характеризовались растения, выращенные при 30 ° С (П30) (соответственно 64,57 и 25,27 см), минимальным — растения при 20 ° С (36,70 и 14,36 см) (см. рис. 1, А). Длина надземной и подземной частей растений в условиях повышенной температуры (30 ° С) была на 76 % больше (для обоих показателей), чем при 20 ° С (p < 0,05), и на 36 % больше (для обоих показателей), чем при пониженной температуре (15 ° С). При оценке длины надземной части растений при разных температурных режимах установлены достоверные различия (p < 0,05). Действительно, в работе Д.Р. Исламгулова с соавт. (48) отмечается тепло-любивость конопли, которая требует для полноценного роста и развития умеренно теплого климата (оптимальная температура 30-35 ° С).
Накопление хлорофилла растениями в значительной степени связано с их развитием и продуктивностью (49). Мы определили содержание хлорофилла в листьях технической конопли на 28-е, 56-е и 98-е сут (см. рис. 1, Б). Достоверные различия в содержании хлорофилла в листьях (р < 0,05) были выявлены только на 28-е сут для всех температур. Максимальные значения на 56-е сут при всех температурных режимах, вероятно, обусловлены совпадением с фазой интенсивного роста и развития растения. Однако к концу эксперимента содержание хлорофилла во всех вариантах снизилось и при разных температурах достоверно не различалось (р > 0,05).
Анализ содержания общего (С общ. ) и органического (С орг. ) углерода в контрольной почве на 1-е сут показал, что показатели были стабильными и составили соответственно 3,82 и 3,03 % для К15, 3,98 и 3,26 % для К20 и 3,76 и 3,06 % для К30. На 98-е сут изменений в количестве общего и органического углерода в контрольной почве отмечено не было, как и влияния разных температурных режимов (соответственно 3,74 и 3,11 % для К15, 3,82 и 3,10 % для К20 и 3,93 и 3,13 % К30). В почве под технической коноплей на 1-е сут содержание С общ. и С орг. составило 3,55 и 2,96 % для П15, 3,63 и 2,89 % для П20 и 3,73 и 2,97 % для П30. На 98-е сут содержание С общ. и С орг. было равно 3,65 и 2,86 % для П15, 3,73 и 2,99 % для П20 и 3,83 и 3,02 % для П30. Эти значения в использованной модельной системе изменялись в пределах ошибки и достоверно не различались в почве под растениями или при воздействии разных температур (р > 0,05).
Углерод микробной биомассы (С мик. ) формируется за счет почвенных микроорганизмов, активно участвующих в процессах разложения и синтеза органических соединений, и представляет собой чувствительную к внешним воздействиям форму (50). С мик. служит ключевым показателем качества и здоровья почвы, используется для оценки динамики почвенного углерода, при изучении процессов секвестрации углерода в почве по отдельным пулам (51). Микробная биомасса тесно связана с рН, количеством и составом органического вещества почвы, ее структурой, влажностью, температурным режимом (52-54). Растения и их экссудаты стимулируют активность почвенных микроорганизмов (55, 56). В нашем опыте количественные различия микробной биомассы при одной и той же температуре инкубации образцов в контроле (почва без растений) и в опыте (почва под растениями технической конопли) не были статистически значимыми (p > 0,05) (рис. 2).
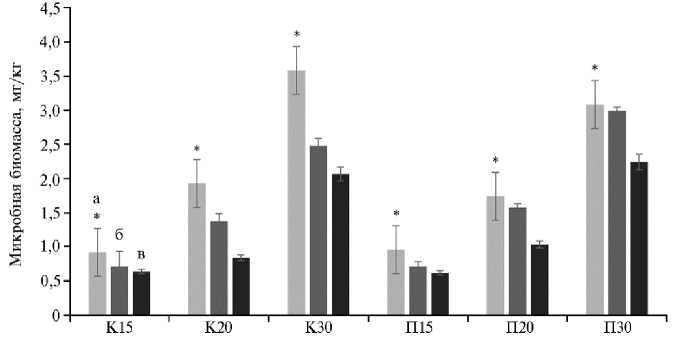
Рис. 2. Микробная биомасса почвы на 7-е сут (а) , 28-е сут (б) и 98-е сут (в) в зависимости от температуры инкубации образцов в вегетационном опыте : варианты П15, П20, П30 — почва под растениями технической конопли Cannabis sativa L. сорта Надежда соответственно при 15 ° С, 20 ° С и 30 ° С, варианты К15, К20, К30 — без растений (контроль) ( n = 27, M ±SEM; вегетационный опыт в оранжерее, г. Казань, 2023 год).
* Различия между микробной биомассой в зависимости от температурного режима статистически значимы при p < 0,05.
Повышение температуры (до 30 °С) приводило к увеличению микробной биомассы как в опыте, так и в контроле. При этом показатели в начале выращивания (7-е сут) и в опыте, и в контроле были выше, чем в остальные сроки (28-е и 98-е сут) (см. рис. 2) (p < 0,05). Так, на 7-е сут микробная биомасса в контрольных вариантах (К15, К20, К30) увеличивалась в среднем соответственно на 36, 85 и 59 %, тогда как в почве под растениями технической конопли этот показатель в те же сроки был выше в среднем на 45 % (П15), 39 % (П20) и 20 % (П30). В литературе часто приводятся сведения об увеличении микробной биомассы при культивировании почвы с растениями в сравнении с почвой без растений (57-60), в то же время есть публикации, в которых сообщается об отсутствии такого увеличения или лишь кратковременных изменениях (61, 62). Следует, однако, отметить, что при том же количестве микробной биомассы дыхательная активность микроорганизмов значительно возрастала в вариантах с растениями в сравнении с контрольными (без растений) (см. рис. в дополнительных материалах на сайте . Таким образом, в нашем случае растительные экссудаты стимулировали не увеличение биомассы почвенных микроорганизмов, а их активность.
Функциональная активность микроорганизмов может быть описана разными способами. Один из них — оценка способности микроорганизмов потреблять различные субстраты. Метод, основанный на использовании технологии Biolog EcoPlates™, позволяет выявить множество метаболических активностей микроорганизмов (63, 64). Мы применили Biolog EcoPlates™, чтобы проанализировать способность микробных сообществ аэробно разлагать 31 углеродсодержащий субстрат (65). В качестве функциональных характеристик микробного сообщества использовали усредненный показатель общей активности микроорганизмов, установленный на основании показателей AWCD, потребление отдельных видов субстратов, оцененное по окрашиванию определенных ячеек Biolog EcoPlates™, индексы альфа-разнообразия микробных сообществ (индекс Шеннона) и бета-разнообразия микробных сообществ, рассчитанного методом NMDS.
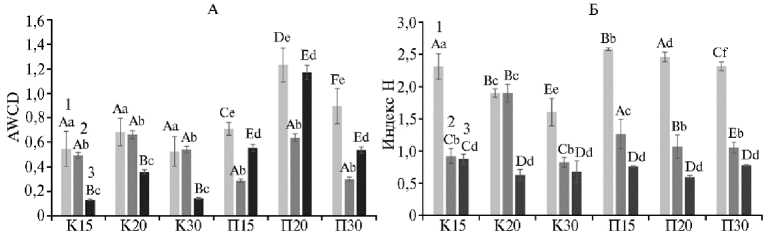
Рис. 3. Изменение потребления углеродсодержащих субстратов (AWCD, average well-color development; метод Biolog EcoPlates™) (А) и индекса функционального альфа-разнообразия Шеннона Н (Б) на 7-е сут (1) , 28-е сут (2) и 98-е сут (3) в зависимости от температуры инкубации образцов в вегетационном опыте : варианты П15, П20, П30 — почва под растениями технической конопли Cannabis sativa L. сорта Надежда соответственно при 15 ° С, 20 ° С и 30 ° С, варианты К15, К20, К30 — без растений (контроль) ( n = 27, M ±SEM; вегетационный опыт в оранжерее, г. Казань, 2023 год).
Разными строчными буквами обозначены статистически значимые различия между вариантами контроля и почвы с растениями при одной и той же температуре инкубации при р < 0,05. Разными прописными буквами обозначены статистически значимые различия между показателями в вариантах контроля и почвы с растениями при разной температуре инкубации при р < 0,05.
На 7-е сут значения АWCD во всех вариантах почвы с растениями различались статистически значимо (p < 0,05) (рис. 3, А). Увеличение активности микроорганизмов на 7-е сут в вариантах П20 и П30, вероятно, связано со стимулирующим действием одновременно двух факторов — состава и количества секретируемых корневых экссудатов и повышения тем- пературы, ускоряющего биохимические процессы (66, 67). Наблюдаемое на 28-е сут снижение метаболической активности в вариантах почвы без растений при 15 °С и 20 °С (на 98-е сут — снижение во всех вариантах без растения), а также в образцах с технической коноплей, вероятно, связано с фазой роста растений и характерными для микробиологических процессов синусоидными колебаниями, которые под воздействием растений и температуры происходили в вариантах несинхронно (p > 0,05) (68, 69).
Результаты оценки альфа-разнообразия микробных сообществ проб почв (см. рис. 3, Б) показали, что из всех вариантов наибольшим разнообразием выделялись сообщества на 7-е сут (p < 0,05). Возможно, рыхление и полив в начале эксперимента привели к активизации микроорганизмов (70). Несколько более высокое разнообразие в вариантах под растениями можно объяснить наличием микроорганизмов, привносимых растениями в почву из семени при прорастании (71). Наблюдаемое на 28-е сут (за исключением варианта К20, p > 0,05) и 98-е сут снижение микробного разнообразия, вероятно, связано со стабилизацией сообщества в результате его адаптации к условиям окружающей среды и возврату многих видов в неактивное состояние, хотя эти значения достоверно не различались (p > 0,05) (72, 73).
Анализ показателя SWCD позволил выявить субстраты, которым отдают предпочтение одни сообщества микроорганизмов, тогда как другие их не потребляют (см. рис. в дополнительных материалах на сайте . Так, показатель в контрольных вариантах (на 7-е, 28-е и 98-е сут) варьировался от 0,19 до 2,88 для К15, от 0,29 до 3,53 для К20, от 0,23 до 2,98 для К30; в вариантах с технической коноплей от 0,17 до 2,32 для П15, от 0,18 до 3,33 для П20 и от 0,16 до 2,28 для П30. При этом максимальные значения потребления субстрата (3,53) относились к D-ксилозе и были отмечены в варианта К20 (98-е сут), а минимальные (0,16) — к фенилэтил-амину в образце П30 (98-е сут) (p < 0,05).
Установлено, что в контрольном варианте почвы при пониженной температуре (К15) микроорганизмы на протяжении всего эксперимента в основном потребляли D-ксилозу (максимум потребления на 28-е и 98-е сут), D-маннитол, L-аспарагин и L-аргинин. При этом тенденция потребления D-ксилозы оставалась постоянной и усиливалась с течением времени. Вероятно, эти субстраты были более предпочтительны в качестве источников углерода для микробных сообществ. В меньшем количестве потреблялась 2-гидроксибензойная кислота, β -метил-D-глюкозид и α -кетомалонат. Для микробного сообщества в варианте К30 более предпочтительным субстратом также оказалась D-ксилоза (максимум потребления на 28-е и 98-е сут), а на 7-е сут — γ -гидроксимасляная кислота. Относительно низкими уровнями потребления характеризовались α -кетомасляная кислота, итаконовая кислота, метиловый эфир пировиноградной кислоты, фенилэтиламин, путресцин и 2-гидроксибензойная кислота.
В варианте П15 отмечалась высокая скорость потребления D-ксилозы с максимумом на 98-е сут. Метиловый эфир пировиноградной кислоты в значительно большем количестве использовался на 28-е и 98-е сут, что, вероятно, связано с активной фазой роста растения. Кроме того, имело место заметное потребление L-аспарагина и N-ацетил-D-глюкозамина в течение всего эксперимента, тогда как утилизация D-целлюлозы и α -кетомалоната, наоборот, оказалась минимальной. Такое различие в потреблении субстратов на 7-е сут и на 28-е и 98-е сут указывает на то, что некоторые их них стали более востребованы микроорганизмами в течение эксперимента.
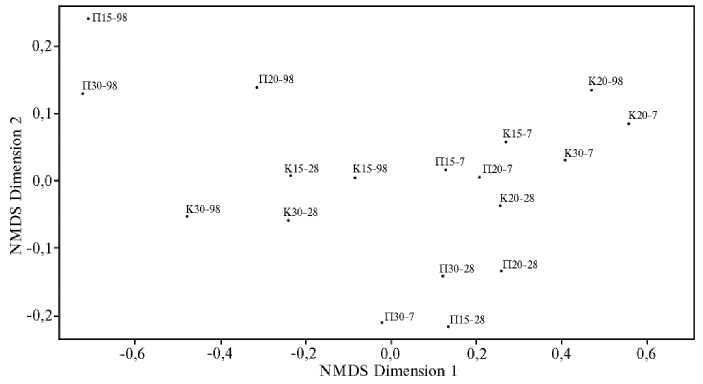
Рис. 4. Сходство и различие микробных сообществ по функциональным свойствам в зависимости от температуры инкубации образцов на 7-е, 28-е и 98-е сут вегетационного опыта : варианты П15, П20, П30 — почва под растениями технической конопли Cannabis sativa L. сорта Надежда соответственно при 15 ° С, 20 ° С и 30 ° С, варианты К15, К20, К30 — без растений (контроль) ( n = 27, M ±SEM; вегетационный опыт в оранжерее, г. Казань, 2023 год). Анализ показателей SWCD выполнен методом неметрического многомерного шкалирования (NMDS, nonmetric multidimensional scaling).
На заключительных этапах мы оценили, насколько сообщества микроорганизмов различались по вариантам в течение опыта, используя для этого метод NMDS (рис. 4). Точки в системе координат соответствуют сообществам микроорганизмов в разных образцах в определенные сроки эксперимента (если точки расположены близко друг к другу, сообщества имеют значительное сходство, если далеко друг от друга — сходство между такими сообществами невелико). Видно, что почвенные образцы, инкубированные при всех трех температурах и отобранные под растениями в конце эксперимента (П15-98, П20-98 и П30-98), образуют отдельную группу. Возможно, большее единообразие микробных сообществ в этом случае связано с длительным влиянием растений (вероятно, через экссудаты) на функциональные характеристики микробиоты почвы, тогда как неодинаковая температура не привела к различиям между сообществами. Точки, характеризующие сообщества на 7-е сут эксперимента (как в контроле, так и в почве с растениями), можно объединить в еще одну группу, но они расположены менее кучно. Сходства между всеми сообществами под растениями и контрольными вариантами (на 7-е и 28-е сут) обусловлены тем, что в эксперименте использована одна и та же почва, обладающая одним и тем же исходным микробным пулом и обработанная одинаковым образом. Таким образом, различий между почвами (в совокупности), отобранными на 7-е и 28-е сут при различных температурах инкубации, выявлено не было. Однако исключением стали образцы с растениями, отобранные на 98-е сут, что, вероятно, связано с накопительным эффектом при длительном выращивании растений, но не с температурой инкубации.
Полученные нами в этом пилотном исследовании результаты, рассматриваемые как предварительные, в целом подтвердили пригодность предложенной модельной системы для оценки параметров (рост растений, накопление и функциональная активность микробной биомассы в почве, содержание углерода в почве), значимых для разработки программ выращивания конопли как эффективного секвестратора СО2. Также предложенная модельная система может быть полезна для получения новых данных о зако- номерностях взаимного влияния растений, почвы и микроорганизмов в агро- и экосистемах. Эти исследования будут продолжены как на больших выборках, так и в полевых экспериментах с целью оценки воздействия других абиотических и биотических факторов на эффективность улавливания углекислого газа атмосферы фитомассой технической конопли — растения-суперпоглотителя СО2.
Итак, в условиях модельного опыта мы показали, что на рост надземной и подземной части растений технической конопли за 98 сут более выраженное влияние оказала повышенная температура (30 ° С, соответственно 64,57 и 25,27 см, p < 0,05). Минимальные значения зафиксированы для образцов при 20 ° С (соответственно 36,70 и 14,36 см, p < 0,05). При оценке содержания хлорофилла в листьях растений на 28-е, 56-е и 98-е сут достоверные различия были выявлены только на 28-е сут для всех температур (15 ° С, 20 ° С, 30 ° С). Максимальные значения (29 ед. SPAD) были установлены на 56-е сут при всех температурных режимах (p > 0,05). Выращивание технической конопли на почвах, где ранее эту культуру не возделывали, не привело к изменению микробной биомассы (p > 0,05), но с повышением температуры воздуха биомасса микроорганизмов увеличивалась. В контрольных и в опытных вариантах на 7-е сут значения показателя были выше, чем в остальные сроки (соответственно в 2,9 и в 2,5 раза, p < 0,05). Метаболическая активность почвенных микробных сообществ (AWCD, average well-color development) зависела от наличия или отсутствия растений, особенно на 7-е сут: в их присутствии она была выше (0,7 для почвы с растением при 15 ° С, 1,23 для почвы с растением при 20 ° С и 0,89 для почвы с растением при 30 ° С; р < 0,05). Результаты оценки альфа-разнообразия микробных сообществ почв (индекс Шеннона) показали, что из всех вариантов наибольшим разнообразием выделялись сообщества на 7-е сут (p < 0,05). Разнообразие потребляемых почвенными микроорганизмами углеродcодержащих субстратов (SWCD, substrate well color development) зависело и от времени от начала эксперимента, и от наличия растений, особенно в конце вегетации. Активнее всего микробным сообществом потреблялась D-ксилоза (3,53) в контрольном варианте при 20 ° С (на 98-е сут), меньше всего — фенилэтиламин в образцах с растениями при 30 ° С (на 98-е сут) (p < 0,05). Метод неметрического многомерного шкалирования (NMDS, non-metric multidimensional scaling) не выявил различий между почвами (контроль и почва с растениями) при разных температурных режимах на 7-е и 28-е сут, тогда как образцы под технической коноплей, отобранные на 98-е сут, различались. В этом случае выраженное влияние оказала длительность роста растений, но не температура. Содержание С общ. и С орг. достоверно не различалось под воздействием растений или при изменении температуры (p > 0,05).


