Ростостимулирующее действие дельта-эндотоксина Bacillus thuringiensis на ювенильные растения пшеницы
Автор: Коробов Яков Александрович, Каменек Людмила Кирилловна, Каменек Валерий Михайлович, Усеева Лилия Фагимовна
Журнал: Ульяновский медико-биологический журнал @medbio-ulsu
Рубрика: Общая биология
Статья в выпуске: 2, 2017 года.
Бесплатный доступ
Цель. Изучение ростостимулирующего действия дельта-эндотоксина Bacillus thuringiensis на пшеницу мягкую сорта «алтайская 105». Материалы и методы. В работе был использован штамм 202 B. thuringiensis ssp. thuringiensis. В качестве объекта исследования - семена пшеницы яровой мягкой сорта «алтайская 105» фирмы «Живые продукты Алтая». Результаты. Оценка влияния различных концентраций раствора дельта-эндотоксина на энергию прорастания и лабораторную всхожесть семян показала, что наиболее оптимальной и эффективной для предпосевного замачивания является концентрация 0,6 %. Выявлено стимулирующее действие дельта-эндотоксина Bacillus thuringiensis, приводящее к повышению биометрических и биохимических показателей ювенильных проростков пшеницы мягкой. Установлено усиление синтеза в тканях проростков растений гетероауксина и аскорбиновой кислоты. Выявленные эффекты могут быть следствием как прямого стимулирующего воздействия дельта-эндотоксина на растения, так и общего оздоровления растений.
Дельта-эндотоксин, гетероауксин, аскорбиновая кислота, ростостимулирующий эффект, энергия прорастания, реактив сальковского, реактив жиру
Короткий адрес: https://sciup.org/14113271
IDR: 14113271 | УДК: 579.64:573.6.086.83:631.811.98 | DOI: 10.23648/UMBJ.2017.26.6230
Текст научной статьи Ростостимулирующее действие дельта-эндотоксина Bacillus thuringiensis на ювенильные растения пшеницы
Введение. Пшеница является ведущей зерновой культурой, обладает высокой интенсивностью и урожайностью. Она выращивается в разных почвенно-климатических условиях [1]. Это обусловливает разнообразие фитопатогенов, поражающих растения, и, как следствие, применение всевозможных пестицидов. Большинство применяемых пестицидов имеет небиологическое происхождение. Их систематическое использование негативно сказывается на продукции [2].
Экологизация сельского хозяйства доказывает возможность использования биологических агентов в качестве важного средства решения вопросов современной агротехники [3].
Особое внимание следует уделить проблеме иммунизации растений и стимуляции их роста. Предпосевная обработка семян биопрепаратами способствует более интенсивному накоплению биомассы растениями, увеличению синтеза витаминов и фитогор- монов, а также повышению резистентности растений к фитопатогенам [4]. Кроме того, следует отметить сравнительно небольшую концентрацию рабочих растворов биопрепаратов и цикличность их применения [5].
Микробиологические препараты представляют собой как живые клетки отселекти-рованных по полезным свойствам микроорганизмов, так и продукты их жизнедеятельности, оказывающие прямое либо опосредованное действие на растения [5]. В литературе имеются данные о том, что подобные свойства проявляются у некоторых подвидов Bacillus thuringiensis. В частности, отмечена способность дельта-эндотоксина стимулировать развитие проростков фасоли и огурца [6].
Известно, что функциональным компонентом B. thuringiensis являются параспо-ральные кристаллы дельта-эндотоксина, обладающие антибиотическими и антифунгаль-ными свойствами в отношении целого ряда фитопатогенов [7, 8].
Цель исследования. Изучение возможного ростостимулирующего действия дельтаэндотоксина B. thuringiensis на пшеницу мягкую.
Материалы и методы. В работе в качестве продуцента дельта-эндотоксина был использован штамм 202 B. thuringiensis ssp. thuringiensis. Культура получена из ФГБУ ГосНИИ генетики и селекции промышленных микроорганизмов (г. Москва). В качестве объекта исследования использовали семена пшеницы яровой мягкой сорта «алтайская 105» фирмы «Живые продукты Алтая». Поверхностное культивирование B. thuringiensis осуществляли в термостатах при 27 ° С в чашках Петри на питательной среде РПА.
Биомассу B. thuringiensis , содержащую кристаллы эндотоксина и споры продуцента, отмывали дистиллированной водой от водорастворимых токсинов. Путем центрифугирования суспензии кристаллы и споры осаждали при 3000 об/мин в течение 15 мин. Осадок ре-суспендировали и удаляли элементы твердой питательной среды центрифугированием при 500 об/мин в течение 5 мин. Полученный супернатант содержал спорово-кристаллический комплекс. Кристаллы отделяли от спор последовательно путем флотации и экстракции в двухфазной среде хлороформ-водного раствора Na 2 SO 4 . Щелочной гидролиз кристаллов проводили по методу Cooksey [9]. Затем раствор подвергали диализу и доводили водой до необходимой концентрации. рН раствора снижали до 7,8 титрованием 0,1 н. HCl. Доочистку дельта-эндотоксина осуществляли микрофильтрацией (диаметр пор 0,4 мкм). Количество белкового дельта-эндотоксина определяли по методу Лоури [10].
Энергию прорастания семян определяли на 4-й день инкубации путем подсчета числа проросших семян и выражали в процентах от первоначально взятого количества. Лабораторную всхожесть семян определяли на 7-й день проращивания. Для этого подсчитывали число проросших семян и выражали в процентах от первоначально взятого количества (ГОСТ 8074-82).
Влияние концентрации дельта-эндотоксина на всхожесть и энергию прорастания семян оценивали в ходе проращивания семян в чашках Петри на бумажной подложке, обработанной растворами дельта-эндотоксина в концентрации от 0,1 до 1,5 %.
После этого опытные образцы обрабатывали в 0,6 % растворе дельта-эндотоксина в течение 30 мин, а контрольные – в воде. Дальнейшее проращивание семян осуществляли в пробирках на стерильном увлажненном песке при 28–30 оС в условиях шестнадцатичасового светового дня. Полив осуществляли с интервалом в 24 ч в течение 10 сут. В варианте с предварительной обработкой полив осуществлялся водой, в варианте с постоянной обработкой – 0,6 % раствором дельта-эндотоксина. В каждом варианте оценивали по 20 растений в соответствии с ГОСТ 123038–84 «Семена сельскохозяйственных культур. Методы определения всхожести».
Для определения гетероауксина и аскорбиновой кислоты растения фиксировали, проводя через серию спиртовых растворов: 20, 40, 60, 80 % – по 30 мин, 96 и 100 % – в течение 1 ч в каждом. Полученный материал пропитывали последовательно смесью абсолютного спирта и ксилола в соотношениях 3:1, 2:2 и 1:3 по 1 ч в каждом. Фиксацию заканчивали замещением промежуточной жидкости парафином: использовали ксилол и парафин при температуре 56 оС до полного испарения ксилола (в течение 3–6 сут) с последующей заливкой материала в парафин. При помощи микротома получали срезы толщиной 8 мкм и наклеивали их на предметные стекла. Препарат просушивали при 40–50 оС, удаляли парафин последовательно ксилолом, 96 % спиртом и дистиллированной водой, обезвоживали 96 и 100 % растворами этилового спирта в течение 2 ч. Спирт в срезах замещали на ксилол. Срезы заключали в канадский бальзам и просушивали [11].
Определение гетероауксина осуществляли с использованием реактива Сальковского, состоящего из 0,1 г железоаммонийных квасцов и 100 мл 50 % раствора серной кислоты, в течение 20 мин при комнатной температуре [11].
Окрашивание аскорбиновой кислоты проводили с использованием реактива Жиру, представляющего смесь 5 % раствора нитрата серебра и 5 % раствора уксусной кислоты, в течение 15–20 мин в темноте. Наблюдали выпадение черных кристаллов восстановленного серебра [11].
Обработку полученных данных проводили по методике «МЕКОС» на микроскопе Zeiss Axiostarplus (ГОСТ 8074–82 «Микроскопы инструментальные»).
Все эксперименты проводили в 10-кратной повторности по 20 растений в каждой.
Все полученные данные подвергли статистической обработке по методу Стьюдента [12].
Результаты и обсуждение. Анализ влияния дельта-эндотоксина в разных концентрациях на энергию прорастания и лабораторную всхожесть семян показал, что наиболее эффективной для предпосевного замачивания является концентрация 0,6 % (рис. 1).
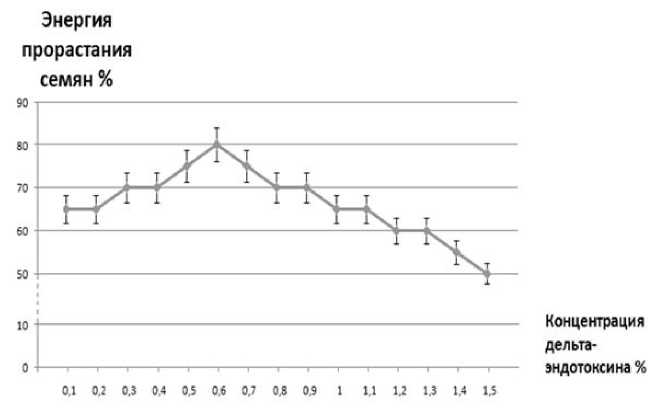
Рис. 1. Влияние дельта-эндотоксина на энергию прорастания семян пшеницы мягкой
Полученные данные демонстрируют возрастание энергии прорастания семян при увеличении концентрации раствора дельтаэндотоксина от 0,1 до 0,6 %. Далее при увеличении концентрации дельта-эндотоксина от 0,6 до 1,5 % наблюдается снижение энергии прорастания.
Анализ лабораторной всхожести семян показал, что при росте концентрации раствора дельта-эндотоксина от 0,1 до 0,6 % происходит увеличение всхожести (рис. 2), при увеличении концентрации дельта-эндотоксина от 0,6 до 1,5 % – уменьшение.
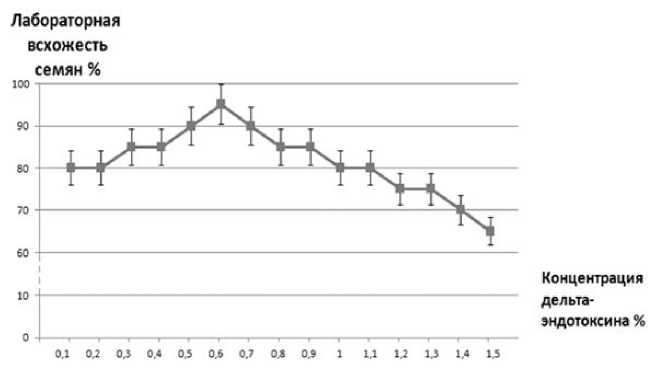
Рис. 2. Влияние дельта-эндотоксина на лабораторную всхожесть семян пшеницы мягкой
Таблица 1
|
Вариант опыта |
Сырая масса проростка, г |
Длина стебля, мм |
Длина корня, мм |
Длина листа по средней жилке, мм |
Обхват стебля, мм |
||
|
1 |
Контроль |
0,203±0,006 |
103,0±0,5 |
52,0±0,5 |
61,0±0,4 |
3,0±0,1 |
|
|
2 |
Дельта-эндотоксин (предварительная обработка)* |
0,275±0,008 |
168,0±0,6 |
63,0±0,5 |
128,0±0,5 |
4,0±0,1 |
|
|
3 |
Дельтаэндотоксин** |
0,208±0,006 |
110,0±0,5 |
55,0±0,4 |
77,0±0,4 |
3,0±0,1 |
|
|
Разница по сравнению с контролем, % |
2 |
35,468 |
63,1 |
21,2 |
109,8 |
25 |
|
|
3 |
2,463 |
6,8 |
5,8 |
26,2 |
0 |
||
Примечание. * – семена обрабатывали дельта-эндотоксином только перед посадкой, в дальнейшем осуществляли полив дистиллированной водой; ** – растения обрабатывали раствором дельта-эндотоксина в течение всего периода.
Влияние дельта-эндотоксина на морфологические показатели (n=200)
В табл. 1 представлены результаты, демонстрирующие изменение морфометрических показателей проростков растений: увеличение массы проростков по сравнению с контрольными образцами на 35,4 % при предварительной обработке дельта-эндотоксином, на 2,4 % при обработке растений дельта-эндотоксином в течение всего эксперимента. Показано увеличение длины корня на 21,2 % при предварительной обработке дельта-эндотоксином и на 5,8 % при постоянном его использовании. Полученные результаты также демонстрируют увеличение обхвата стебля на 25 % при предварительной обработке, в то время как при постоянной обработке увеличения показателей не наблюдалось. Показано увеличение длины стебля на 63,1 % по сравнению с контролем при предварительной обработке и на 6,8 % – при постоянной. Отмечено увеличение длины листа по средней жилке на 109,8 и 26,2 % соответственно.
Важным показателем, характеризующим рост растений и устойчивость к неблагоприятным факторам среды, является содержание в тканях растений гетероауксина и аскорбиновой кислоты.
Гетероауксин (р-индолилуксусная кислота, ИУК), являющийся производным индола, синтезируется в растении из аминокислоты триптофана. Образование ИУК зависит от снабжения растения питательными вещест- вами, особенно азотом и водой. ИУК образуется в очень малых количествах.
У высших растений ИУК синтезируется прежде всего в верхушечной меристеме и в прилегающих к ней молодых листочках, в растущих зародышах, семяпочках и семядолях, верхушках корней.
Гетероауксин, являясь растительным гормоном, контролирует разнообразные обменные процессы в растительных тканях, как анаболические, так и катаболические, усиливая рост тканей и всего растения [13].
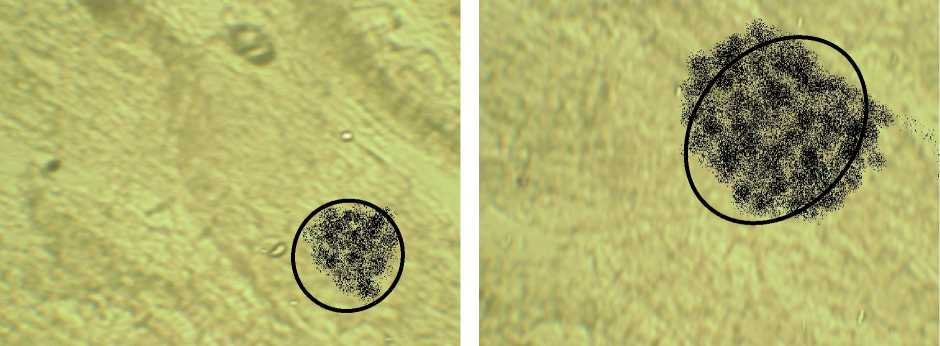
На микрографии (рис. 3) представлена типичная картина изменения содержания гетероауксина. Площадь окрашенных кристаллов гетероауксина в меристеме пшеницы мягкой в контрольном образце составляет 40±1 мкм, а на экземпляре с дельта-эндотоксином – 60±2 мкм.
В настоящее время полагают, что аскорбиновая кислота синтезируется в растениях из Д-глюкозы и Д-галактозы независимыми путями.
Больше всего аскорбиновой кислоты синтезируется в листьях растений, особенно на солнечной стороне. В период подготовки к цветению количество аскорбиновой кислоты достигает максимума. Растения, содержащие большое количество аскорбиновой кислоты, характеризуются повышенной морозо- и га-зоустойчивостью. Участвуя в окислительновосстановительных процессах, аскорбиновая кислота оказывает активирующее действие на ферменты, являясь коферментом, способствует нормальному развитию и повышению сопротивляемости организма к неблагоприятным факторам внешней среды [14].
На микрографии (рис. 4) представлена типичная картина зон распределения аскорбиновой кислоты. Площадь окрашенных кри- сталлов аскорбиновой кислоты в тканях пшеницы мягкой в контрольном варианте составляет 50±1 мкм, а на образце с дельта-эндотоксином – 85±2 мкм.
Таким образом, показано увеличение синтеза гетероауксина и аскорбиновой кислоты в тканях пшеницы мягкой и связанное с ним увеличение морфометрических показателей.
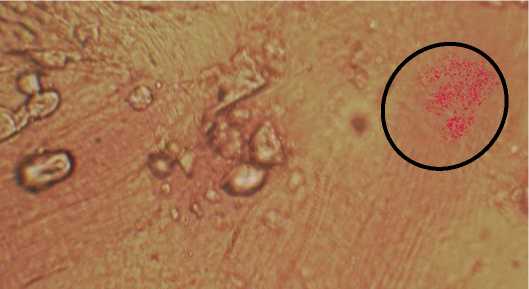
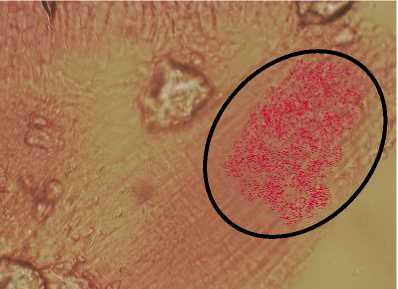
а
б
Рис. 3. Влияние дельта-эндотоксина на синтез гетероауксина: а) контроль; б) дельта-эндотоксин
а
б
Рис. 4. Влияние дельта-эндотоксина на синтез аскорбиновой кислоты: а) контроль; б) дельта-эндотоксин
Выявленный ростостимулирующий эффект может быть следствием как прямого стимулирующего воздействия дельта-эндотоксина на растения, так и общего оздоровления растений, связанного с подавлением фитопатогенов, которыми могут быть контаминированы семена [15].
Выводы:
-
1. Предварительная обработка семян пшеницы мягкой раствором кристаллов дель-
- та-эндотоксина B. thuringiensis в концентрации 0,6 %, а также обработка растений в течение всего эксперимента обеспечивает достоверное увеличение морфометрических показателей (длины листа по средней жилке, обхвата стебля, массы растения, длины корня).
-
2. Обработка дельта-эндотоксином Bacillus thuringiensis приводит к достоверному увеличению синтеза гетероауксина (50 %) и аскорбиновой кислоты (70 %).
Список литературы Ростостимулирующее действие дельта-эндотоксина Bacillus thuringiensis на ювенильные растения пшеницы
- Мелехина Т.С., Пинчук Л.Г. Урожайность и адаптивность сортов озимой пшеницы в условиях юго-востока Западной Сибири. Вестник АГАУ. 2015; 6: 5-8.
- Ефимов В.Н. Система удобрений. М.: Колос; 2002. 32.
- Менликеев М.Я., Смирнов В.В., Байгузина Ф.А. Фитоспорин -биологический препарат для защиты растений от болезней. Уфа; 1991: 21-23.
- Чулкина В.А. Управление агроэкосистемами в защите растений. Новосибирск; 1995. 201.
- Гилязетдинов Ш.Я., Нугуманов А.Х., Пусенкова Л.И. Эффективность антистрессовых препаратов и биофунгицидов в системе защиты сельскохозяйственных культур от неблагоприятных абиотических и биотических факторов. Уфа; 2008. 372.
- Терехина Л.Д., Терехин Д.А. Дельта-эндотоксин Bacillus thuringiensis как стимулирующий агент развития ювенильных растений INVITRO. Материалы 12-й Международной пущинской конференции. 11-15 мая 2008 г. Пущино; 2008: 229-230.
- Юдина Т.Т., Бурцева Л.И. Действие эндотоксинов четырех подвидов Bacillus thuringiensisна различных прокариот. Микробиология. 1997; 1: 25-31.
- Каменек Л.К., Климентова Е.Г. Действие дельта-эндотоксина Bacillus thuringiensis в отношении фитопатогенных грибов родов Phytophthora и Fusarium. Биотехнология. 2005; 1: 76-83.
- Cooksey K.E. Purification of a protein from Bacillus thuringiensis toxic to a larvae of Lepidoptera. Biochem. J. 1968; 106: 445-454.
- Каменек Л.К. Выделение и очистка кристаллов эндотоксина Bacillus thuringiensis. Бюл. научно-техн. информации. 1981; 2: 14-15.
- Паушева З.П. Практикум по цитологии растений. М.: Агропромиздат; 1988: 111-112.
- Доспехов Б.А. Методика полевого опыта. М.: Агропромиздат; 1985: 193-196.
- Кузнецов В.В. Физиология растений. М.: Высшая школа; 2006: 742-743.
- Рубин Б.А. Физиология сельскохозяйственных растений. М.; 1967: 496-497.
- Каменек Л.К., Терехина Л.Д., Каменек В.М. Изучение ростостимулирующего действия дельта-эндотоксина на примере растений огурца. Вестник НГАУ. 2010; 4: 13-18.


