Селекция f гибридов редиса (raphanussativus L.) на основе линий с мужской стерильностью
Автор: Монахос Г.Ф., Миронов А.А., Тюханова С.М.
Журнал: Овощи России @vegetables
Рубрика: Селекция и семеноводство сельскохозяйственных растений
Статья в выпуске: 1 (26), 2015 года.
Бесплатный доступ
Предложена схема скрещиваний для создания закрепителя стерильности при ядерно-цитоплазматическом типе контроля стерильности у редиса. Показана необходимость отсутствия S-аллелей у закрепителя стерильности. Приведены результаты генетико-селекционной работы по созданию коллекции изогенных пар: цмс - закрепитель стерильности. На основе изогенной пары Мс2 Зк2 выделены две перспективные гибридные комбинации, включенные в Госреестр под названиями F 1 Марс и F 1 Файер.
Редис, ядерно-цитоплазматическая мужская стерильность, f 1 гибрид, закрепитель стерильности
Короткий адрес: https://sciup.org/14025148
IDR: 14025148 | УДК: 635.63:631.527.56
Текст научной статьи Селекция f гибридов редиса (raphanussativus L.) на основе линий с мужской стерильностью
При генетическом анализе проявления мужской сте- рильности и планировании селекционного процесса с ее участием следует четко различать и учитывать особенности различных типов мужской стерильности, что избавит селекционера от неточных толкований и ошибок в практической работе. В селекции растений рода Raphanus используют в основном ядерно-цитоплазматическую мужскую стерильность, которая контролируется взаимодействием мутант- ных генов стерильности, возникших спонтанно в митохондриях цитоплазмы с гомозиготностью по рецессивным аллелям мутантного гена стерильности в хромосомах ядра. Этот тип стерильности у капустных культур впервые был обнаружен у японского редиса Raphanus sativus Огурой в 1968 году
(Ogura H., 1968), и в последующие годы предпринималось много усилий по созданию F1 гибридов редиса и дайкона на основе мужской стерильности (Янаева Д.А., 2011, Бунин М.С., 1994).
Если обозначить цитоплазму с фактором стерильности символом ЦитS, а нормальную цитоплазму ЦитN, соответственно аллель фертильности Rf, а мутантный аллель,
вызывающий стерильность rf, то генотип стерильного растения будет таким ЦитSrfrf. Все другие сочетания генов цитоплазмы и ядра (ЦитNRfRf, ЦитNRfrf, ЦитNrfrf, ЦитSRfRf, ЦитSRfrf) обеспечивают фертильность.
Для размножения стерильных растений необходим поиск или создание закрепителя стерильности, то есть генотипа ЦитNrfrf, обеспечивающего при опылении стерильного растения (ЦитSrfrf) стерильное потомство, которое
1. Число стерильных и фертильных растений в комбинациях скрещиваний, Москва, 2005
|
F1 гибриды |
Изучено растений, шт |
Фертильные растения, шт |
Стерильные растения, шт |
|
Ms x Мох 1-2 |
40 |
40 |
0 |
|
Ms x Мох 1-3 |
10 |
10 |
0 |
|
Ms x Мох 1-32 |
11 |
11 |
0 |
|
Ms x Мох 1-4 |
40 |
40 |
0 |
|
Ms x Кс 4-4312 |
20 |
20 |
0 |
|
Ms x Кс 4-45221 |
21 |
21 |
0 |
|
Ms x Кс 4-45215 |
22 |
22 |
0 |
|
Ms x Жа 3-1 |
8 |
5 |
3 |
|
Ms x Жа 3-2 |
18 |
13 |
5 |
|
Ms x Жа 4-2 |
20 |
20 |
0 |
|
Ms x Жа 5-1 |
7 |
4 |
3 |
|
Ms x Жа 5-2 |
5 |
5 |
0 |
|
Ms x Жа 6-2 |
20 |
20 |
0 |
|
Ms x Жа 9 |
19 |
0 |
19 |
|
Ms x ВРКТ 1-4333151 |
20 |
20 |
0 |
|
Ms x ВРКТ 1-43315 |
10 |
10 |
0 |
|
Ms x СП 1 |
5 |
2 |
3 |
|
Ms x СП 1-13112 |
28 |
21 |
7 |
|
Ms x Ил 2-2(11)22 |
33 |
19 |
14 |
|
Ms x Ил 2-2(11)21 |
20 |
20 |
0 |
|
Ms x Ил 2-21121 |
20 |
20 |
0 |
|
Ms x Ил 2-331 |
10 |
10 |
0 |
|
Ms x Ил 2-332 |
10 |
10 |
0 |
|
Ms x Ил 2-362 |
22 |
22 |
0 |
|
Ms x Ил 2-1122 |
11 |
11 |
0 |
|
Ms x Ил 2-921 |
12 |
12 |
0 |
|
Ms x Зл 2-1 |
10 |
10 |
0 |
|
Ms x Зл 2-2 |
20 |
20 |
0 |
|
Ms x Ил 2-01 |
18 |
9 |
9 |
|
Ms x Ки 2-1 |
19 |
19 |
0 м |
|
Ms x Соф 1-41 |
29 |
29 |
0 |
|
Ms x ЗСБ 2-1 |
5 |
5 |
0 |
|
Ms x Рц 15-612 |
21 |
11 |
10 |
|
Ms x Рц 14-1332 |
2 |
2 |
0 |

используют материнским компонентом при производстве гибридных семян.
Поиск закрепителя стерильности можно проводить двумя способами. Первый, наиболее простой – анализирующими скрещиваниями стерильного растения (источника мужской стерильности) фертильными растениями из сортовых популяций. В качестве источника мужской стерильности используют коммерческие F1 гибриды. Анализ потомств F1 гибридов зарубежной селекции позволил выявить наличие стерильных растений в F2 гибрида Radius. Скрещивания стерильных растений из этого потомства с 34 фертильными линиями показало, что у большинства гибридов все растения были фертильными и лишь в потомстве линии Жа9 все потомство было стерильным. В некоторых комбинациях присутствовали фертильные и стерильные растения, таким образом нами выяснено, что линия Жа9 обладает генотипом закрепителя стерильности (ЦитNrfrf). В восьми комбинациях, где наблюдали расщепление, чаще 1:1, опылители являются гетерозиготами, т.е. имели генотип ЦитNRfrf. В самоопыленных потом-ствах отцовских линий опылителей стерильных растений не выявлено, что свидетельствует в пользу наличия у них нормальной цитоплазмы (ЦитN). Линии, в потомствах которых доля фертильных растений составляла 100% (Мох1-2, Мох 1-3, Мох1-32, Мох1-4, Кс4-4312, Кс 445221, Кс 4-45212, Жа4-2, Жа5-2, Жа6-2, ВРКТ1-4333151, Ил2(11)21, Ил 2-1121, Ил2-331, И2-332, Ил2-363, Ил2-1122, Ил2-921, Зл2-1, Зл2-2, Ки2-1, Соф4-1, ЗСБ2-1, Рц14-1332), являются восстановителями фертильности и дальнейшей ценности для создания на их базе закрепителя стерильности не имеют.
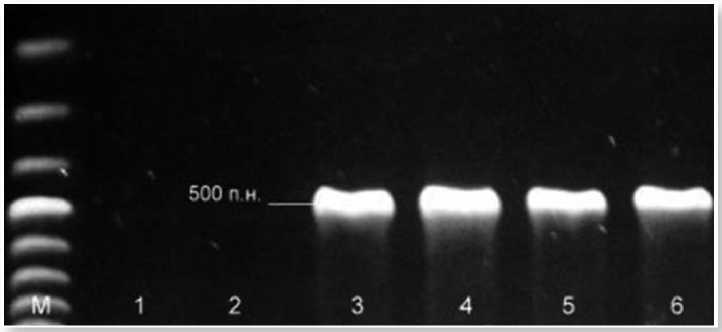
Рис. 1. ПЦР анализ c использованием праймеров orf138-5' и orf138-3'.
Варианты: 1, 2 – линии редиса (ферт), 3, 4 – стерильные линии (ogu), 5, 6- потомства от скрещивания стерильной линии с закрепителем стерильности (ogu), M –маркер размеров 100 bp.
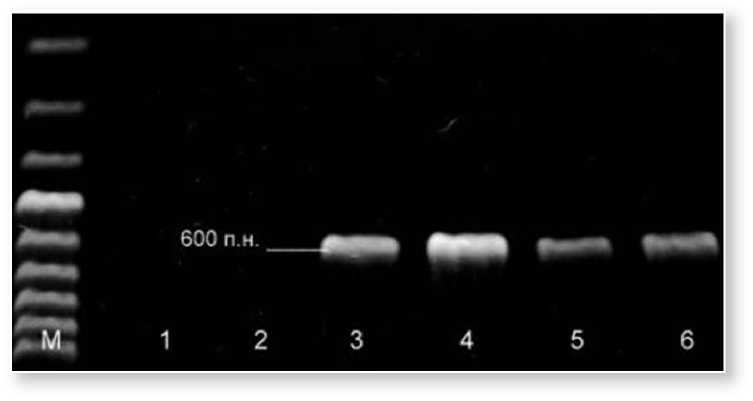
Рис. 2. ПЦР анализ c использованием праймеров ogu-5' и ogu-3'.
Варианты: 1, 2 – линии редиса (ферт), 3, 4 – стерильные линии (ogu), 5, 6- потомства от скрещивания стерильной линии с закрепителем стерильности (ogu), M –маркер размеров 100 bp.
Самоопылением растений линии Жа9 и многократным беккроссиро-ванием гибрида (MsxЖа9) и отбором создана изогенная пара Жа9Ms и Жа9 закрепитель стерильности.
Кроме того, для создания линий закрепителей стерильности нами разработана программа, предусматривающая серию специальных скрещиваний с анализом потомств. На первом этапе провели поиск источников стерильности в сортовых популяциях и в F2 коммерческих зарубежных гибридов. Идентификацию типа мужской стерильности у источников осуществили с помощью SCAR маркеров на наличие фактора стерильности в цитоплазме типа Ogura (рис. 1 и рис. 2), для этого использовали две пары праймеров orf138-5' и orf138-3' (500 п.н.) и ogu-5' и ogu-3' (600 п.н.) (Motegi et al., 2003; Giancola et al., 2007).
Второй этап: скрещивание стерильных растений с фертильными самосовместимыми растениями из сорта Ранний красный. Потомство этих гибридов было полностью фертильным и указывало на то, что стерильность у материнского растения обусловлена взаимодействием фактора стерильности в цитоплазме с рецессивным аллелем в гомозиготном состоянии в ядре.
Р $ ЦитSrfrf x 8 ЦитNRfRf
F 1 ЦитSRfrf
I. 2 PI x *P2
(LbtTsrfrf) (UhtnRIRO (стерильный) (фертильный)
F| (самоопыление) ' • UinsRfRf, 14 HinsRfrf. 1« ЦитнгМ(стерильная форма)
ЦатцКМ *
(фертильный)
<; lbnNRfRf (фертильный)
•UwrsRfrf
(ферныьный)
*6 HMTxRfRf (фертильный)
И Uxr4Rfrf
(фертильный)
анал1П1ф)'юишс скрещивания
i UnTSrfrf х UinsRfRf (стерильный) I (фертильный)
LbnsRfrf (фертильный)
анализирующие скрещивания Цит\ИгГ
llHTsrfrf х UHisRfrf (самоо пыление) J« UinxRfRf * '4 LlHTsRfrf * 1 • ЦитыГ<Н
(стерильный) I (фертильный)
' т UinsRfrf * ^ LbtTsrfrf (ферпстьный) (стерильный)
1, IbnsRfrf + % IlHTsrtrl (фертильный) (стерильный)
HnTvrfrf (С1СрНЛЫ1ЫЙ|
Ыкрстпсль CtCpW.IbHOCtH
Цит\гГтГ
IbnsRhf (фсртмлышй)
Рис. 3. Схема скрещиваний для создания закрепителя стерильности.
Для передачи рецессивного (rf) аллеля в растения с нормальной цитоплазмой на следующем этапе проводили скрещивания фертильных самосовместимых растений, имевших генотип ЦитNRfRf (сорта Ранний красный), пыльцой фертильных гибридных растений с генотипом ЦитSRfrf. Потомство этих скрещиваний состояло из генотипов ЦитNRfRf и ЦитNRfrf в соотношении 1:1, поэтому все растения были фертильными и фенотипически по строению цветков не различались. С целью выявления гетерозигот и получения

Рис. 4. Перспективная гибридная комбинация F 1 Марс (слева) и стандарт F 1 Селеста (справа).
от них сегрегирующих потомств проводили анализирующие скрещивания, для чего в качестве материнского компонента использовали стерильные растения из потомств от гетерозиготных фертильных гибридов ЦитSRfrf, полученные на первом этапе, где их доля составляла 25%. В результате изучения проявления мужской стерильности, в потомствах от анализирующих скрещиваний были идентифицированы гетерозиготы. Это те растения, которые показали в потомстве от скрещивания со стерильными растениями соотношение, близкое один к одному: половина растений фертильные и половина стерильные. Самоопыленное потомство таких гетерозигот ЦитNRfrf является источником растений закрепите-
2. Анализ хозяйственных признаков гибридов, 2013-2014 годы
|
Название |
Масса корнеплода, г |
Листовая масса, г |
Диаметр корнеплода, с м |
Длина корнеплода, см |
Индекс формы, H/D |
|
Марс |
45,6 |
26,2 |
3,7 |
4,1 |
1,2 |
|
Файер |
26,7 |
25,9 |
3,5 |
3,9 |
1,2 |
|
Селеста, стандарт |
20,5 |
11,8 |
3,4 |
3,9 |
1,3 |
|
НСР05 |
7,366 |
4,320 |
0,098 |
0,029 |
F1 HYBRIDS BREEDING OF RADISH (RAPHANUS SATIVUS L.) ON THE BASIS
OF MALE STERILE LINES
лей стерильности ЦитNrfrf, их доля составляет 25%.
ся плодов и семян, и эти растения
Для их выявления провели
Monakhos G.F.1, Mironov A.A.1
Tiukhanova S.M.2
последнее анализирующее скрещивание с оценкой потомств. В потомствах, где все растения были
стерильными, опылители являются
1Limited Company «Breeding station after N.N. Timofeev» Pasechnaya st., 5,
закрепителями ЦитNrfrf.
стерильности
С помощью этой методики нами
создана вторая изогенная пара Ms2-Зк2.
Одним из требований к линии
закрепителю стерильности являет-
ся ее скрещиваемость со стерильным аналогом. При наличии аллеля
гена самонесовместимости у
растений закрепителя
сти при размножении
стерильностерильной
использовали при создании закрепителей стерильности.
Следующий этап селекции F1 гибридов заключается в оценке комбинационной способности созданных стерильных и фертильных линий в схеме скрещиваний двух
групп различающихся генотипов.
Для биологической беспатентной защиты авторских прав в качестве отцовских линий опылителей
мы предлагаем использовать линии
закрепители стерильности из других пар с генотипом ЦитNrfrf. В
этом будут будут
случае F1 гибриды всегда иметь генотип ЦитSrfrf и
стерильными, что делает
Summary . The line fixers of steril ity from the other pairs with genotype TsitNrfrf are encour aged to use for off-patent biolog ical copyright protection paternal pollinating lines. In this case, the F1 hybrids will always have a TsitSrfrf genotype and will be sterile, which makes it impossible to obtain F2 progeny.
линии происходит
насыщение
растений стерильной линии тем же
аллелем гена самонесовместимо-
сти, и в следующих поколениях бек-
кросса в зависимости от типа взаимодействия S-аллелей семенная
продуктивность снижается, и, в
конце концов, они не скрещиваются. Для преодоления этой пробле-
невозможным получение F2 потомства.
мы нами создана коллекция само-совместимых линий, для чего проводили гайтеногамное самоопыле-
ние цветков и подсчет завязавших-
Российской Федерации два гибрида F1 Марс и F1 Файер, превосходящие стандарт F1 Селеста (табл. 2).
Список литературы Селекция f гибридов редиса (raphanussativus L.) на основе линий с мужской стерильностью
- Бунин М.С. Мужская стерильность сельскохозяйственных растений семейства Brassicacea.L. и ее использование в селекции//С.-х. Биология, сер. Биология растений. -1994. -№1. -С.20-31.
- Янаева Д.А. Особенности современных технологий выращивания редиса/Янаева Д.А., Аникеева Н.А., Леунов В.И., Девочкина Н.Л., Ховрин А.Н., Антипова О.В.//Картофель и овощи. -2011.-№3.-С.16-17.
- Giancola S., Rao Brown G.G., L’Homme Y., Stahl R.J., Li X.-Q., Hameed A. (1997). Brassica nap cytoplasmic male sterility is associated with expression of a mtDNA region containing a chimeric gene similar to the pol CMS-associated orf224 gene. Current Genet. 31: 325-335.
- Y., Chaillou S., Hiard S., Martin-Canadell A., Pelletier G., Budar F. Cytoplasmic suppression of Ogura cytoplasmic male sterility in European natural populations of Raphanus raphanistrum.//Theor Appl Genet, 2007.
- Motegi T., Nou I.S., Zhou J., Kanno A., Kameya T., Hirata Y. Obtaining an Ogura-type CMS line from asymmetrical protoplast fusion between cabbage (fertile) and radish (fertile).//Euphytica Vol.129.-2003.-p. 319-323.
- Ogura H (1968) Studies on the new male sterility in Japanese radish, with special reference to the utilization of this sterility towards the practical raising of hybrid seeds. Mem Fac Agri Kagoshima Univ. 6: 39-78.


