Селекция яровой мягкой пшеницы (Triticum aestivum L.) для производства экологически чистого зерна с функциональными свойствами в условиях Западной Сибири
Автор: Шаманин В.П., Потоцкая И.В., Чурсин А.С., Шепелев С.С., Нардин Д.С., Пожерукова В.Е., Kksel H., Моргунов А.И.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Улучшение сортов растений
Статья в выпуске: 3 т.59, 2024 года.
Бесплатный доступ
В связи с изменением климата и экологическими проблемами возникает необходимость создания сортов пшеницы с комплексной и пролонгированной устойчивостью к засухе и болезням. Селекционные программы, направленные на выведение сортов, пригодных для экологического и органического земледелия, позволят снизить производственные затраты и пестицидную нагрузку на агроценозы на ближайшие десятилетия. В настоящей работе впервые в условиях Западной Сибири показана значимость сортов яровой мягкой пшеницы с комплексной устойчивостью к бурой и стеблевой ржавчине при беспестицидной агротехнологии на интенсивном естественном инфекционном фоне для получения экологически чистого зерна, в том числе с функциональными свойствами фиолетовозерной пшеницы. Урожайность созданных сортов в годы исследований составила 3,4-4,4 т/га, определена их экономическая эффективность. Цель работы - оценить сорта пшеницы селекции Омского ГАУ с комплексной устойчивостью к болезням, а также с фиолетовой окраской зерна по урожайности, качеству и эффективности их возделывания при беспестицидной агротехнологии и условиях высокой инфекционной нагрузки в Западной Сибири. Исследования были проведены на опытном поле Омского ГАУ (55°02′′ с.ш., 73°31′′ в.д.) в южной лесостепи Западной Сибири в 2016-2021 годах. Материалом служили лучшие сорта и линии яровой мягкой пшеницы ( Triticum aestivum L.) селекции Омского ГАУ, полученные по программе челночной селекции и изученные в конкурсном сортоиспытании: среднеранние - Столыпинская 2, Нива 55, Агрономическая 5, Лютесценс 128-15; среднеспелые - Силантий, Лютесценс 27-12; среднепоздние - ЭФ 22. В качестве стандартов использовали среднеранний сорт Памяти Азиева, среднеспелый сорт Дуэт и среднепоздний сорт Элемент 22. Предшественник - черный пар. Оценку продолжительности вегетационного периода и анализ урожайности проводили по методике Госсортсети. Содержание белка и клейковины в зерне определяли с помощью прибора Инфралюм ФТ 10М («Люмэкс», Россия) по ГОСТ ISO 12099-2017. Уборку урожая осуществляли однофазным комбайном Sampo-130 («Sampo-Rosenlew», Финляндия). Восприимчивость сортов к бурой и стеблевой ржавчине (возбудители Puccinia triticina Erikss . и P. graminis f. sp. tritici Erikss . et Henn.) оценивали по шкалам, рекомендованным CIMMYT: R - высокая устойчивость, интенсивность поражения 0-5 %; M - гетерогенный тип, пустулы различного размера, окруженные хлоротическими и некротическими пятнами или без них; MR - умеренная устойчивость, 10-25 %; MS - умеренная восприимчивость, 30-50 %; S - восприимчивость, > 50 %. В Кении (г. Njoro) дополнительно оценили сорта Нива 55, Силантий и линию Лютесценс 128-15 на естественном инфекционном фоне P. graminis Ug99 по шкале CIMMYT. Идентификацию генов устойчивости к бурой и стеблевой ржавчине проводили в соответствии с установленным протоколом (http://maswheat.ucdavis.edu). Провели анализ содержания фенольных соединений в зерне фиолетовозерного сорта ЭФ 22 и оценили их антиоксидантные свойства в сравнении с краснозерными стандартами Памяти Азиева и Элемент 22. Экономическая эффективность производства зерна изученных сортов и линий рассчитывалась с учетом применения интенсивных зональных технологий возделывания. Показано, что в годы эпифитотий (2016-2020 годы) сорта с комплексной устойчивостью в условиях Западной Сибири в среднем имели достоверную прибавку урожайности: в зависимости от генотипа сорта от 0,3 до 1,1 т/га. Содержание белка и клейковины в зерне этих сортов соответствовало требованиям, предъявляемым к сильной пшенице (16 % и > 28 %). PCA (principal component analysis) анализ данных за 2017-2019 годы с интенсивным инфекционным фоном выявил отрицательную связь между поражением бурой, стеблевой ржавчиной и урожайностью, признаками качества зерна. Сравнительные испытания рекуррентного сорта Элемент 22 с комплексной устойчивостью к бурой и стеблевой ржавчине ( Lr10 , Lr26 / Sr31, Sr35 ) и его аналога ЭФ 22 с фиолетовой окраской зерна показали статистически значимое преимущество аналога по урожайности, общему содержанию фенолов в зерне, в том числе по количеству связанных фенолов и их антиоксидантной активности (соответственно 565,6 мг-экв. GAE/100 г и 62,7 %). Превышение валовой прибыли при возделывании сортов с комплексной устойчивостью к болезням варьировалось в пределах 25-40 % без учета рыночной премии для сорта ЭФ 22 за функциональные свойства продукта. Снижение фунгицидной нагрузки на посевы пшеницы имеет важное значение для производства экологически чистого зерна и сохранения окружающей среды в условиях Западной Сибири.
Пшеница, сорт, гены, устойчивость к болезням, урожайность, фенолы, антиоксиданты, органическое земледелие
Короткий адрес: https://sciup.org/142242457
IDR: 142242457 | УДК: 633.111.1:631.52(571.1) | DOI: 10.15389/agrobiology.2024.3.492rus
Текст научной статьи Селекция яровой мягкой пшеницы (Triticum aestivum L.) для производства экологически чистого зерна с функциональными свойствами в условиях Западной Сибири
По данным международной организации ФАО (Food and Agriculture Organization, FAO), к середине текущего столетия численность населения Земли достигнет своего пика — 10 млрд человек . По мере роста населения в мире критически уменьшается доступность ресурсов для высокозатратного интенсивного сельскохозяйственного производства — воды, нефти, удобрений, химических средств защиты растений. Селекционные программы по сельскохозяйственным культурам, направленные на выведение сортов, пригодных для органического земледелия, позволят на ближайшие десятилетия обеспечить устойчивую траекторию развития сельского хозяйства, снизить производственные затраты и улучшить экологическую обстановку в агроценозах (1, 2).
Оценку продолжительности вегетационного периода и анализ урожайности проводили по методике Госсортсети .
Содержание белка и клейковины в зерне определяли с помощью прибора Инфралюм ФТ 10М («Люмэкс», Россия) по ГОСТ ISO 12099-2017.
Восприимчивость сортов яровой пшеницы к бурой и стеблевой ржавчине (возбудители соответственно Puccinia triticina Erikss. и P. graminis f. sp. tritici Erikss. et Henn.) оценивали по шкалам, рекомендованным CIMMYT (International Maize and Wheat Improvement Center): R — высокая устойчивость, интенсивность поражения 0-5 %; M — гетерогенный тип, пустулы разного размера, окруженные хлоротическими и некротическими пятнами или без них; MR — умеренная устойчивость, 10-25 %; MS — умеренная восприимчивость, 30-50 %; S — восприимчивость, > 50 % (20). Восприимчивость сортов Нива 55, Силантий, линии Лютесценс 128-15 для сравнения дополнительно оценили на естественном инфекционном фоне P. graminis Ug99 в Кении в 2019 году (г. Нджоро, Njoro) по шкале CIMMYT.
Идентифицированные по ДНК-маркерам гены устойчивости к бурой ржавчине Lr1, Lr3, Lr9, Lr10, Lr20, Lr21, Lr24, Lr26, Lr34, 1AL.1RS указаны в соответствии с данными литературы (21-24). При идентификации генов устойчивости к стеблевой ржавчине использовали маркеры для Sr24 (XTaLr16_RGA266585), Sr24 (Sr24#12), Sr31 (Scm009), Sr33 (Xbarc152), Sr35 (ХАК335187), Sr36 (stm773-2), Sr57 (CSLV34) и SrCad (FSD-RSA), ПЦР-амплификацию проводили в соответствии с протоколами для Sr-маркеров . Праймеры, используемые в ПЦР, синтезированы компанией ООО «БИОССЕТ» (Россия). ПЦР-продукты разделяли на 2 % агарозном геле, окрашивали бромидом этидия, визуализацию проводили с помощью системы документирования геля Gel Doc XR+ («Bio-Rad», США) (ФИЦ Институт цитологии и генетики СО РАН, г. Новосибирск).
Содержание свободных и связанных фенолов определяли методом Фолина-Чокальтеу (25) с некоторыми модификациями: 100 мкл экстрактов свободных и связанных фенольных соединений смешивали с 500 мкл реагента Фолина-Чокальтеу (2 н.), 1,5 мл раствора Na 2 CO 3 (200 г/л), 7,9 мл дистиллированной воды и добавляли 100 мкл метанола. Для контроля вместо экстракта добавляли 100 мкл метанола. После 120 мин отстаивания в темноте экстракты центрифугировали (4000 g, 5 мин, центрифуга Heraeus Multifuge X3FR, «Thermo Fisher Scientific», Германия) и измеряли оптическую плотность супернатанта при X = 760 нм (спектофотометр Shimadzu 150 UV-1800, «Shimadzu», Япония). Содержание свободных и связанных фенолов в каждом образце, выраженное в мг-экв. галловой кислоты (GAE) на 100 г зерна, определяли по калибровочной кривой для стандарта галловой кислоты (98 %, p.a., ACS, anhydrous, «Carl Roth», Германия). Общее содержание фенольных соединений рассчитывали суммированием значений для свободных и связанных фенольных соединений.
Для определения антиоксидантной активности в экстрактах свободных и связанных фенольных соединений к 100 мкл экстракта добавляли 3,9 мл свежеприготовленного раствора DPPH-радикала (2,2-дифенил-1-пик-рилгидрозил, «Alfa Aesar», США). После 60 мин реакции при комнатной температуре измеряли оптическую плотность раствора при X = 517 нм (спектрофотометр Shimadzu 150 UV-1800, «Shimadzu», Япония). Антиоксидантную активность (AA, %) вычисляли по формуле (26):
AA = [(A 517 контроля - A 517 образца)/A 517 контроля] х 100 %, где A 517 контроля — оптическая плотность DPPH (95 %), A 517 образца — оптическая плотность экстракта.
Экономическую эффективность производства зерна изученных сортов и линий рассчитывали с учетом применения интенсивных зональных технологий возделывания по Б.С. Кошелеву с соавт. (27).
Статистическая обработка экспериментальных данных включала однофакторный и двухфакторный дисперсионный анализ по Б.А. Доспехову (28) с использованием пакета прикладных программ Microsoft Excel и STA-TISTICA v. 6.0 («StatSoft, Inc.», США). Достоверность различий оценивали по наименьшей существенной разности при уровне значимости 5 % (НСР05), определяли средние значения показателей (M) и стандартные ошибки средних (±SEM). Анализ главных компонент (PCA) выполняли в программе Microsoft R Open 3.3.3 .
Результаты. Данные по гидротермическим условиям в годы проведения исследований получали с сайта Погода_в_Омске). Погодные условия в этот период были контрастными, с преобладанием умеренно-засушливых лет. В 2020-2021 годах сложились менее благоприятные условия по влагообеспеченности: средняя температура в период вегетации яровой пшеницы составила 16,8-17,1 °С, сумма осадков — 167-168 мм, в связи с чем наблюдалось отсутствие поражения посевов пшеницы бурой и стеблевой ржавчиной. В 2016-2019 годах была умеренно теплая влажная погода (сумма осадков — 237-249 мм), что способствовало интенсивному развитию ржавчинных болезней.
Результаты конкурсного сортоиспытания в 2016-2019 годах свидетельствовали об интенсивной инфекционной нагрузке бурой и стеблевой ржавчины на агроценозы пшеницы, за исключением острозасушливого периода 2020-2021 годов, когда поражение сортов указанными патогенами отсутствовало (табл. 1).
1. Оценка устойчивости сортов и линий мягкой пшеницы ( Triticum aestivum L.) селекции Омского ГАУ к бурой и стеблевой ржавчине ( Puccinia triticina Erikss . И P. graminis f. sp. tritici Erikss . et Henn.) в условиях Западной Сибири (конкурсное сортоиспытание, г. Омск, 2016-2019 годы)
|
Сорт, линия |
Бурая/стеблевая ржавчина, % поражения и тип восприимчивости |
Оценка на Ug99, Кения, 2019 год |
Гены устойчивости |
|
2016 год 2017 год 2018 год 2019 год |
Среднеранние
Памяти Азиева,
|
стандарт |
100S/10M |
80S/40S |
80S/90S 50S/80S |
– |
Lr10 |
|
Столыпинская 2 |
R/5MR |
R/R |
R/20MS R/20M |
– |
Lr34 / Sr57 , SrCad |
|
Нива 55 |
5MR/R |
R/R |
R/5MR R/5M |
5MR |
Lr1 , Lr9 , Lr24 / Sr24 , 1AL.1RS |
|
Агрономическая 5 R/5M |
R/R |
R/10MR R/5M |
– |
Lr9 , Lr26/Sr31 , Sr33 |
|
|
Лютесценс 128-15 |
R/R |
R/R |
R/5MR 20MR/30MR Среднеспелые |
10M |
Lr20 |
|
Дуэт, стандарт |
60S/5M |
R/40S |
30MS/80MS 40S/80S |
– |
Lr9, Lr10 |
|
Силантий |
5MR/10MR R/R |
R/10MR R/5M |
30MS |
Lr3 , Lr16/Sr23 , Lr21 , Sr2 |
|
|
Лютесценс 27-12 |
R/5MR |
R/R |
R/5MR 10MR/20MR Среднепоздние |
– |
Sr36 |
|
Элемент 22 |
R/R |
R/R |
R/10MR R/10M |
– |
Lr10 , Lr26/Sr31 , Sr35 |
|
ЭФ 22 |
R/R |
R/R |
R/10MR R/5M |
– |
Lr10, Lr26/Sr31 , Sr35 |
П р и м е ч ани е. R — высокая устойчивость, интенсивность поражения 0-5 %; M — гетерогенный тип, пустулы различного размера, окруженные хлоротическими и некротическими пятнами или без них; MR — умеренная устойчивость, 10-25 %; МS — умеренная восприимчивость, 30-50 %; S — восприимчивость, > 50 %. Ug99 — естественный инфекционный фон P. graminis расы Ug99. Прочерки означают, что сорта и линии не участвовали в оценке восприимчивости к расе Ug99.
Стандарт восприимчивости к ржавчинным болезням (сорт Памяти Азиева) поражался в сильной степени как бурой (50-100S; % поражения и тип восприимчивости), так и стеблевой ржавчиной (40-80S). Для сортов Столыпинская 2, Нива 55, Силантия, Агрономическая 5, Элемент 22, ЭФ 22 и линий Лютесценс 128-15, Лютесценс 27-12, полученных по программе челночной селекции с CIMMYT, была характерна умеренная устойчивость к бурой и стеблевой ржавчине (соответственно R/5M и R/20MS). У них идентифицированы гены устойчивости к бурой и стеблевой ржавчине в разных сочетаниях: Lr1 , Lr3 , Lr9, Lr10, Lr16 / Sr23 , Lr20 , Lr21 ( Lr40 ), Lr24 / Sr24 , 1BL / 1RS ( Lr26 / Sr31 ), 1AL.1RS , Lr34 / Sr57 , Sr2 , Sr33 , Sr 35 , Sr36 , SrCad. В основном в генотипе сортов и линий среди идентифицированных генов присутствовали гены возрастной устойчивости к бурой и стеблевой ржавчине, обусловливающие расонеспецифическую длительную устойчивость к местным популяциям возбудителей этих болезней. Оценка на естественном инфекционном фоне P. graminis Ug99 в Кении некоторых из представленных сортов выявила перспективность сорта Нива 55 (5MR) и линии Лютесценс 128-15 (10M) в случае распространения патотипа TTKSK (Ug99) в омской популяции стеблевой ржавчины.
Сорта среднераннего типа с комплексной устойчивостью к ржавчинным болезням Столыпинская 2, Нива 55, Агрономическая 5 и перспективная линия Лютесценс 128-15 дали статистически значимую (р < 0,05) прибавку урожайности над стандартом Памяти Азиева в среднем за годы исследований — 0,3-1,1 т/га (табл. 2). Наибольшее преимущество этих сортов по урожайности над сортом Памяти Азиева отмечали в 2016 году с максимальным проявлением бурой ржавчины (0,8-1,4 т/га) и в 2019 году с максимальным распространением стеблевой ржавчины (0,7-1,9 т/га). Сорта Столыпинская 2 и Нива 55 также характеризовались повышенной засухоустойчивостью : в острозасушливом 2020 году они имели урожайность соответственно 3,8 и 3,9 т/га, что выше урожайности стандарта (2,7 т/га) на 1,1 и 1,2 т/га (р < 0,05).
-
2. Вегетационный период, урожайность, содержание белка и клейковины в зерне у сортов и линий яровой мягкой пшеницы ( Triticum aestivum L.) селекции Омского ГАУ в условиях Западной Сибири ( n = 4, M ±SEM, конкурсное сортоиспытание, г. Омск, 2016-2019 годы)
Сорт, линия
Происхождение
Вегетационный период, сут
Содержание, %
Урожайность, т/га
Прибавка к стандарту, т/га
белка
клейковины
Памяти Азиева, стандарт
Среднеранние
Saratovskaya 29/ Lutescens 99/80-1.7 84,0±6,16
15,7±1,86
29,0±4,29
3,3±0,41
Столыпинская 2
GLE/3/KA/NAC/2/ TRCH/4/Оmskaya 37
83,0±5,43
16,1±2,47
29,5±2,90
4,4±0,45а
1,1
Нива 55
Lutescens 307-97-
23/3/EMB16/CBRD//CBRD/4/Altayskaya 530
83,0±4,36
16,1±2,35
30,5±3,48
4,1±0,44а
0,8
Агрономическая 5
Sonata*2//TAM200/TURACO
84,0±5,18
16,2±2,85
32,4±4,46а
3,8±0,36а
0,5
Лютесценс 128-15
Lutescens 210.99.10/3/SRN/ Аegilops squarros (358)//Mi-lan/ SHA7/4/Chelyaba Yubileinaya
85,0±6,62
17,0±3,37а
34,0±5,10а
3,6±0,38а
0,3
Дуэт, стандарт
Среднеспелые
Erythrospermum 59/ /Tselinnaya 20/ANK 102 86,0±4,17
15,2±2,47
28,3±2,16
3,5±0,34
Силантий
Lutescens 30-94*2/3/ Triticum dicoccon PI 94625/ Аegilops squarrosa (372)//3*Pastor
88,0±5,49
16,1±2,01а
29,6±3.39
4,3±0,44а
0,8
Лютесценс 27-12
Lutescens 30-94*2/3/ Triticum dicoccon PI 94625/ Аegilops
88,0±6,23
16,0±3,45а
28,5±4,03
4,1±0,42а
0,6
НСР 05
а Прибавка над стандартами
squarrosa (372)//3*Pastor
1,8
Памяти Азиева и Дуэт статистически значима при р ≤ 0,05.
0,79
1,83
0,19
-
3. Содержание, антиоксидантная активность фенольных соединений в зерне и урожайность у сортов фиолетовозерной и краснозерной яровой мягкой пшеницы ( Triticum aestivum L.) в условиях Западной Сибири (конкурсное сортоиспытание, г. Омск, 2021 год)
Содержание, мг-экв. галловой кислоты (GAE)/100 г
Антиоксидантная активность, %
Урожайность, т/га
свободные связанные всего
свободные связанные
(2019-2021 годы)
Краснозерная пшеница (стандарты)
|
Памяти Азиева, стандарт |
188,6±0,52 |
399,2±0,13 |
587,8±0,64 |
47,9±0,17 |
59,6±0,13 |
2,9±0,34 |
|
Элемент 22, стандарт |
243,9±0,61 |
386,6±1,08 |
630,5±1,60 Фиолетовозерная пшеница |
57,8±0,34 |
59,6±0,29 |
3,1±0,46 |
|
ЭФ 22 (Элемент 22*2/i:S29PF) |
206,2±0,00 |
565,6±0,36а |
771,8±0,35а |
53,5±0,00 |
62,7±0,24а |
3,4±0,32а |
|
НСР 05 7,43 28,8 36,4 а Прибавка над стандартами Памяти Азиева и Элемент 22 статистически значима при р ≤ 0,05. |
1,54 |
1,90 |
0,24 |
|||
Среднеспелый сорт Силантий с пирамидой генов устойчивости и линия Лютесценс 27-12 имели в родословной синтетическую пшеницу, полученную с привлечением образца полбы PI 94625 в качестве тетраплоид-ного компонента и образца Ae. tauschii (372). Урожайность сортов этой группы спелости составила 4,1 и 4,3 т/га с достоверной прибавкой урожайности над сортом Дуэт 0,6 и 0,8 т/га (p ≤ 0,05). В соответствии с требованиями ГОСТ 34702-2020 (М., 2020) по содержанию белка и клейковины в зерне все изученные сорта были отнесены к сильной пшенице (16 % и > 28 %). Сорт Агрономическая 5 и линия Лютесценс 128-15 характеризовались высоким содержанием белка (16,2 и 17,0 %) и клейковины в зерне (32,4 и 34,0 %) (p ≤ 0,05).
С помощью маркер-вспомогательной селекции (marker-assisted selection, MAS), срок создания фиолетовозерного сорта яровой пшеницы ЭФ 22 был сокращен вдвое по сравнению с традиционной схемой селекционного процесса (29). Сорт высокоурожайный, характеризуется комплексной устойчивостью к бурой и стеблевой ржавчине ( Lr10 , Lr26 / Sr31 , Sr35 ) . В конкурсном испытании по пару его средняя урожайность за 2019-2021 годы составила 3,4 т/га, что оказалось достоверно выше на 0,3 т/га (p ≤ 0,05), чем у стандарта Элемент 22 (табл. 3). Мука грубого помола имела повышенное содержание общих и связанных фенолов (соответственно 771,8 и 565,6 мг-экв. GAE/100 г).
Антиоксидантная активность свободных фенольных соединений в зерне сорта ЭФ 22 составляла 53,5 %, связанных фенольных соединений — 62,7 % (p ≤ 0,05) в сравнении с краснозерными стандартами. Зерно сорта ЭФ 22 предназначено для производства хлеба и хлебобулочных изделий в качестве функциональных продуктов питания. Сорт ЭФ 22 включен в Государственный реестр селекционных достижений по Западно-Сибирскому региону в 2024 году.
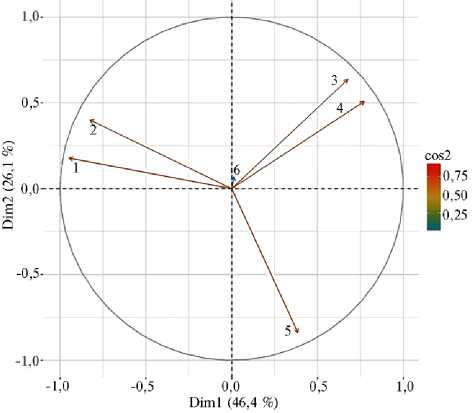
Результаты анализа главных компонент (РСА) , показывающие взаимосвязь между поражением бурой и стеблевой ржавчиной, урожайностью и признаками качества зерна у сортов пшеницы ( Triticum aestivum L.) селекции Омского ГАУ в условиях Западной Сибири (Столыпинская 2, Нива 55, Агрономическая 5, Лютесценс 128-15, Силантий, Лютесценс 27-12, ЭФ 22): 1 — стеблевая ржавчина, %, 2 — бурая ржавчина, %, 3 — клейковина, %, 4 — белок, %, 5 — урожайность, т/га, 6 — вегетационный период, сут; cos2 — вектор исходных переменных, указывающий на значимость главного компонента для наблюдений (конкурсное сортоиспытание Омского ГАУ, г. Омск, 2017-2019 годы).
Мы проанализировали взаимосвязь между поражением бурой и стеблевой ржавчиной, урожайностью и признаками качества зерна у сортов КСИ в годы с интенсивным инфекционным фоном (2017-2019 годы), использовав метод главных компонент (PCA, рис.).
Вариабельность каждого фактора отражалась длиной вектора. Взаимосвязь между изученными элементами определялась направлением векторов, то есть векторы, расположенные близко друг к другу в одном направлении, означали тесную положительную связь между элементами. В первую очередь следует отметить тесную взаимосвязь между поражением сортов бурой и стеблевой ржавчиной, что указывает на усиление эпифитотийной нагрузки на посевы пшеницы в течение трех лет исследований. Накопление белка и клейковины в зерне также было тесно взаимосвязано и имело отрицательную связь с поражением ржавчинными болезнями, как и с урожайностью зерна. Отрицательная взаимосвязь между изученными компонентами факторного анализа свидетельствовала о резком снижении урожайности и качества зерна у сортов пшеницы, восприимчивых к грибным болезням.
Мы рассчитали экономическую эффективность производства зерна изученных сортов в сравнении со стандартом в каждой из трех групп спелости. Превышение валовой прибыли при возделывании среднеранних устойчивых сортов Столыпинская 2, Нива 55, Агрономическая 5 над стандартом составило 28-40 %, для среднеспелых сорта Силантий и линии Лютесценс 27-12 — 27-34 %, для среднепозднего сорта ЭФ 22 — 25 %. Высокая эффективность возделывания сорта ЭФ 22 может быть обусловлена рыночной премией за функциональные свойства продукта, которая может достигать 30-40 % к рыночной цене традиционной продукции. Реализация такого сценария возможна лишь в случае, когда функциональный продукт на рынке пользуется спросом. Для российского зерна с функциональными свойствами наиболее перспективны рынки Азиатско-Тихоокеанского региона.
Согласно оценкам Росгидромета, на территории России изменение климата происходит в сторону повышения температуры и влажности, 2020 год пока зафиксирован как самый теплый по данным метеорологических наблюдений в России . Это создает благоприятные условия для ускорения эволюционного процесса патогенов и эпифито-тийного развития ржавчинных заболеваний. Оценка устойчивости сортов пшеницы из селекционных учреждений Западной Сибири к листостебельным патогенам в 2015-2018 годах выявила корреляционную зависимость урожая от поражения бурой ржавчиной на 21,9-25,1 % и стеблевой — на 40,1-45,3 % (30). Генетическая основа устойчивости к бурой и стеблевой ржавчине у сибирских сортов яровой пшеницы, возделываемых в производственных посевах, достаточно узкая, и распространенные сочетания эффективных генов устойчивости — Sr31/Lr26 и Sr25/Lr19 (31). Наиболее перспективными генами устойчивости к бурой и стеблевой ржавчине для пирамидирования в селекции на иммунитет в условиях Западной Сибири считаются Lr19, Lr24, Lr39 (Lr41), Lr4 7, Lr51, Lr53 (23) и Sr2, Sr6Ai#2, Sr24, Sr25, Sr26, Sr31, Sr39, Sr40, Sr44, Sr57 (32). Разнообразие генов устойчивости и их пирамидирование позволили получить сорта с комплексной устойчивостью, у которых постулированы гены устойчивости к бурой и стеблевой ржавчине, включая пшенично-ржаную транслокацию: Lr1, Lr3, Lr9, Lr10, Lr16/Sr23, Lr20, Lr21 (Lr40), Lr24/Sr24, 1BL/ 1RS (Lr26/Sr31), Lr34/Sr57, Sr2, Sr33, Sr35, Sr36, SrCad, 1AL.1RS. Сорт Столыпинская 2 несет эффективные гены возрастной устойчивости Sr57 (источники — итальянские сорта мягкой пшеницы
Ardito и Mentana) с плейотропным эффектом ( Lr34 / Yr18 / Pm38 / Bdv1 ), SrCad (источник — канадский сорт AC Cadillac), широко используемые в селекционных программах CIMMYT (33, 34).
Ген Sr2 обеспечивает длительную возрастную устойчивость к стеблевой ржавчине и широко используется в селекции на иммунитет. Эффективность комбинаций с геном Sr2 у сорта из CIMMYT Pavon 76 и сорта Омского ГАУ Силантия (Sr2 + Sr23) в отношении местной популяции стеблевой ржавчины доказана в наших предыдущих исследованиях (35), а для комбинаций Sr2 с генами ювенильной устойчивости (Sr22, Sr32, Sr39 и Sr40) в Нечерноземной зоне России — у линий озимой пшеницы, полученных с участием образцов из коллекций ВИР и «Арсенал» (36). Морфологическим маркером гена Sr2 у сорта Силантий служит псевдочерная колосковая чешуя (pseudo black chaff) (37, 38), это надежный признак для проведения сортовых прополок при производстве семян высших категорий. У сорта Нива 55 выявлены транслокации от Ag. elongatum с эффективными генами устойчивости Lr24/Sr24 и от ржи — 1AL.1RS, отсутствующие у отечественных сортов яровой пшеницы (23). У сорта Силантий идентифицирован ген устойчивости к бурой ржавчине Lr21 (Lr40), который привнесен в генофонд мягкой пшеницы от Ae. tauschii .
Доказано, что цельное зерно пшеницы служит источником биологически активных фитохимических соединений, в частности антоцианов и фенольных кислот, обладающих противовоспалительным, антиканцерогенным и антиоксидантным действием (39, 40), поэтому одно из направлений селекции — создание сортов пшеницы с фиолетовым зерном для производства функциональных продуктов питания.
На концентрацию фитохимических соединений в зерне влияют генотипические особенности сорта, агротехнологические приемы и факторы внешней среды (41-43). Фенольные кислоты служат регуляторами метаболизма и отвечают за экспрессию генов, формирующих антиоксидантную защиту (44-47). Новый сорт пшеницы ЭФ 22, предназначенный для функционального питания, обладает повышенными содержанием и антиоксидантными свойствами связанных фенольных соединений (соответственно 565,62 мг-экв. GAE/100 г и 62,7 %). При выпечке цельнозернового хлеба из зерна сортов фиолетовой пшеницы Indigo и Кonini статистически подтверждено (p ≤ 0,05) увеличение содержания свободных фенолов во время смешивания, ферментации и выпечки (от 65 до 68 %) и связанных фенолов в течение 65 мин брожения и выпечки (от 16 до 27 %) (48). Отмечены лучшие органолептические и вкусовые свойства хлебобулочных изделий из зерна, насыщенного антоцианами, по сравнению с изделиями, полученными из краснозерной пшеницы (49, 50). Хлеб, испеченный из зерна фиолетовой пшеницы сорта 178MF, также обладал приятным ароматом и хорошим вкусом, при этом гликемический индекс значительно снижен (до 46 по сравнению с белым хлебом, имеющим гликемический индекс 100) (51). По хлебопекарному качеству зерна сорт ЭФ 22 отвечает требованиям, предъявляемым к ценной пшенице .
По результатам конкурсного испытания 2016-2019 годов сорта Си-лантий, Нива 55 и Агрономическая 5 были переданы на Государственное сортоиспытание. Сорта Силантий и Нива 55 в 2022 году включены в Государственный реестр селекционных достижений по Уральскому и ЗападноСибирскому регионам РФ, сорт Агрономическая 5 — в 2023 году по Западно-Сибирскому региону.
На наш взгляд, высокоурожайные сорта пшеницы Столыпинская 2, Нива 55, Агрономическая 5, Силантий с комплексной устойчивостью к грибным болезням и сорт фиолетовой пшеницы ЭФ 22 с улучшенными функциональными свойствами имеют большой потенциал для развития беспестицидных технологий в Западной Сибири. Несмотря на значительное число сортов пшеницы отечественной селекции, представленных на рынке, экономическая эффективность возделывания сортов селекции Омского ГАУ свидетельствует об их преимуществе и служит весомым аргументом для перехода к земледелию со сниженным уровнем химизации. Это позволит в ближайшей перспективе получать качественное и экологически безопасное зерно с повышенной добавленной стоимостью за счет сокращения затрат и себестоимости зерна с единицы площади.
Таким образом, результаты конкурсного испытания сортов яровой мягкой пшеницы селекции Омского ГАУ при интенсивной инфекционной нагрузке бурой и стеблевой ржавчины в условиях естественного фона 20162019 годов свидетельствовали о значении устойчивости к болезням для получения стабильной урожайности и качества зерна. Сорта пшеницы с комплексной устойчивостью к грибным болезням Столыпинская 2, Нива 55, Агрономическая 5, Силантий и сорт фиолетовой пшеницы ЭФ 22 формировали урожайность 3,4-4,4 т/га. Содержание белка и клейковины в зерне этих сортов соответствовало требованиям, предъявляемым к сильной пшенице (16 % и > 28 %). Новый сорт пшеницы ЭФ 22 включен в Государственный реестр селекционных достижений по Западно-Сибирскому региону в 2024 году, характеризуется повышенным содержанием связанных фенольных соединений и антиоксидантов (соответственно 565,6 мг GAE/100 г и 62,7 %) и предназначается для производства продуктов функционального питания. Сорта с комплексной устойчивостью к болезням имели превышение валовой прибыли над стандартами в пределах 25-40 %, что указывает на высокую эффективность их возделывания. При этом снижение фунгицидной нагрузки на посевы пшеницы имеет важное значение для производства экологически чистого зерна и сохранения окружающей среды в условиях Западной Сибири.
Список литературы Селекция яровой мягкой пшеницы (Triticum aestivum L.) для производства экологически чистого зерна с функциональными свойствами в условиях Западной Сибири
- Fess T.L., Kotcon J.B., Benedito V.A. Crop breeding for low input agriculture: a sustainable response to feed a growing world population. Sustainability, 2011, 3(10): 1742-1772 (doi: 10.3390/su3101742).
- Mesterházy Á., Oláh J., Popp J. Losses in the grain supply chain: causes and solutions. Sustaina-bility, 2020, 12(6): 2342 (doi: 10.3390/su12062342).
- Шагайда Н.И., Светлов Н.М., Узун В.Я., Логинова Д.А., Прищепов А.В. Потенциал роста сельскохозяйственного производства России за счет вовлечения в оборот неиспользуемых сельскохозяйственных угодий. М., 2018.
- Тарасова А.А., Галеев М.М. Производство органической продукции как фактор реализации национальных проектов. Наука и образование, 2020, 3(3): 118-125.
- Ван Мансвельт Я.Д., Темирбекова С.К. Органическое сельское хозяйство: принципы, опыт и перспективы. Сельскохозяйственная биология [Agricultural Biology], 2017, 52(3): 478-486 (doi: 10.15389/agrobiology.2017.3.478rus).
- Мистратова Н.А., Ступницкий Д.Н., Яшин С.Е. Органическое земледелие в России (Обзорная статья). Вестник Красноярского ГАУ, 2021, 11(176): 100-107 (doi: 10.36718/1819-4036-2021-11-100-107).
- Rahmann G., Nieberg H. New insights into organic farming in Germany — empirical results of a survey in 218 farms. Landbauforschung Völkenrode, 2005, 3(55): 193-202.
- Chable V., Dawson J., Bocci R., Goldringer I. Seeds for organic agriculture: development of participatory plant breeding and farmers’ networks in France. In: Organic farming, prototype for sustainable agricultures /S. Bellon, S. Penvern (eds). Springer, Dordrecht, 2014: 383-400 (doi: 10.1007/978-94-007-7927-3_21).
- Mäder P., Hahn D., Dubois D., Gunst L., Alföldi T., Bergmann H., Oehme M., Amadò R., Schneider H., Graf U., Velimirov A., Fließbach A., Niggli U. Wheat quality in organic and conventional farming: results of a 21 year field experiment. Science of Food and Agriculture, 2007, 87(10): 1826-1835 (doi: 10.1002/jsfa.2866).
- Ryan M.H., Derrick J.W., Dann P.R. Grain mineral concentrations and yield of wheat grown under organic and conventional management. Science of Food and Agriculture, 2004, 84(3): 207-216 (doi: 10.1002/jsfa.1634).
- Стекольников К.Е Органическое земледелие в России — благо или катастрофа? Биосфера, 2020, 12(1-2): 53-62 (doi: 10.24855/BIOSFERA.V12I1.537).
- Chiriacò M.V., Grossi G., Castaldia S., Valentini R. The contribution to climate change of the organic versus conventional wheat farming: a case study on the carbon footprint of wholemeal bread production in Italy. Journal of Cleaner Production, 2017, 153(1): 309-319 (doi: 10.1016/j.jclepro.2017.03.111).
- Шаманин В.П., Потоцкая И.В., Кузьмин О.Г. Скрининг сортов яровой мягкой пшеницы питомника КАСИБ к бурой и стеблевой ржавчине в условиях Западной Сибири. Вестник Казанского ГАУ, 2017, 12 (2-44): 58-63.
- Singh R.P., Huerta-Espino J., Bhavani S., Herrera-Foessel S.A., Singh D., Singh P.K., Velu G., Mason R.E., Jin Y., Njau P., Crossa J. Race non-specific resistance to rust diseases in CIMMYT spring wheats: breeding and advances. Euphytica, 2011, 179: 175-186 (doi: 10.1007/s10681-010-0322-9).
- Lapochkina I.F., Baranova O.A., Shamanin V.P., Volkova G.V., Gainullin N.R., Anisimova A.V., Galinger D.N., Lazareva E.N., Gladkova E.V., Vaganova O.F. The development of the initial material of spring common wheat for breeding for resistance to stem rust (Puccinia graminis Pers. f. sp. tritici), including the Ug99 race, in Russia. Russian Journal of Genetics: Applied Research, 2017, 7(3): 308-317 (doi: 10.1134/S207905971703008X).
- Гультяева Е.И., Шайдаюк Е.Л., Шаманин В.П., Ахметова А.К., Тюнин В.А., Шрей-дер Е.Р., Кашина И.В., Ерошенко Л.А., Середа Г.А., Моргунов А.И. Генетическая струк-тура российских и казахстанских популяций возбудителя бурой ржавчины Puccinia triticina Еrikss. по вирулентности и SSR маркерам. Сельскохозяйственная биология [Agricultural Biol-ogy], 2018, 53(1): 85-95 (doi: 10.15389/agrobiology.2018.1.85rus).
- Сколотнева Е.С., Кельбин В.Н., Шаманин В.П., Бойко Н.И., Апарина В.А., Салина Е.А. Ген Sr38: значение для селекции мягкой пшеницы в условиях Западной Сибири. Вавилов-ский журнал генетики и селекции, 2021, 25(7): 740-745 (doi: 10.18699/VJ21.084).
- Гончарова Ю.К., Гончаров С.В., Харитонов Е.М., Фотев Ю.В., Симонова В.В., Очкас Н.А. Антиоксиданты растительного происхождения и их нетрадиционные источники (обзор). Сельскохозяйственная биология [Agricultural Biology], 2024, 59(1): 39-53 (doi: 10.15389/agrobiology.2024.1.39rus).
- Gordeeva E., Badaeva E., Yudina R., Shchukina L., Shoeva O., Khlestkina E. Marker-assisted development of a blue-grained substitution line carrying the Thinopyrum ponticum chromosome 4Th (4D) in the spring bread wheat Saratovskaya 29 background. Agronomy, 2019, 9(11): 723 (doi: 10.3390/agronomy9110723).
- Койшыбаев М., Шаманин В.П., Моргунов А.И. Скрининг пшеницы на устойчивость к основным болезням. Анкара, 2014.
- Гультяева Е.И. Методы идентификации генов устойчивости пшеницы к бурой ржавчине с использованием ДНК-маркеров и характеристика эффективности Lr-генов: метод. указ. СПб, 2012.
- Gultyaeva E., Shaydayuk E., Gannibal Ph. Leaf rust resistance genes in wheat cultivars registered in Russia and their influence on adaptation processes in pathogen populations. Agriculture, 2021, 11: 319 (doi: 10.3390/agriculture11040319).
- Гультяева Е.И., Шайдаюк Е.Л., Рсалиев А. Идентификация генов устойчивости к бурой ржавчине у образцов яровой мягкой пшеницы российской и казахстанской селекции. Вестник защиты растений, 2019, 3(101): 41-49 (doi: 10.31993/2308-6459-2019-3(101)-41-49).
- Morgunov A., Pozherukova V., Kolmer J., Gultyaeva E., Abugalieva A., Chudinov V., Kuzmin O., Rasheed A., Rsymbetov A., Shepelev S., Ydyrys A., Yessimbekova M., Shamanin V. Genetic basis of spring wheat resistance to leaf rust in Kazakhstan and Russia. Euphytica, 2020, 216(11): Article 170 (doi: 10.1007/s10681-020-02701-y).
- Adom K.K., Liu R.H. Antioxidant activity of grains. J. Agric. Food Chem., 2002, 50(21): 6182-6187 (doi: 10.1021/jf0205099).
- Brand-Williams W., Cuvelier M.E., Berse C. Use of a free radical method to evaluate antioxidant activity. LWT — Food Science and Technology, 1995, 28(1): 25-30 (doi: 10.1016/S0023-6438(95)80008-5).
- Кошелев Б.С., Асташова Е.А. Зональная эффективность размещения и специализации зерновых культур в Омской области. Экономические науки, 2021, 12(205): 296-303 (doi: 10.14451/1.205.296).
- Доспехов Б.A. Методикa полевого опытa (с основaми стaтистической обpaботки pезультaтов исследовaний). М., 1985.
- Gordeeva E., Shamanin V., Shoeva O., Kukoeva T., Morgounov A., Khlestkina E. The strategy for marker-assisted breeding of anthocyanin-rich spring bread wheat (Triticum aestivum L.) culti-vars in Western Siberia. Agronomy, 2020, 10(10): 1603 (doi: 10.3390/agronomy10101603).
- Россеева Л.П., Мешкова Л.В., Белан И.А., Поползухин П.В., Василевский В.Д., Гайдар А.А., Паршуткин Ю.Ю. Устойчивость сортов яровой пшеницы к листостебельным патогенам в Западной Сибири. Вестник Алтайского ГАУ, 2019, 5(175): 5-11.
- Shamanin V., Salina Е., Wanyera R., Zelenskiy Yu., Morgounov A. Genetic diversity of spring wheat from Kazakhstan and Russia for resistance to stem rust Ug99. Euphytica, 2016, 12: 287-296. (doi: 10.1007/s10681-016-1769-0).
- Кельбин В.Н., Сколотнева Е.С., Салина Е.А. Возможности и перспективы формирования генетической защиты мягкой пшеницы от стеблевой ржавчины в Западной Сибири. Ва-виловский журнал генетики и селекции, 2020, 24(8): 821-828 (doi: 10.18699/VJ20.679).
- Singh R.P., Hodson D.P., Jin Y., Lagudah E.S., Ayliffe M.A., Bhavani S., Rouse M.N., Preto-rius Z.A., Szabo L.J., Huerta-Espino J., Basnet B.R., Lan C., Hovmøller M.S. Emergence and spread of new races of wheat stem rust fungus: continued threat to food security and prospects of genetic control. Phytopathology, 2015, 105(7) (doi: 10.1094/PHYTO-01-15-0030-FI).
- Draz I.S., Ashmawy M.A., Shahin A.A., Omar H.A. Hereditary and molecular validity of plei-otropic resistance to rusts and powdery mildew in hexaploid wheat. Archives of Phytopathology and Plant Protection, 2021, 54(19-20): 2110-2129 (doi: 10.1080/03235408.2021.1920312).
- Шаманин В.П., Потоцкая И.В., Шепелев С.С., Пожерукова В.Е., Салина Е.А., Сколот-нева Е.С., Hodson D., Hovmøller M., Patpour M., Моргунов А.И. Стеблевая ржавчина в Западной Сибири – расовый состав и эффективные гены устойчивости. Вавиловский журнал генетики и селекции, 2020, 24(2): 131-138 (doi: 10.18699/VJ20.608).
- Лапочкина И.Ф., Баранова О.А., Гайнуллин Н.Р., Волкова Г.В., Гладкова Е.В., Ковалева Е.О., Осипова А.В. Создание линий озимой пшеницы с несколькими генами устойчивости к Puccinia graminis Pers. f. sp. tritici для использования в селекционных программах России. Вавиловский журнал генетики и селекции, 2018, 22(6): 676-684 (doi: 10.18699/VJ18.410).
- Kota R., Spielmeyer W., McIntosh R.A., Lagudah E.S. Fine genetic mapping fails to dissociate durable stem rust resistance gene Sr2 from pseudo-black chaff in common wheat (Triticum aes-tivum L.). Theor. Appl. Genet., 2006, 112: 492-499 (doi: 10.1007/s00122-005-0151-8).
- Vishwakarma G., Sanyal R.P., Shitre A., Gadekar D.A., Saini A., Das B.K.,Validation and Marker-assisted selection of stem rust resistance gene Sr2 in Indian wheat using gel-based and gel-free methods. J. Crop Sci. Biotech., 2019, 22(4): 309-315 (doi: 10.1007/s12892-017-0083-0).
- Paznocht L., Kotíková Z., Burešová B., Lachman J., Martinek P. Phenolic acids in kernels of different coloured-grain wheat genotypes. Plant Soil Environ., 2020, 66(2): 57-64 (doi: 10.17221/380/2019-PSE).
- Liu J., Yu L.L., Wu Y. Bioactive components and health beneficial properties of whole wheat foods. J. Agric. Food Chem, 2020, 68(46): 12904-12915 (doi: 10.1021/acs.jafc.0c00705).
- Sharma S., Kapoor P., Kaur S., Kumari A., Sharma N., Kumar A., Chunduri V., Gard M. Changing nutrition scenario: colored wheat — a new perspective. In: Physiological, molecular, and genetic perspectives of wheat improvement /S.H. Wani, A. Mohan, G.P. Singh (eds). Springer, Cham, 2020: 71-88 (doi: 10.1007/978-3-030-59577-7_4).
- Liu J., Zhou H., Song L., Yang Z., Qiu M., Wang J., Shi S. Anthocyanins: promising natural products with diverse pharmacological activities. Molecules, 2021, 26(13): 3807 (doi: 10.3390/molecules26133807).
- Liu R.H. Whole grain phytochemicals and health. Journal of Cereal Science, 2007, 46: 207-219 (doi: 10.1016/j.jcs.2007.06.010).
- Gordeeva E., Shamanin V., Shoeva O., Kukoeva T., Morgounov A., Khlestkina E. The strategy for marker-assisted breeding of anthocyanin-rich spring bread wheat (Triticum aestivum L.) cultivars in Western Siberia. Agronomy, 2020, 10(10): 1603 (doi: 10.3390/agronomy10101603).
- Garg M., Kaur S., Sharma A., Kumari A., Tiwari V., Sharma S., Kapoor P., Sheoran B., Goyal A., Krishania M. Rising demand for healthy foods-anthocyanin biofortified colored wheat is a new research trend. Front. Nutr, 2022, 9: 878221 (doi: 10.3389/fnut.2022.878221).
- Loskutov I.G., Khlestkina E.K. Wheat, barley, and oat breeding for health benefit components in grain. Plants, 2021, 10(1): 86 (doi: 10.3390/plants10010086).
- Nigro D., Grausgruber H., Guzmán C., Laddomada B. Phenolic compounds in wheat kernels: genetic and genomic studies of biosynthesis and regulations. In: Wheat quality for improving processing and human health /G. Igrejas, T. Ikeda, C. Guzmán (eds). Springer, Cham, 2020: 225-253 (doi: 10.1007/978-3-030-34163-3_10).
- Yu L., Beta T. Identification and antioxidant properties of phenolic compounds during production of bread from purple wheat grains. Molecules, 2015, 20(9): 15525-15549 (doi: 10.3390/molecules200915525).
- Liu J., Zhou H., Song L., Yang Z., Qiu M., Wang J., Shi S. Anthocyanins: promising natural products with diverse pharmacological activities. Molecules, 2021, 26(13): 3807 (doi: 10.3390/molecules26133807).
- Ivanišová E., Ondrejovič M., Chmelová D., Maliar T., Havrlentová M., Rückschloss L’. Antioxi-dant activity and polyphenol content in milling fractions of purple wheat. Cereal Research Com-munications, 2014, 42(4): 578-588 (doi: 10.1556/crc.2014.0008).
- Ficco D.B.M., Borrelli G.M., Giovanniello V., Platani C., De Vitaa P. Production of anthocyanin-enriched flours of durum and soft pigmented wheats by air-classification, as a potential ingredient for functional bread. Journal of Cereal Science, 2018, 79(1): 118-126 (doi: 10.1016/j.jcs.2017.09.007).


