Селекция линий томата (lycopersicon esculentum), устойчивых к бронзовости
Автор: Монахос Г.Ф., Нгуен Тхи Лоан , Нгуен Минь Ли
Журнал: Овощи России @vegetables
Рубрика: Защита растений
Статья в выпуске: 3 (24), 2014 года.
Бесплатный доступ
Приведены результаты оценки устойчивости к бронзовости томата селекционного материала с использованием инфекционного фона и сравнение её с результатами оценки молекулярным маркером SCAR Sw421. Анализ спектров ДНК, амплифицирован- ных SCAR маркером Sw421, позволил провести отбор устойчивых растений по генотипу, выявляя гомо- и гетерозиготное состояние гена Sw5. При использовании молекулярного маркера выявление растений, гомозиготных по доминантному аллелю гена Sw5, сокращается на одно поколение по сравнению с традиционным генетическим анализом. Получены линии томата с генетической устойчивостью к бронзовости, гомозиготные по доминантному аллелю гена Sw5.
Аллели sw5, молекулярный маркер, томат, тосповирус, бронзовость
Короткий адрес: https://sciup.org/14025102
IDR: 14025102 | УДК: 635.64:631.524.86
Текст научной статьи Селекция линий томата (lycopersicon esculentum), устойчивых к бронзовости
Впоследнее время возрастает вредоносность бронзовости томата, проявляющаяся в резком снижении урожайности (более 50%) и ухудшении качества продукции (Джос Е.А. и др., 2009; Джалилов Ф.С., Ахатов Е.А., 2014). Заболевание вызывается вирусом бронзовости TSWV (tomato spotted wilt virus) – Тоспови-рус. Тосповирус передается механическим способом трипсами (Naidu et al., 2008), включая табачный трипс Frankliniella fucusa и западный цветочный трипс F. occi-dentalis. Передача происходит по персистентному типу, когда в период питания личинок на больных расте- ниях они сами заражаются вирусом (Джалилов Ф.С., Ахатов Е.А., 2014.)
У восприимчивых растений вирус бронзовости вызывает разнообразные симптомы: бронзовость листьев, побурение, искривление и израстание побегов, карликовость и увядание растения, кольцевую пятнистость, концентрические круги на поверхности плодов (рис.1).
Существуют различные гены устойчивости к бронзо-вости томата, но чаще используют Sw5 . Это объясняется его продолжительной эффективностью, несмотря на сложную структуру Тосповирусов (Anong Shi, 2011).

PLANT PROTECTION
Рис.1. Симптомы бронзовости на листьях и плодах томата
Ген Sw5 , который выявили Stevens и другие (1992) в L. peruvianum , доминантный, локализуется на длинном плече хромосомы 9 (Giordano et al., 2000), дает устойчивость к TSWV во многих географических местах (Boiteux and Giordano, 1993; Stevens et al., 1994; Rosello et al., 1998). Кроме этого, этот ген также обеспечивает устойчивость к двум другим Тосповирусам TCSV и GRSV (Boiteux and Giodano 1993, Soler и др., 2003). Эта особенность гена Sw5 дает возможность создания новых видов Lycopersicon с устойчивостью к широкому спектру видов Тосповирусов (Giordano et al., 2000).
В настоящее время применение молекулярных маркеров значительно расширило возможности оценки генов устойчивости к болезням и вредителям растений. Анализ молекулярных маркеров, связанных с генами, обеспечивающими устойчивость, дает возможность проводить отбор устойчивых растений на генетическом уровне, снижать трудности при фитопатологической оценке образцов, устойчивых к болезням. В конеч- ном итоге это позволяет сделать процесс селекции более эффективным посредством сокращения времени работ, площадей под посевы, в также проводить отбор генотипов по признакам, плохо поддающимся селекции классическим путем (Подвицкий Т.А., Галиновский Д.В., Тарутина Л.А., 2013).
Цель работы – выделить устойчивые к бронзовости образцы томата, изучить генетику устойчивости и возможность оценки устойчивости с помощью молекулярных маркеров, создать устойчивые линии.
Материалы и методы исследования:
Опыт проводили в лаборатории генетики, селекции и биотехнологии овощных культур в 2014 году. Материалом опыта служили различные формы томата, показавшие в предыдущие годы высокую устойчивость к бронзовости: F 1 Гилгал (7 растений), F 2 Гилгал (40 растений), F 2 Исфара (39 растений), F 3 Манон 1-7 (6 растений), F 2 (Гилгал х 19-22) (24 растения). Оценку феноти-
1. Наименование и нуклеотидная последовательность праймеров
|
Название праймеров |
Последовательность праймеров 5' ––– > 3' |
Размер амплифицируемого фрагмента, п.н. |
Авторы |
|
SCAR Sw5-f2 |
CGGAACCTGTAACTTGACTG |
541 п.н. |
Anong Shi et al., 2011 |
|
SCAR Sw5-r2 |
GAGCTCTCATCCATTTTCCG |
||
|
SCAR Sw 421-1 |
GACTTGTTGCCATAGGTTCC |
Доминантная аллель 940 п.н. Рецессивная аллель 900 п.н. |
Nascimento et al., 2009 |
|
SCAR Sw 421-2 |
GCCCACCCCGAAGTTAATCC |
-
2. Результаты оценки коллекции образцов томата на устойчивость к бронзовости на инфекционном фоне, 2014 год
Образец
Число устойчивых растений
Число восприимчивых растений
Соотношение
Значение χ 2
F1 Гилгал
7
0
-
-
F 3 Манон 1-7
6
0
-
-
F2 Гилгал
29
11
2,6:1
0,13
F2 Исфара
29
10
2,9:1
0,008
F2 (Гилгал х 19-22)
14
10
1,4:1
-
пического проявления устойчивости к бронзовости томата проводили визуально в теплице на естественном инфекционном фоне. Устойчивость растений определяли только одним качественным показателем – наличие или отсутствие поражений, по внешним признакам проявления реакции растения на заражение патогеном – на молодых листьях многочисленные мелкие темные пятна, листья приобретают бронзовый оттенок, и засыхают; на стеблях, особенно в верхней части образуются некрозы в виде черных полос и растения прекращают рост. Анализ проводили весь период вегетации растений от высадки рассады до начала созревания плодов.
ДНК выделяли из молодых листьев с помощью це-тилтриметиламмоний-N-бромида («Sigma», США) по методике (Murray, Thompson, 1980). Молекулярное генотипирование проводили с использованием двух маркеров гена устойчивости к бронзовости томата: SCAR Sw5 -f2/ Sw5 -r2 (Anong Shi et al., 2011) и SCAR Sw421-1/SCAR Sw421-2 (Nascimento et al., 2009) по ме-
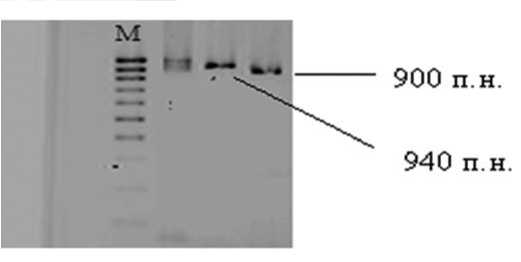
Рис.2. Электрофореграмма продуктов амплификации с маркером Sw421
тодике, рекомендованной авторами.
Продукты амплификации окрашивали флуоресцентным красителем GelRed и разделяли электрофорезом в 1,5% агарозном геле. Маркер молекулярных весов, используемый в работе, представляет 100bp.
Результаты и обсуждение
При оценке всех селекционных образцов на инфекционном фоне установлено, что большинство растений каждого из них устойчивы к бронзовости. Причем полная устойчивость наблюдалась у всех 7 растений гибрида F 1 Гилгал и 6 растений F 3 потомства Манон 1-7, а в потомствах F 2 Гилгал, F 2 Исфара и F 2 (Гилгал х 19-22) отмечено расщепление на устойчивые и восприимчивые растения (табл. 2).
Из таблицы 2 видно, что фенотипическое расщепление в двух F 2 потомствах Гилгал и Исфара близко к теоретически ожидаемому при моногенном контроле признака (3:1), χ2 (F 2 Гилгал) = 0,13 и χ2 (F 2 Исфара) = 0,008 меньше, чем χ2 теор. =3,84. В группу устойчивых входят доминантные гомозиготы и гетерозиготы. В потомстве F 2 (Гилгал х 19-22) восприимчивых растений больше, чем можно ожидать. Вероятно, это связано с малым числом растений.
Продукт амплификации ДНК с парой праймеров Sw5 -r2/ Sw5 -f2 составил около 540 п.н. и соответствует указанному авторами размеру маркера (Anong Shi et al., 2011), однако маркер в исследованных популяциях мономорфен и проявляется у всех растений томата, как у устойчивых, так и у восприимчивых. То есть пара праймеров маркера Sw5 -f2/ Sw5 -r2 не пригодна для
940 п.н.
R R R
Fl Гилгал
S К R R
940п.н.---
SCOn н
F2 (Гилгал х 19-22)
34 35 36 37 38 39 6
R R R S R R R R R
1S 16 17 18 19
S К К К
3 4 5 9 10 11 12 13 14
RRRRRRRRSSR
R R R S S
S R R R
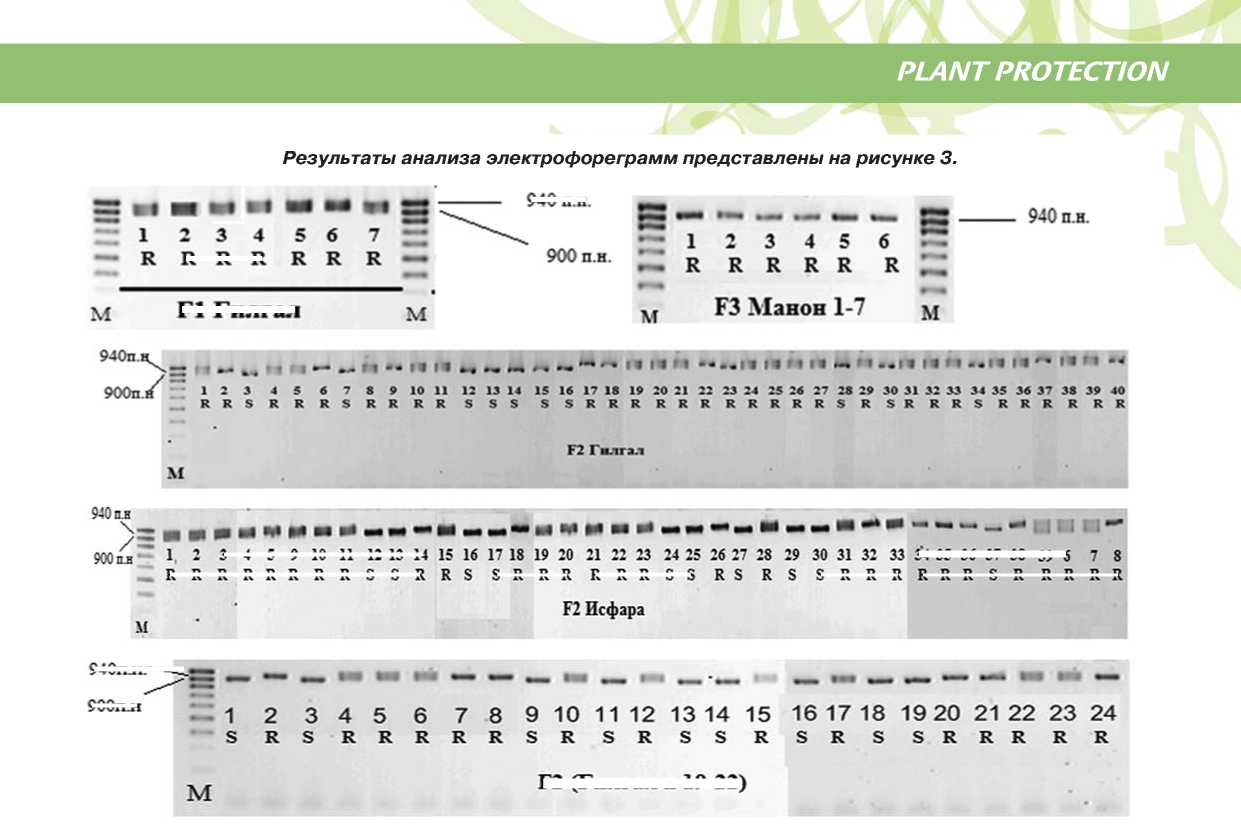
Рис. 3. Электрофореграмма изученных образцов томата
Примечание:
S-восприимчивый, R-устойчивый;
М- маркер молекулярного веса 100bp; п.н. - пар нуклеотидов
выявления устойчивых растений в анализируемых образцах.
Молекулярный маркер Sw-421 кодоминантный и локализуется на расстоянии 1,0 сМ от гена Sw5 в геноме вида L.peruvianum (Nascimento et al., 2009). Фрагмент ДНК размером 940 п.н. соответствует доминантному аллелю, а размером 900 п.н. – рецессивному. Присутствие обоих «бендов» говорит о гетерозиготности генотипа (рис. 2).
Из рисунка 3 видно, что все 7 растений гибрида F 1 Гилгал являются гетерозиготами Sw5sw5 , и все 6 растений потомства F 3 Манон 1-7 являются доминантными гомозиготами Sw5Sw5 .
В потомстве F 2 Гилгал и F 2 Исфара наблюдается расщепление на доминантные гомозиготы, рецессивные гомозиготы и гетерозиготы по аллелям гена Sw5 . У потомства F 2 Гилгал: 8 растений (№ 2, 6, 9, 17, 18, 22, 37, 40) имеют доминантный гомозиготный генотип Sw5Sw5 ; а генотип sw5sw5 отмечен у 11 растений (№ 3, 7, 12, 13, 14, 15, 16, 23, 28, 30, 34; остальные 21 растение (№ 1, 4 , 5, 8, 10, 11, 19, 20, 21, 24, 25, 26, 27, 29,
-
31, 32, 33, 35, 36, 38, 39) имеют гетерозиготный генотип ( Sw5sw5 ).
-
3. Проявление признака устойчивости томата к бронзовости, 2014, Москва
Генотипирование потомства F 2 Исфара (39 растений) по маркеру Sw421 показало, что имеется 9 растений с доминантным гомозиготным генотипом Sw5Sw5 (№ 8, 14, 18, 26, 32, 34, 35, 36, 38), 10 растений с рецессивным гомозиготным генотипом sw5sw5 (№ 12, 13, 16, 17, 24, 25, 27, 29, 30, 37), и 20 остальных растений (№1, 2, 3, 4, 5, 6, 7, 9, 10, 11, 15, 19, 20, 21, 22, 23, 28, 31, 33, 39) обладают гетерозиготным генотипом Sw5sw5 .
Сопоставление результатов фенотипической оценки устойчивости на инфекционном фоне и молекулярного генотипирования показало их полное соответствие (табл.3). Это подтверждает высокую эффективность молекулярного анализа с использованием праймеров SCAR Sw421-1/ Sw421-2.
В настоящее время в семеноводстве гетерозисных гибридов использование форм томата с признаком функциональной мужской стерильности (ФМС) в качестве материнских компонентов становится популяр-
|
Потомство |
№ раст. |
Генотип (по маркеру) |
Фенотип (на фоне) |
Потомство |
№ раст. |
Генотип (по маркеру) |
Фенотип (на фоне) |
Потомство |
№ раст. |
Генотип (по маркеру) |
Фенотип (на фоне) |
|
с; го с; 1— иГ |
1 |
+/- (R) |
уст. |
с; го с; 1— LL |
31 |
+/- (R) |
уст. |
СО ГО ГО е о X LL? |
4 |
+/- (R) |
уст. |
|
2 |
+/- (R) |
уст. |
32 |
+/- (R) |
уст. |
5 |
+/- (R) |
уст. |
|||
|
3 |
+/- (R) |
уст. |
33 |
+/- (R) |
уст. |
6 |
+/- (R) |
уст. |
|||
|
4 |
+/- (R) |
уст. |
34 |
-/- (S) |
восп. |
7 |
+/- (R) |
уст. |
|||
|
5 |
+/- (R) |
уст. |
35 |
+/- (R) |
уст. |
8 |
+/+ (R) |
уст. |
|||
|
6 |
+/- (R) |
уст. |
36 |
+/- (R) |
уст. |
9 |
+/- (R) |
уст. |
|||
|
7 |
+/- (R) |
уст. |
37 |
+/+ (R) |
уст. |
10 |
+/- (R) |
уст. |
|||
|
с; го с; 1— U? |
1 |
+/- (R) |
уст. |
38 |
+/- (R) |
уст. |
11 |
+/- (R) |
уст. |
||
|
2 |
+/+ (R) |
уст. |
39 |
+/- (R) |
уст. |
12 |
-/- (S) |
восп. |
|||
|
3 |
+/- (R) |
уст. |
40 |
+/+ (R) |
уст. |
13 |
-/- (S) |
восп. |
|||
|
4 |
+/- (R) |
уст. |
СМ см О) X с; го с; 1— LL? |
1 |
-/- (S) |
восп. |
14 |
+/+ (R) |
уст. |
||
|
5 |
+/- (R) |
уст. |
2 |
+/+ (R) |
уст. |
15 |
+/- (R) |
уст. |
|||
|
6 |
+/+ (R) |
уст. |
3 |
-/- (S) |
уст. |
16 |
-/- (S) |
восп. |
|||
|
7 |
+/- (R) |
уст. |
4 |
+/- (R) |
уст. |
17 |
-/- (S) |
восп. |
|||
|
8 |
+/- (R) |
уст. |
5 |
+/- (R) |
уст. |
18 |
+/+ (R) |
уст. |
|||
|
9 |
+/+ (R) |
уст. |
6 |
+/- (R) |
уст. |
19 |
+/- (R) |
уст. |
|||
|
10 |
+/- (R) |
уст. |
7 |
-/- (S) |
восп. |
20 |
+/- (R) |
уст. |
|||
|
11 |
+/- (R) |
уст. |
8 |
-/- (S) |
восп. |
21 |
+/- (R) |
уст. |
|||
|
12 |
-/- (S) |
восп. |
9 |
-/- (S) |
восп. |
22 |
+/- (R) |
уст. |
|||
|
13 |
-/- (S) |
восп. |
10 |
+/- (R) |
уст. |
23 |
+/- (R) |
уст. |
|||
|
14 |
-/- (S) |
восп. |
11 |
-/- (S) |
восп. |
24 |
-/- (S) |
восп. |
|||
|
15 |
-/- (S) |
восп. |
12 |
+/- (R) |
уст. |
25 |
-/- (S) |
восп. |
|||
|
16 |
-/- (S) |
восп. |
13 |
-/- (S) |
восп. |
26 |
+/+ (R) |
уст. |
|||
|
17 |
+/+ (R) |
уст. |
14 |
-/- (S) |
восп. |
27 |
-/- (S) |
восп. |
|||
|
18 |
+/+ (R) |
уст. |
15 |
+/- (R) |
уст. |
28 |
+/- (R) |
уст. |
|||
|
19 |
+/- (R) |
уст. |
16 |
-/- (S) |
восп. |
29 |
-/- (S) |
восп. |
|||
|
20 |
+/- (R) |
уст. |
17 |
+/- (R) |
уст. |
30 |
-/- (S) |
восп. |
|||
|
21 |
+/- (R) |
уст. |
18 |
-/- (S) |
восп. |
31 |
+/- (R) |
уст. |
|||
|
22 |
+/+ (R) |
уст. |
19 |
-/- (S) |
восп. |
32 |
+/+ (R) |
уст. |
|||
|
23 |
-/- (S) |
восп. |
20 |
+/+ (R) |
уст. |
33 |
+/- (R) |
уст. |
|||
|
24 |
+/- (R) |
уст. |
21 |
+/+ (R) |
уст. |
34 |
+/- (R) |
уст. |
|||
|
25 |
+/- (R) |
уст. |
22 |
+/- (R) |
уст. |
35 |
+/+ (R) |
уст. |
|||
|
26 |
+/- (R) |
уст. |
23 |
+/- (R) |
уст. |
36 |
+/+ (R) |
уст. |
|||
|
27 |
+/- (R) |
уст. |
24 |
+/+ (R) |
уст. |
37 |
-/- (S) |
восп. |
|||
|
28 |
-/- (S) |
восп. |
1 |
+/- (R) |
уст. |
38 |
+/+ (R) |
уст. |
|||
|
29 |
+/- (R) |
уст. |
2 |
+/- (R) |
уст. |
39 |
+/- (R) |
уст. |
|||
|
30 |
-/- (S) |
восп. |
3 |
+/- (R) |
восп. |
Примечание: +/+ (R): генотип Sw5Sw5; +/- (R) - генотип Sw5sw5; -/-(S)- генотип sw5sw5
Список литературы Селекция линий томата (lycopersicon esculentum), устойчивых к бронзовости
- Джалилов Ф.С., Ахатов Е.А. Защита томата от болезней.//Картофель и овощи. -2014, -№5. -С. 13-15.
- Джое Е.А., Енга Лычева Н.А., Пышная О.Н., Мамедов М.И. Виды и межвидовые гибриды рода Capsicum L. -источники устойчивости к вирусу бронзовости томата в условии защищенного грунта Московской области//Селекция и семеноводство овощных культур -сб. науч. тр./Всерос.НИИ селекции и семеноводства овощных культур. -М., 2009. -Вып. 42,-С. 64-74.
- Мамедов М.И., Пышная О.Н., Харченко В.А. Использование ФМС в гибридном семеноводстве томата и перца сладкого: Метод рекомендации/Всерос.НИИ селекции и семеноводства овощных культур. -М., 2000. -11с.
- Подвицкий Т.А., Галиновский Д.В., Тарутина Л.А. Источники устойчивости томата (род Lycopersicon) к возбудителям хозяйственно значимых заболеваний.//Известия национальной академии наук Беларуси. -2013. -№ 4. -С. 45-50.
- Ainong Shi, Richard Vierling, Richard Grazzini, Pegyin Chen, Homer Caton, Dilip Panthee. Identification of molecular markers for Sw-5 gene of tomato spotted wilt virus resistance.//American Journal Biotechnology and Molecular Sciences. -2011. -№1(1). -P.8-16.
- Boiteux L.S., Giodano L. de B. Genetic basis of resistance against two Tospovirus species in tomato (Lycopersicon esculentum).//Euphytica. -1993. -№ 71. -P. 151 -164.
- Giordano L. De, Avila A.C. De, Charchar J.M., Boitex L.S. A tospovirus -resistant processing tomato cultivar adapted to trop-dival environments.//Hort. Sci. -2000. -№ 35. -P. 1368-1370.
- Naidu R.A., Sherwood J.L., Deom C.M. Characterization of a vector -non -transmissible isolate of tomato spotted wilt virus.//Plant Pathology. -2008. -№ 57. -P. 190-200.
- Nascimentol. R. D., Maluf W. R., Figueira A.R. et al. Marker assisted identification of tospovirus resistant tomato genotypes in segregating progenies.//Sci. agric. (Piraciacaba, Braz.). -2009. -V.66. -№3. -P.298-303.
- Rosello S., Diez M.J., Nuez F. Genetics of tomato spotted wilt virus resistance coming from Lycopersicon peruvianum.//European Journal of Plant Pathology. -1998. -№5. -P. 499-509.
- Soler S., Cebolla-Cornejo J., Nuez F. Control of diseases induced by tospoviruses in tomato: an update of the genetic approach.//Phytopathol Mediterr. -2003. -№42. -P. 207-219.
- Steven M.R, Scott S.J., Gergerich R.C. Inheritance of a gene for resistance to tomato spotted wilt virus (TSWV) from Lycopersicon peruvianum Mill.//Euphytic. -1992. -№59. -P. 9-17.

