Семафорин Sema4D в регуляции TFH-подобных клеток
Автор: Куклина Е.М., Некрасова И.В., Валиева Ю.В.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Медико-биологические науки
Статья в выпуске: 4, 2016 года.
Бесплатный доступ
Изучена роль эндогенного семафорина Sema4D в контроле активности циркулирующих фолликулярных Т-хелперных клеток (CD4 CXCR5 Т-лимфоцитов). Показано участие Sema4D в экспрессии этими клетками функциональной молекулы PD-1, а также в Т-зависимой дифференцировке В-лимфоцитов в совместной Т-/В-клеточной культуре в ответ на поликлональную активацию Т-лимфоцитов. Представленные данные демонстрируют новый потенциальный механизм Sema4D-зависимой регуляции гуморального иммунного ответа, связанный с непосредственным участием семафорина в дифференцировке В-лимфоцитов, поддерживаемой фолликулярными Т-хелперами.
Фолликулярные т-хелперы, дифференцировка в-лимфоцитов
Короткий адрес: https://sciup.org/147204801
IDR: 147204801 | УДК: 612.018
Текст научной статьи Семафорин Sema4D в регуляции TFH-подобных клеток
Фолликулярные хелперные Т-клетки (Т follicular helper cells. Tfli) - субпопуляция CD4'T-лимфоцигов, ответственная за формирование эффективного гуморального иммунного ответа, предполагающего клональную экспансию В-лимфоцитов, переключение классов иммуноглобулинов и «созревание» их аффинности к антигену [Oi. 2016]. Эти процессы протекают в зародышевых центрах вторичных лимфоидных органов и завершаются образованием плазмобластов - активно пролиферирующих и продуцирующих иммуноглобулины клеток, которые, покидая зародышевые центры, финально дифференцируются в плазматические клетки или В-клетки памяти. Маркеры Tfh тесно связаны с функциями этих клеток: хемокиновый рецептор CXCR5 нужен для хоминга Т-лимфоцитов в В-клеточные фолликулы, а функциональная молекула PD-1 регулирует формирование зародышевых центров, выживание В-лимфоцитов и селекцию высокоаффинных плазматических клеток, а также продукцию интерлейкина 21 (IL-21) [Good-Jacobson el ah, 2010: Oi, 2016]. Циркулирующие Till, так называемые ТДь подобные клетки, имеют общие черты с фолликулярными Т-хелперами зародышевых центров [Feng el ah. 201L Morita el ah, 2011]3 поэтому анализ Tlh-подобных клеток периферической крови рассматривается как эффективный альтернативный подход к изучению их аналогов в зародышевых центрах [Т follicular . 2015].
Семафорин Seina4D - многофункциональная молекула, играющая важную роль в процессах аксонального наведения, а также в ангиогенезе и иммунорегуляции [Zhang el al.♦ 2013]. В иммунной системе основным источником Sema4D являются Т-лимфоциты [Kumanogoh el ah, 2002]. Они экс-
(С Куклина Е. М., Некрасова И. В> Валиева Ю. В.3 2016
прессируют семафорив на мембране и частично «сбрасывают» его в ответ на активацию [Wang et al., 2001]* При этом растворимый Sema4D сохраняет функции мембранной молекулы [Wang et aL 2001]* Основной рецептор для Sema4D в иммунной системе* CD72* экспрессируется преимущественно В-лимфоцитами и играет важную роль в ответе этих клеток на антиген [Kumanogoh et aL 2000], поэтому7 особый интерес вызывает роль семафори-на в Т-ТВ-клсточных взаимодействиях* В первую очередь* это относится к Tfh-зависимой дифференцировке В-лимфоцитов* Цель настоящей работы -определить вклад эндогенного Sema4D в регуляцию активности Tlh-подобных клеток in vitro, в совместной Т-/В-клеточной культуре на фоне поликлональной активации Т-лимфоцитов* В частности* мы оценили экспрессию функционального маркера PD-1 ТП1-подобными клетками в культуре и эффективность Tlh-зависимой дифференцировки В-лимфоцитов на фоне блокады семафорина.
Материал и методы исследования
Результаты и их обсуждение
Процессы Т-зависимой В-клеточной активации исследовали на модели in vitro. предполагающей совместное культивирование Т-лимфоцитов с аутологичными В-клетками в условиях поликлональной активации Т-лимфоцитов [Т follicular ..** 2015J. При этом активность Tfh-подобных клеток оценивали как косвенно* по экспрессии молекулы PD-L участвующей в реализации функций этих клеток* так и напрямую, по дифференцировке В-лимфоцитов* индуцируемой фолликулярными Т-хелперами*
Культивирование CD41 Т-лимфоцитов в присутствии В-клеток не приводило к статистически значимым изменениям содержания Tfh-подобных (CD4CXCR5 -) клеток ни в спонтанном варианте* ни в случае активации* и блокада Sema4D не оказывала влияния на эти процессы (рис* 1). Анализ функциональной молекулы PD-1 выявил повышение ее экспрессии на мембране CD4'CXCR5'T-лимфоцитов в ответ на активацию, причем на фоне блокады семафорина повышение было недостоверным (рис. I), указывая на участие Sema4D в реализации данного эффекта.
Одновременно с экспрессией PD-1 оценивали непосредственную хелперную активность Tfh-подобных клеток, а именно - способность индуцировать дифференцировку' В-лимфоцитов в плаз-мобласты, которая сопровождается характерными фенотипическими изменениями - появлением и последовательным усилением экспрессии на мембране гликопротеина CD3S. а также утратой В-клеточного маркера CD20 [Jourdan et al . 2011].
Совместное культивирование Т-/В-лимфоцитов сопровождалось значительным увеличением количества плазмобластов (С019'С020 С038'-клеток) в ответ на поликлональную активацию Т-лимфоцитов (рис. 2). причем на фоне блокады Sema4D этот показатель статистически значимо снижался.
Полученные данные свидетельствуют об участии Sema4D в ключевом этапе Т-зависимой дифференцировки В-л им фоцитов. форм ирова НИИ плазмобластов* и о том. что одним из механизмов реализации эффекта семафорина является регуляция активности Tfh-подобных клеток* в частности, повышение экспрессии этими клетками функциональной молекулы PD-L которая защищает В-лимфоциты от апоптоза, поддерживает селекцию высокоаффинных плазматических клеток; а также 2016].
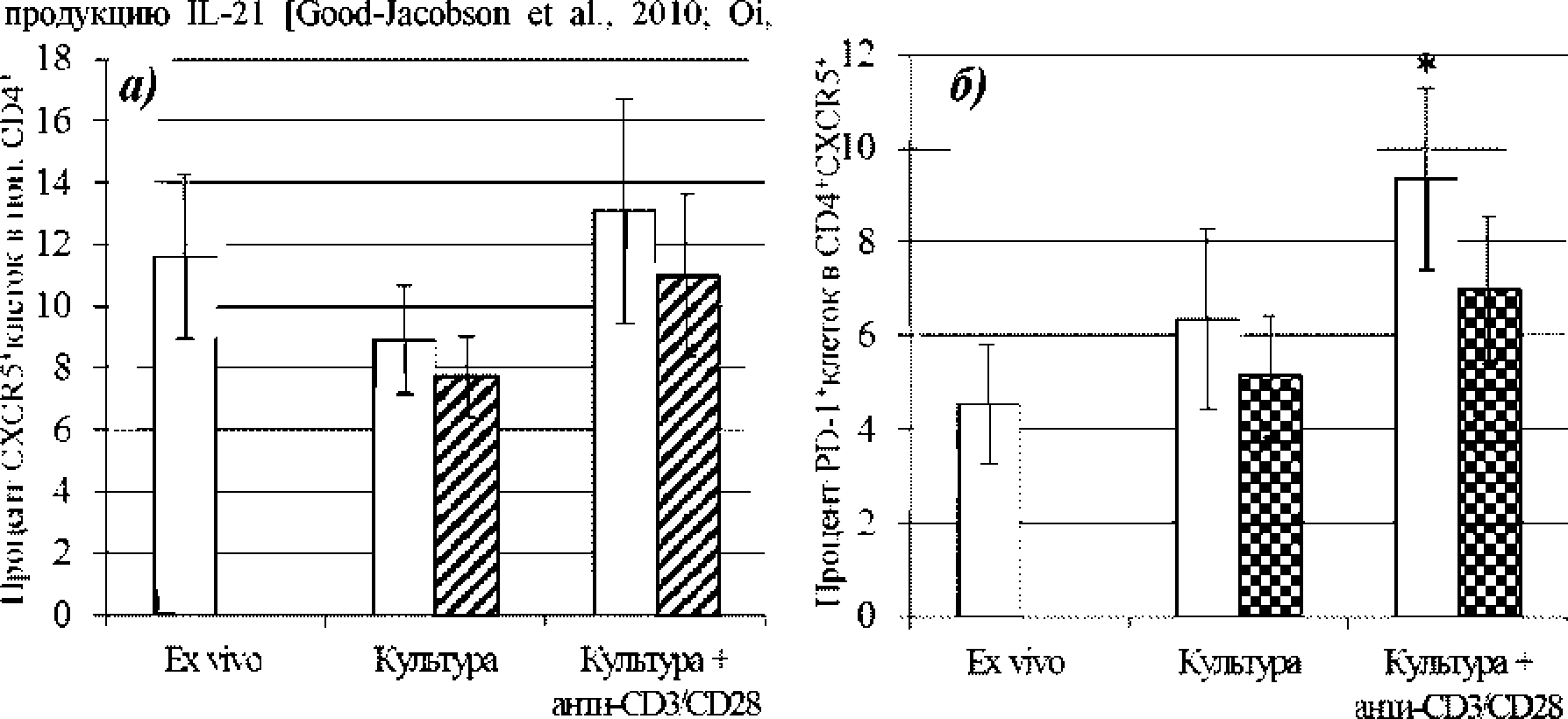
Рис. I* Характеристика Tfh-подобных CD41 Т-лимфоцитов ex vivo и в совместной Т-/В-клеточной культуре на фоне поликлональной активации Т-лимфоцитов:
а) содержание СХСК5+-клеток в популяции СГМ+Т-лимфощтгов; 6) экспрессия PD-1 СХСК5+С1)4"ьТ-лимфощ1таьш. Незапприхованные столбцы - пробы без блокатора; заштрихованные столбцы - на фоне блокады Sema4D. * - р < 0,05 (сопоставление с соответствующим показателем без активации)
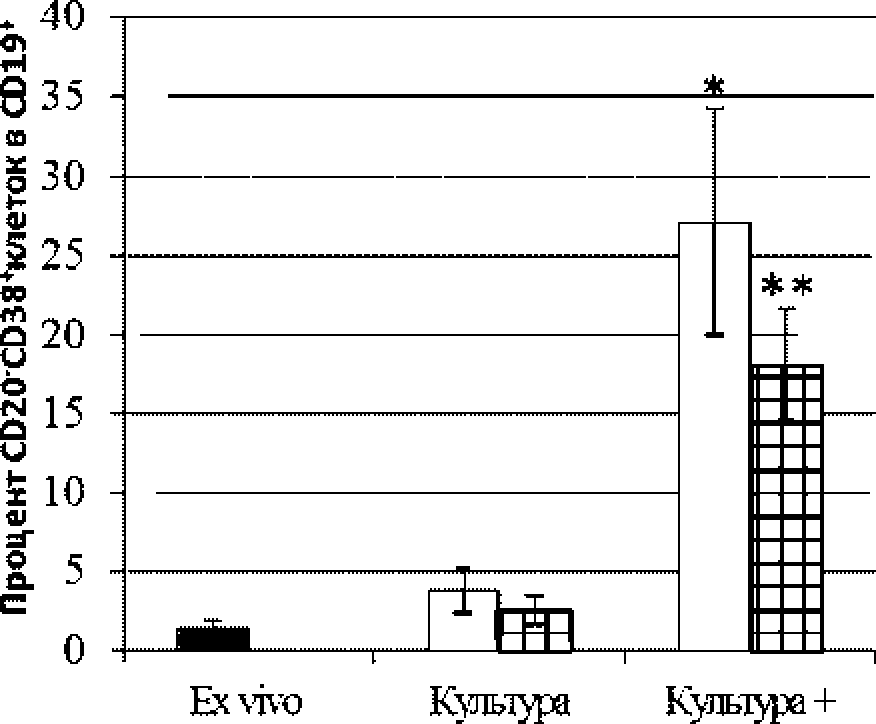
aHni Рис. 2. Уровень плазмобластов ex vivo и в Т-/В-клеточной культуре. Незапприхованные столбцы - пробы без блокатора; заштрихованные столбцы - на фоне блокады Sema4D, * -р < 0,05 (сопоставление с соответствующим показателем без активации); ** -р <0.05 (сопоставление с соответствующим показателем без блокады Seina4l)) Исследование выполнено при финансовой поддержке РФФИ в рамках научного проекта № 15-04-05694.
Список литературы Семафорин Sema4D в регуляции TFH-подобных клеток
- Feng J. et al. High frequency of CD4+CXCR5+TFH cells in patients with immune-active chronic hepatitis B//PLoS One. 2011. Vol. 6, № 7. P. 1-9
- Good-Jacobson K.L. et al. PD-1 regulates germinal center B cell survival and the formation and affinity of long-lived plasma cells//Nat. Immunol. 2010. Vol. 11, № 6. P. 535-542
- Jourdan M. et al. Characterization of a transitional preplasmablast population in the process of human B cell to plasma cell differentiation//J. Immunol. 2011. Vol. 187, № 8. P. 3931-3941
- Kumanogoh A. et al. Identification of CD72 as a lymphocyte receptor for the class IV semaphorin CD100: a novel mechanism for regulating B cell signaling//Immunity. 2000. Vol. 13, № 5. P. 621-631
- Kumanogoh A. et al. Requirement for the lymphocyte semaphorin, CD100, in the induction of antigen-specific T cells and the maturation of dendritic cells//J. Immunol. 2002. Vol. 169, № 3. P. 11751181
- Morita R. et al. Human blood CXCR5+CD4+T cells are counterparts of T follicular cells and contain specific subsets that differentially support antibody secretion//Immunity. 2011. Vol. 34, № 1. P. 108-121
- Oi H. T follicular helper cells in space-time//Nature. 2016. Vol. 16. P. 612-625
- T follicular helper cells. Preface/eds. M. Espeli, Ml. Linterman//Methods in Molecular Biology. 2015. Vol. 1291. P. 209-226
- Wang X. et al. Functional soluble CD100/Sema4D released from activated lymphocytes: possible role in normal and pathologic immune responses//Blood. 2001. Vol. 97, № 11. P. 3498-3504
- Zhang Y. et al. Sema 4D/CD100-plexin B is a multifunctional counter-receptor//Cell. Mol. Immunol. 2013. Vol. 10, № 2. P. 97-98


