Семиохимические взаимодействия между фитофагами и фитопатогеном Pseudomonas syringae pv. tomato на томатах (Solanum lycopersicum L.)
Автор: Степанычева Е.А., Петрова М.О., Щеникова А.В., Черменская Т.Д.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Фитопатология. Иммунитет и защита растений
Статья в выпуске: 5 т.51, 2016 года.
Бесплатный доступ
До недавнего времени индуцированную устойчивость к патогенам и фитофагам рассматривали отдельно и только в последние годы обратили внимание на возможность возникновения приобретенной кроссрезистентности. Целью настоящей работы стало изучение характера химического взаимодействия растений с фитопатогенными микроорганизмами и членистоногими фитофагами, занимающими общую экологическую нишу. Показана возможность взаимно-модифицирующего влияния фитофагов и фитопатогена на количественные и качественные показатели защитного ответа томата. В качестве консументов первого порядка были выбраны опасные фитофаги и фитопатогены культур защищенного грунта (калифорнийский трипс Frankliniella occidentalis, тепличная белокрылка Trialeurodes vaporariorum, возбудитель бактериальной крапчатости томатов Pseudomonas syringae pv. tomato ). Критериями оценки были изменения поведенческой реакции фитофагов и их демографических показателей, а для патогена - степень развития, оцениваемая в баллах. В условиях свободного выбора растения томата, предварительно зараженные P. syringae, оказались более предпочтительны для трипса, чем интактные, в то время как для белокрылки эти группы растений были равнозначны. Привлечение трипса к зараженным растениям могло быть обусловлено появлением и увеличением содержания таких летучих веществ, как 2-метилбутановая кислота и додекан, служащих компонентами феромонов и алломонов трипсов. При первичном повреждении растений трипсом и белокрылкой были выявлены различия в интенсивности развития патогена в зависимости от индуктора-фитофага (повреждение трипсом подавляло заболевание, а белокрылкой - создавало благоприятные условия для его развития). Ингибирование развития патогена на растениях, поврежденных трипсом, можно объяснить увеличением содержания таких химических соединений, как (Е)-β-оцимена и α-гумулена, которые входят в состав многих эфирных масел и экстрактов растений, обладающих антимикробной активностью. Содержание этих же веществ повышалось в растениях в ответ на инокуляцию патогеном. Полученные результаты свидетельствуют как о различиях, так и о некотором сходстве сигнальных путей и механизмов защитной реакции у растений в ответ на индукцию фитофагами или фитопатогенами. Выявлены индуцированная устойчивость и частичный антагонизм (вплоть до полностью противоположного эффекта - снижения устойчивости растений) по отношению к одной из групп консументов. Тщательная оценка характера ответных реакций, биохимических и молекулярно-генетических принципов действия позволит определить их место в стратегии экологизированной защиты растений. Такие исследования могут стать основой для создания средств защиты растений с использованием синтетических элиситоров, обладающих различной степенью селективности действия по отношению к определенным группам биотических агентов.
Калифорнийский трипс, оранжерейная белокрылка, индуцированный иммунитет
Короткий адрес: https://sciup.org/142213977
IDR: 142213977 | УДК: 635.64:632.937 | DOI: 10.15389/agrobiology.2016.5.731rus
Текст научной статьи Семиохимические взаимодействия между фитофагами и фитопатогеном Pseudomonas syringae pv. tomato на томатах (Solanum lycopersicum L.)
Один из общепризнанных подходов в экологизации растениеводства — снижение пестицидной нагрузки на компоненты агробиоценоза. Решение обозначенной проблемы связывают с более полным изучением адаптивного потенциала растений, в частности устойчивости к основным биотическим и абиотическим стрессорам. Выбирая соответствующий сорт, важно использовать приемы, способствующие максимальной мобилизации защитных сил растения — индукции неспецифической устойчивости. Существуют достаточно убедительные данные об общих механизмах такой защиты, называемой приобретенным иммунитетом и обеспечивающей резистентность при повторном поражении. Индуцированная устойчивость может носить как локальный, так и системный характер, проявляясь в удаленных от места первичной инфекции частях и органах растений. Это явление, наиболее полно изученное для системы растение—фитопатоген, связано, в частности, с активацией генов защиты и изменением обмена веществ в сторону, неблагоприятную для патогена. Имеются убедительные данные о проявлении системной перекрестной устойчивости к грибным, бактериальным и вирусным патогенам после предшествующего или одновременного контакта с родственными и неродственными возбудителями (1, 2).
Сходная способность повышать устойчивость к фитофагам после предварительного повреждения конспецифическими или гетероспецифиче-скими видами членистоногих была установлена значительно позже (3). В настоящее время накоплен обширный материал, подтверждающий вовлеченность различных защитных механизмов в эти процессы (4-6). Индукция летучих соединений — важная и быстро проявляющаяся реакция растений на повреждения фитофагами. Эти соединения играют значительную роль в сложных взаимодействиях между различными трофическими уровнями, выполняя функцию репеллентов, детеррентов и т.д. (7, 8). Химический анализ позволил идентифицировать некоторые вещества, обеспечивающие индуцированную устойчивость растений. Такие соединения характеризуются отсутствием у них прямого токсического действия на вредный объект, обеспечивая защитный эффекта через влияние на регуляторные механизмы (9-12).
До недавнего времени индуцированную устойчивость к патогенам и фитофагам рассматривали по отдельности, и только в последние годы ученые обратили внимание на возможность возникновения приобретенной перекрестной резистентности. Имеются достаточно противоречивые данные о взаимном влиянии индуцированных изменений, вызванных повреждением фитофагами или фитопатогенами, на организмы, сосуществующие в одном биотопе (13-16).
Нами впервые проведено изучение характера ответных реакций растений на одновременное воздействие нескольких наносящих повреждение агентов с разными характеристиками локализации повреждений и неодинаковыми механизмами повреждающего воздействия.
Нашей задачей было изучение характера химического взаимодействия растений с фитопатогенными микроорганизмами и членистоногими фитофагами как средообразующими элементами различной природы, занимающими общую экологическую нишу.
Методика . Эксперименты проводили со слабоустойчивым сортом томата ( Solanum lycopersicum L.) Белый налив. Растения выращивали индивидуально в пластиковых стаканчиках при температуре 24-26 ° С с регулярным поливом и подкормками комплексным удобрением. Консументами 1-го порядка были калифорнийский трипс Frankliniella occidentalis Pergande и тепличная белокрылка Trialeurodes vaporariorum Westwood — опасные вредители культур закрытого грунта; культуру фитопатогена Pseudomonas syrin-gae pv. tomato (возбудитель бактериальной крапчатости томатов) получили из Российского государственного аграрного университета—МСХА им. К.А. Тимирязева (г. Москва). Эти же объекты использовались как индукторы.
При оценке защитной реакции томата на повреждающее воздействие фитопатогеном растения в фазу 3-4 настоящих листьев инокулировали патогеном P. syringe (106 кл/мл). Суспензией патогена обрабатывали два нижних настоящих листа, предварительно повреждая их песком. Аналогичную процедуру проводили с контрольными растениями, опрыскивая их после повреждения водой. В дальнейшем использовали растения в фазу 5-6 листьев с баллом повреждения 2,2-2,5 (по 5-балльной шкале). Перед экспериментом у пораженных и интактных растений удаляли 2 нижних поврежденных листа. Подготовленные таким образом растения попарно (опыт + контроль) помещали в стеклянные цилиндры (5 л) и выпускали туда самок калифорнийского трипса или имаго тепличной белокрылки (из расчета 30 особей на растение). Через 2 сут учитывали распределение насекомых на растениях. После удаления имаго томаты помещали в изо-732
лированные боксы для предотвращения повторного заселения. Численность дочернего поколения трипсов учитывали при отрождении личинок, белокрылки — при появлении личинок 2-го возраста. Эффективность ответа оценивали по изменению численности потомства фитофагов.
При изучении влияния повреждения калифорнийским трипсом и тепличной белокрылкой на развитие заболевания растения в фазу 2-3 настоящих листьев по одному помещали в стеклянные цилиндры и заселяли их взрослыми особями вредителей (30 особей на растение). Через 1 сут (в варианте с белокрылкой через 2 сут) имаго удаляли, а растения оставляли на 5 либо 7 сут (для нанесения повреждений развившимися личинками соответственно трипса и белокрылки). Нагрузка составляла для трипса 13,8±1,47, для белокрылки — 25,4±4,59 личинки на растение. После подсчета личинок (в варианте с трипсом их удаляли) на поврежденные и интактные растения наносили патоген P. syringe (106 кл/мл). В контроле верхние листья предварительно травмировали песком. Оценку степени по-врежденности растений проводили через 7 сут после инокуляции.
Для экстракции летучих веществ отбирали верхние листья растений томата из соответствующих серий экспериментов. Измельченный материал (навеска 1 г) помещали в конические колбы объемом 50 мл и добавляли гексан до верхнего края растительной массы. Экстракцию проводили в ультразвуковой ванне Град 13-35 (ООО «Град-Технолоджи», Россия) 15 мин. Экстракт декантировали и фильтровали через слой безводного сульфата натрия. Гексан отгоняли под вакуумом при 35 ° С. Экстракт концентрировали до 500 мкл под азотом и хранили при - 18 ° С.
Образцы анализировали с использованием газовой хроматографии— масс-спектрометрии (ГХ-МС) на приборном комплексе GCMS-QP5000 («Shimadzu Corporation», Япония). Для идентификации компонентов сопоставляли их масс-спектры по времени удерживания с референтными. Регламент газохроматографического разделения: температура испарителя 250 ° С; ввод пробы без деления потока (0,2 мин); температурная программа — начальная температура колонки (DB-5) 40 ° С, скорость подъема температуры 10 ° С/мин, конечная температура колонки 270 ° С, выдержка при конечной температуре 15 мин; газ-носитель — гелий, скорость прохождения газа-носителя через колонку — 1 мм3/мин; температура интерфейса и детектора 280 ° С. Регламент масс-спектрометрического анализа: энергия ионизирующих электронов 70 эВ, температура интерфейса и ионного источника 280 ° С, режим идентификации — по полному ионному току.
Эксперименты выполняли в 10-кратной повторности. Данные каждого эксперимента проанализировали с помощью ANOVA. Различия считали достоверными при P < 0,05.
Результаты . Принимая во внимание, что следствием развития защитной реакции растения может быть отказ фитофага от контакта с растением и использования его для питания и яйцекладки, в качестве критериев при оценке индуцированной устойчивости использовали изменения поведенческой реакции фитофагов и их демографических показателей, а для патогена — степень развития болезни.
Эксперименты по учету защитной реакции томата на повреждающее воздействие фитопатогеном показали, что в условиях свободного выбора самки калифорнийского трипса для питания и откладки яиц предпочитали растения, ранее пораженные патогеном. Число взрослых особей трипса на пораженных растениях в 3,0 раза превышало этот показатель в контроле. Такое распределение самок привело к увеличению численности потомства в опыте в 1,8 раза по сравнению с контролем. В варианте с бело-
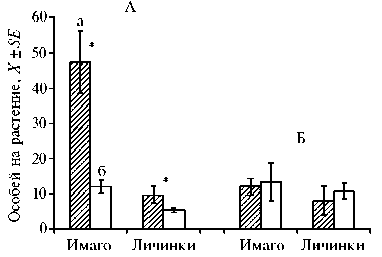
Рис. 1. Демографические показатели, отражающие поведенческие реакции калифорнийского трипса Frankliniella occidentalis Pergande (А) и тепличной белокрылки Trialeurodes va-porariorum Westwood (Б) на растениях слабоустойчивого сорта томата ( Solanum lycopersicum L.) Белый налив, поврежденных Pseudomonas sy-ringae : а — опыт, б — контроль. Общий объем выборки — 600 особей, число повторностей — 10. Звездочкой отмечены результаты, достоверные при Р ≤ 0,05 (лабораторные опыты).
крылкой достоверных различий по привлечению имаго или численности дочернего поколения не наблюдали (рис. 1).
При заражении томата P. sy-ringae в растениях появлялся 2,2-ди-метилгептан, 2-метилбутановая кислота, 3-метилоктан, додекан, стеариновая кислота; увеличивалось содержание 1,4-диметилциклогексана, (E)- β -оцимена и α -гумулена в 2,0 раза, бутилизобутилфталата и дибутилфталата — соответственно в 2,6 и 8,7 раза (по сравнению с контролем), линалоола, пальмитиновой кислоты, линоленовой кислоты — в 1,3 раза.
Изучая влияние первичного повреждения растений томатов личинками и имаго калифорнийского трипса на развитие заболевания, от- мечали системную индуцированную устойчивость растений в опыте. Сред-
невзвешенный балл поражения верхних листьев на поврежденных фитофагом растениях оказался в 3,0 раза ниже, чем на интактных. Белокрылка, наобо- рот, не проявила свойства индуктора устойчивости у томата: достоверное превышение балла поражения в опыте было 1,8-кратным (рис. 2).
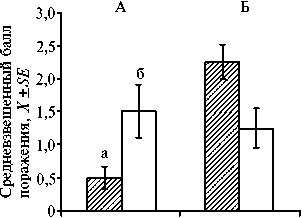
Рис. 2. Развитие фитопатогена Pseudomonas syringae на растениях слабоустойчивого сорта томата ( Solanum ly-copersicum L.) Белый налив, поврежденных калифорнийским трипсом Fran-kliniella occidentalis Pergande (А) и тепличной белокрылкой Trialeurodes va-porariorum Westwood (Б): а — опыт, б — контроль. Общий объем выборки — 600 особей, число повторностей — 10. Звездочкой отмечены результаты, достоверные при Р ≤ 0,05 (лабораторные опыты).
При повреждениях трипсом в растениях увеличивалось содержание β -оцимена и α -гумулена в 2,0 раза, α -терпинена — в 1,7 раза, сабинена — в 1,2 раза, диэтилфталата и диизооктилфталата — более чем в 5 раз, 9-октадеценола — в 2,0 раза, диизобутилфталата, дибутилсебацината, дибутилфталата — в 1,2 раза (по сравнению с контролем). В случае повреждения белокрыл-кой появлялся цимол, мирцен, метилсали-цилат, увеличивалось количество α -пинена.
Следует отметить, что растения в процессе вегетации сталкиваются с разнообразными внешними воздействиями, которые индуцируют широкий спектр ответных химических реакций, способных оказывать как синергетический, так и антагонистический эффект. Поэтому изучение характера такого ответа при взаимодействии растений с несколькими группами гетеротрофных консументов — членистоногими фитофагами и патогенными микроорганизмами, которые имеют разную природу, но присутствуют в одной трофической нише, весьма актуально. Кроме того, в условиях обычно наблюдаемого одновременного или поочередного воздействия на растение фитофагов и возбудителей болезней возникает особая необходимость в изучении влияния этих биологических индукторов друг на друга.
Анализ литературы показывает возможность взаимно модифици- рующего влияния фитофагов и фитопатогенов как на количественные, так и на качественные показатели защитного ответа растения. Так, повреждение растений арбуза трипсом и тлей предотвращает развитие на них гриба Colletotrichum orbiculare (17), щавелевый листоед Gastrophysa viridula индуцирует устойчивость растений к фитопатогенам Ramularia rubella и Venturia rumicis (14). Питание гусениц Pieris rapae на растениях арабидопсиса Arabidopsis thaliana достоверно снижает степень развития заболеваний, вызванных бактериальными патогенами P. syringae pv. tomato и Xanthomonas campestris pv. armoraciae, но не вызывает устойчивости к развитию гриба Alternaria brassicicola (18). На томатах присутствие гусениц Helicoverpa zea негативно сказывается как на самой совке (при повторном заселении), так и на развитии P. syringae pv. tomato. На тех же томатах инокуляция P. syringae вызывает системную индуцированную устойчивость и к конспецифиче-скому виду патогена, и к таким видам совок, как H. zea и Spodoptera exigua. Диаметрально противоположное действие на фитофагов с разным типом питания оказывает поражение томатной мозаикой, когда создаются благоприятные условия для гусениц S. exigua (увеличение массы тела) и в то же время подавляется размножение тли Myzus persicae (16, 19).
Ингибирование развития патогена на растениях, поврежденных трипсом, может объясняться увеличением содержания определенных химических соединений. В частности, (Е)- β -оцимен и α -гумулен входят в состав многих эфирных масел и экстрактов растений, обладающих антимикробной активностью (20-22). Терпеноид α -терпинен значительно подавляет рост грибов Sporothrix, Ceratocystis minor (23). Сабинен проявлял антимикробную активность (24, 25). Диэтилфталат ингибирует рост Rhizobium vitis и Bacillus subtilis (26). Другие эфиры фталевых кислот показали выраженную антибактериальную и антигрибную активность против трех грамположительных и двух грамотрицательных бактерий и трех патогенных грибов (27).
Сложнее интерпретировать результаты химического анализа растений, поврежденных белокрылкой, у которых балл поражения P. syringae достоверно выше контроля. Вероятно, большое значение имеет количество выделяемых соединений. Несмотря на то, что монотерпены обладают антимикробной активностью, было установлено, например, что o-цимен (цимол) в дозе 50 и 150 ppm способствовал более быстрому росту некоторых оомицетов (28).
Накопленные к настоящему времени данные свидетельствуют о способности биологических индукторов существенно изменять характер метаболизма растений, что проявляется или в усилении продукции ранее синтезируемых интактными растениями вторичных метаболитов, или в синтезе de novo ряда не имевшихся ранее в этом растении защитных веществ (летучих или экстрагируемых соединений). Вероятно, каждый вид патогена или фитофага запускает различные защитные механизмы и индуцирует определенные химические реакции в растениях.
В наших экспериментах в условиях свободного выбора растения, предварительно зараженные P. syringae, были более предпочтительны для калифорнийского трипса, чем интактные, в то время как для белокрылки эти группы растений оказались равнозначными. Сопоставление данных о влиянии повреждения растений трипсом и белокрылкой позволило выявить различия в интенсивности развития патогена в зависимости от индуктора-фитофага (повреждение трипсом подавляло заболевание, белокрыл-кой — создавало благоприятные условия для его развития). Возможно, это связано с особенностями воздействия индукторов (фитофагов и фитопатогена) на ткани-мишени и, как следствие, с характером ответных реакций растений, что проявляется в неодинаковой динамике накопления синтезируемых до этого веществ и появления новых.
Привлечение трипса к зараженным растениям может быть обусловлено появлением и увеличением содержания некоторых летучих веществ. Так, 2-метилбутановая кислота и додекан являются компонентами феромонов и алломонов трипсов (29, 30). Значительный электроантенно-графический ответ калифорнийского трипса был зафиксирован на α -гу-мулен (31), а (E)- β -оцимен был определен как минорный компонент с синергетической активностью в составе агрегационного феромона этого вредителя (32). Кроме того, установлено, что трипс Cycadothrips chadwicki ( Thysanoptera : Aeolothripidae ) привлекается (E)- β -оцименом (33). Линалоол и линоленовая кислота обнаружены в хризантемах — кормовых растениях для калифорнийского трипса, также считается, что именно линалоол, обладающий запахом, ответствен за привлечение насекомого (34, 35). Дибутилфталат характеризуется слабым фруктовым запахом, который может привлекать насекомых, а бутил-изобутилфталат обнаружен у некоторых цветущих растений (36).
Наше сопоставление данных о химическом составе растений томата выявило общие закономерности проявления последствий поражения патогеном и калифорнийским трипсом. В обоих случаях зарегистрировано значительное увеличение содержания (E)- β -оцимена, α -гумулена, фталатов.
Таким образом, полученные нами результаты свидетельствуют как о различиях, так и о некотором сходстве сигнальных путей и механизмов защитной реакции у растений в ответ на индукцию фитофагами или фитопатогенами. Выявлена как индуцированная устойчивость, так и частичный антагонизм (вплоть до полностью противоположного эффекта — снижения устойчивости растений) по отношению к одной из групп консументов. Вероятно, характер ответных защитных реакций растений зависит от систематической принадлежности биотических агентов и может быть направлен как на конспецифический, так и на гетероспецифический вид. Углубленное изучение индуцируемых защитных реакций позволит определить их экологическую роль, принцип действия биохимических и молекулярно-генетических механизмов и создать основу стратегии для разработки синтетических элиситоров с различной селективностью в отношении определенных групп биотических агентов.
Список литературы Семиохимические взаимодействия между фитофагами и фитопатогеном Pseudomonas syringae pv. tomato на томатах (Solanum lycopersicum L.)
- Duijff B.J., Pouhair D., Olivain C., Alabouvette C., Lemanceau P. Implication of systemic induced resistance in the suppression of Fusarium wilt of tomato by Pseudomonas fluorescens WCS417r and by nonpathogenic Fusarium oxysporum Fo47. Eur. J. Plant Pathology, 1998, 104: 903-910.
- Ran L.X., Li Z.N., Wu G.J., van Loon L.C., Bakker P.A.H.M. Induction of systemic resistance against bacterial wilt in Eucalyptus urophylla by fluorescent Pseudomonas spp. Eur. J. Plant Pathology, 2005, 113: 59-70 ( ) DOI: 10.1007/s10658-005-0623-3
- Буров В.Н., Петрова М.О., Селицкая О.Г., Степанычева Е.А., Черменская Т.Д., Шамшев И.В. Индуцированная устойчивость растений к фитофагам. М., 2012.
- Felton G.W., Summers C.B., Mueller A.J. Oxidative responses in soybean foliage to herbivory by bean leaf beetle and three cornered alfalfa hopper. J. Chem. Ecol., 1994, 20(3): 639-650 ( ) DOI: 10.1007/BF02059604
- Srinivas P., Danielson S.D., Smith C.M., Foster J.E. Cross-resistance and resistance longevity as induced by bean leaf beetle, Cerotoma trifurcate and soybean looper, Pseudoplusia includens herbivory on soybean. J. Insect Sci., 2001, 1: 5.
- Степанычева Е.А., Черменская Т.Д., Петрова М.О., Щеникова А.В., Буров В.Н., Савельева Е.И. Влияние насекомых-фитофагов с различным типом питания на индуцированную устойчивость растений томата. Евразиатский энтомологический журнал, 2007, 6(1): 19-24.
- De Moraes C.M., Mescher M.C., Tumlinson J.H. Caterpillar-induced nocturnal plant volatiles repel conspecific females. Nature, 2001, 410: 577-580 ( ) DOI: 10.1038/35069058
- Delphia C.M., Mescher M.C., De Moraes C.M. Induction of plant volatiles by herbivores with different feeding habits and the effects of induced defenses on host-plant selection by thrips. J. Chem. Ecol., 2007, 33(5): 997-1012 ( ) DOI: 10.1007/s10886-007-9273-6
- Yalpani N., Raskin I. Salicylic acid: a systemic signal in induced plant disease resistance. Trends Microbiol., 1993, 1(3): 88-92 ( ) DOI: 10.1016/0966-842X(93)90113-6
- Sudhakar N., Nagendra-Prasad D., Mohan N., Murugesan K. Induction of systemic resistance in Lycopersicon esculentum cv. PKM1 (tomato) against Cucumber mosaic virus by using ozone. J. Virol. Methods, 2007, 139(1): 71-77 ( ) DOI: 10.1016/j.jviromet.2006.09.013
- Поликсенова В.Д. Индуцированная устойчивость растений к патогенам и абиотическим стрессовым факторам (на примере томата). Вестник Белорусского ГУ, 2009, 1: 48-60.
- Тютерев С.Л. Механизмы действия фунгицидов на фитопатогенные грибы. СПб, 2010.
- Moran P. Plant-mediated interactions between insects and a fungal plant pathogen and the role of plant chemical responses to infections. Oecologia, 1998, 115(4): 523-530 ( ) DOI: 10.1007/s004420050550
- Hatcher P.E., Paul N.D. Beetle grazing reduces natural infection of Rumex obtusifolius by fungal pathogens. New Phytologist, 2000, 146: 325-333 ( ) DOI: 10.1046/j.1469-8137.2000.00646.x
- Rostas M., Hilker M. Asymmetric plant-mediated cross-effects between a herbivorous insect and a phytopathogenic fungus. Agr. Forest Entomol., 2002, 4(3): 223-231 ( ) DOI: 10.1046/j.1461-9563.2002.00147.x
- Thaler J.S., Agrawal A.A., Halitschker R. Salicylate-mediated interactions between pathogens and herbivores. Ecology, 2010, 91(4): 1075-1082 ( ) DOI: 10.1890/08-2347.1
- Russo V.M., Russo B.M., Peters M., Perkins-Veazie P., Cartwright B. Interaction of Colletotrichum orbiculare with thrips and aphid feeding on watermelon seedlings. Crop Protection, 1997, 16: 581-584 ( ) DOI: 10.1016/S0261-2194(97)00024-0
- De Vos M., Van Zaanen W.V., Koornneef A., Korzelius J.P., Dicke M., Van Loon L.C., Pieterse C.M.J. Herbivore-induced resistance against microbial pathogens in Arabidopsis. Plant Physiol., 2006, 142(1): 352-363 ( ) DOI: 10.1104/pp.106.083907
- Stout M.J., Fidantsef A.L., Duffey S.S., Bostock R.M. Signal interactions in pathogen and insect attack: systemic plant-mediated interactions between pathogens and herbivores of the tomato, Lycopersicon esculentum. Physiol. Mol. Plant P., 1999, 54(3-4): 115-130. ( ) DOI: 10.1006/pmpp.1998.0193
- Edris A.E., Farrag E.S. Antifungal activity of peppermint and sweet basil essential oils and their major aroma constituents on some plant pathogenic fungi from the vapor phase. Nahrung/Food, 2003, 47(2): 117-121 ( ) DOI: 10.1002/food.200390021
- Pitarokili D., Tzakou O., Loukis A., Harvala C. Volatile metabolites from Salvia fruticosa as antifungal agents in soilborne pathogens. J. Agric. Food Chem., 2003, 51: 3294-3301 ( ) DOI: 10.1021/jf0211534
- Chorianopoulos N., Kalpoutzakis E., Aligiannis N., Mitaku S., Nychas G.-J., Haroutounian S.A. Essential oils of Satureja, Origanum, and Thymus species: chemical composition and antibacterial activities against foodborne pathogens. J. Agric. Food Chem., 2004, 52: 8261-8267 ( ) DOI: 10.1021/jf049113i
- Bridges J.R. Effects of terpenoid compounds on growth of symbiotic fungi associated with the southern pine beetle. Phytopathology, 1987, 77: 83-85 ( ) DOI: 10.1094/Phyto-77-83
- Glisik S.B., Milojevic S.Z., Dimitrijevic S.I., Orlovic A.M., Skala D.U. Antimicrobial activity of the essential oil and different fractions of Juniperus communis L. and a comparison with some commercial antibiotics. J. Serb. Chem. Soc., 2007, 72(4): 311-320 ( ) DOI: 10.2298/JSC0704311G
- Kohzaki K., Gomi K., Yamasaki-Kokudo Y., Ozawa R., Takabayashi J., Akimitsu K. Characterization of a sabinene synthase gene from rough lemon (Citrus jambhiri). J. Plant Physiol., 2009, 166(15): 1700-1704 ( ) DOI: 10.1016/j.jplph.2009.04.003
- Islam M.T., Ahn S.-Y., Cho S.-M., Yun H.K. Isolation of antibacterial compounds from hairy vetch (Vicia villosa) against grapevine crown gall pathogen. Hortic. Environ. Biotechnol., 2013, 54(4): 338-345 ( ) DOI: 10.1007/s13580-013-0028-8
- Srinivasan G.V., Sharanappa P., Leela N.K., Sadashiva C.T., Vijayan K.K. Chemical composition and antimicrobial activity of Leea indica (Burm. f.) Merr. flowers. Nat. Prod. Radiance, 2009, 8: 488-493.
- Camele I., Altieri L., De Martino L., De Feo V., Mancini E., Rana G.L. In vitro control of post-harvest fruit rots fungi by some plant essential oil components. Int. J. Mol. Sci., 2012, 13(2): 2290-2300 ( ) DOI: 10.3390/ijms13022290
- Suzuki T., Haga K., Kataoka M., Tsutsumi T., Nakano Y., Matsuyama S., Kuwahara Y. Secretion of thrips VIII. Secretions of the two Ponticulothrips species (Thysanoptera: Phlaeothripidae). Appl. Entomol. Zool., 1995, 30: 509-519.
- Suzuki T., Haga K., Tsutsumi T., Matsuyama S. Analysis of anal secretions from Phlaeothripine thrips. J. Chem. Ecol., 2004, 30: 409-423 ( ) DOI: 10.1023/B:JOEC.0000017985.89897.c3
- Abdullah Z.S., Ficken K.J., Greenfield B.P.J., Butt T.M. Innate responses to putative ancestral hosts: Is the attraction of western flower thrips to pine pollen a result of relict olfactory receptors? J. Chem. Ecol., 2014, 40: 534-540 ( ) DOI: 10.1007/s10886-014-0450-0
- Dublon I.A.N. The aggregation pheromone of the western flower thrips. Thesis: Doctor of Philosophy by research (Ph.D.). Keele, Staffordshire, UK, 2009.
- Terry I., Walter G.H., Moore C., Roemer R., Hull C. Odor-mediated push-pull pollination in Cycads. Science, 2007, 318: 70 ( ) DOI: 10.1126/science.1145147
- Leiss K.A., Maltese F., Choi Y.H., Verpoorte R., Klinkhamer P.G.L. Identification of chlorogenic acid as a resistance factor for thrips in Chrysanthemum. Plant Physiol., 2009, 150: 1567-1575 ( ) DOI: 10.1104/pp.109.138131
- Yang T., Stoopen G., Thoen M., Wiegers G., Jongsma M.A. Chrysanthemum expressing a linalool synthase gene ‘smells good', but ‘tastes bad' to western flower thrips. Plant Biotechnol. J., 2013, 11(7): 875-882 ( ) DOI: 10.1111/pbi.12080
- Данилов Д.А., Зыкова И.Д., Ефремов А.А. Содержание микро-и макроэлементов в различных частях Pulmonaria mollis Hornem. Успехи современного естествознания, 2013, 9: 156-158.


