Штамм-деструктор фталатов Stutzerimonas sp. SJ1gcor из почвы береговой зоны техногенного галощелочного водоема
Автор: Нечаева Ю.И., Пьянкова А.А., Плотникова Е.Г.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Микробиология
Статья в выпуске: 4, 2025 года.
Бесплатный доступ
Галощелочные среды представляют особый интерес для исследований, поскольку характеризуются уникальным разнообразием экстремофильных микроорганизмов, которые приспособлены к условиям высокой солености и щелочности среды. Среди экстремофильных микроорганизмов особенного внимания заслуживают биодеструкторы различных ароматических и алифатических соединений, оказывающих негативное воздействие на экосистемы и здоровье человека. Из почвы береговой зоны техногенного галощелочного водоема, расположенного на территории Верхнекамского месторождения калийно-магниевых солей (г. Березники, Пермский край), выделен штамм SJ1gcor, который идентифицирован как представитель рода Stutzerimonas. Анализ гена 16S рРНК данного штамма показал наибольший уровень сходства (99.69%) с гомологичным геном Stutzerimonas zhaodongensis NEAU-ST5-21T. Штамм способен к росту в присутствии фталатов в качестве единственного источника углерода и энергии: дибутилфталата (ДБФ) и диметилфталата (ДМФ), а также возможных продуктов биодеструкции этих соединений: орто-фталевой (ОФК), бензойной кислот (БК) и бутанола. Выделенный штамм может развиваться на ДБФ в качестве субстрата с содержанием в среде культивирования до 70 г/л NaCl. Наиболее высокий показатель удельной скорости роста штамма SJ1gcor выявлен при культивировании клеток в среде с содержанием 30 г/л NaCl, а максимальная оптическая плотность зафиксирована на среде с содержанием 70 г/л NaCl. В геноме штамма выявлен ген benA, кодирущий α-субъединицу бензоат 1,2-диоксигеназы – ключевого фермента разложения БК. На основании полученных данных для штамма SJ1gcor предложены 2 альтернативных пути разложения ДБФ. Штамм Stutzerimonas sp. SJ1gcor представляет интерес для дальнейших исследований и перспективен для использования в биотехнологических целях.
Галощелочной водоем, экстремофилы, Stutzerimonas, дибутилфталат, биодеструкция
Короткий адрес: https://sciup.org/147252649
IDR: 147252649 | УДК: 579.26:579.222 | DOI: 10.17072/1994-9952-2025-4-415-423
Текст научной статьи Штамм-деструктор фталатов Stutzerimonas sp. SJ1gcor из почвы береговой зоны техногенного галощелочного водоема
Засоленные и щелочные среды (соленые и щелочные озера, шламохранилища, засоленные и щелочные почвы, промышленные регионы добычи соли и морские отложения) представляют собой уникальные экосистемы с высоким разнообразием экстремофильных микроорганизмов, которые приспособлены к условиям высокой солености и щелочности среды. Данные микроорганизмы обладают высоким биотехнологическим потенциалом, поскольку способны продуцировать биохимически активные ферменты, устойчивые к щелочным показателям рН и высокой концентрации соли. В связи с этим они широко используются в различных областях, таких как медицина, сельское хозяйство и промышленность [Yadav et al., 2018; Varshney et al., 2023].
На территории Верхнекамского месторождения калийно-магниевых солей в г. Березники (Пермский край, Россия) расположен техногенный щелочной водоем, который долгое время использовался в качестве накопителя для производственных отходов. Особенностями данного водоема являются высокое содержание водорастворимых солей, сильнощелочной показатель рН (10‒12) и высокая концентрация тяжелых металлов, мышьяка и органических загрязнителей [Белкин, 2020; Belkin et al., 2024], к которым относятся и эфиры фталевой кислоты (фталаты).
Эфиры фталевой кислоты (ЭФК) – это синтетические органические соединения, которые повсеместно используются в качестве пластификаторов при производстве различных пластмасс для обеспечения гибкости и прочности материалов, а также при производстве строительных материалов, мебели, косметики, игрушек, медицинских устройств и пестицидов [Sharma et al., 2021]. Поскольку ЭФК связаны с полимерной матрицей только за счет слабых нековалентных связей, они легко мигрируют в окружающую среду и накапливаются в почвах, воде, осадках сточных вод, донных отложениях, воздухе и растениях [Khurshid et al., 2025]. Доказано, что ЭФК оказывают неблагоприятное воздействие как на здоровье человека, так и на экосистемы в целом. Несмотря на это, бо́льшая часть стран все еще использует ЭФК в различных сферах производства. В связи с этим актуален поиск наиболее эффективных способов разрушения данных токсичных соединений для уменьшения пагубного влияния на экосистемы и здоровье человека [Wang et al., 2021].
Биодеградация является одним из основных способов разложения различных ЭФК и мо-но(поли)ароматических соединений, поскольку отличается высокой эффективностью, экологичностью, безопасностью и низкой стоимостью. Доказано, что аэробная деградация более эффективна по сравнению с анаэробной [Benjamin et al., 2015]. Известны бактерии-деструкторы фталатов, являющихся представителями разных таксонов, в частности родов Achromobacter , Agrobacterium , Arthrobacter , Bacillus , Comamonas , Enterobacter , Gordonia , Paracoccus , Pseudomonas , Rhodococcus , Sphingobium и Variovorax [Kaur et al., 2023].
В настоящее время накоплен большой объем данных о штаммах, способных к деградации ЭФК [Kaur et al., 2023], показана сложность и многообразие механизмов биодеградации у различных штаммов бак- терий, однако данных о деструкции эфиров фталевой кислоты и других ароматических соединений в условиях засоления и высокой щелочности среды недостаточно. Данный факт подчеркивает необходимость более детального изучения механизмов деградации ЭФК в условиях засоления и щелочности среды, а также поиск эффективных галофильных/галотолерантных и алкалофильных штаммов биодеструкторов ЭФК.
Цель исследования – физиологическая и молекулярно-генетическая характеристика галотолерантного штамма-деструктора фталатов, выделенного из почвы береговой зоны галощелочного водоема (г. Березники, Пермский край).
Материалы и методы
Объект исследования . В работе использован бактериальный штамм SJ1gcor, который был выделен из почвы береговой зоны техногенного галощелочного водоема, расположенного на территории Верхнекамского месторождения калийно-магниевых солей в г. Березники (Пермский край, Россия). Образцы почвы для исследований были предоставлены сотрудниками ЕНИ ПГНИУ. Данный водоем использовался в качестве резервного накопителя производственных отходов на время строительства основного шла-мохранилища и отличается высокой концентрацией легкорастворимых солей, тяжелых металлов, а также щелочным показателем pH [Belkin et al., 2024]. В почве, из которой выделен исследованный штамм, обнаружен дибутилфталат (неопубликованные данные).
Среды и условия культивирования . При получении накопительной культуры и изучении способности штамма к деструкции ароматических и алифатических углеводородов использовали минеральную среду Раймонда (МСР) [Raymond, 1961]. В качестве субстратов в МСР добавляли дибутилфталат (ДБФ), диметилфталат (ДМФ), диэтилфталат (ДЭФ), орто -фталевую, терефталевую (ТФК) и бензойную кислоты, дизельное топливо, бутанол, нафталин, бифенил и фенантрен в концентрации 1.0 г/л. Для приготовления богатой среды Раймонда (БСР) в МСР добавляли 2.5 г/л дрожжевого экстракта («Biospringer», Франция) и 5 г/л триптона («VWR Life Science Amresco», США) в качестве ростовых субстратов. Агар («Helicon», Россия) в количестве 15 г/л использовали для приготовления твердых сред. В экспериментах использовали среды без добавления соли, а также среды с концентрацией NaCl до 100 г/л. Для проверки способности штамма к росту при различных значениях pH использовали буферные системы, приготовленные на основе БСР. Бактериальные клетки выращивали на агаризованной среде БСР при рН 5.0, 6.0, 7.0, 8.0, 9.0, 10.0. Рост оценивали на седьмой день культивирования [Методы ..., 1983].
Накопительное культивирование и выделение бактерий . Образец почвы (5 г) ресуспендировали в 10 мл МСР, далее 200 мкл почвенной суспензии добавляли в 50 мл МСР с орто -фталевой кислотой (1 г/л) в качестве единственного источника углерода и энергии в колбу объемом 100 мл. Культивирование проводили на термостатируемом шейкере Environmental Shaker Incubator ES-20/60 («BioSan», Латвия) при 100 об/мин в течение 2 мес., после этого проводили последовательные пересевы полученной накопительной культуры на МСР с орто -фталевой кислотой (1 г/л). Полученную путем 3-х последовательных пересевов суспензию высевали на агаризованную БСР c содержанием 30 г/л NaCl и инкубировали при температуре 28°С до появления отдельных колоний. Описание морфологии колоний бактерий проводили при росте клеток на агаризованной БСР (30 г/л NaCl). Чистые бактериальные культуры для долгосрочного хранения замораживали при температуре -80°С в 20% растворе глицерола [Нетрусов, 2005].
Идентификация бактерий . Выделение ДНК из чистой культуры бактерий проводили общепринятым методом [Ausbel et al., 1995]. Амплификацию гена 16S рРНК осуществляли с использованием универсальных бактериальных праймеров 8F и 1492R [Lane, 1991] на амплификаторе C1000 TouchTM Thermal Cycler («Bio-Rad Laboratories», США).
Исследование гена деструкции бензойной кислоты ( benA ) . Амплификацию фрагмента гена benA (длина – 521 п.н.), который кодирует α -субъединицу бензоат 1,2-диоксигеназы, проводили с использованием праймеров benA-F (5'-GCCCACGAGAGCCAGATTCCC-3') и benA-R (5'-GGTGGCGGCGTAGTTCCAGTG-3') [Baggi et al., 2008]. В качестве положительного контроля использовали ДНК штамма-деструктора бензойной кислоты Rhodococcus wratislaviensis KT112-7 [Егорова и др., 2013].
Для детекции ПЦР-продуктов использовали горизонтальный электрофорез в 1% агарозном геле с использованием 1× буфера ТВЕ (Трис – 10.8 г/л, борная кислота – 5.5 г/л, 0.5М ЭДТА – 4 мл, вода дистиллированная – 79.7 мл/л) при комнатной температуре, напряжении 5‒15 В/см в течение 20‒40 мин. Агарозные гели окрашивали раствором бромистого этидия (0.5 мкг/мл) в течение 15 мин и фотографировали в УФ-свете с помощью системы гельдокументирования BioDocAnalyze («Bio-Rad Laboratories»,
США). Для определения размеров полученных фрагментов использовали маркер длин ДНК 100+ bp DNA Ladder («Евроген», Россия).
Секвенирование и анализ генов. Определение нуклеотидных последовательностей генов 16S рРНК и benA проводили с применением набора реактивов «GenSeq-100» («Синтол», Россия) на автоматическом секвенаторе Нанофор 05 («Синтол», Россия) согласно рекомендациям производителя. Анализ полученных последовательностей осуществляли с использованием программ Sequence Scanner v. 2.0, MEGA v. 10 . Поиск гомологичных последовательностей осуществляли по международным базам данных EzBioCloud и GenBank (http:/.
Рост штамма на ДБФ оценивали с использованием культивирования в жидкой МСР c ДБФ (1 г/л) без добавления соли и в присутствии 30, 50 и 70 г/л NaCl. В качестве инокулята использовали культуру в экспоненциальной фазе роста, предварительно выращенную в жидкой МСР с ДБФ в концентрации 1.0 г/л. Оптическую плотность (ОП 600 ) культуральной жидкости определяли на спектрофотометре UV-Visible BioSpec-mini («Shimadzu», Япония) при длине волны 600 нм в кювете с длиной оптического пути 1 см. Удельную скорость роста (μ, ч-1) рассчитывали по стандартной формуле:
μ = (lnB2 – lnB1)/(t2 – t1), где В1 и В2 – оптическая плотность культуры в момент времени t1 и t2, соответственно [Нетрусов, 2005].
Статистическая обработка результатов . Все эксперименты были выполнены в трехкратной повторности. Для обработки полученных данных использовали среду программирования R.
Результаты и их обсуждение
С использованием метода накопительного культивирования на МРС с добавлением орто -фталевой кислоты в качестве единственного источника углерода и энергии из образца почвы, отобранной в береговой зоне галощелочного техногенного водоема, изолирован бактериальный штамм SJ1gcor. Выделенный штамм имел округлые бежево-желтые прозрачные колонии, размером около 1‒2 мм, с гладкой блестящей поверхностью.
Согласно анализу фрагмента гена 16S рРНК (647 п.н.), штамм SJ1gcor имеет наибольшее (99.69%) сходство со штаммом Stutzerimonas zhaodongensis NEAU-ST5-21T (ранее Pseudomonas zhaodongensis ). Представители вида S. zhaodongensis были выделены из засоленных и щелочных почв [Zhang et al., 2015], морских отложений [Xu et al., 2022], морской воды [Zhao et al., 2024] и загрязненных нефтью грунтовых вод [Khodaei et al., 2017]. Показано, что штаммы вида Stutzerimonas ( Pseudomonas ) zhaodongensis способны к биоремедиации загрязненных нефтью отложений [Qiao et al., 2024], деградации дизельного топлива [Xu et al., 2022], смеси углеводородов (бензол, толуол, этилбензол и ксилен) [Khodaei et al., 2017] и гербицида Хизалофоп-П-этил (QPE) [Zhang et al., 2017].
При культивировании штамма на среде БСР с разной концентрацией соли показано, что штамм способен к росту на среде как без добавления NaCl, так и в присутствии NaCl до 70 г/л. Также выявлено, что штамм способен к росту на среде с pH 6‒8.
Поскольку штамм был выделен из накопительной культуры с добавлением в качестве субстрата ОФК, в первую очередь была проведена проверка способности штамма к росту на орто -фталевой кислоте, эфирах фталевой кислоты – дибутилфталате (ДБФ), диметилфталате (ДМФ), диэтилфталате (ДЭФ) и терефталевой кислоте (ТФК). Также проведена проверка роста штамма на бензойной кислоте, нафталине, фенантрене, бифениле, дизельном топливе (ДТ) и бутаноле. Установлено, что штамм способен к эффективному росту на ДБФ, ДМФ, орто -фталевой и бензойной кислотах, а также бутаноле. При этом он не растет на ДЭФ, терефталевой кислоте, бифениле, нафталине, фенантрене и ДТ.
Согласно литературным данным, орто -фталевая кислота – ключевой метаболит разложения фталатов. В частности, основной путь деградации ДБФ (один из представителей ЭФК) включает: гидролиз ДБФ через образование монобутилфталата до ОФК с использованием различных гидролаз; разложение ОФК до протокатеховой кислоты (ПКК), которая далее метаболизируется по орто - и мета -пути до соединений цикла Кребса [Hu et al., 2021]. Бензойная кислота является промежуточным метаболитом при разложении различных ароматических соединений (бифенил, фенол, толуол), кроме того, известно, что данное соединение может быть метаболитом при разложении ОФК. Ранее путь разложения орто фталевой кислоты через образование бензоата упоминался для штаммов Glutamicibacter sp. 0426 [Ren et al., 2024] и Pseudarthrobacter defluvii E5 [Chen et al., 2021]. Также известно, что возможным метаболитом при разложении ДБФ может быть бутанол, который преобразуется в масляную кислоту. Образующийся ацетил-КоА при окислении жирной кислоты вступает в цикл Кребса [Mahajan et al., 2019].
Ростовой эксперимент был проведен на МСР с добавлением ДБФ в качестве субстрата с содержанием NaCl до 70 г/л и без нее. Среди эфиров фталевых кислот ДБФ представляет особый интерес, поскольку обладает мутагенными и канцерогенными свойствами даже в минимальных концентрациях, а также является одним из наиболее используемых ЭФК во всем мире [Peng et al., 2025]. В связи с тем, что ДБФ обладает высокой токсичностью, биоаккумуляционным потенциалом и низкой скоростью биодеградации в окружающей среде, он включен в списки приоритетных загрязнителей Агентством по охране окружающей среды США, Европейского союза, Канады, Японии, а также Китайским национальным центром мониторинга окружающей среды [Lakshmikandan et al., 2025]. Поэтому изучение ростовых показателей штамма при использовании ДБФ в качестве единственного источника углерода и энергии может быть полезно для разработки мероприятий по биоремедиации загрязненных местообитаний.
Нами при культивировании бактериальных клеток на ДФБ в качестве субстрата в среде без содержания соли и в присутствии NaCl показано, что наиболее высокий показатель удельной скорости роста наблюдался при культивировании бактерий в среде с содержанием 30 г/л NaCl, а максимальная ОП 600 зафиксирована на среде с содержанием 70 г/л NaCl (табл. 1, рисунок).
Таблица 1
Параметры роста штамма SJ1gcor в МСР с ДБФ (1.0 г/л) при разных концентрациях NaCl
[Growth parameters of the strain SJ1gcor in MMR and DBP (1.0 g/L) at different concentrations of NaCl]
|
Концентрация NaCl, г/л |
Удельная скорость роста, ч-1 |
Максимальное значение ОП 600 |
|
Без NaCl |
0.018±0.001 |
1.04 |
|
30 |
0.030±0.002 |
1.29 |
|
50 |
0.015±0.001 |
1.39 |
|
70 |
0.012±0.001 |
1.45 |
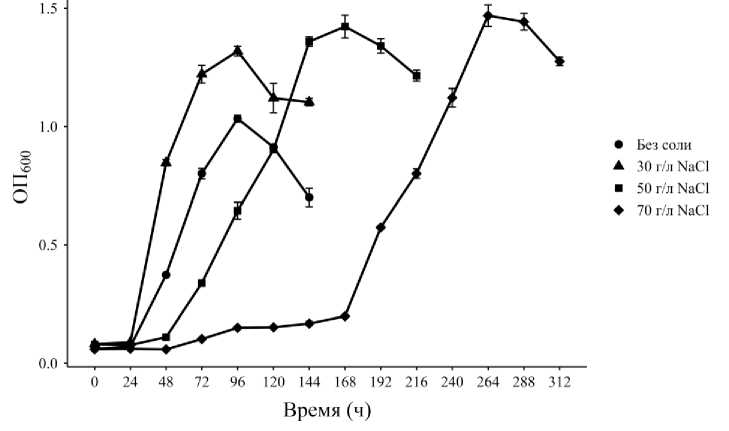
Рост штамма SJ1gcor в МСР с ДБФ (1.0 г/л) при разных концентрациях NaCl [Growth of the strain SJ1gcor in MMR and DBP (1.0 g/L) at different concentrations of NaCl]]
Поскольку штамм способен к росту на бензойной кислоте, являющейся возможным метаболитом разложения ЭФК, проведена амплификация гена benA, кодирующего α-субъединицу бензоат 1,2-диоксигеназы, которая является ключевым ферментом начального пути окисления бензоата [Parales et al., 2006]. Проведено секвенирование и анализ амплифицированного benA-гена. Сравнительный анализ benA-гена с гомологичными последовательностями из базы данных GenBank показал, что наибольшее сходство данная последовательность имеет с последовательностями гена benA бактерий-представителей родов Stutzerimonas. В таблице 2 представлены гомологичные последовательности гена benA, которые имеют наибольшее сходство с геном штамма SJ1gcor. Сходство на уровне 94.07% сравниваемая последовательность имеет с геном benA штамма Stutzerimonas kunmingensis 7850S, который был выделен из донных отложений Марианской впадины (табл. 2).
На основании полученных данных можно предположить, что разложение ДБФ идет до ортофталевой кислоты через образование монобутилфталата. По литературным данным, в преобразовании ДБФ до монобутилфталата участвуют альфа/бета гидролазы, эстеразы, карбоксилэстеразы или липазы [Ren et al., 2018]. Способность штамма SJ1gcor к росту на бензойной кислоте и наличие гена benA могут свидетельствовать о том, что у данного штамма может быть 2 альтернативных пути разложения ортофталевой кислоты: либо с помощью кластера генов, участвующих в разложении орто-фталевой кислоты до протокатеховой кислоты, либо через преобразование ОФК до бензойной кислоты за счет декарбоксилирования и разложения бензоата с использованием кластера генов benABCDE.
Таблица 2
Сравнительный анализ гена benA штамма Stutzerimonas sp. SJ1gcor с ближайшими гомологичными последовательностями из базы данных GenBank
[Comparative analysis of the benA gene of the strain Stutzerimonas sp. SJ1gcor with the closest homologous sequences from the GenBank database]
|
Гомологичные гены в GenBank |
Номер в GenBank |
Сходство, (%) |
Место выделения |
|
Ген benA , Stutzerimonas kunmingensis 7850S |
CP090366 |
94.07 |
Донные отложения Марианской впадины |
|
Ген benA , Stutzerimonas chloritidismutans ABH-495 |
CP085257 |
93.01 |
Донные отложения озера: Китай |
|
Ген benA , Pseudomonas stutzeri 19SMN4T |
CP007509 |
93.01 |
Загрязненные морские донные отложения: Испания |
|
Ген benA , Pseudomonas knackmussii B09-2 |
CP096208 |
92.58 |
Вода: Индийский океан, Китай |
|
Ген benA , Stutzerimonas chloritidismutans 6L11 |
CP086067 |
91.74 |
Галощелочная ризосферная почва: Китай |
|
Ген benA , Pseudomonas stutzeri CCUG 29243 |
CP003677 |
91.53 |
Загрязненные морские отложения: Средиземное море |
Для получения более полных данных о метаболических путях штамма и кластерах генов, участвующих в разложении различных ароматических соединений, необходимо проведение дополнительных исследований, в частности полногеномное секвенирование и анализ транскриптомных данных.
Заключение
В результате проведенных исследований из почвы береговой зоны галощелочного водоема, расположенного на территории Верхнекамского месторождения солей (г. Березники, Пермский край), изолирован штамм-деструктор фталатов (дибутилфталата, диметилфталата) Stutzerimonas sp. SJ1gcor. Кроме эффективного роста на среде с дибутилфталатом и диметилфталатом, штамм способен к росту на орто фталевой, бензойной кислотах и бутаноле в качестве субстрата. Необходимо отметить, что штамм способен к росту на ДБФ в условиях повышенного содержания NaCl (до 70%). В геноме штамма выявлен ген benA , который участвует в первой стадии разложения бензойной кислоты. Нуклеотидная последовательность гена имеет наибольший процент идентичности с геном benA штамма Stutzerimonas kunmingensis 7850S, который изолирован из донных отложений Марианской впадины. На основании полученных данных выдвинуто предположение о том, что у штамма могут быть 2 альтернативных пути разложения орто -фталевой кислоты до соединений цикла Кребса: 1) через образование бензойной кислоты и последующее разложение бензоата, 2) через разложение с использованием кластера фталатных генов.
Таким образом, исследованный штамм Stutzerimonas sp. SJ1gcor представляет интерес для дальнейших исследований, поскольку обладает высоким биодеградационным потенциалом. Данный штамм может быть использован в качестве бактериального агента при планировании мероприятий, направленных на очистку окружающей среды от эфиров фталевой кислоты, в том числе биоремедиации местообитаний, характеризующихся высоким содержанием NaCl.


