Симбиотическая эффективность генотипов гороха посевного (Pisum sativum L.) при моделировании в вегетационном эксперименте
Автор: Жуков В.А., Ахтемова Гульнара Асановна, Жернаков Александр Игоревич, Сулима Антон Сергеевич, Штарк Оксана Юрьевна, Тихонович Игорь Анатольевич
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Анализ и отбор генотипов
Статья в выпуске: 3 т.52, 2017 года.
Бесплатный доступ
Для успешного использования растительно-микробных систем на основе бобовых в сельском хозяйстве необходимо создавать принципиально новые культурные сорта, способные эффективно взаимодействовать с полезными почвенными микроорганизмами. Для селекции сортов бобовых предлагается рассматривать интегральный признак эффективность взаимодействия с полезными почвенными микроорганизмами (ЭВППМ), который рассчитывается как прибавка ряда агрономически значимых параметров (биомасса растений, число и общая биомасса семян, а также масса 1000 семян) при обработке микробиологическими препаратами по сравнению с необработанным контролем. Целью нашего исследования была оценка эффективности взаимодействия двух генотипов гороха ( Pisum sativum L.) (высокоэффективного и низкоэффективного в условиях полевого опыта) с полезными почвенными микроорганизмами в модельном вегетационном эксперименте. В работе использовали высокоэффективный в симбиозе с клубеньковыми бактериями и арбускулярно-микоризными грибами генотип к-8274 (Франция, сорт Vendevil) и низкоэффективный к-3358 (Саратовская обл., Россия) из коллекции культурного гороха ВИР (Всероссийский институт генетических ресурсов растений им. Н.И. Вавилова, г. Санкт-Петербург). Растения выращивали в летний сезон 2012 года в вегетационных домиках в сосудах объемом 5 л на дерново-подзолистой легкосуглинистой почве. Применяли следующие варианты обработки: контроль (необработанная почва); клубеньковые бактерии + арбускулярно-микоризные грибы (КБ + АМГ); КБ; минеральные удобрения (NPK). Сравнивали также эффект низкой (с поливом 30 % от полной влагоемкости, ПВ) и оптимальной (60 % от ПВ) увлажненности. Повторность опыта 6-кратная для оптимального полива и 3-кратная для варианта 30 % от ПВ. Минеральные удобрения (NPK) вносили в виде чистых солей в дозе 0,1 мг д.в. на 1 кг почвы. Для инокуляции КБ использовали эффективный штамм Rhizobium leguminosarum bv. viciae RCAM1026. Микоризные грибы для инокуляции выращивали на корнях сорго ( Sorghum sp.). Применяли смешанный инокулюм, содержащий три изолята АМГ: Rhizophagus irregularis (syn. Glomus intraradices ) RCAM8 (= BEG144), R. irregularis BEG53 и Glomus sp. ST3. Образцы отбирали на стадии бутонизации-цветения через 1 мес после посадки (для подсчета клубеньков и определения сухой биомассы растений) и в конце вегетации примерно через 3 мес после посадки (для определения сухой биомассы растений, биомассы и числа семян). При выращивании в сосудах высокоэффективные и низкоэффективные генотипы гороха демонстрировали ожидаемые различия по признаку ЭВППМ. Так, сухая биомасса надземной части растений, собранных после 1 мес вегетации, у высокоэффективного генотипа к-8274 достоверно повышалась относительно контроля в вариантах КБ и NPK. В то же время у низкоэффективного генотипа к-3358 этот показатель достоверно увеличивался только под действием минеральных удобрений, но не клубеньковых бактерий. Также при обработке КБ у генотипа к-8274 увеличивалась масса 1000 семян, в то время как у генотипа К-3358 она несколько уменьшалась. Выявлено статистически достоверное негативное действие низкой увлажненности почвы на все оцененные параметры у к-3358 и на большинство показателей у к-8274. Таким образом, растения, выращенные в условиях вегетационного эксперимента, эквивалентны полученным в полевых условиях и могут использоваться для определения физиолого-биохимических маркеров функционирования симбиотических систем с целью выявления молекулярных основ признака ЭВППМ. Для моделирования признака ЭВППМ на горохе в условиях вегетационных экспериментов рекомендуется использовать не менее 6 повторностей для каждого генотипа. Необходимо также тщательно контролировать увлажненность почвы.
Бобово-ризобиальный симбиоз, арбуcкулярная микориза, симбиотическая эффективность, горох посевной
Короткий адрес: https://sciup.org/142214160
IDR: 142214160 | УДК: 633.358:579.64:581.557 | DOI: 10.15389/agrobiology.2017.3.607rus
Текст научной статьи Симбиотическая эффективность генотипов гороха посевного (Pisum sativum L.) при моделировании в вегетационном эксперименте
Для минимизации химической нагрузки на окружающую среду (снижение использования химических удобрений и средств защиты от патогенов) (1, 2) и негативного действия факторов внешней среды (неблагоприятные погодные условия, влияние патогенов и др.) (3) целесообразно применение микробиологических препаратов, например на основе клу-
Работа финансово поддержана РНФ (грант ¹ 16-16-00118).
беньковых бактерий или арбускулярно-микоризных грибов, положительно влияющих на растения (4, 5). Существуют также препараты, содержащие комплекс полезных почвенных микроорганизмов (6, 7).
Бобовые растения — подходящие культуры для возделывания в рамках современной концепции адаптивного растениеводства, что продемонстрировано для чечевицы (8), сои (9), гороха (10, 11), фасоли (12, 13), нута (14) и других бобовых (15-17). Для успешного использования растительно-микробных систем на основе бобовых необходимо создавать принципиально новые сорта, способные эффективно взаимодействовать с полезными почвенными микроорганизмами (17, 18). Один из способов достижения этой цели состоит в мобилизации генетических ресурсов растений — поиске ценных аллелей генов, способных улучшить симбиотические свойства и ростовые параметры растения при введении в генотип.
Традиционно при селекции бобовых культур на повышение симбиотического потенциала используют признак эффективность азотфик-сации (19-21). Также предложено рассматривать интегральный признак эффективность взаимодействия с полезными почвенными микроорганизмами (ЭВППМ, EIBSM, effectiveness of interactions with beneficial soil microorganisms) (17, 22), который рассчитывается как прибавка по экономически значимым параметрам (биомасса растений, число и общая биомасса семян, а также масса 1000 семян) при обработке микробиологическими препаратами по сравнению с необработанным контролем. Ранее для 25 генотипов гороха в полевых экспериментах была оценена вариабельность проявления признака ЭВППМ и идентифицированы контрастные генотипы (высокоэффективные и низкоэффективные при взаимодействии с полезными почвенными микроорганизмами) (10, 12).
В настоящей работе мы впервые рассмотрели возможность моделирования ЭВППМ в условиях вегетационного эксперимента, а также оценили степень влияния увлажненности почвы на проявление этого признака.
Целью исследования была оценка эффективности взаимодействия двух генотипов гороха (высокоэффективного и низкоэффективного в условиях полевого опыта) с полезными почвенными микроорганизмами в модельном вегетационном эксперименте.
Методика. В работе использовали высокоэффективный в симбиозе с клубеньковыми бактериями генотип к-8274 (Франция, сорт Vendevil) и низкоэффективный к-3358 (Саратовская обл., Россия) гороха посевного ( Pisum sativum L.) из коллекции культурного гороха ВИР (Всероссийский институт генетических ресурсов растений им. Н.И. Вавилова, г. Санкт-Петербург) (23). Растения выращивали в летний сезон 2012 года в вегетационных домиках в сосудах объемом 5 л (по 3 растения на сосуд). Почва — дерново-подзолистая легкосуглинистая (Ленинградская обл., территория НПО «Белогорка») с содержанием Сгум. 1,27 % и Nобщ. 0,11 %, рНсол. 4,92. Агрохимические исследования почвы проводили общепринятыми методами (24). Почву известковали карбонатом кальция.
Применяли следующие варианты обработки: контроль (необработанная почва); клубеньковые бактерии + арбускулярно-микоризные грибы (КБ + АМГ); КБ; минеральные удобрения (NPK). Также сравнивали эффект низкой (30 % от полной влагоемкости, ПВ) и оптимальной (60 % от ПВ) увлажненности (повторность опыта 6-кратная для оптимального полива и 3-кратная — для варианта 30 % от ПВ). Минеральные удобрения (NPK) вносили в виде чистых солей в дозе 0,1 мг д.в. на 1 кг почвы (N0,1P0,1K0,1). Применяли азотнокислый аммоний NH4NO3, фосфорнокислый однозамещенный кальций Са(H2PO4)2•H2O и хлористый калий 608
KCl. Для инокуляции КБ использовали эффективный штамм Rhizobium leguminosarum bv. viciae RCAM1026 из коллекции Всероссийского НИИ сельскохозяйственной микробиологии (ВНИИСХМ) (25, 26). Бактерии выращивали в жидкой среде ¹ 79 (K2HPO4 — 0,5 г/л; MgSO4•7H2O — 0,2 г/л; NaCl — 0,1 г/л; CaCO3 — следы; маннит — 10 г/л; дрожжевой экстракт — 0,4 г/л) с аэрацией в течение 3 сут. Затем в суспензию бактерий с титром 107-108 клеток помещали стерилизованные семена гороха посевного и выдерживали 12 ч на шейкере (27, 28). Микоризные грибы для инокуляции выращивали на корнях сорго ( Sorghum sp.) в субстрате, состоящем из почвенной смеси с фильтрационно-моечным осадком (ФМО) (6, 29). Использовали смешанный инокулюм, содержащий три изолята АМГ из коллекции ВНИИСХМ: Rhizophagus irregularis (syn. Glomus intraradices ) RCAM8 (= BEG144), R. irregularis BEG53 и Glomus sp. ST3. Перед посадкой иноку-люм АМГ смешивали с почвой из расчета 20 г на сосуд и дополнительно вносили по 1,5 г инокулюма под каждое семя гороха.
Образцы отбирали на стадии бутонизации—цветения через 1 мес после посадки (для подсчета клубеньков и определения сухой биомассы растений) и в конце вегетации примерно через 3 мес после посадки (для определения сухой биомассы растений, биомассы и числа семян).
Статистическую обработку результатов проводили в программе SigmaPlot 12.0 («Systat Software», США). Действие факторов «степень увлажненности» и «обработка» на проявление признаков оценивали с помощью двухфакторного дисперсионного анализа для каждого из генотипов. Для сравнения вариантов обработки между собой использовали t -критерий Стьюдента. Для оценки массы 1000 семян, рассчитанной по формуле (масса семян с растения/число семян с растения) ½ 1000, применяли непараметрический U-критерий Манна-Уитни.
Результаты. Двухфакторный дисперсионный анализ выявил статистически достоверное негативное влияние низкой увлажненности почвы на все исследованные показатели у низкоэффективного генотипа к-3358 и на большинство — у высокоэффективного к-8274 (табл., рис.).
Влияние различных факторов и их взаимодействия на показатели продуктивности у генотипов гороха ( Pisum sativum L.) в условиях оптимальной и недостаточной увлажненности при обработке (КБ, КБ + АМГ, NPK) и без обработки, выявленное с помощью двухфакторного дисперсионного анализа
|
Генотип |
Фактор |
Сухая биомасса надземной части по срокам вегетации |
Семена |
Число клубеньков |
||
|
1 мес |
3 мес |
число |
масса |
|||
|
к-8274 |
Увлажненность |
0,347 |
< 0,001* |
< 0,001* |
< 0,001* |
0,107 |
|
Обработка |
0,004* |
0,010* |
0,005* |
0,034* |
< 0,001* |
|
|
Взаимодействие двух факторов |
0,809 |
0,090 |
0,354 |
0,073 |
0,002* |
|
|
к-3358 |
Увлажненность |
< 0,001* |
< 0,001* |
< 0,001* |
< 0,001* |
0,011* |
|
Обработка |
< 0,001* |
0,0770 |
0,243 |
0,291 |
< 0,001* |
|
|
Взаимодействие двух факторов |
0,118 |
0,076 |
0,212 |
0,248 |
0,025* |
|
П р и м е ч а н и е. Оптимальная и недостаточная увлажненность — соответственно 60 и 30 % полной влагоемкости; КБ — клубеньковые бактерии Rhizobium leguminosarum bv. viciae RCAM1026; АМГ — ар-бускулярно-микоризные грибы, смешанный инокулюм Rhizophagus irregularis (syn. Glomus intraradices ) RCAM8 (= BEG144), R. irregularis BEG53 и Glomus sp. ST3; NPK — N 0,1 P 0,1 K 0,1 . Приведены значения P-value, отражающие степень достоверности действия каждого из факторов и их взаимодействия.
* P < 0,05.
В то же время вариант обработки не оказывал ярко выраженного действия (см. табл., рис.). Следовательно, проявление признака ЭВППМ в сосудах ограниченного объема находилось под сильным влиянием увлажненности почвы, которое превосходило действие симбиотических микроорганизмов и минеральных удобрений.
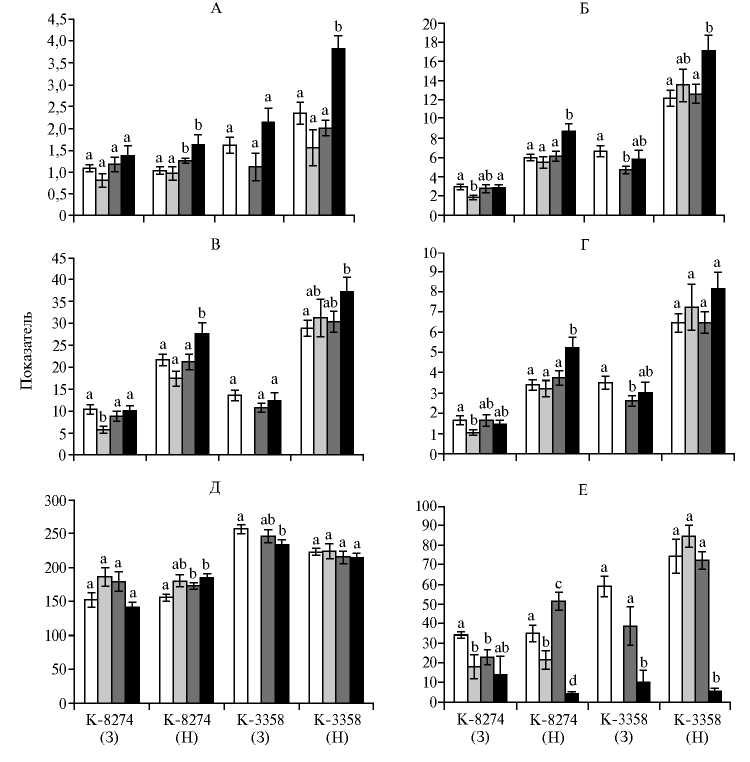
Cухая биомасса надземной части растений, собранных через 1 (А) и 3 мес вегетации (Б) , г; число семян с растения, шт. (В) ; масса семян с растения, г (Г) ; масса 1000 семян, г (Д) ; число клубеньков, шт. (Е) у генотипов гороха ( Pisum sativum L.) к-8274 (высокоэффективный при взаимодействии с полезными почвенными микроорганизмами в условиях полевого опыта) и к3358 (низкоэффективный) при различной увлажненности почвы и разных вариантах обработки: 1 — контроль (необработанная почва), 2 — клубеньковые бактерии + арбускулярно-мико-ризные грибы (КБ + АМГ), 3 — КБ, 4 — минеральные удобрения (NPK). З — недостаточная увлажненность почвы, Н — оптимальная увлажненность. Данные по варианту КБ + АМГ для к-3358 в условиях недостаточной увлажненности отсутствуют. Значения, обозначенные разными буквами (a, b, c, d), различаются статистически достоверно (P < 0,05) в пределах одного варианта обработки (a отличается от b, при этом ab не отличается от a и не отличается от b).
У к-8274 при низкой увлажненности сухая биомасса надземной части растений, собранных после 1 мес вегетации, не изменялась в зависимости от варианта обработки (см. рис., А). В условиях оптимальной увлажненности была обнаружена достоверная прибавка биомассы в вариантах КБ и NPK по отношению к контролю. У к-3358 изучаемый показатель не изменялся при недостатке влаги, а на фоне оптимальной увлажненности достоверной оказалась прибавка под действием минеральных удобрений, но не клубеньковых бактерий.
Низкая увлажненность усиливала негативное действие обработки КБ + АМГ на сухую биомассу надземной части у растений генотипа к8274, собранных после завершения вегетации (см. рис., Б). Для к-3358 данные по этому варианту обработки отсутствовали. Возможно, образование и поддержание арбускулярно-микоризного симбиоза в условиях де- фицита влаги в ограниченном по размеру сосуде становились для растений энергетически невыгодными. Обработка КБ на фоне низкой увлажненности приводила к уменьшению биомассы у генотипа к-3358, что свидетельствовало о проявлении его низкой эффективности при взаимодействии с симбионтами. В условиях оптимальной увлажненности статистически значимым было действие минеральных удобрений, но не обработки микроорганизмами. Вероятно, в течение длительной вегетации положительный эффект микроорганизмов нивелировалось вследствие стресса, который растения испытывали из-за ограниченного объема сосудов.
Число семян у к-8274 (см. рис., В) снижалось в варианте КБ + АМГ при низкой увлажненности. Обработка только КБ не оказывала значимого влияния на этот показатель у обоих генотипов в условиях как оптимальной, так и низкой увлажненности. Положительное действие минеральных удобрений отмечали для к-8274 и к-3358 при оптимальной влажности, но не при недостатке влаги.
В условиях низкой увлажненности обработка КБ + АМГ негативно влияла на массу семян у генотипа к-8274 (см. рис., Г). Тот же эффект наблюдался при обработке КБ семян к-3358 при недостаточном увлажнении. Повышало массу семян только применение минеральных удобрений при оптимальной увлажненности почвы.
Масса 1000 семян у генотипа к-8274 не зависела от увлажненности в контроле, однако возрастала при обработке КБ (статистически значимо лишь в условиях оптимальной увлажненности) (см. рис., Д). У генотипа к3358 масса 1000 семян, напротив, несколько снижалась при обработке КБ (статистически значимо в условиях недостатка влаги). Это согласуется с результатами полевых испытаний, в которых масса 1000 семян повышалась при обработке микробиологическими препаратами у высокоэффективных генотипов и не изменялась или несколько снижалась у низкоэффективных (10, 22).
Внесение минеральных удобрений отрицательно сказалось на числе клубеньков (см. рис., Е), что было связано с активацией систем авторегуляции (негативного контроля энергозатратного процесса клубенькообразо-вания при достаточном количестве связанного азота в почве) (30, 31). Недостаток влаги приводил к снижению числа клубеньков у генотипа к-3358 при любых вариантах обработки. У обоих генотипов инокуляция КБ (в том числе в варианте КБ + АМГ) на фоне недостатка влаги вызывала подавление клубенькообразования вследствие авторегуляции. В варианте с оптимальным увлажнением наблюдалось уменьшение числа клубеньков у генотипа к-8274 при сочетании КБ + АМГ, что, вероятно, было связано с работой единой системы авторегуляции клубенькового и арбускулярно-микоризного симбиозов (30-32). Число клубеньков при применении только КБ у к-8274 оказалось выше, чем без обработки, что может отражать генетически обусловленную сниженную способность к клубенькообразо-ванию у этого генотипа.
Таким образом, генотипы гороха, у которых в полевых экспериментах проявлялась высокая и низкая эффективность при взаимодействии с клубеньковыми бактериями, в условиях вегетационного опыта демонстрировали аналогичные различия. Например, статистически значимая прибавка биомассы растений через 1 мес после посадки и массы 1000 семян под воздействием инокуляции клубеньковыми бактериями (по отношению к неинокулированному контролю) наблюдалась только у высокоэффективного генотипа к-8274, в то время как у низкоэффективного к3358 по этим показателям положительной связи с инокуляцией не выяви- ли. Напротив, масса семян с растения при инокуляции клубеньковыми бактериями в условиях недостаточной увлажненности достоверно снижалась по сравнению с контролем (без инокуляции). Следовательно, неизвестные пока генетические программы, лежащие в основе проявления признака ЭВППМ, реализуются в вегетационных экспериментах и в полевых условиях сходным образом. Материал, выращенный в вегетационном эксперименте, эквивалентен полученному в полевых условиях и может использоваться для идентификации молекулярных основ генетического контроля признака ЭВППМ при помощи транскриптомного секвенирования.
Итак, для моделирования интегрального признака ЭВППМ (эффективность взаимодействия с полезными почвенными микроорганизмами) на горохе в условиях вегетационных экспериментов рекомендуется использовать не менее 6 повторностей для каждого генотипа. Необходимо тщательно контролировать увлажненность почвы, поскольку стресс, вызванный засухой, маскирует полезное действие микроорганизмов, нивелируя различия между высокоэффективными и низкоэффективными генотипами. Стадия бутонизации—цветения, на которой отмечаются первые различия между генотипами, может быть рекомендована для сбора материала, предназначенного для анализа дифференциальной экспрессии генов, ферментативной активности и определения других физиолого-биохимических маркеров функционирования симбиотических систем.
Список литературы Симбиотическая эффективность генотипов гороха посевного (Pisum sativum L.) при моделировании в вегетационном эксперименте
- Beddington J. Food security: contributions from science to a new and greener revolution. Philosophical Transactions of the Royal Society of London B: Biological Sciences, 2010, 365(1537): 61-71 ( ) DOI: 10.1098/rstb.2009.0201
- O'Callaghan M. Microbial inoculation of seed for improved crop performance: issues and opportunities. Appl. Microbial. Biot., 2016, 100(13): 5729-5746 ( ) DOI: 10.1007/s00253-016-7590-9
- FAOSTAT 2014. Food and Agriculture Organization of the United Nations. Режим доступа: www.faostat.fao.org. Без даты.
- Handbook of microbial biofertilizers/M.K. Rai (ed.). Haworth Press Technology Engineering, 2006.
- IJdo M., Cranenbrouck S., Declerck S. Methods for large-scale production of AM fungi: past, present, and future. Mycorrhiza, 2011, 21: 1-16 ( ) DOI: 10.1007/s00572-010-0337-z
- Чеботарь В.К., Наумкина Т.С., Борисов А.Ю. Комплексное микробное удобрение «БисолбиМикс»: фундаментальные основы, способы производства и применения, назначение/Под ред. А.Ю. Борисова. СПб, 2015.
- Shtark O., Kumari S., Singh R., Sulima A., Akhtemova G., Zhukov V., Shcherbakov A., Shcherbakova E., Adholeya A., Borisov A. Advances and prospects for development of multi-component microbial inoculant for legumes. Legume Perspectives, 2015, 8: 40-44.
- Xavier L.J.C., Germida J.J. Response of lentil under controlled conditions to co-inoculation with arbuscular mycorrhizal fungi and rhizobia varying in efficacy. Soil Biol. Biochem., 2002, 34(2): 181-188 ( ) DOI: 10.1016/S0038-0717(01)00165-1
- Лабутова Н.М., Поляков А.И., Лях В.А., Гордон В.Л. Влияние инокуляции клубеньковыми бактериями и эндомикоризным грибом Glomus intraradices на урожай различных сортов сои и содержание белка и масла в семенах. Доклады РАСХН, 2004, 4(2): 2-4.
- Штарк О.Ю., Данилова Т.Н., Наумкина Т.С., Васильчиков А.Г., Чеботарь В.К., Казаков А.Е., Жернаков А.И., Неманкин Т.А., Прилепская Н.А., Борисов А.Ю., Тихонович И.А. Анализ исходного материала гороха посевного (Pisum sativum L.) для селекции сортов с высоким симбиотическим потенциалом и выбор параметров для его оценки. Экологическая генетика, 2006, 4(2): 22-28.
- Данилова Т.Н. Эффективность взаимодействия гороха (Pisum sativum L.) с комплексом полезной почвенной микрофлоры. Новый признак селекции зернобобовых культур. Автореф. канд. дис. СПб, 2011.
- Парахин Н.В., Наумкина Т.С., Осин А.А., Осина В.С. Роль биопрепаратов в повышении симбиоза и продуктивности фасоли. Вестник орловского государственного аграрного университета, 2008, 4: 2-4.
- Наумкина Т.С., Суворова Г.Н., Васильчиков А.Г., Мирошникова М.П., Барбашов М.В., Донская М.В., Донской М.М., Громова Т.А., Наумкин В.В. Создание высокоэффективных растительно-микробных систем фасоли. Зернобобовые и крупяные культуры, 2012, 2: 21-26.
- Лобков В.Т., Донская М.В., Васильчиков А.Г. Повышение эффективности симбиотических систем нута (Cicer arietinum L.). Вестник орловского государственного аграрного университета, 2011, 30(3): 39-43.
- Lüscher A., Mueller-Harvey I., Soussana J.F., Rees R.M., Peyraud J.L. Potential of legume-based grassland-livestock systems in Europe: a review. Grass Forage Sci., 2014, 69(2): 206-228 ( ) DOI: 10.1111/gfs.12124
- Oldroyd G.E.D., Dixon R. Biotechnological solutions to the nitrogen problem. Curr. Opin. Biotech., 2014, 26: 19-24 ( ) DOI: 10.1016/j.copbio.2013.08.006
- Штарк О.Ю., Жуков В.А., Сулима А.С., Сингх Р., Наумкина Т.С., Ахтемова Г.А., Борисов А.Ю. Перспективы использования многокомпонентных симбиотических систем бобовых. Экологическая генетика, 2015, 13(1): 33-46 ( ) DOI: 10.17816/ecogen13133-46
- Zhukov V.A., Shtark O.Y., Borisov A.Y., Tikhonovich I.A. Breeding to improve symbiotic effectiveness of legumes. In: Plant breeding from laboratories to fields/S.B. Andersen (ed.). Rijeka, 2013: 167-207.
- Graham P.H., Hungria M., Tlusty B. Breeding for better nitrogen fixation in grain legumes: where do the rhizobia fit in? Crop Management, 2004 ( ) DOI: 10.1094/CM-2004-0301-02-RV
- Rengel Z. Breeding for better symbiosis. Plant Soil, 2002, 245: 147-162 ( ) DOI: 10.1023/A:1020692715291
- Сидорова K.K., Гончарова А.В., Гончаров П.Л., Шумный В.К. Селекция кормового гороха (Pisum sativum L) на повышение азотфиксации с использованием симбиотических мутантов. Сельскохозяйственная биология, 2012, 1: 105-109 ( ) DOI: 10.15389/agrobiology.2012.1.105rus
- Shtark O.Y., Borisov A.Y., Zhukov V.A., Tikhonovich I.A. Mutually beneficial legume symbioses with soil microbes and their potential for plant production. Symbiosis, 2012, 57(3): 51-62 ( ) DOI: 10.1007/s13199-013-0226-2
- Борисов А.Ю., Цыганов В.Е., Штарк О.Ю., Якоби Л.М., Наумкина Т.С., Сердюк В.П., Вишнякова М.А. Горох (Симбиотическая эффективность): Каталог мировой коллекции ВИР/Под ред. И.А. Тихоновича, М.А. Вишняковой. СПб, 2002, вып. 728.
- Агрохимические методы исследования почв/Под ред. А.В. Соколова. М., 1975.
- Safronova V.I., Novikova N.I. Comparison of two methods for root nodule bacteria preservation: lyophilization and liquid nitrogen freezing. J. Microbial. Meth., 1996, 24(3): 231-237 ( ) DOI: 10.1016/0167-7012(95)00042-9
- Afonin A., Sulima A., Zhernakov A., Zhukov V. Draft genome of the strain RCAM1026 Rhizobium leguminosarum bv. viciae. Genomics Data, 2017, 11: 85-86 ( ) DOI: 10.1016/j.gdata.2016.12.003
- Борисов А.Ю., Розов С.М., Цыганов В.Е., Куликова О.А., Колычева А.Н., Якоби Л.М., Овцына А.О., Тихонович И.А. Выявление симбиотических генов гороха (Pisum sativum L.) с использованием экспериментального мутагенеза. Генетика, 1994, 30(11): 1484-1494.
- Цыганов В.Е., Ворошилова В.А., Кукалев А.С., Якоби Л.М., Азарова Т.С., Борисов А.Ю., Тихонович И.А. Гены гороха (Pisum sativum L.) Sym14 и Sym35 контролируют инициацию роста инфекционной нити в процессе развития симбиотических клубеньков. Генетика, 1999, 35(3): 352-360.
- Ахтемова Г.А., Першина Е.В., Пинаев А.Г., Андронов Е.Е., Штарк О.Ю., Чеботарь В.К., Борисов А.Ю., Тихонович И.А., Кипрушкина Е.И., Абдурашитов С.Ф., Джианиназзи-Пирсон В. Формирование структуры бактериального сообщества в отвалах заводов по переработке Сахарной свеклы. Сахар, 2010, 10: 30-36.
- Oka-Kira E., Kawaguchi M. Long-distance signaling to control root nodule number. Curr. Opin. Plant Biol., 2006, 9(5): 496-502 ( ) DOI: 10.1016/j.pbi.2006.07.012
- Mortier V., Holsters M., Goormachtig S. Never too many? How legumes control nodule numbers. Plant, Cell & Environment, 2012, 35(2): 245-258 ( ) DOI: 10.1111/j.1365-3040.2011.02406.x
- Штарк О.Ю., Борисов А.Ю., Жуков В.А., Неманкин Т.А., Тихонович И.А. Многокомпонентный симбиоз бобовых c полезными почвенными микроорганизмами: генетическое и эволюционное обоснование использования в адаптивном растениеводстве. Экологическая генетика, 2011, 2: 80-94.


