Симбиотические взаимоотношения грибов Fusarium и Alternaria, колонизирующих зерно овса
Автор: Орина А.С., Гаврилова О.П., Гагкаева Т.Ю., Лоскутов И.Г.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Генетические ресурсы, интрогрессия, иммунитет (к 130-летию со дня рождения Н.И. Вавилова)
Статья в выпуске: 5 т.52, 2017 года.
Бесплатный доступ
Известно, что в естественной микобиоте зерна доминируют представители родов Fusarium и Alternaria. Также очевидно, что, обитая совместно на общем субстрате, они могут влиять друг на друга. В представленном исследовании мы впервые показали, что взаимоотношения между продуцирующими токсины грибами Fusarium и Alternaria, обитающими на зерне овса Avena L., имеют симбиотический характер. Селекционные сорта и перспективные линии овса (21 генотип) разного эколого-географического происхождения, сохраняемые в мировой коллекции ВИР (Всероссийский институт генетических ресурсов растений им. Н.И. Вавилова), были оценены по зараженности грибами Fusarium и Alternaria с помощью количественной ПЦР (qPCR) и накоплению микотоксина дезоксиниваленола (ДОН). Наиболее зараженными грибами Alternaria и F. culmorum оказались генотипы Gere, Våler, КСИ 731/01 и КСИ 432/08. Максимальные количества микотоксина (до 1179 мкг/кг) были выявлены в зерне селекционной линии КСИ 432/08, а также сортов Belinda и Конкур. Самым устойчивым к заражению грибами Alternaria и F. culmorum при минимальном накоплении ДОН оказался сорт Стиплер. Генотипы овса c более крупным зерном сильнее подвергались заражению грибами, а генотипы с высоким показателем пленчатости содержали больше ДОН. При анализе образцов зерна была выявлена высокая достоверная связь между содержанием ДНК F. culmorum и ДНК видов Fusarium spp., способных продуцировать трихотеценовые микотоксины (Tri- Fusarium ) ( r = +0,67, p
Овес, зерно, грибы, днк, дезоксиниваленол, симбиотические отношения
Короткий адрес: https://sciup.org/142214088
IDR: 142214088 | УДК: 633.13:579.26:632.4.01/.08 | DOI: 10.15389/agrobiology.2017.5.986rus
Текст научной статьи Симбиотические взаимоотношения грибов Fusarium и Alternaria, колонизирующих зерно овса
Н.И. Вавилов писал, что иммунитет растения к заболеванию приходится рассматривать как результат взаимодействия многих слагаемых, связанных со средой обитания (1). Взаимовлияние патогенов в сообществе микобиоты зерна, несомненно, влияет на их жизнедеятельность, что в конечном счете сказывается и на отношениях с растением-хозяином. Поэтому селекцию на устойчивость к заболеванию можно успешно проводить только с учетом всех факторов среды.
Грибы рода Fusarium Link вызывают фузариоз — вредоносное заболевание зерновых культур, приводящее к снижению урожая и ухудшению его качества. Особенность этой болезни заключается в ее специфической этиологии: в инфекционном процессе участвуют разнообразные виды рода Fusarium . Так, в одном образце зерна могут сосуществовать от 10 до 20 представителей рода при явном доминировании одного вида или группы видов, наиболее адаптированных в конкретных условиях среды . F. culmorum (W. G. Smith) Sacc. — агрессивный патоген зерновых культур в регионах с умеренным климатом, способный также заражать многие другие виды растений. С наибольшей частотой гриб отмечается в центральной и северной Европе (2, 3), на территории России — в Центральном, ЦентральноЧерноземном и Северо-Западном регионах (4-6). F. culmorum продуцирует
∗ Исследование выполнено при финансовой поддержке Российского научного фонда (проект ¹ 14-2600067).
дезоксиниваленол (ДОН), 3-ацетат-ДОН и реже ниваленол (7). Эти микотоксины относятся к наиболее широко распространенной и изученной группе трихотеценовых метаболитов, представляющих значительную угрозу при употреблении контаминированного зерна. Существуют модели оценки развития фузариоза и накопления микотоксинов, учитывающие влияние сорта, окружающей среды, агрономических приемов, однако не всегда фактическая контаминация зерна грибами и микотоксинами соответствует прогнозируемой, что может быть, по мнению многих исследователей, обусловлено влиянием сопутствующей микобиоты (8-10). Действительно, обычно фузариевые грибы не являются единственными в микобиоте зерна и сосуществуют с ее другими представителями.
В природе все грибы неизбежно взаимодействуют прямо или косвенно — как контактно при конкуренции за субстрат, так и аллелопатиче-ски за счет влияния вторичных метаболитов, накапливаемых в субстрате, а также летучих органических соединений, функции которых до сих пор недостаточно расшифрованы (11-13). Грибы рода Alternaria Nees, присутствующие в зерне одновременно с грибами Fusarium , выделяют с высокой частотой (14-16). На зерновых культурах встречаются около 30 видов рода Alternaria , таксономическое положение многих из которых остается неясным (15, 17). Чаще всего упоминают мелкоспоровые виды A. alternata (Fr.) Keissl, A. tenuissima (Kunze) Wiltshire и A. infectoria E.G. Simmons, которые имеют сходные морфологические признаки (17, 18), что зачастую приводит к ошибочной идентификации перечисленных видов. Между тем, по некоторым данным, эти виды различаются по способности продуцировать вторичные метаболиты, например альтернариол (АОЛ) (18), и, как следствие, влиять на остальных представителей микобиоты. Показано, что наличие Alternaria по-разному соотносится с зараженностью зерна другими грибами. Так, сообщалось, что у пшеницы количество ДНК Alternaria spp. отрицательно коррелировало с содержанием ДНК F. graminearum Schwabe в остях и зерне (19) и зараженность A. alternata приводила к снижению накопления ДОН в зерне (20). Однако другие исследователи, несмотря на заметные количества ДНК Fusarium и Alternaria , не выявили достоверной связи между обилием этих грибов на зерне ячменя, ржи и пшеницы (21).
Овес Avena L. — пленчатая культура, зерно которой в значительной степени поражается грибами разной степени патогенности (22), взаимодействия между которыми в процессе колонизации растительной ткани изучено недостаточно. Cообщения о взаимном влиянии типичных представителей Fusarium и Alternaria , сосуществующих на одном субстрате, в случае поражения зерна немногочисленны.
В представленном исследовании мы впервые показали симбиотический характер взаимоотношений между грибами Fusarium и Alternaria , обитающими на зерне овса, что имеет важное практическое значение, так как эти грибы продуцирую опасные для человека и животных микотоксины.
Цель работы заключалась в изучении взаимодействия между типичными представителями естественной микобиоты зерна овса — грибами Alternaria и Fusarium на основании определения содержания ДНК этих патогенов в зерне и его загрязнения микотоксинами.
Методика . Зараженность зерна грибами Fusarium и Alternaria оценили у селекционных сортов и перспективных линий овса Avena sativa L. (19 генотипов) и A. byzantina C. Koch (сорта Медведь и CDC Dancer) разного эколого-географического происхождения, сохраняемых в мировой коллекции ВИР (Всероссийский институт генетических ресурсов растений им. Н.И. Вавилова). Растения каждого генотипа выращивали в рядках дли-987
ной 1 м в двух повторностях (экспериментальная станция, г. Пушкин, Ленинградская обл., 2015 год). В фазу выметывания растения инокулировали суспензией конидий и мицелия (1,3½107 КОЕ/мл) четырех штаммов F. cul-morum — MFG 58219, 58562, 58578, 58585 (коллекция микроорганизмов лаборатории микологии и фитопатологии, Всероссийский НИИ защиты растений). Расход суспензии составлял 50 мл/м2. В качестве неинокулиро-ванного контроля дополнительно высевали овес сорта Borrus, который ранее охарактеризовали как среднеустойчивый к фузариозу зерна (23). Этот участок обрабатывали стерильной водой.
После сбора и обмолота урожая учитывали массу 1000 зерен при влажности 12 % и долю цветковой пленки согласно методическим указаниям (24). У каждого генотипа определяли массу 1000 зерен, для чего из образца отбирали две порции по 250 зерен, взвешивали и полученную величину удваивали. Пленчатость генотипа оценивали взвешиванием 4 порций зерна (по 50 шт.), из которых в двух цветковые пленки сохраняли, а в двух снимали вручную, рассчитывая процент массы пленок от общей массы зерна. Среднее значение массы принимали, если расхождение между двумя измерениями не превышало 5 % от средней. При б о льших различиях, взвешивали новую порцию зерен и вновь рассчитывали среднее значение между ближайшими показателями. Зерно каждого образца (10 г) гомогенизировали в стерильных размольных стаканах на мельнице Tube Mill Control («IKA», Германия) при 25000 об/мин в течение 25 с. Размолотую муку хранили при -20 °С до последующей экстракции ДНК и микотоксинов.
ДНК выделяли из 200 мг зерновой муки адаптированным СТАВ-методом (25). ДНК типовых штаммов грибов F. culmorum и Alternaria al-ternata (Fr.) Keiss получали из активно растущего мицелия с помощью набора реагентов Genomic DNA Purification Kit («Thermo Fisher Scientific», США) в соответствии с прилагаемым протоколом. Концентрацию ДНК оценивали на флуориметре Qubit 2.0 с набором реагентов Quant-iT dsDNA HS Assay Kit («Thermo Fisher Scientific», США). Исходные препараты ДНК грибов разбавляли до концентрации 10 нг/мл и использовали для построения калибровочной кривой (10-кратные последовательные разведения от 10-1 до 10-6 нг/мл). ДНК, выделенную из зерна, доводили до рабочих концентраций в диапазоне 2-50 нг/мл.
Содержание ДНК F. culmorum в муке образцов зерна оценивали методом количественной ПЦР в реальном времени (qPCR) с красителем SYBR Green (26). Реакцию проводили в объеме 20 мкл, содержащем 4 мкл 5½ qPCRmix-HS SYBR мастер-микса («Евроген», Россия), 300 нМ каждого праймера («Евроген», Россия) и 2 мкл раствора ДНК. Содержание ДНК грибов Tri- Fusarium, Alternaria и F. poae определяли методом qPCR с флуоресцентными пробами TaqMan (27-29) в объеме реакционной смеси 20 мкл, содержащем 10 мкл 2½ TaqAB мастер-микс («АлкорБио», Россия), 300 нМ каждого праймера, 100 нМ флуоресцентной пробы («Евроген», Россия) и 2 мкл раствора ДНК, применяя рекомендуемые протоколы с авторскими модификациями. Амплификацию выполняли на термоциклере CFX96 Real-Time System («Bio-Rad», США), обработку первичных данных — с помощью программного обеспечения Bio-Rad CFX Manager 1.6. Количество ДНК грибов выражали как долю от общей ДНК, выделенной из зерновой муки (нг/нг общей ДНК).
Количество ДОН в размолотом зерне определяли методом конкурентного иммуноферментного анализа (ИФА). Микотоксин экстрагировали из 1 г муки, добавляя 5 мл раствора ацетонитрил:вода (84:16), и оставляли на 14-16 ч при постоянном перемешивании (300 об/мин) на шейкере 988
S-3M («ELMI», Латвия). ИФА проводили с помощью тест-системы с пределом чувствительности 20 мкг/кг (ВНИИВСГЭ, Россия). Оптическую плотность растворов измеряли на фотометре LEDETECT 96 («Biomed», Австрия) при X = 492 нм.
Все лабораторные анализы выполняли не менее чем в двух повторности. Результаты обрабатывали с помощью статистических пакетов программ Microsoft Excel 2010 («Microsoft Corporation», США), Statistica 10.0 («StatSoft, Inc.», США) и 4.PAST (30). В таблице приведены средние ( X ) со стандартной ошибкой (±SE), на рисунке — средние ( X ) со стандартным отклонением (±SD). Связи между изученными показателями оценивали методом корреляционного анализа, используя критерий Пирсона. Рассчитанные коэффициенты считали статистически значимыми при p < 0,05.
Результаты . Мы проанализировали генотипы овса, представленные пленчатыми сортами и перспективными линиями. У этих генотипов масса 1000 зерен варьировала в пределах 29,8-46,7 г, доля цветковых пленок в общей массе составила 22,8-28,6 % (табл. 1).
-
1. Основные характеристики сортов и селекционных линий овса ( Avena L.) из мировой коллекции ВИР (Всероссийский институт генетических ресурсов растений им. Н.И. Вавилова), использованных в исследовании (экспериментальная станция, г. Пушкин, Ленинградская обл., 2015 год)
¹ по
каталогу ВИР
Сорт, линия
Происхождение
Пленчатость, % ( X ±SE)
Масса 1000 зерен, г ( X ±SE)
к-14648
Аргамак
Россия, Кировская обл.
24,5±3,2
36,9±5,6
к-11840
Borrus
Германия
28,3±3,7
34,9±5,3
к-15068
Конкур
Россия, Ульяновская обл.
25,7±3,4
42,5±6,9
к-10841
Бисуандороду
Россия, Сахалинская обл.
25,6±3,4
34,4±5,0
к-14329
Kouzan Zairai
Япония
24,5±3,2
42,0±6,4
к-13911
Камбулинский
Россия, Ленинградская обл.
25,0±3,3
43,0±6,6
к-14911
Belinda
Швеция
25,5±3,3
42,0±6,4
к-15297
Geszty
Венгрия
22,8±2,7
29,8±4,5
к-15301
CDC Dancer
Канада
23,7±3,1
41,7±6,3
к-15506
Fux
Германия
24,6±3,2
39,4±6,0
к-15442
Залп
Россия, Московская обл.
25,8±3,0
41,5±6,3
к-15496
Стиплер
Россия, Ульяновская обл.
26,4±3,5
44,5±6,8
к-15444
Сапсан
Россия, Кировская обл.
24,3±3,2
43,8±6,6
к-15494
Медведь
Россия, Кировская обл.
27,2±3,8
46,7±7,1
к-15348
Hurdal
Норвегия
24,5±3,2
42,8±6,5
к-15353
Odal
Норвегия
23,3±3,1
40,4±6,1
к-15611
Bessin
Норвегия
25,3±3,3
44,4±6,2
к-15612
Vеler
Норвегия
24,2±3,2
41,2±6,3
к-15347
Gere
Норвегия
24,0±3,1
37,8±5,7
к-15326
КСИ 432/08
Россия, Ульяновская обл.
28,6±3,7
42,9±6,5
к-15327
КСИ 731/01
Россия, Ульяновская обл.
25,0±3,3
43,1±6,5
-
2. Последовательности использованных праймеров и проб и условия qPCR в исследовании
Объект (ссылка)
Название праймеров и проб
Нуклеотидная последовательность 5 '^ 3 '
Протокол амплификации
F. culmorum
FculC561f
CACCGTCATTGGTATGTTGTCACT
2 мин при 50 ° С, 10 c
(27)
FculC614r
CGGGAGCGTCTGATAGTCG
при 95 ° С; 40 циклов: 15 с при 95 ° С, 60 с
при 62 ° С
F. poae
TMpoae,f
GCTGAGGGTAAGCCGTCCTT
15 c при 95 ° С; 40 ци-
(28)
TMpoae,r
TMpoae,p
TCTGTCCCCCCTACCAAGCT
TET-ATTTCCCCAACTTCGACTCTCCGAGGA-BHQ1
клов: 15 с при 95 ° С, 1 мин при 60 ° С
Tri -Fusarium
TMTRI,f
CAGCAGMTRCTCAAGGTAGACCC
3 мин при 95 ° С; 40 ци-
(29)
TMTRI,r
TMTri,p
AACTGTAYACRACCATGCCAAC
Cy5-AGCTTGGTGTTGGGATCTGTCCTTACCG-BHQ2
клов: 15 с при 95 ° С, 60 с при 60 ° С
Alternaria
DirITSAlt
TGTCTTTTGCGTACTTCTTGTTTCCT
3 мин при 95 ° С; 40 ци-
(30)
InvITSAlt AltTM
CGACTTGTGCTGCGCTC
FAM-AACACCAAGCAAAGCTTGAGGGTACAAAT-TAMRA
клов: 10 с при 95 ° С, 60 с при 60 ° С, 3 с при 72 ° С
П р и м е ч а н и е. Tri -Fusarium — все виды грибов Fusarium , способные продуцировать трихотеценовые микотоксины.
Протоколы амплификации суммирует таблица 2.
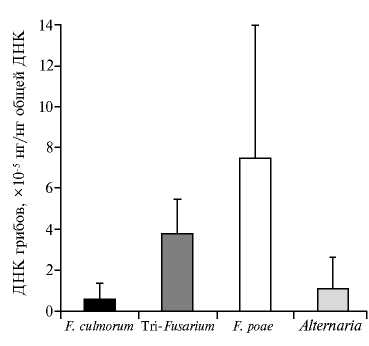
Содержание ДНК грибов в зерне при инокуляции растений овса ( Avena L.) суспензией штаммов MFG 58219, 58562, 58578, 58585 Fusarium culmorum , выявленное методом qPCR ( X ±SD, экспериментальная станция, г. Пушкин, Ленинградская обл., 2015 год).
Наряду с F. culmorum в зерне овса выявляют других представителей Fusarium , в том числе способных образовывать микотоксины трихотеце-новой группы. Поэтому дополнительно мы оценивали содержание ДНК гриба F. poae , встречающегося в микобиоте зерна овса с высокой частотой (5, 31, 32). Кроме того, используя группоспецифичные праймеры, дополнительно определяли количество ДНК всех видов Fusarium , способных продуцировать трихотецено-вые микотоксины (Tri -Fusarium ), а также грибов рода Alternaria .
Количество биомассы F. cul-morum в зерне сорта Borrus (неиноку-лированный контроль) при оценке методом qPCR в среднем составило (1,45±0,24)½10-6, группы Tri -Fusarium —
(1,73±0,02)½10-5, F. poae — (2,23±0,33)½10-5, Alternaria — (6,24±0,31)½10-7 нг/нг общей ДНК. На фоне инокуляции грибом F. culmorum обилие перечислен- ных видов существенно различалось. Количество ДНК F. culmorum в зерне у генотипов варьировало от 7,39½10-8 до 3,07½10-5 нг/нг общей ДНК и в среднем составило (5,3±0,42)½10-6 нг/нг общей ДНК (рис.). Общее количество ДНК грибов Tri-Fusarium находилось в пределах от 1,5½10-5 до 9,1½10-5, в среднем (5,3±0,28)½10-5 нг/нг общей ДНК, ДНК F. poae — составило 1,05½10-5-3,06½10-4 и в среднем равнялось (7,45±0,83)½10-5 нг/нг общей ДНК. Для ДНК Alternaria были получены показатели от 3,9½10-7 до 5,4½10-5, или среднем (1,07±0,6)½10-5 нг/нг общей ДНК. По всей видимости, виды Alternaria хорошо адаптированы и занимают свою нишу среди различных представителей микобиоты, независимо от влияния условий окружающей среды и генотипа растения-хозяина. Образцы Gere, Vеler, КСИ 731/01, КСИ 432/08 оказались наиболее инфицированными грибами F. culmorum и Alternaria.
Метод qPCR позволяет оценивать содержание ДНК целевого объекта в зерне, однако имеет свои ограничения. Так, праймеры для количественного выявления видов Tri- Fusarium и F. culmorum созданы на основе нуклеотидной последовательности генов, которые присутствуют в геноме в единичных копиях, — соответственно Tri-5 и EF1 (26, 27). В отличие от них праймеры для количественного выявления гриба F. poae и видов рода Alternaria разработаны на основе мультикопийных последовательностей IGS- и ITS-регионов рибосомальной ДНК (28, 33). Изначальные различия между исходными количествами амплифицируемых фрагментов позволяют сравнивать генотипы между собой по инфицированности тем или другим целевым объектом, но не дают возможности сравнивать содержание ДНК разных объектов между собой в одном образце.
Результаты ИФА показали, что 100 % проанализированных генотипов овса на фоне искусственной инокуляции F. culmorum содержали ДОН (от 25 до 1179 мкг/кг, в среднем 198±57 мкг/кг). Наибольшие количества микотоксина отмечали в зерне селекционной линии КСИ 432/08, а также у сортов Belinda и Конкур. У самого устойчивого к заражению всеми гри- бами сорта Стиплер содержание ДОН составило 33 мкг/кг. В зерне не-инокулированного контроля (сорт Borrus) ДОН не обнаружили.
Корреляционный анализ выявил высокую достоверную связь между количеством ДНК F. culmorum и ДНК группы грибов Tri- Fusarium ( r = +0,67, p < 0,001), что демонстрирует успешность проведенной инокуляции (табл. 3). Также имелась сильная связь между количеством ДНК F. culmorum — продуцента ДОН и содержанием этого микотоксина ( r = +0,57, p < 0,01).
3. Взаимосвязь показателей ( r ) при оценке генотипов овса ( Avena L.) на фоне инокуляции грибом Fusarium culmorum (экспериментальная станция, г. Пушкин, Ленинградская обл., 2015 год)
|
Показатель |
Содержание ДНК в зерне |
Содержа- |
|||
|
Показатель |
F. culmorum |
F. poae |
Tri- Fusarium |
Alternaria |
ние ДОН |
|
Содержание ДНК в зерне: |
|||||
|
F. poae |
- 0,34 |
||||
|
Tri- Fusarium |
0,67** |
- 0,25 |
|||
|
Alternaria |
0,66** |
- 0,27 |
0,86** |
||
|
Содержание ДОН |
0,57* |
0,19 |
0,21 |
0,18 |
|
|
Пленчатость |
0,37 |
0,08 |
- 0,06 |
0,01 |
0,49* |
|
Масса 1000 зерен |
0,34 |
- 0,25 |
0,45* |
0,39 |
0,16 |
П р и м е ч а н и е. ДОН — дезоксиниваленол .
*, ** Коэффициенты корреляции статистически значимы соответственно при р < 0,05 и р < 0,001.
Масса 1000 зерен достоверно коррелировала с содержанием ДНК Tri- Fusarium ( r = +0,45, p < 0,05) . Крупнозерные генотипы овса относительно сильнее заражались грибами, что может быть связано с большим содержанием питательных веществ в более крупных зерновках, позволяющим грибу накапливать биомассу. В то же время увеличение пленчатости приводило к существенному загрязнению зерна микотоксином ДОН. Цветковая пленка препятствует проникновению грибов в зерновку, богатую питательными субстратами, и способствует (вероятно, за счет своей структуры и химического состава) интенсивному продуцированию вторичных метаболитов грибами Fusarium .
Достоверная положительная взаимосвязь была выявлена как между содержанием ДНК грибов Alternaria и F. culmorum ( r = +0,66, p < 0,01), так и между содержанием ДНК грибов Alternaria и всего разнообразия видов Fusarium , образующих трихотеценовые микотоксины ( r = +0,86, p < 0,001) . По всей видимости, при колонизации общего субстрата агрессивными видами Fusarium и относительно слабыми патогенами Alternaria возникают взаимовыгодные условия для развития тех и других, вследствие чего их взаимоотношения можно охарактеризовать как симбиотические . Даже значительное содержание ДОН в зерне не оказывало негативного влияния на накопление биомассы грибов Alternaria. В то же время мы не наблюдали каких-либо взаимоотношений между грибами Alternaria и другим, наиболее обильным на зерне представителем рода Fusarium — относительно слабым патогеном F. poae . Следовательно, в процессе колонизации зерна овса между этими грибами не возникает конкуренции за питательный субстрат и их взаимоотношения могут быть охарактеризованы как комменсализм.
Известно, что некоторые микотоксины, образуемые грибами, могут играть важную роль во взаимоотношениях между грибами и растениями-хозяевами (2, 10, 14). В нашем исследовании мы не обнаружили аллелопатического влияния микотоксинов гриба F. culmorum на грибы рода Alter-naria, хотя некоторые исследователи отмечали различные типы взаимодействия между представителями этих родов. В частности, описано замедление роста А. alternata под действием F. graminearum в лабораторных экспериментах при совместном культивировании (34). В такой смешанной куль- туре образование микотоксина ДОН грибом F. graminearum оказалось ниже, а продукция зеараленона (ЗЕН) — выше, чем в чистой культуре этого патогена. Еще одна группа исследователей сообщает, что скорость колонизации зерна пшеницы грибом A. tenuissima и количество образуемых им вторичных метаболитов, например АОЛ, существенно увеличивались, если зерно предварительно обрабатывали микотоксинами ДОН или ЗЕН (35). Обработка зерна АОЛ имела незначительный эффект на F. culmorum, но приводила к усилению роста F. graminearum. В то же время присутствие грибов Fusarium на колосе не влияло на количество АОЛ.
Таким образом, нами выявлены симбиотические взаимоотношения между грибами Alternaria и Fusarium , колонизирующими зерно овса. Статистический анализ данных подтвердил, что между обилием этих грибов в зерне существует достоверная положительная связь, которая особенно значима при сочетании грибов Alternaria и высокоагрессивного вида F. cul-morum . Между F. poae , который считается относительно слабым патогеном, и грибами рода Alternaria не возникает конкуренции за питательный субстрат в процессе колонизации зерна овса, следовательно, их взаимоотношения могут быть охарактеризованы как комменсализм. Взаимодействие грибов и растений сложилось в процессе эволюции, и знание его механизмов в сложных экосистемах необходимо для их контроля.
Список литературы Симбиотические взаимоотношения грибов Fusarium и Alternaria, колонизирующих зерно овса
- Вавилов Н.И. Избранные произведения в двух томах. Т. 2. Учение о иммунитете растений к инфекционным заболеванием/Под ред. Ф.Х. Бахтеева. Л., 1967.
- Xu X., Nicholson P. Community ecology of fungal pathogens causing wheat head blight. Ann. Rev. Phytopathol., 2009, 47: 83-103 ( ) DOI: 10.1146/annurev-phyto-080508-081737
- Scherm B., Balmas V., Spanu F., Pani G., Delogu G., Pasquali M., Migheli Q. Fusarium culmorum: causal agent of foot and root rot and head blight on wheat. Mol. Plant Pathol., 2013, 14(4): 323-341 ( ) DOI: 10.1111/mpp.12011
- Левитин М.М., Иващенко В.Г., Шипилова Н.П., Нестеров А.Н., Гагкаева Т.Ю., Поторочина И.Г., Афанасьева О.Б. Возбудители фузариоза колоса зерновых культур и форм проявления болезни на северо-западе России. Микология и фитопатология, 1994, 28(3): 58-64.
- Гаврилова О.П., Гагкаева Т.Ю., Буркин А.А., Кононенко Г.П. Зараженность грибами рода Fusarium и контаминация микотоксинами зерна овса и ячменя на севере Нечерноземья. Сельскохозяйственная биология, 2009, 6: 89-93.
- Гагкаева Т.Ю., Гаврилова О.П., Левитин М.М. Биоразнообразие и ареалы основных токсинпродуцирующих грибов рода Fusarium. Биосфера, 2014, 6(1): 36-45.
- Pasquali M., Beyer M., Logrieco A. et al. A European database of Fusarium graminearum and F. culmorum trichothecene genotypes. Front. Microbiol., 2016, 7: 406 ( ) DOI: 10.3389/fmicb.2016.00406
- Schaafsma A.W., Hooker D.C. Climatic models to predict occurrence of Fusarium toxins in wheat and maize. Int. J. Food Microbiol., 2007, 119: 116-125 ( ) DOI: 10.1016/j.ijfoodmicro.2007.08.006
- Lindblad M., Börjesson T., Hietaniemi V., Elen O. Statistical analysis of agronomical factors and weather conditions influencing deoxynivalenol levels in oats in Scandinavia. Food Addit. Contam., 2011, 29(10): 1566-1571 ( ) DOI: 10.1080/19440049.2011.647335
- Müller M.E.H., Steier I., Köppen R., Siegel D., Proske M., Korn U., Koch M. Cocultivation of phytopathogenic Fusarium and Alternaria strains affects fungal growth and mycotoxin production. J. Appl. Microbiol., 2012, 113: 874-887 ( ) DOI: 10.1111/j.1365-2672.2012.05388.x
- Solomon P.S. Assessing the mycotoxigenic threat of necrotrophic pathogens of wheat. Mycotoxin Res., 2011, 27: 231-237 ( ) DOI: 10.1007/s12550-011-0108-5
- Savelieva E., Gustyleva L., Kessenikh E., Khlebnikova N., Leffingwell J., Gavrilova O., Gagkaeva T. Study of the vapor phase over Fusarium fungi cultured on various substrates. Chemistry and Biodiversity, 2016, 13(7): 891-903 ( ) DOI: 10.1002/cbdv.201500284
- Weikl F., Ghirardo A., Schnitzler J.-P., Pritsch K. Sesquiterpene emissions from Alternaria alternata and Fusarium oxysporum: effects of age, nutrient availability, and co-cultivation. Scientific Reports, 2016, 6: 22152 ( ) DOI: 10.1038/srep22152
- Kosiak B., Torp M., Skjerve E., Andersen B. Alternaria and Fusarium in Norwegian grains of reduced quality -a matched pair sample study. Int. J. Food Microbiol., 2004, 93(1): 51-62 ( ) DOI: 10.1016/j.ijfoodmicro.2003.10.006
- Ганнибал Ф.Б. Alternaria spp. в семенах зерновых культур в России. Микология и фитопатология, 2008, 42(4): 359-368.
- Гаврилова О.П., Ганнибал Ф.Б., Гагкаева Т.Ю. Зараженность зерна овса грибами Fusarium и Alternaria и ее сортовая специфика в условиях северо-запада России. Сельскохозяйственная биология, 2016, 51(1): 111-118 ( ) DOI: 10.15389/agrobiology.2016.1.111rus
- Simmons E.G. Alternaria. An Identification Manual. Utrecht, CBS, 2007.
- Andersen B., Krøger E., Roberts R.G. Chemical and morphological segregation of Alternaria arborescens, A. infectoria and A. tenuissima species-group. Mycol. Res., 2002, 106(2): 170-182 ( ) DOI: 10.1017/S0953756201005263
- Lević J., Stanković S., Krnjaja V., Tančić S., Ivanović D., Bočarov-Stan-čić A. Relationships of mycobiota on rachides and kernels of wheat. Eur. J. Plant Pathol., 2012, 134(2): 249-256 ( ) DOI: 10.1007/s10658-012-9982-8
- González H.H.L., Martínez E.J., Pacin A., Resnik S.L. Relationship between Fusarium graminearum and Alternaria alternata contamination and deoxynivalenol occurrence on Argentinian durum wheat. Mycopathologia, 1999, 144: 97-102.
- Kulik T., Treder K., Załuski D. Quantification of Alternaria, Cladosporium, Fusarium and Penicillium verrucosum in conventional and organic grains by qPCR. J. Phytopathol., 2015, 163: 522-528 ( ) DOI: 10.1111/jph.12348
- Гаврилова О.П., Грибченко Э.С., Лоскутов И.Г., Гагкаева Т.Ю. Влияние цветковой пленки на микобиоту генотипов овса. Современная микология в России, 2015, 5: 44-46.
- Gagkaeva T.Y., Gavrilova O.P., Yli-Mattila T., Loskutov I.G. The sources of resistance to Fusarium head blight in VIR oat collection. Euphytica, 2013, 191(3): 355-364 ( ) DOI: 10.1007/s10681-013-0865-7
- Лоскутов И.Г., Ковалева О.Н., Блинова Е.В. Методические указания по изучению и сохранению мировой коллекции ячменя и овса. СПб, 2012.
- European commission. Community reference laboratory for GM food and feed. Event-specific for the quantitation of maize line NK603 using real-time PCR. 2005. Режим доступа: http://gmo-crl.jrc.ec.europa.eu/summaries/NK603report_mm.pdf. Без даты.
- Nicolaisen M., Suproniene S., Nielsen L.K., Lazzaro I., Spliid N.H., Justesen A.F. Real-time PCR for quantification of eleven individual Fusarium species in cereals. J. Microbiol. Meth., 2009, 76: 234-240 ( ) DOI: 10.1016/j.mimet.2008.10.016
- Halstensen A.S., Nordby K.C., Eduard W., Klemsdal S.S. Real-time PCR detection of toxigenic Fusarium in airborne and settled grain dust and associations with trichothecene mycotoxins. J. Environ. Monitor., 2006, 8: 1235-1241 ( ) DOI: 10.1039/b609840a
- Pavón M.Á., Luna A., de la Cruz S., González I., Martín R., García T. PCR based assay for the detection of Alternaria species and correlation with HPLC determination of altenuene, alternariol and alternariol monomethyl ether production in tomato products. Food Control, 2012, 25(1): 45-52 ( ) DOI: 10.1016/j.foodcont.2011.10.009
- Yli-Mattila T., Paavanen-Huhtala S., Parikka P., Hietaniemi V., Jestoi M., Gagkaeva T., Sarlin T., Haikara A., Laaksonen S., Rizzo A. Real-time PCR detection and quantification of Fusarium poae, F. graminearum, F. sporotrichioides and F. langsethiae as compared to mycotoxin production in grains in Finland and Russia. Arch. Phytopathol. Pfl., 2008, 41: 243-260 ( ) DOI: 10.1080/03235400600680659
- Hammer Ø., Harper D.A.T., Ryan P.D. PAST: Paleontological statistics software package for education and data analysis. Palaeontologia Electronica, 2001, 4(1): 9.
- Tekauz A., McCallum B., Ames N., Fetch J.M. Fusarium head blight of oat -current status in western Canada. Can. J. Plant Pathol., 2004, 26: 473-479 ( ) DOI: 10.1080/07060660409507167
- Kurowski T.P., Wysocka U. Fungi colonizing grain of winter spelt grown under two production systems. Phytopathologia, 2009, 54: 45-52.
- Konstantinova P., Yli-Mattila T. IGS-RFLP analysis and development of molecular markers for identification of Fusarium poae, Fusarium langsethiae, Fusarium sporotrichioides and Fusarium kyushuense. Int. J. Food Microbiol., 2004, 95: 321-331 ( ) DOI: 10.1016/j.ijfoodmicro.2003.12.010
- Saß V., Milles J., Krämer J., Prange A. Competitive interactions of Fusarium graminearum and Alternaria alternata in vitro in relation to deoxynivalenol and zearalenone production. International Journal of Food, Agriculture and Environment, 2007, 5: 257-261.
- Müller M.E.H., Urban K., Köppen R., Siegel D., Korn U., Koch M. Mycotoxins as antagonistic or supporting agents in the interaction between phytopathogenic Fusarium and Alternaria fungi. World Mycotoxin J., 2015, 8(3): 311-321 ( ) DOI: 10.3920/WMJ2014.1747


