Симптом центральной вены при магнитно-резонансной диагностике рассеянного склероза
Автор: Потемкина Е.А., Турчинская И.А., Ефимцев А.Ю., Труфанов А.Г., Бисага Г.Н., Полушин А.Ю., Волгина В.В.
Журнал: Вестник медицинского института "РЕАВИЗ": реабилитация, врач и здоровье @vestnik-reaviz
Рубрика: Медицинская визуализация
Статья в выпуске: 2 т.14, 2024 года.
Бесплатный доступ
Актуальность. Рассеянный склероз - это хроническое аутоиммунное демиелинизирующее заболевание, приводящее к инвалидизации пациентов в долгосрочной перспективе, что обуславливает актуальность данной проблемы. В настоящее время ведётся активное усовершенствование методов диагностики рассеянного склероза, к которым можно отнести применение симптома центральной вены при магнитно-резонансной томографии как нейровизуализационного биомаркера рассеянного склероза с высокой чувствительностью и специфичностью.Цель: определение возможности оценки симптома центральной вены по данным магнитнорезонансной томографии как потенциального диагностического биомаркера рассеянного склероза.Материал и методы. Было проведено открытое одноцентровое ретроспективное исследование данных магнитно-резонансной томографии головного мозга у 55 пациентов с верифицированным диагнозом «рассеянный склероз» (EDSS 1.0-6.5) в возрасте от 19 до 72 лет. Магнитно-резонансные изображения были получены на томографе с силой индукции магнитного поля 3.0Т. Пациентам выполняли томографию головного мозга по стандартному протоколу: Т2-ВИ, FLAIR, T1-ВИ (до и после введения контрастного вещества), SWI. Комплексный статистический анализ и оценку полученных данных магнитно-резонансной томографии проводили с использованием программы Statistica 12.Результаты. При оценке магнитно-резонансных томограмм у всех пациентов с верифицированным диагнозом в очагах рассеянного склероза был выявлен симптом центральной вены. У 14,5 % пациентов симптом центральной вены определялся в 10-30 % очагах, у 61,8 % пациентов - в 30-60 %, у 23,6 % пациентов выявлен от 60 до 95 %. Соответственно 52,7 % пациентов преодолели пороговое значение 45 %, необходимое для дифференциальной диагностики рассеянного склероза от других состояний.Выводы. Применение симптома центральной вены при магнитно-резонансной томографии помогает решить проблему дифференциальной диагностики рассеянного склероза от других демиелинизирующих заболеваний при использовании его порогового критерия - процентного количества очагов, содержащих центральные вены.
Магнитно-резонансная томография, симптом центральной вены, рассеянный склероз, flair, swi
Короткий адрес: https://sciup.org/143182955
IDR: 143182955 | УДК: 616.832-004.2:616-073.756.8 | DOI: 10.20340/vmi-rvz.2024.2.MIM.2
Текст научной статьи Симптом центральной вены при магнитно-резонансной диагностике рассеянного склероза
Рассеянный склероз (РС) – это хроническое аутоиммунное демиелинизирующее заболевание. В настоящее время ведётся активный поиск усовершенствования его диагностики [1–3]. Актуальность данного вопроса постоянно возрастает, что обусловлено как ростом выявляемых случаев, так и неизбежной инвалидизацией пациентов в долгосрочной перспективе [4].
Основными клиническими проявлениями являются:
-
- симптомы поражения спинного мозга – частичный поперечный миелит, обычно сенсорные симптомы соответствуют поражению дорсолатерального канатика; в зависимости от степени поражения симптомы могут быть односторонними или двусторонними, на уровне поражения или ниже него, что при рассеянном склерозе чаще всего возникает в шейном отделе позвоночника);
-
- неврит зрительного нерва (острое, одностороннее, болезненное снижение остроты зрения, достигающее пика в течение нескольких дней и начинающее восстанавливаться в течение нескольких недель);
-
- стволовой или мозжечковый синдром (диплопия, слабость лица или потеря чувствительности, головокружение, атаксия, невралгия тройничного нерва);
-
- когнитивные нарушения;
-
- другие клинические проявления: пароксизмальные симптомы – это преходящие, повторяющиеся, стереотипные симптомы, такие как ощущение вибрации или удара при сгибании шеи (феномен Лермитта), тонические спазмы, невралгия тройничного нерва или пароксизмальная дизартрия.
Другие, менее распространённые симптомы включают судороги и симптомы, связанные с нарушениями терморегуляции или сна [5, 6].
Существуют несколько типов течения рассеянного склероза.
Ремиттирующе-рецидивирующий рассеянный склероз (РРРС) – характеризуется острыми обострениями, от которых пациенты обычно полностью или частично выздоравливают, с периодами относительной клинической стабильности между ними.
Клинически изолированный синдром (КИС). Пациента классифицируют как КИС, если имеются клинические признаки одного обострения, а МРТ-признаки не полностью соответствует критериям РРРС.
Радиологически изолированный синдром (РИС) – определяются МР-признаки, характерные для РИС, что, в свою очередь, являлось бы случайной находкой, и в анамнезе у пациента не должно быть неврологических симптомов, указывающих на демиелинизирующее заболевание.
Первично-прогрессирующий РС (ППРС) - характеризуется наличием у пациентов прогрессирующим снижением неврологических функций с момента начала заболевания. У пациентов чаще всего клинически проявляется прогрессирующая миелопатия, хотя у них также может наблюдаться прогрессирующий мозжечковый синдром или другие симптомы.
Вторично-прогрессирующий РС (ВПРС) - характеризуется постепенным прогрессированием после первоначального диагностируемого ремиттирующе-рецидивирующего течения, возникает у 40-50 % пациентов через 15-20 лет после первого обострения. Переход из РРРС в ВПРС происходит в виде постепенного нарастания тяжести заболевания на фоне обострений и периодов стабилизаций, а затем - без четких обострений, неуклонно [5].
Верификация диагноза РС происходит на основании критериев Мак-Дональда (пересмотр от 2021 г.), в перечень которых входит и магнитно-резонансная томография (МРТ) [7-9]. Одним из недостатков диагностических критериев является ограниченная специфичность при наличии высокой чувствительности, особенно при атипичном течении, что приводит к постановке ошибочного диагноза, несвоевременному и неэффективному лечению [10].
Поэтому многие исследователи стали отмечать перспективность использования такого МР-признака, как симптом центральной вены.
Симптом центральной вены (СЦВ) - нейровизуа-лизационный биомаркер РС, потенциально обладающий высокой чувствительностью и специфичностью [11]. Впервые признак был обнаружен при проведении МРТ с использованием сверхвысокопольного томографа [9, 12, 13]. Данный симптом следует дифференцировать на SWI-последовательностях (FLAIR*, T2*), которые чувствительны к дезоксигемоглобину, что позволяет непосредственно визуализировать вену в очаге РС [2, 9, 10, 14].
SWI (Susceptibility weighted imaging - изображения, взвешенные по неоднородности/чувствительности магнитного поля) представляет собой импульсную последовательность МРТ, которая особенно чувствительна к соединениям, которые искажают локальное магнитное поле, что делает её полезной для обнаружения продуктов крови, кальция и т.д.
На SWI-изображениях к признакам СЦВ относят тонкую гипоинтенсивную линию, являющуюся паренхиматозной веной, размером менее 2 мм, проходящую через центр очага демиелинизации [9].
По мнению ряда авторов, СЦВ характерен для всех вариантов течения РС, в том числе для атипичных форм [9]. Атипичные формы РС первоначально соответствовали вариантам РС с острым началом, которые классически имели плохой прогноз. Такими являются концентрический склероз Бало, вариант рассеянного склероза Марбурга и болезнь Шильдера. Их связь с рассеянным склерозом была основана на общих проявлениях и одновременном возникновении этих вариантов у пациентов с типичным РС [15]. Многие заболевания могут «мимикрировать» МР-картину рассеянного склероза, однако СЦВ является патогномоничным только для РС. В виду высокой специфичности СЦВ можно провести дифференциальный диагноз с такими заболеваниями, как васкулопатии, синдром Сусака, системная красная волчанка, мигрень, саркоидоз, синдром Шегрена и метастатическое поражение, которые проявляются очаговым поражением головного мозга [12, 16], однако СЦВ не включён ни в один гайдлайн по диагностике РС.
Цель исследования: определить возможности оценки симптома центральной вены по данным магнитно-резонансной томографии как потенциального диагностического биомаркера рассеянного склероза.
Материалы и методы
Было проведено открытое одноцентровое ретроспективное исследование МР-данных головного мозга 55 пациентов с верифицированным диагнозом РС (EDSS 1.0-6.5) в возрасте от 19 до 72 лет. Средний возраст составил 39 ± 11,2 года. Соотношение мужчин и женщин в выборке составило 1:2 соответственно. В исследовании преимущественно участвовали пациенты с ремитирующим типом течения РС (50,9 %), а также с вторичнопрогрессирующим типом (30,9 %), с первичнопрогрессирующим типом (10,9 %) и с радиологически изолированным синдромом (7,2 %).
Верификация диагноза проводилась по данным клинико-лабораторных и МР-данных.
На сегодняшний день основными критериями диагностики являются критерии Мак-Дональда (пересмотр от 2021 г.). К МР-критериям относят диссе-минацию во времени и пространстве:
-
А . Диссеминация в пространстве: для распространения в пространстве требуется ≥ 1 гиперинтенсивных очагов на Т2-ИП (> 3 мм по длинной оси), симптоматических и/или бессимптомных, которые характерны для рассеянного склероза в двух или более из четырех следующих локализаций [1 7]:
-
- перивентрикулярный (≥ 1 очаг, за исключением случаев, когда пациент старше 50 лет; в этом случае рекомендуется искать большее количество очагов);
-
- кортикальный или юкстакортикальный (≥ 1 очаг поражения);
-
- инфратенториальный (> 1 очаг);
-
- спинной мозг (> 1 очаг).
Б. Диссеминация во времени может быть установлена одним из двух способов:
-
- появление нового гиперинтенсивного поражения (очага) на Т2ВИ или очага, накапливающего парамагнетик по сравнению с предыдущим исходным МРТ;
-
- одновременное наличие очага, накапливающего парамагнетик, и гиперинтенсивного очага на Т2ВИ без накопления контраста на любом МРТ-сканировании [17].
По клинико-лабораторным данным РС верифицировался как определение наличия олигоклональ-ных полос IgG, которые визуализируются путём нанесения образцов спинномозговой жидкости для изоэлектрического фокусирования с последующей иммунофиксацией антителом против человеческого IgG и последующим окрашиванием серебром. Этот параметр не может использоваться в качестве маркера активности заболевания или средства достижения целевых антигенов при рассеянном склерозе, поскольку было показано, что олигоклональные IgG являются нонсенс-антителами.
Определение индекса IgG, который рассчитывают по следующей формуле: IgGсмж/IgGсыворотки× Albuminсыворотки/Albuminсмж. Значение более 0,7 обычно расценивается как повышенное.
Третий маркер – ежедневный синтез IgG в ЦНС de novo, оцениваемый по следующей формуле:
[(IgG смж
– IgG сыворотки /369) – (Albumin смж
– Albumin
сыворотки /
230)×(IgGсыворотки/Albuminсыворотки)×0,43]×5. Заявленные референсные значения этого параметра варьиру- ются от –9,9 до 3,3 мг/день. Все эти параметры указывают на наличие активации B-клеток в ЦНС [18].
МР-изображения были получены на томографе с силой индукции магнитного поля 3.0Т. Пациентам выполняли МРТ головного мозга по стандартному протоколу: Т2-ВИ, FLAIR, T1-ВИ (до и после введения контрастного вещества), SWI (табл. 1).
Таблица 1. Характеристики импульсных последовательностей в составе протокола МРТ-исследования Table 1. Characteristics of pulse sequences as part of the MRI protocol
|
№ |
Импульсная последовательность |
Время сканирования |
Характеристики ИП |
|
1 |
t2 tse 320 (p2) |
2 мин 30 сек |
Поле обзора – 220×220 мм, срез – 4,0 мм, TR – 6000 мс, ТЕ – 93 мс, разрешение – 320×320 пикс., число срезов – 27 |
|
2 |
t2 tirm dark-fluid |
4 мин 30 сек |
Поле обзора –199×220 мм, срез – 4,0 мм, TR – 9000 мс, ТЕ – 93 мс, разрешение – 256×232 пикс., число срезов – 27 |
|
3 |
Т1-MPRAGE |
8 мин |
Поле обзора – 240×256 мм, срез – 1,2 мм, TR – 2300 мс, ТЕ – 3 мс, разрешение – 256×240 пикс., число срезов – 160 |
|
4 |
SWI |
4 мин 30 сек |
Поле обзора – 172×230 мм, срез – 1,2 мм, TR – 28 мс, ТЕ – 20 мс, разрешение – 221×320 пикс., число срезов – 80 |
SWI представляет собой 3D-последовательность МРТ градиентного эхо с высоким пространственным разрешением и полной коррекцией по скорости [19-21]. Стандартные характеристики SWI последовательности: TR = 25–50, TE = 20–40 и FA = 15–20° (чем больше индукция магнитного поля томографа, тем используются более короткие TE, TR и меньший FA). В отличие от большинства других традиционных последовательностей, SWI использует эффект как по фазе, так и по магнитуде [22].
Соединения, обладающие парамагнитными, диамагнитными и ферромагнитными свойствами, взаимодействуют с локальным магнитным полем, искажая его и, тем самым, изменяя фазу местной ткани, что, в свою очередь, приводит к изменению сигнала. Парамагнитные соединения включают в себя дезоксигемоглобин, ферритин и гемосидерин. К диамагнитным соединениям относят костные минералы и дистрофические кальцинаты [19].
После сбора данных происходит постобработка, которая включает в себя фильтр верхних частот для устранения фоновой неоднородности магнитного поля и применение фазовой карты для подчеркивания непосредственно наблюдаемых потерь сигнала [20, 22].
Обычно представлены следующие наборы изображений: величина, фильтрованная фаза и SWI (комбинированная величина и фаза постобработки). Часто предоставляется четвертый набор изображе- ний – проекция минимальной интенсивности (mIP), которая представляет собой всего лишь толстую часть обычных изображений SWI и лучше способна продемонстрировать венозную анатомию.
С помощью данной импульсной последовательности возможна диагностика следующих заболеваний: кавернозная ангиома, телеангиоэктазия, гипертоническая и амилоидная микроангиопатия, венозная мальформация, поверхностный сидероз, сосудистая патология (артериальная аневризма, артериовенозная мальформация), церебральная аутосомнодоминантная артериопатия с подкорковыми инфарктами и леи ̆ коэнцефалопатиеи ̆ , черепно-мозговая травма: сотрясение (лёгкая травма), диффузное аксональное повреждение (тяжёлая травма) [23].
Визуализация очагов РС у пациентов происходила на последовательностях Т2-ВИ, FLAIR, а наличие центральной вены в очаге оценивали на импульсной последовательности SWI. Все три последовательности сопоставляли и оценивали в одной плоскости.
Наличие положительного СЦВ на МР-томограмме расценивалось при наличии совокупности следующих признаков [24]:
-
- тонкая гипоинтенсивная линия на нескольких срезах SWI;
-
- диаметр линии менее 2 мм;
-
- проходит частично или полностью через очаг, визуализируемый на FLAIR при сопоставлении МР-изображений;
-
- линия локализована в центре очага и проходит через границу очага не более, чем в двух местах, несмотря на формы очага.
При наличии всех вышеописанных критериев можно высказаться о достоверном наличии вены.
Статистическая обработка полученных данных
Программа Statistica 12 использовалась для анализа размерных данных. Проведён комплексный статистический анализ данных исследования. Для статистического описания измеряемых данных проверялось их соответствие нормальному распределению и оценка средних значений и медиан с 95 % доверительными интервалами.
Ограничения исследования: необходимо обратить внимание на то, что подсчёт доли очагов РС с СЦВ – это операторозависимый метод. На сегодняшний день отсутствует тип постпроцессинга МР-изображений, помогающий в определении и выявлении очагов РС с симптомом центральной вены.
Для исключения погрешности анализ МР-данных проводился двумя независимыми рентгенологами.
За пороговое значение было принято 45 % – доля очагов с определяемым СЦВ по отношению к общему количеству очагов.
Результаты
При оценке МР-томограмм у всех пациентов с верифицированным диагнозом в очагах РС был выявлен СЦВ, который характеризовался всеми вышеописанными признаками (рис. 1–3).
Таким образом, было установлено, что диапазон очагов РС с определяемым СЦВ в выборке составил от 10 до 95 %, доля очагов с центральной веной ко всем очагам РС в среднем составила 43,3 %.
У 14,5 % пациентов СЦВ определялся в 10–30 % очагах, у 61,8 % пациентов – в 30–60 %, у 23,6 % пациентов выявлен от 60 до 95 %. Соответственно 52,7 % пациентов преодолели пороговое значение 45 %, необходимое для дифференциальной диагностики РС от других состояний.
В группе пациентов с ремиттирующим типом течения доля пациентов, преодолевших пороговое значение очагов, с СЦВ составила 46,4 %, с вторично-прогрессирующим типом – 47 %, с первичнопрогрессирующим типом – 50 %, с учётом небольшой выборки пациентов разница не представляется значительной.
Корреляции между количеством очагов с СЦВ возрастом и полом не была обнаружена.
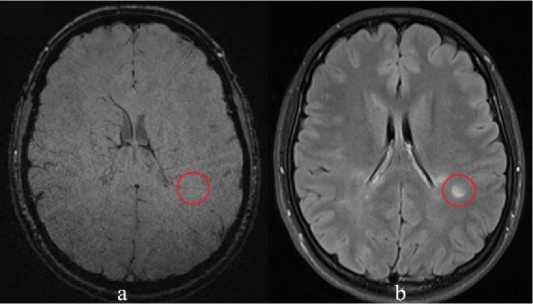
Рисунок 1. Пациент 25 лет с верифицированным диагнозом РС (ремиттирующий тип течения): a – FLAIR; b – SWI. Симптом центральной вены (обведено)
Figure 1. A 25-year-old patient with a verified diagnosis of MS (remitting type of course): a – FLAIR; b – SWI. Central vein symptom (circled)
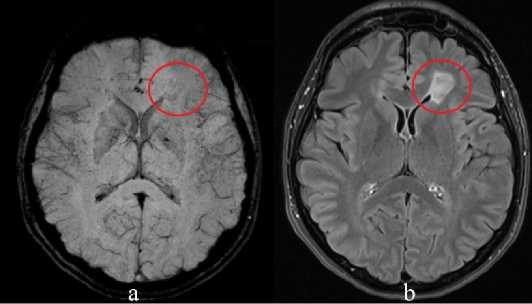
Рисунок 2. Пациентка 42 лет с верифицированным диагнозом РС (первично прогрессирующий тип течения): a – SWI, b – FLAIR. Симптом центральной вены (обведено)
Figure 2. A 42-year-old patient with a verified diagnosis of MS (primary progressive type of course): a – SWI, b – FLAIR. Central vein symptom (circled)
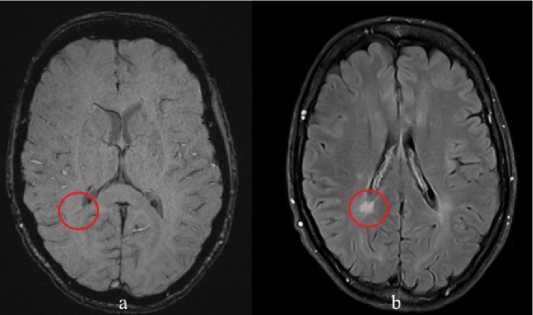
Рисунок 3. Пациентка 30 лет с верифицированным диагнозом РС (вторично прогрессирующий тип течения): a – SWI, b – FLAIR.
Симптом центральной вены (обведено)
Figure 3. A 30-year-old patient with a verified diagnosis of MS (secondary progressive MS): a – SWI, b – FLAIR. Central vein symptom (circled)
Доля пациентов преодолевших пороговое значение очагов с СЦВ
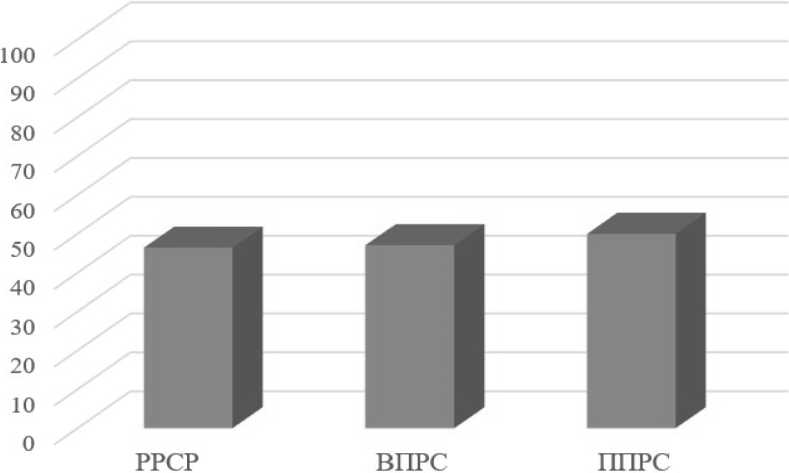
Рисунок 4. Доля пациентов. преодолевших пороговое значение очагов с СЦВ в зависимости от типа течения заболевания
Figure 4. Proportion of patients with SWI depending on the type of disease course
Обсуждение
Определяется высокая чувствительность МРТ с SWI к деоксигенированной крови и гемосидерину, что делает эту импульсную последовательность основной в визуализации микрокровоизлияний в вещество головного мозга и в оценке сосудистых структур. О синдроме центральной вены стали говорить с 2000-х гг., когда при обследовании пациентов с РС на высокопольном томографе с применением SWI-последовательности были обнаружены паренхиматозные вены, локализованные в очагах демиелинизации.
Спустя несколько лет члены комитета North American Imaging in Multiple Sclerosis (NAIMS) обобщили все результаты и выпустили практические рекомендации, содержащие радиологические характеристики данного синдрома [9].
В настоящее время идет поиск порога, при котором были бы достигнуты высокие показатели как чувствительности, так и специфичности данного симптома.
Нами было предложено несколько вариантов пороговых критериев. Например, в литературе встречается «правило 40 %», впервые введённое Evangeloy и соавт., которое оценивает процент пе-ривенулярных поражений и использует пороговое значений 40 % для рентгенологического отличия РС от других патологий, не связанных с ним [25].
Также в недавно проведённом крупном многоцентровом перекрёстном исследовании за пороговое значение было взято 35 % с достижением 68,1 % чувствительности и 82,9 % специфичности [26].
В 2019 году вышел систематический обзор и метаанализ, в котором был рассмотрен диапазон пороговых значений от 30 до 67 %. В результате исследователи пришли к выводу, что оптимальное значение порога – 45 %, т.к. при нём достигается 97 % чувствительности и 99 % специфичности [27].
В нашем исследовании принимали участие только пациенты с верифицированным диагнозом РС. В 100 % случаев были обнаружены центральные вены в очагах демиелинизации. Нами было принято решение взять предпочтительный пороговый критерий – 45 % в соответствии с данными зарубежных исследований. По полученным результатам 52,7 % пациентов преодолели данный пороговый критерий.
Таким образом, больше половины пациентов преодолели пороговое значение 45 %, которое является, по данным литературы, наиболее оптимальным значением для дифференциальной диагностики РС, однако доля всех очагов с СЦВ в выборке в среднем составила чуть больше 40 %.
Выводы
Выполнение магнитно-резонансной томографии позволяет выявить синдром центральной вены в очагах демиелинизации у пациентов с рассеянным склерозом, что может быть использовано для дифференциальной диагностики с другими очаговыми поражениями головного мозга при первичном обращении пациента.
Синдром центральной вены помогает решить проблему дифференциальной диагностики рассеянного склероза от других демиелинизирующих заболеваний при использовании его порогового критерия – процентного количества очагов, содержащих центральные вены. На сегодняшний день требуется дальнейшее изучение возможности использования синдрома центральной вены как диагностического критерия рассеянного склероза, расширение выборки пациентов и сопоставление МР-данных группы пациентов с рассеянным склерозом и другими очаговыми поражениями головного мозга.
Список литературы Симптом центральной вены при магнитно-резонансной диагностике рассеянного склероза
- Samaraweera A.P.R., Clarke M.A., Whitehead A., Falah Y., Driver I.D., Dineen R.A. et al. The Central Vein Sign in Multiple Sclerosis Lesions Is Present Irrespective of the T2* Sequence at 3 T. Journal of Neuroimaging. 201 6;27(1): 114-121. https://doi.org/10.1111/jon.12367
- Weber C. E., Sandikci V., Ebert A., Szabo K., Platten M., Gass A., Eisele P. Investigation of the "central vein sign" in infratentorial multiple sclerosis lesions. Multiple Sclerosis and Related Disorders. 2020;45:102409. https://doi.org/10.1016/j.msard.2020.102409
- Lamot U., Avsenik J., Sega S., & Surlan Popovic K. Presence of central veins and susceptibility weighted imaging for evaluating lesions in multiple sclerosis and leukoaraiosis. Multiple Sclerosis and Related Disorders. 2017;13:67-72. https://doi.org/10.1016/j.msard.2017.02.008
- La Rosa F, Wynen M, Al-Louzi O, Beck ES, Huelnhagen T, Maggi P, Thiran JP, Kober T, Shinohara RT, Sati P, Reich DS, Granziera C, Absinta M, Bach Cuadra M. Cortical lesions, central vein sign, and paramagnetic rim lesions in multiple sclerosis: Emerging machine learning techniques and future avenues. 2022. https://doi.org/ 10.1016/j.nicl.2022.103205
- Katz Sand I. Classification, diagnosis, and differential diagnosis of multiple sclerosis. Current Opinion in Neurology. 2015;28(3):193-205. https://doi.org/10.1097/wco.0000000000000206
- Oh J., Vidal-Jordana A., Montalban X. Multiple sclerosis. Current Opinion in Neurology. 2018;1. https://doi.org/10.1097/wco.0000000000000622
- Bhandari A., Xiang H., Lechner-Scott J., Agzarian M. Central vein sign for multiple sclerosis: A systematic review and meta-analysis. Clinical Radiology. 2020. https://doi.Org/10.1016/j.crad.2020.01.011
- Filippi M., Preziosa P., Rocca, M.A. MRI in multiple sclerosis. Current Opinion in Neurology. 2018;31(4):386-395. https://doi.org/10.1097/wco.000000000000057
- Belov SE, Boyko AN. A symptom of the central vein in various diseases and protocols of MRI examination. 2020. https://doi.org/ 10.17116/jnevro202212207219
- Castellaro M., Tamanti A., Pisani A. I., Pizzini F. B., Crescenzo F., Calabrese M. The Use of the Central Vein Sign in the Diagnosis of Multiple Sclerosis: A Systematic Review and Meta-analysis. Diagnostics. 2020;10(12):1025. https://doi.org/10.3390/diagnostics10121025
- Kaisey M, Solomon AJ, Guerrero BL, Renner B, Fan Z, Ayala N, Luu M, Diniz MA, Sati P, Sicotte NL (2021). Preventing multiple sclerosis misdiagnosis using the "central vein sign": A real-world study. https://doi.org/ 10.1 016/j.msard.2020.102671
- Sinnecker T., Clarke M. A., Meier D., Enzinger C., Calabrese M. et al. Evaluation of the Central Vein Sign as a Diagnostic Imaging Biomarker in Multiple Sclerosis. JAMA Neurology. 2019. https://doi.org/10.1001/jamaneurol.2019.2478
- Miller A.E., Calabresi P.A. Central vein sign in multiple sclerosis. Neurology. 2018;90(14):631-632. https://doi.org/10.1212/wnl.0000000000005241
- Eisele P., Fischer K., Szabo K., Platten M., Gass A. Characterization of Contrast-Enhancing and Non-contrast-enhancing Multiple Sclerosis Lesions Using Susceptibility-Weighted Imaging. Frontiers in Neurology. 201 9;10. https://doi.org/10.3389/fneur.2019.01082
- Ayrignac X., Carra-Dalliere C., Labauge P. Atypical inflammatory demyelinating lesions and atypical multiple sclerosis. Revue Neurologique. 2018;174(6):408-418. https://doi.org/10.! 016/j.neurol.2018.03.007
- Suh C.H., Kim S.J., Jung S.C., Choi C.G., Kim H.S. The "Central Vein Sign" on T2*-weighted Images as a Diagnostic Tool in Multiple Sclerosis: A Systematic Review and Meta-analysis using Individual Patient Data. Scientific Reports. 2019;9(1). https://doi.org/10.1038/s41598-019-54583-3
- Thompson A, Banwell B, Barkhof F et al. Diagnosis of Multiple Sclerosis: 2017 Revisions of the McDonald Criteria. The Lancet Neurology. 2018;17(2):162-73. https://doi.org/10.1016/s1474-4422(17)30470-2
- Tomioka R., Matsui M. Biomarkers for Multiple Sclerosis. Internal Medicine. 2014;53(5):361-365. https://doi.org/1 0.2169/internalmedicine.53.1
- Schweser F, Deistung A, Lehr BW et-al. Differentiation between diamagnetic and paramagnetic cerebral lesions based on magnetic susceptibility mapping. Med Phys. 2010;37 (10): 5165-78.
- Tong KA, Ashwal S, Obenaus A et al. Susceptibility-weighted MR imaging: a review of clinical applications in children. AJNR Am J Neuroradi-ol. 2008;29(1):9-17. https://doi.org/10.3174/ajnr.A0786
- Wu Z, Mittal S, Kish K et-al. Identification of calcification with MRI using susceptibility-weighted imaging: a case study. J Magn Reson Imaging. 2009;29(1):177-82. https://doi.org/10.1002/jmri.2161 7
- Barnes S., Haacke E. Susceptibility-Weighted Imaging: Clinical Angiographic Applications. Magn Reson Imaging Clin N Am. 2009;17(1):47-61. https://doi.org/10.1016/jj.mric.2008.12.002
- Пронин И.Н., Туркин А.М., Долгушин М.Б. и соавт. Тканевая контрастность, обусловленная магнитной восприимчивостью: применение в нейрорентгенологии. Мед. визуализация. 2011;3:2-11. Pronin I.N., Turkin A.M., Dolgushin M.B. et al. Tissue contrast due to magnetic susceptibility: application in neurorentgenology. Med. visualization. 2011;3:2-11. (In Russ).
- Белов С.Е., Губский И.Л., Лелюк В.Г., Бойко А.Н. Использование симптома центральной вены для дифференциальной диагностики демиелинизирующих заболеваний центральной нервной системы. Медицина экстремальных ситуаций. 2021;23(3):1 31-136. Belov S.E., Gubsky I.L., Lelyuk V.G., Boyko A.N. The use of the central vein symptom for the differential diagnosis of demyelinating diseases of the central nervous system. Emergency medicine. 2021;23(3):131 -1 36. (In Russ). https://doi.org/ 10.47183/mes.2021.021
- Ryan D, Knipe H, Baba Y et al. Central vein sign. Reference article, Radiopaedia.org (Accessed on 24 Dec 2023) https://doi.org/10.53347/rID-71999
- Sinnecker T, Clarke MA, Meier D, Enzinger C, Calabrese M, De Stefano N et al. MAGNIMS Study Group. Evaluation of the Central Vein Sign as a Diagnostic Imaging Biomarker in Multiple Sclerosis. JAMA Neurol. 2019 Dec 1;76(12):1446-1456. https://doi.org/ 10.1001/jamaneurol.2019.2478
- Suh CH, Kim SJ, Jung SC, Choi CG, Kim HS. The "Central Vein Sign" on T2*-weighted Images as a Diagnostic Tool in Multiple Sclerosis: A Systematic Review and Meta-analysis using Individual Patient Data. Sci Rep. 2019 Dec 3;9(1):18188. https://doi.org/ 10.1038/s41598-019-54583-3


