Синдром Бругада и острый инфаркт миокарда при необструктивных изменениях коронарных артерий: особенности диагностики и лечения (обзор литературы и разбор клинического случая)
Автор: Попонина Т. М., Попонина Ю. С.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические случаи
Статья в выпуске: 2 т.38, 2023 года.
Бесплатный доступ
Представлен обзор литературы с разбором клинического случая пациента с сочетанием синдрома Бругада (СБ) и инфаркта миокарда без обструктивного поражения коронарных артерий (ИМБОКА). Наличие СБ у пациента не исключает развитие у него инфаркта миокарда (ИМ). В статье обсуждаются сложности дифференциальной диагностики синдрома и фенокопий Бругада у пациентов, экстренно госпитализированных в кардиологическое отделение с рецидивирующим болевым синдромом в грудной клетке и диагнозом острого коронарного синдрома с подъемом сегмента ST (ОКСПST). Тщательный сбор анамнеза, анализ динамики электрокардиограммы (ЭКГ), проведение инвазивной коронарной ангиографии способствовали выявлению сочетания СБ и ИМБОКА у пациента.
Синдром бругада, фенокопии бругада, острый коронарный синдром с подъемом сегмента st, инфаркт миокарда при необструктивных изменениях коронарных артерий
Короткий адрес: https://sciup.org/149142839
IDR: 149142839 | УДК: 616.127-005.8-036.11:616.12-008.218-056.7:616.132.2 | DOI: 10.29001/2073-8552-2023-38-2-241-247
Текст научной статьи Синдром Бругада и острый инфаркт миокарда при необструктивных изменениях коронарных артерий: особенности диагностики и лечения (обзор литературы и разбор клинического случая)
В 2022 г. опубликованы обновленные Рекомендации экспертов Европейского общества кардиологов (ЕОК), посвященные диагностике и профилактике внезапной сердечной смерти [1]. Однако на сегодняшний день по-прежнему имеются сложности в диагностике кана-лопатий, в частности синдрома Бругада (СБ), который может дебютировать как синкопе и жизнеугрожающими желудочковыми нарушениями ритма, так и внезапной сердечной смертью [2–5]. У пациентов, госпитализированных в порядке неотложной помощи, с затяжным ангинозным синдромом, сопровождающимся изменением конечной части желудочкового комплекса в виде подъема сегмента ST на электрокардиограмме (ЭКГ), могут быть выявлены при проведении инвазивной коронаро-вентрикулографии (иКВГ) не только гемодинамически значимые стенозы, но и отсутствие обструкции коронарных артерий [6–10]. У некоторых пациентов, поступивших с предварительным диагнозом острого коронарного синдрома с подъемом сегмента ST (ОКСПST), может быть верифицирована каналопатия, в частности СБ. Нередко сложно дифференцировать наличие сочетания СБ и ОКСПST и фенокопии Бругада у пациента с ОКС-ПST [11, 12].
Описание случая
Пациент В., 31 года, был госпитализирован в порядке неотложной помощи в кардиологическое отделение № 1 НИИ кардиологии с жалобами на эпизод потери сознания однократно, а также на жгучие боли за грудиной с иррадиацией в левое плечо, руку, лопатку. За одни сутки до госпитализации после похорон родственника появились жалобы на периодически появляющиеся, до 5 раз, затяжные жгучие боли за грудиной с иррадиацией в левое плечо, руку, лопатку, возникающие в покое, продолжительностью до 15 мин, нитроглицерин не принимал. После похорон алкоголизировался. В день госпитализации внезапно потерял сознание – 1 эпизод, подобных состояний ранее не было. Родственники вызвали бригаду скорой медицинской помощи (СМП). Пришел в себя самостоятельно до приезда СМП: сердечно-легочная реанимация не проводилась. После восстановления сознания, со слов пациента, учащения частоты сердечных сокращений (ЧСС), перебоев в работе сердца не ощущал. За 3 мес. до потери сознания появились эпизоды перебоев в работе сердца, возникающие на фоне физической нагрузки, но к врачам не обращался и не обследовался.
Пациент родился в сельском поселении 2-м ребенком, рос и развивался соответственно возрасту; образование – среднее, работал водителем грузового автотранспорта. В армии служил в погранвойсках. Со слов пациента, на ЭКГ были изменения (не может уточнить характер изменений на ЭКГ), но он настоял на службе в армии. Физические нагрузки переносил хорошо. Наличие оперативных вмешательств, хронических заболеваний, черепно-мозговых травм отрицает. Вредные привычки: курит с 15 лет по настоящее время по 1 пачке сигарет в день, алкоголь – по праздникам. Случаев внезапной сердечной смерти (ВСС) среди родственников первой линии, со слов пациента, не было. Наследственность по сердечно-сосудистым заболеваниям не отягощена. Аллергический анамнез не отягощен.
Пациент был доставлен бригадой СМП в приемное отделение НИИ кардиологии с диагнозом: ОКСПST. На момент поступления сознание ясное, температура тела – 36,4 °С, кожа обычной окраски, телосложение – гиперстеническое: вес – 102 кг, рост – 180 см, индекс массы тела – 31,5: ожирение I степени; дыхание жесткое, хрипов нет, частота дыхательных движений – 16 в мин. Периферическая сатурация крови SpO2 – 99%. Границы сердца в пределах нормы. Тоны сердца приглушены, ритмичные, 104 уд/мин. АД 120/80 мм рт. ст.
На ЭКГ при поступлении в приемное отделение (рис. 1) – синусовая тахикардия, ЧСС – 104 уд/мин. Отклонение электрической оси сердца влево. Переходная зона – V3. Неполная блокада правой ножки пучка Гиса с подъемом сегмента ST по типу свода на 3 мм с переходом в отрицательный зубец Т в трех правых прекордиальных отведениях V1–V3, подъем сегмента ST на 1,5 мм в aVL, реципрокная депрессия сегмента ST в II, III, aVF; нельзя исключить ЭКГ паттерн СБ (1-й тип).
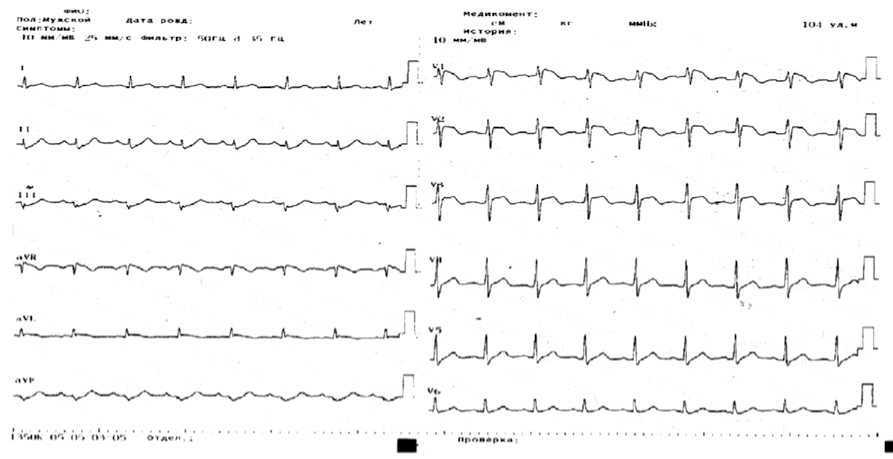
Рис. 1. ЭКГ пациента В. при поступлении Fig. 1. ECG V. at admission
При эхокардиографии (ЭхоКГ) патологии не найдено. При рентгенографии органов грудной клетки установлены признаки легочной венозной гипертензии I степени, перераспределение легочного рисунка в верхние отделы. При поступлении общий анализ крови – без патологии; выявлено повышение концентрации Тропонина I – 0,987 нг/мл (референсные значения – 0,00–0,04 нг/мл, пороговое значение для инфаркта миокарда (ИМ) – 0,5 нг/мл); МВ-Креатинкиназа (МВ-КК) – 13,00 Ед/л (референсные значения – 0,00–25,00) и Креатинкиназа (КК) – 54,00 Ед/л (референсные значения – 38– 195,00 Ед/л) – в пределах референсных значений.
Пациенту проводилось следующее лечение: инфузия нефракционированного гепарина (НФГ), скорость которой корректировалась посредством мониторинга активированного частичного тромбопластинового времени (АЧТВ), а также инфузии нитратов, метопролола; внутрь – двойная антитромбоцитарная терапия: клопидогрел, ацетилсалициловая кислота (АСК), а также розувастатин, пантопразол.
Нами был рассчитан риск внутригоспитальной и шестимесячной летальности по шкале GRACE – риск вну-тригоспитальной летальности для пациента В. составил более 8%, риск летального исхода – высокий; риск шестимесячной летальности – от 1 до 3%, риск летального исхода – средний (126 баллов).
С учетом сохраняющегося дискомфорта за грудиной, наличия изменений на ЭКГ и повышения уровня тропонина I пациенту была проведена экстренно иКВГ, заключение: тип кровоснабжения правый. Замедленный коронарный кровоток. Атеросклероз коронарных артерий не выявлен. Болевой синдром был купирован в первые сутки госпитализации. В динамике через двое суток было выявлено снижение Тропонина I до менее 0,01 нг/мл, МВ-КК – до 8,0 Ед/л, КК – до 59,0 Ед/л. Показатели плазменного гемостаза (общий фибриноген, растворимые фибрин-мономерные комплексы) оставались в пределах референсных значений, лишь АЧТВ было удлинено до
75 с на фоне инфузии НФГ и вернулось к нормальным значениям после прекращения лечения гепарином.
У пациента была выявлена гиперхолестеринемия: повышение уровня общего холестерина до 7,3 ммоль/л, к сожалению, другие показатели липидного спектра не были определены. Через сутки в динамике на ЭКГ (рис. 2) сохранялся синусовый ритм, отмечалось урежение ЧСС от 104 уд/мин, зафиксированных в день госпитализации, до 69 уд/мин. Сохранялась неполная блокада правой ножки пучка Гиса с подъемом сегмента ST на 3 мм, но не по типу свода, а по типу седла с дугой выпуклостью книзу, с переходом в положительный зубец Т в трех правых прекардиальных отведениях V1–V3, что характерно для СБ 2-го типа; сегмент ST в aVL опустился до изолинии, исчезла реципрокная депрессия сегмента ST в II, III, aVF.
У пациента имеются факторы риска ишемической болезни сердца (ИБС): мужской пол, курение, ожирение, гиперхолестеринемия. С учетом наличия факторов риска ИБС у пациента, появления жгучих болей за грудиной с типичной иррадиацией, сопровождавшихся изменениями на ЭКГ (подъем сегмента ST в I, aVL,V1– V3, реципрокная депрессия сегмента ST в II, III, aVF с последующим уменьшением степени выраженности подъема ST и исчезновением депрессии ST), повышения тропонина I с последующим его снижением, данных иКВГ (замедленный коронарный кровоток; атеросклероз коронарных артерий не выявлен) не вызывает сомнений наличие у пациента острого первичного переднего не Q-инфаркта миокарда без обструктивного поражения коронарных артерий.
До 14% всех ИМ происходит при отсутствии обструктивного (> 50% стеноз) поражения коронарных артерий [13]. Отсутствие обструктивного поражения коронарных артерий у пациента с симптомами ишемии миокарда не отрицает атеротромботической этиологии. В соответствии с Рекомендациями экспертов ЕОК [7] предложены следующие диагностические критерии ИМ без обструктивного поражения коронарных артерий (ИМБОКА):
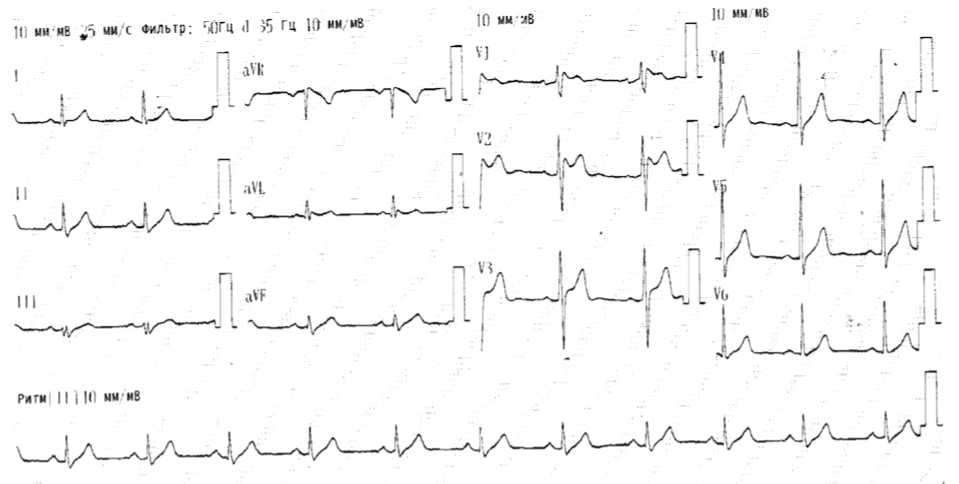
Рис. 2. ЭКГ пациента В. через сутки госпитализации Fig. 2. ECG V. after a day of hospitalization
-
1. Универсальные критерии острого ИМ: нарастание и/или снижение уровня сердечного тропонина (при условии, что хотя бы одно значение превышало 99-й перцентиль от верхней границы нормы) должно сочетаться хотя бы с одним признаком из нижеперечисленных клинических критериев: a) симптомы ишемии миокарда; b) вновь возникшие ишемические изменения на ЭКГ; c) появление патологического зубца Q; d) выявление по данным визуализирующих методик новых участков нежизнеспособного миокарда либо новых участков нарушения локальной сократимости, предположительно ишемической этиологии; e) выявление тромба в коронарных артериях по данным коронароангиографии или аутопсии).
-
2. Отсутствие окклюзии коронарной артерии по ангиографии, определяемое как отсутствие стеноза коронарной артерии ≥ 50% в потенциальной инфаркт-связанной артерии.
-
3. Нет явных причин, обусловливающих клиническое состояние.
Таким образом, не вызывает сомнений наличие ИМ-БОКА у пациента В. Согласно Рекомендациям экспертов ЕОК [7], после выполнения иКВГ и выявления отсутствия обструктивного поражения коронарных артерий в течение 2 нед. после развития ИМБОКА для уточнения этиологии заболевания показано проведение магнитно-резонансного исследования сердца, которое, к сожалению, не было выполнено в связи с отсутствием возможности проведения данного исследования. В то же время обращает на себя внимание наличие у пациента синкопе в анамнезе, а также изменений на ЭКГ, характерных для СБ 1-го типа при поступлении (неполная блокада правой ножки пучка Гиса с подъемом сегмента ST по типу свода на 3 мм с переходом в отрицательный зубец Т в отведениях V1–V3), которые через сутки трансформировались во 2-й тип (сохранялась неполная блокада правой ножки пучка Гиса с подъемом сегмента ST на 3 мм, но не по типу свода, а по типу седла с дугой выпуклостью книзу, с переходом в положительный зубец Т в трех правых прекардиальных отведениях V1–V3), и отсутствие признаков органического поражения миокарда; все это послужило основанием для постановки диагноза СБ. Пациент был осмотрен заведующим отделением хирургического лечения сложных нарушений ритма сердца и электрокардиостимуляции, был поставлен диагноз: СБ (1-й тип), рекомендована имплантация кардиовертера-дефибриллятора (АИКД) не ранее, чем через 40 дней от острого ИМ. Пациент был выписан через 7 сут в удовлетворительном состоянии со следующим комбинированным диагнозом:
ИБС. Острый первичный передний не Q-инфаркт миокарда левого желудочка. Микрососудистая коронарная ангиопатия.
СБ, 1-й тип.
Осложнения: Легочно-венозная гипертензия 1-й степени. Легочно-артериальная гипертензия 1–2-й степени. Хроническая сердечная недостаточность с сохраненной фракцией выброса (60%) I стадии. ФК II (NYHA).
Сопутствующие: Ожирение 1-й степени. Дислипидемия.
СБ был описан еще в 1992 г. [14], однако распространенность данного синдрома в общей популяции до сих пор неясна, что связано, возможно, с динамикой ЭКГ-изменений, характерных для СБ [15, 16]. СБ – это канало-патия с доминантным наследованием и различной пенетрантностью, зависимой от возраста и пола: клинические проявления заболевания встречаются чаще у взрослых и в 8 раз чаще у мужчин, чем у женщин.
Паттерн Бругада 1-го типа характеризуется наличием полной или неполной блокады правой ножки пучка Гиса с подъемом точки J > 2 мВ с выпуклой элевацией ST и инверсией зубца T, по крайней мере, в одном правом пре-кардиальном отведении ЭКГ, V1 или V2, расположенном во втором, третьем или четвертом межреберье, или при регистрации ЭКГ в верхних прекардиальных отведениях (межреберных промежутках на 1–2 ребра выше положений электродов в V1 и V2). Это может произойти спонтан- но или быть вызвано воздействием лекарств – блокаторов натриевых каналов, например, гилуритмала в дозе 1 мг/кг, прокаинамида в дозе 10 мг/кг, флекаинида 2 мг/кг, или лихорадкой [1]. На ЭКГ возможно укорочение интервала Q–T и удлинение P–Q (P–R). Типичная ЭКГ-картина напоминает морду бультерьера, поэтому данное изменение иногда называют «типом бультерьера».
СБ диагностируется у пациентов без других заболеваний сердца и спонтанным паттерном 1-го типа, независимо от симптомов, из-за его редкости в общей популяции и в связи с высоким риском внезапной сердечной смерти вследствие полиморфной желудочковой тахикардии (ЖТ) или фибрилляции желудочков [1]. Фибрилляция желудочков (ФЖ) встречается в среднем возрасте 41 ± 15 лет, но может возникать в любом возрасте, обычно во время отдыха или сна. Лихорадка, чрезмерное употребление алкоголя и обильное питание – это триггеры, которые позволяют выявить ЭКГ 1-го типа и предрасполагают к ФЖ.
СБ – наследственное заболевание, обусловленное в 20% случаев аутосомно-доминантной мутацией гена SCN5A, расположенного в коротком плече 3-й хромосомы (3p21), кодирующего биосинтез белковых субъединиц натриевого канала кардиомиоцитов.
С момента идентификации гена SCN5A в 1998 г. в качестве первого генетического виновника было выявлено более 450 патогенных вариантов в 24 генах, которые связывают с развитием СБ (ABCC9, CACNA1C, CACNA2D1, CACNB2, FGF12, GPD1L, HCN4, HEY2, KCND2, KCND3, KCNE3, KCNE5, KCNH2, KCNJ8, PKP2, RANGRF, SCN10A, SCN1B, SCN2B, SCN3B, SCN5A, SEMA3A, SLMAP, и TRPM4) [17]. Данные гены кодируют сердечные натриевые, калиевые и кальциевые ионные каналы, участвующие в формировании потенциала действия в миокарде, или ассоциированные с ними белки, что позволяет рассматривать СБ как врожденную (первичную) ионную каналопатию с аутосомно-доминантным типом наследования. СБ относится к 3-му типу синдрома удлиненного интервала QT (LQT3).
Таким образом, критериями постановки СБ у пациента В. послужили наличие спонтанного ЭКГ-паттерна 1-го типа, синкопе, а также отсутствие признаков органического поражения миокарда. Пациент был выписан со следующими рекомендациями на амбулаторный этап лечения: показана повторная госпитализация в НИИ кардиологии с целью имплантации АИКД; диспансерное наблюдение кардиолога; проведение холтеровского мониторирования ЭКГ; консультация врача-генетика, проведение селективного молекулярно-генетического скрининга у родственников первой и второй линии, а также их обследование для исключения СБ; рекомендовано избегать экзогенной гипертермии (отказ от посещения бань, саун и других парных); срочно снижать температуру тела при лихорадке различного генеза (острые респираторные заболевания и пр.); не принимать антиаритмические препараты I класса, психотропные препараты, антигистаминные и холинолитические средства. Прием пищи – часто, небольшими порциями. Аэробная физическая нагрузка, дозированная ходьба на свежем воздухе по самочувствию, дыхательная гимнастика. Пациенту рекомендовано продолжить прием препаратов: фиксированной комбинации клопи-догрела + АСК (75 + 100 мг) – 1 т. утром × 1 раз в день, пантапразола (40 мг) – 1 т. утром × 1 раз в день, а также розувастатина (40 мг) – 1 т. утром × 1 раз в день.
Обсуждение
Данный клинический пример демонстрирует сложности выявления СБ у пациентов, госпитализированных экстренно с болевым синдромом в грудной клетке и наличием подъема сегмента ST на ЭКГ. Почему мы диагностировали у пациента В. сочетание СБ и ИМБОКА? Необходимо помнить о так называемых фенокопиях синдрома Бругада (ФБ) – это клинические состояния или заболевания, которые этиологически отличаются от истинного врожденного СБ, но имеют изменения на ЭКГ, идентичные Бругада паттерну 1-го или 2-го типов в прекарди-альных отведениях (V1–V3) [11, 12]. ФБ могут возникать транзиторно на фоне метаболических расстройств, электротравмы, ишемии и пр. Как только причина ФБ исчезает, наблюдается нормализация ЭКГ в отличие от случаев с СБ. Фармакологический тест при ФБ – отрицательный. Генетическое тестирование не подтвердит наличие мутаций, отвечающих за СБ.
С целью снижения гипердиагностики СБ были предложены диагностические критерии, так называемая Шанхайская система оценки для диагностики СБ, которая помимо анализа ЭКГ учитывает клинические проявления, семейный анамнез и результаты генетического тестирования [12]. В отличие от ФБ у пациента В. наряду со спонтанным ЭКГ-паттерном СБ 1-го типа было синкопе; согласно Шанхайской шкале у пациента – определенный СБ (4,5 балла) [1, 12]. В динамике у пациента В. сохранялся ЭКГ-паттерн 2-го типа.
Заключение
Описанный нами клинический случай представляет интерес наличием достаточно редко встречающегося сочетания СБ и ИМБОКА. СБ диагностируется у пациентов без других заболеваний сердца и спонтанным паттерном 1-го типа, независимо от симптомов, из-за его редкости в общей популяции и высоким риском ВСС. Паттерн 1-го типа также может быть вызван введением препарата, блокирующего натриевые каналы в качестве диагностического теста у пациентов с подозрением на скрытый СБ, но без спонтанного 1го типа ЭКГ [1, 2, 12, 18].
Необходимо исключить другие состояния, которые могут объяснить паттерн 1-го типа, так называемые фенокопии Бругада [11, 12, 19]. Индуцированный ЭКГ-паттерн 1-го типа требует для постановки диагноза СБ другие клинические признаки, такие как документально подтвержденная полиморфная ЖТ/ФЖ, аритмический обморок или соответствующий семейный анамнез. Результат генетического тестирования у пациентов с СБ составляет примерно 20% с геном SCN5A, единственным геном с доказательствами ассоциации для клинических испытаний [19]. Несоответствие фенотипа и генотипа наблюдается в семействах SCN5A, что объясняется переменными эффектами серьезности мутации и шкале полигенного риска, полученной из полногеномных ассоциативных исследований [1, 17, 20]. Примерно у трети пациентов с СБ имеется обморок [3, 4]. Риск аритмических событий у пациентов с СБ с необъяснимым обмороком в 4 раза выше, чем риск у бессимптомных пациентов [3, 21]. Эксперты ЕОК [1] рекомендуют диагностировать СБ у пациентов без других заболеваний сердца и со спонтанным ЭКГ-паттерном Бругада 1го типа (класс IC). Рекомендуется диагностировать СБ у пациентов без других заболеваний сердца, пережив- ших остановку сердца из-за ФЖ или полиморфной ЖТ, у которых на ЭКГ имеется паттерн Бругада 1-го типа, индуцированный провокацией блокаторами натриевого канала или во время лихорадки (класс IC). Генетическое тестирование на ген SCN5A рекомендовано проводить для пробандов с СБ (класс IC).
Таким образом, наличие СБ следует рассматривать у пациентов без других заболеваний сердца и с индуцированным паттерном Бругада 1-го типа, у которых есть хотя бы один из нижеперечисленных признаков: аритмический обморок или ночное агональное дыхание (класс IIaC), семейная история СБ (класс IIaC), семейный анамнез внезапной смерти (возраст < 45 лет) с отрицательным результатом вскрытия и подозрительными обстоятельствами для СБ (класс IIаС).
СБ может рассматриваться как диагноз у пациентов без других заболеваний сердца, у которых наблюдается индуцированный паттерн ЭКГ Бругада 1-го типа (класс IIbC). Для профилактики ВСС имплантация АИКД рекомендуется пациентам с СБ, которые: (a) пережили прерванную остановку сердца (класс IC), и/или (b) была задокументирована спонтанная устойчивая ЖТ (класс IC).
Имплантацию АИКД следует рассматривать у пациентов с паттерном Бругада 1-го типа и аритмическим синкопе (класс IIaC), имплантацию петлевого регистратора – у пациентов с СБ с необъяснимым обмороком (класс IIaC), хинидин – у пациентов с СБ, которые подходят для ИКД, но имеют противопоказания, ухудшение или имеют повторяющиеся разряды ИКД (класс IIa C). Инфузия изопротеренола должна рассматриваться у пациентов с СБ, перенесших электрический шторм (класс IIaC), катетерная аблация триггерного эпикардиального субстрата преждевременных желудочковых комплексов и/или выходного тракта правого желудочка – у пациентов с СБ с повторными соответствующими разрядами ИКД, рефрактерными к медикаментозной терапии (класс IIaC). Программируемая электрическая стимуляция может быть рассмотрена у бессимптомных пациентов со спонтанной ЭКГ 1-го типа СБ (класс IIb B), имплантация ИКД – у отдельных бессимптомных пациентов с СБ с индуцируемой ФЖ во время программируемой электростимуляции с использованием до 2 дополнительных стимулов (класс IIb C). Катетерная аблация у бессимптомных пациентов с СБ не рекомендуется (класс III С).
Список литературы Синдром Бругада и острый инфаркт миокарда при необструктивных изменениях коронарных артерий: особенности диагностики и лечения (обзор литературы и разбор клинического случая)
- Zeppenfeld K., Tfelt-Hansen J., de Riva M., Winkel B.G., Behr E.R., Blom N.A. 2022 ESC Guidelines for the management of patients with ventricular arrhythmias and the prevention of sudden cardiac death. Developed by the task force for the management of patients with ventricular arrhythmias and the prevention of sudden cardiac death of the European Society of Cardiology (ESC). Endorsed by the Association for European Paediatric and Congenital Cardiology (AEPC). Eur. Heart J. 2022; 43(40):3997-4126. https://doi.org/10.1093/eurheartj/ehac262.
- Adler A., Rosso R., Chorin E., Havakuk O., Antzelevitch C., Viskin S. Risk stratification in Brugada syndrome: clinical characteristics, electrocardiographic parameters, and auxiliary testing. Heart Rhythm. 2016;13(1):299-310. https://doi.org/10.1016/j.hrthm.2015.08.038.
- Subramanian M., Prabhu M.A., Harikrishnan M.S., Shekhar S.S., Pai P.G., Natarajan K. The utility of exercise testing in risk stratification of asymptomatic patients with type 1 Brugada pattern. J. Cardiovasc. Electrophysiol. 2017;28(6):677-683. https://doi.org/10.1111/jce.13205.
- Brignole M., Moya A., de Lange F.J., Deharo J.C., Elliott P.M., Fanciulli A.et al. 2018 ESC Guidelines for the diagnosis and management of syncope. The Task Force for the diagnosis and management of syncope of the European Society of Cardiology (ESC). Developed with the special contribution of the European Heart Rhythm Association (EHRA). Eur. Heart J. 2018;39:1883-1948. https://doi.org/10.1093/eurheartj/ehy037.
- Mascia G., Della Bona R., Ameri P., Canepa M., Porto I., Brignole M.Brugada syndrome and syncope: a systematic review. J. Cardiovasc.Electrophysiol. 2020;31:3334-3338. https://doi.org/10.1111/jce.14787.
- Niccoli G., Scalone G., Crea F. Acute myocardial infarction with no obstructive coronary atherosclerosis: mechanisms and management. Eur.Heart J. 2015;36:475-481. https://doi.org/10.1093/eurheartj/ehu469.
- Ibanez B., James S., Agewall S., Antunes M.J., Bucciarelli-Ducci C., Bueno H. et al. 2017 ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation: The Task Force for the management of acute myocardial infarction in patients presenting with ST-segment elevation of the European Society of Cardiology (ESC). Eur. Heart J. 2018;39(2):119-177. https://doi.org/10.1093/eurheartj/ehx393.
- Воробьева Д.А., Мочула А.В., Баев А.Е., Рябов В.В. Острый коронарный синдром без обструктивного поражения коронарных артерий: тяжесть коронарного атеросклероза и нарушений миокардиальной перфузии (пилотное исследование). Сибирский медицинский журнал. https://doi.org/;34(2):71-78.DOI: 10.29001/2073-8552-2019-34-2-71-78.
- Pustjens T.F.S., Appelman Y., Damman P., ten Berg J., Jukema J.W., de Winter R.J. et al. Guidelines for the management of myocardial infarction/injury with non-obstructive coronary arteries (MINOCA): a position paper from the Dutch ACS working group. Neth. Heart J. 2020;28(3):116-130. https://doi.org/10.1007/s12471-019-01344-6.
- Попонина Ю.С., Попонина Т.М., Мочула О.В., Чернявская Г.М., Рябов В.В. Саркоидоз сердца: трудности и возможности дифференциальной диагностики с острым коронарным синдромом без подъема сегмента ST в реальной клинической практике (клинический случай). Сибирский журнал клинической и экспериментальной медицины. 2022;37(1):142-148. https://doi.org/10.29001/2073-8552-2022-37-1-142-148.
- Anselm D.D., Evans J.M., Baranchuk A. Brugada phenocopy: A new electrocardiogram phenomenon. World J. Cardiol. 2014;6(3):81-86. https://doi.org/10.4330/wjc.v6.i3.81.
- Antzelevitch C., Yan G.-X., Ackerman M.J., Borggrefe M., Corrado D.,Guo J. et al. J-wave syndromes expert consensus conference report: emerging concepts and gaps in knowledge. Europace. 2017;19(4):665-694. https://doi.org/10.1093/europace/euw235.
- Niccoli G., Scalone G., Crea F. Acute myocardial infarction with no obstructive coronary atherosclerosis: mechanisms and management. Eur. Heart J. 2015;36(8):475-481. https://doi.org/10.1093/eurheartj/ehu469.
- Brugada P., Brugada J. Right bundle branch block, persistent ST segment elevation and sudden cardiac death: a distinct clinical and electrocardiographic syndrome: a multicenter report. J. Am. Coll. Cardiol. 1992;20(6):1391-1396. https://doi.org/10.1016/0735-1097(92)90253-j.
- Curcio A., Santarpia G., Indolfi C. The Brugada syndrome - From gene to therapy. Circ. J. 2017;81(3):290-297. https://doi.org/10.1253/circj.CJ-16-0971.
- Бокерия Л.А., Проничева И.В., Сергуладзе С.Ю., Ломидзе Н.Н.,Темботова Ж.Х., Котанова Е.С. Опыт диагностики и десятилетние результаты лечения пациентов с синдромом Бругада. Анналы аритмологии. https://doi.org/;14(2):60-72.DOI: 10.15275/annaritmol.2017.2.1.
- Behr E.R., Ben-Haim Y., Ackerman M.J., Krahn A.D., Wilde A.A.M. Brugada syndrome and reduced right ventricular outflow tract conduction reserve: a final common pathway? Eur. Heart J. 2021;42(11):1073-1081. https://doi.org/10.1093/eurheartj/ehaa1051.
- Priori S.G., Wilde A.A., Horie M., Cho Y., Behr E.R., Berul C. et al. Executive summary: HRS/EHRA/APHRS expert consensus statement on the diagnosis and management of patients with inherited primary arrhythmia syndromes. Heart Rhythm. 2013;10(12):e85-e108. https://doi.org/10.1016/j.hrthm.2013.07.021.
- Hosseini S.M., Kim R., Udupa S., Costain G., Jobling R., Liston E. et al. Reappraisal of reported genes for sudden arrhythmic death: evidence-based evaluation of gene validity for Brugada syndrome. Circulation. 2018;138(12):1195-1205. https://doi.org/10.1161/CIRCULATIONAHA.118.035070.
- Ishikawa T., Kimoto H., Mishima H., Yamagata K., Ogata S., Aizawa Y. et al. Functionally validated SCN5A variants allow interpretation of pathogenicity and prediction of lethal events in Brugada syndrome. Eur. Heart J. 2021;42(29):2854-2863. https://doi.org/10.1093/eurheartj/ehab254.
- Sroubek J., Probst V., Mazzanti A., Delise P., Hevia J.C., Ohkubo K. et al. Programmed ventricular stimulation for risk stratification in the Brugada syndrome: a pooled analysis. Circulation. https://doi.org/;133(7):622-630.DOI: 10.1161/CIRCULATIONAHA.115.017885.


