Синдром сдавления ствола левой коронарной артерии при легочной артериальной гипертензии. Первый клинический опыт
Автор: Быков Александр Николаевич, Архипов Михаил Викторович, Климушева Наталия Федоровна, Иофин Александр Ильич
Журнал: Евразийский кардиологический журнал @eurasian-cardiology-journal
Рубрика: Клинический случай
Статья в выпуске: 4, 2018 года.
Бесплатный доступ
Боль в груди является частым симптомом у пациентов с легочной артериальной гипертензией (ЛАГ). Компрессия коронарных артерий является редким осложнением ЛАГ, что иногда является причиной стенокардических болей у пациентов с ЛАГ в стадии прогрессии заболевания. Стеноз ствола левой коронарной артерии (ЛКА) расширенным стволом легочной артерии зачастую ассоциирован со стенокардией, при этом общепринятых подходов к диагностике и лечению данного состояния в настоящее время нет. В данной работе представлен клинический случай пациентки (38 лет) с диагностированной идиопатической ЛАГ, у которой наблюдалась ишемия миокарда ввиду сдавления ствола ЛКА расширенным стволом легочной артерии. Синдром стеноза ствола ЛКА был подтвержден по данным коронарной ангиографии и мультиспиральной компьютерной томографии. Стентирование ствола ЛКА и применение ЛАГ-специфических препаратов (с целью фармакотерапии ЛАГ) позволили существенно улучшить состояние пациента, включая улучшения функции сердца и качества жизни. Чрезкожное коронарное вмешательство, по-видимому, является эффективным и безопасным методом коррекции синдрома сдавления ствола ЛКА расширенным стволом ЛА
Идиопатическая легочная артериальная гипертензия, ствол левой коронарной артерии, расширение ствола легочной артерии, легочная гипертензия
Короткий адрес: https://sciup.org/143170022
IDR: 143170022
Текст научной статьи Синдром сдавления ствола левой коронарной артерии при легочной артериальной гипертензии. Первый клинический опыт
-
4: 98-107 [Trans. into Eng. ed.: Bykov A.N., Arkhipov M.V., Klimusheva N.F., Iofin A.I. Left main coronary artery compression syndrome in patient with pulmonary arterial hypertension. First clinical experience. Eurasian heart journal. 2018, November 25; 4: 108-117]
Легочная гипертензия (ЛГ) – это группа заболеваний, характеризующихся прогрессирующим повышением давления в легочной артерии и легочного сосудистого сопротивления, что в итоге приводит к правожелудочковой сердечной недостаточности и преждевременной гибели пациентов [7,8].
Диагностическим критерием ЛГ является повышение среднего давления в легочной артерии (ДЛА ср.) ≥25 мм рт. ст. в покое по данным манометрии, проведенной во время катетеризации правых отделов сердца (КПОС). Для определения гемодинамического типа ЛГ во время катетеризации прово- дят измерение также таких показателей как давление заклинивания легочных капилляров (ДЗЛК), легочное сосудистое сопротивление (ЛСС), диастолический градиент давления (ДГД) [8].
ЛГ – это редкое прогрессирующее и угрожающее жизни заболевание. Одним из ключевых моментов патогенеза ЛГ является утрата способности легочных сосудов к адекватной констрикции и дилатации. В результате сосудистого ремоделирования, когда стенка легочных артерий утолщается и становится ригидной, правым отделам сердца приходится преодолевать большее сопротивление для переноса крови через суженные артерии. В результате описанных процессов происходит дилатация правых отделов сердца, что дополнительно ослабляет их насосную функцию, это приводит к правожелудочковой сердечной недостаточности и смерти [1,2,9-12].
Термин «легочная артериальная гипертензия (ЛАГ)» описывает группу пациентов с ЛГ, которые гемодинамически характеризуются наличием прекапиллярной ЛГ, определяемой при ДЗЛК ≤ 15 мм рт. ст и ЛСС >3 единиц по Вуду при отсутствии других причин прекапиллярной ЛГ, таких как ЛГ вследствие заболеваний легких, хронической тромбоэмболической легочной гипертензии (ХТЭЛГ) или других редких заболеваний [7,8,14].
По принципу схожести патогенетических особенностей, клиники, подходов к диагностике и лечению выделяют 5 групп ЛГ [13]:
-
1. легочная артериальная гипертензия (ЛАГ);
-
2. легочная гипертензия вследствие патологии левых отделов сердца;
-
3. легочная гипертензия вследствие заболеваний легких или/и гипоксии;
-
4. хроническая тромбоэмболическая легочная гипертензия (ХТЭЛГ) и другие обструкции легочной артерии;
-
5. легочная гипертензия с неясными и/или многофакторными механизмами.
ЛГ сопровождается не только повышением давления в легочной артерии и изменениями иных параметров гемодинамики, но также может сопровождаться и увеличением ее диаметра, что в некоторых случаях может приводить к синдрому сдавления ствола левой коронарной артерии (ЛКА). Дилатация легочной артерии является общей чертой среди группы пациентов с тяжелой формой легочной гипертензии, которая, согласно некоторым исследованиям, присутствует в 76,6% случаев [67].
Симптомы ЛАГ связаны с развитием правожелудочковой сердечной недостаточности и включают в себя одышку инспираторного характера, слабость и быструю утомляемость, сердцебиение, обмороки, кашель, боль в грудной клетке, периферические отеки, и, в конечном итоге, ухудшение качества жизни [13].
Боли в груди при ЛГ имеют обычно неопределенный характер. При анализе жалоб у больных иЛАГ боли в груди определялись у 53,4%, при этом у 12,1% пациентов отмечались типичные приступы стенокардии [13].
В возникновении боли могут играть такие факторы, как [13]:
-
• уменьшение сердечного выброса (СВ) и снижение давления в коронарных артериях, особенно при физической нагрузке, когда минутный объем сердца увеличивается неадекватно нагрузке;
-
• выраженная гипертрофия правого желудочка с развитием относительной коронарной недостаточности за счет низкого минутного объема и повышенных потребностей миокарда в кислороде, а также относительно слабого развития коронарных коллатералей;
-
• перерастяжение легочной артерии в связи с выраженной ЛГ, что приводит к компрессии коронарных артерий.
Несмотря на недавние достижения в лечении ЛАГ, прогноз для пациентов остается неблагоприятным, особенно при тяжелом течении болезни [16].
Ранняя диагностика может быть затруднена в связи с тем, что типичные симптомы для ЛАГ, такие как одышка, усталость и боль в груди при нагрузке не являются специфическими.
У пациентов с ЛАГ боль в груди обычно отмечается примерно в 29% случаев [18-21]. В некоторых случаях боли в груди напоминают симптомы классической стенокардии (описаны как «прекардиальный дискомфорт»), вызываются физической нагрузкой и быстро регрессируют в покое [17].
Gomez и соавт. описывают классическую стенокардию и ангинозные симптомы у пациентов с ЛАГ, обычно встречающиеся при гипертрофированном и перегруженном правом желудочке, также как и при стенозе коронарных артерий [22].
Однако внешнее сдавление ствола ЛКА расширенным основным стволом легочной артерии все чаще признаётся причиной стенокардии при ЛАГ [17]. Частота компрессии ствола ЛКА у пациентов с ЛАГ доподлинно не известна [23,24]. В ряде случаев сообщалось, что из 26 пациентов с иЛАГ и клиникой стенокардии, у 7 из них наблюдалась компрессия ствола ЛКА [25].
Наряду со стенокардией, компрессия ствола ЛКА может стать причиной осложнений тяжелой ишемии миокарда, таких как инфаркт миокарда [26], аритмия и, в конечном итоге, внезапная смерть [28-30].
Среди всех смертей среди пациентов с ЛАГ на долю внезапной смерти приходится >25% [31], некоторые из этих событий могут быть связанны с компрессией ствола ЛКА, что является потенциально корригируемым осложнением [17].
Синдром сдавления ствола левой коронарной артерии расширенным стволом легочной артерии (ЛА) является редким осложнением у пациентов с легочной гипертензией и был впервые описан Corday и соавт. в 1957 году как причина коронарной недостаточности у пациентов с ЛГ [33, 84]. Синдром сдавления ствола ЛКА является причиной возникновения боли в груди по типу стенокардии и приводит к дисфункции левого желудочка и даже к внезапной сердечней смерти у пациентов с ЛГ. При сдавлении ствола ЛКА ангинозные приступы отмечаются у 41% пациентов с ЛАГ [23].
Несмотря на то, что легочная гипертензия и синдром сдавления ствола ЛКА являются редкими патологическими состояниями, они представляют большой интерес, поскольку могут возникать у лиц трудоспособного возраста, быстро прогрессируют, значительно снижая качество жизни, и являются жизнеугрожающими.
ЭПИДЕМИОЛОГИЯ
Самая низкая оценка распространенности ЛАГ и иЛАГ составляет 15 случаев и 5,9 случаев на миллион взрослого населения, соответственно, тогда как наиболее низкая заболеваемость ЛАГ составляет 2,4 случая на миллион взрослого населения в год. В Европе заболеваемость и распространенность ЛАГ находится в пределах 15-60 пациентов на миллион населения и 5-10 пациентов на миллион в год, соответственно [8].
В Свердловской области регистр пациентов с иЛАГ ведётся с 2013 г., согласно которому распространенность иЛАГ составляет 6,2 случаев на миллион взрослого населения. Но если в настоящий момент в Свердловской областной клинической больнице №1 у нас имеется достаточный опыт и определенные эпидемиологические данные о заболеваемости и распространенности ЛАГ, то истинная распространенность синдрома сдавления ствола ЛКА у пациентов с ЛАГ остается неизвестной.
В небольшом проспективном исследовании у большинства пациентов с ЛАГ с ангинозными приступами отмечалось сдавление ствола левой коронарной артерии аневризмой легочной артерии [25].
Kajita и соавт. сообщают о группе пациентов со значительным стенозом основного ствола ЛКА ( ≥ 50%) расширенной ЛА [30].
Внешняя компрессия ствола ЛКА стволом ЛА является редким и плохо изученным явлением, обычно связанным с наличием ВПС.
Также описаны подобные случаи сочетанной патологии у детей и подростков. В обоих случаях имело место наличие ЛГ у пациентов в сочетании с дефектом межпредсердной перегородки. Гемодинамические исследования подтвердили диагноз, а также продемонстрировали внешнее сдавление ЛКА расширенной легочной артерией. Хирургическое закрытие дефекта в дополнение к пластике легочного ствола было успешно, с улучшением гемодинамических показателей и исчезновением симптомов стенокардии [34,35].
Другие авторы в своих работах описывают пациентов с синдромом Эйзенменгера с синдромом сдавления ствола ЛКА. В обоих случаях пациенты были успешно прооперированы с установкой стентов в ствол ЛКА [36,37].
АСПЕКТЫ ДИАГНОСТИКИ
Если на сегодняшний день у нас имеются международные и российские рекомендации по диагностике и лечению ЛГ [7,8], то алгоритма диагностики синдрома сдавления ствола ЛКА при ЛГ не существует.
Внешняя компрессия левой коронарной артерии дилатированной легочной артерией является редким синдром. В большинстве случаев ЛАГ не сопровождается наличием ишемической болезни сердца, в связи с чем, редко проводится коронарная ангиография. Таким образом, установка окончательного диагноза и правильное лечение часто запаздывает у таких пациентов [51].
Постановка диагноза требует со стороны врача особого внимания, особенно в отношении пациентов с ЛГ и жалобами на стенокардитические боли. Боль в грудной клетке является распространенной жалобой среди пациентов с ЛГ и часто объясняется увеличением размеров легочной артерии или ишемией миокарда [23,30]. Диагностические и лечебные подходы остаются мало изученными [23,30,68].
Perez и соавт. в своих клинических случаях стенокардии у пациентов с ЛАГ, вызванных компрессией ствола ЛКА расширенной легочной артерией, диагноз стеноза ствола ЛКА подтверждали выполнением коронарной ангиографии с последующим проведением КТ-коронарной ангиографии, что подтвердило расширение легочной артерии, как источника внешней компрессии. Восстановление проходимости ЛКА чрескожным коронарным вмешательством и лечение легочной гипертензии привело к значительному улучшению сердечной функции и качества жизни пациентов, а также уменьшению проявления стенокардии. Авторы рекомендуют рассмотреть этот синдром в дифференциальном диагнозе стенокардии или систолической дисфункции ЛЖ у пациентов с тяжелой ЛГ [23].
В своём клиническом случае Choi и соавт. описывают пациента с ЛГ, клинической стенокардией и синдромом сдавления ствола ЛКА стволом легочной артерии, которому было успешно выполнено чрескожное коронарное вмешательство (ЧКВ) с имплантацией стента, что продемонстрировало необходимость проведения коронарной ангиографии с перспективой ЧКВ у пациентов с легочной гипертензией, страдающих стенокардией или дисфункцией левого желудочка [51].
Дилатация ствола легочной артерии является серьезным последствием ЛГ и обычно диагностируется при проведении эхокардиографического исследования, а также при проведении компьютерной томографии [28]. Быстрая диагностика может быть выполнена с использованием неинвазивных методов, таких как КТ коронарной ангиографии и трансторакальной эхокардиографии.
При наличии существенной дилатации ствола легочной артерии необходимо провести дополнительную оценку, чтобы исключить синдром сдавления ствола ЛКА [57], особенно у пациентов со стенокардией, поскольку вероятность сдавления левой коронарной артерии у пациентов с ЛАГ напрямую коррелирует как с диаметром легочной артерии, так и с соотношением диаметра легочной артерии к диаметру аорты [30].
У Kajita и соавт. [30], в серии случаев, где везде присутствовал синдром сдавления ствола ЛКА, среднее значение отношения диаметра легочного ствола к корню аорты составляло 2,0.
Это было также подтверждено Mesquita и соавт. [25], который сообщил, что в группе пациентов с легочной гипертензией средний диаметр легочной артерии составлял 55 мм, а среднее отношение диаметра корня легочного ствола к аорте 1,98 у пациентов с синдромом сдавления ствола ЛКА, в сравнении с теми пациентами, у которых отсутствовал данный синдром, с показателями 37 мм и 1,46, соответственно. В исследование было включено 36 пациентов с ЛАГ (идиопатическая, ассоциированная с ВПС). Синдром сдавления основного ствола ЛКА был подтвержден ангиографически, как обструкция ЛКА ≥ 50%. Диаметр легочной артерии и аорты измерялся трансторакальной эхокардиографией. Из 26 пациентов, имеющих клинику стенокардии, 7 пациентов были с компрессией ствола ЛКА. Компрессия была связана с диаметром легочной артерии (p=0,002) и отношением диаметра ствола легочной артерии к диаметру аорты (p=0,02). Компрессия не наблюдалась при диаметре легочной артерии <40 мм; среди 19 пациентов с диаметром ЛА ≥ 40 мм частота компрессии составила 37%. Аналогично, компрессия не происходила при отношении диаметра ствола ЛА к аорте <1,21; среди 27 пациентов с коэффициентом ≥ 1,21 частота компрессии составила 26%. Авторы пришли к выводу, что неинвазивные методы измерения диаметра ствола легочной артерии у пациентов с ЛГ могут быть полезны для определения вероятности наличия компрессии ствола ЛКА, а также для выбора пациентов для дальнейшего дообследования в объёме коронарной ангиографии.
Компьютерная томография или магнитно-резонансная ангиография являются полезными инструментами для неинвазивного скрининга [47]; коронарная ангиография [57], однако, считается «золотым стандартом» для окончательной диагностики синдрома сдавления ствола ЛКА [60].
Для оценки тяжести и степени сдавления ствола ЛКА также использовались внутрисосудистое ультразвуковое исследование и оценка резерва фракционного кровотока [56,60,61].
Методы перфузии миокарда, по-видимому, не помогают в постановке диагноза. В соответствии с представленными в литературе случаями только 4 из 10 пациентов с документированным синдромом сдавления ствола ЛКА имели признаки региональной ишемии по данным МРТ миокарда [30,62,63].
Seabra L и соавт. описывают применение ультразвукового метода диагностики у пациентов с ЛГ, который позволяет визуализировать механизм появления перемежающихся симптомов стенокардии и говорит в пользу применения метода ЧКВ с последующим стентированием у пациентов с ЛГ [40].
Предыдущие анализы подобных клинических случаев позволяют предположить, что случаи синдрома сдавления ствола ЛКА могут быть связаны с высоким расположением устья основного ствола ЛКА на правой стороне левого синуса Вальсальвы, а угол бифуркации <45° ассоциирован со случаями внезапной смерти [30,69]. Эти наблюдения показывают, что взаиморасположение ствола ЛКА и ствола легочной артерии являются важным аспектом данного синдрома.
В своем исследовании Lee и соавт. пришли к выводу, что коронарная ангиография с внутрисосудистым ультразвуковым исследованием является «золотым стандартом» диагностики этого синдрома, напротив КТ коронарная ангиография и магнитно-резонансная ангиография являются неинвазивными инструментальными методами обследования для проведения скрининга таких пациентов [47].
ЛЕЧЕНИЕ
Следует отметить, что для легочной гипертензии, на сегодняшний день, созданы специфические методы медикаментозного лечения, причем только для некоторых подтипов1-й и 4-й групп ЛГ согласно клинической классификации.
Без специфического лечения ожидаемая продолжительность жизни у пациентов с иЛАГ снижается до 2,8 лет после постановки диагноза, в то время как в актуальных регистрах в эру современной ЛАГ-специфической терапии выживаемость через 1 и 3 года повысилась до 83% и 58%, соответственно [3,4].
На сегодняшний день отсутствует единый взгляд на проблему лечения пациентов с ЛАГ с синдромом сдавления ствола ЛКА. Одни исследования показывают регресс симптомов стенокардии после приёма силденафила и простаноидов [23], в то время как другие сообщали о необходимости коронарной реваскуляризации из-за отсутствия улучшения симптомов стенокардии после лечения такими препаратами, как бозентан [23,56]. Перед началом терапии важно подтвердить ишемию миокарда, вызванную именно стенозом ввиду компрессии ствола ЛКА [60], что будет играть ключевую роль в выборе тактики лечения.
Имеющиеся специфичные для ЛАГ варианты терапии включают стимулятор рГЦ, аналоги простациклинов, антагонисты эндотелиновых рецепторов и ингибиторы ФДЭ-5. Несмотря на успехи в области лечения подобных пациентов благодаря появлению препаратов для терапии ЛГ, медицинская помощь таким больным сохраняет свою актуальность, поскольку по-прежнему наблюдается высокая смертность пациентов с ЛАГ (15% на протяжении первого года и 32% за три года) [6].
Несмотря на то, что большинство авторов говорит о том, что нет однозначного мнения, какой из способов лечения данной патологии является оптимальным, во многих публикациях описывается успешное применение метода чрескожной коронарной интервенции [44-47] с последующим стентированием [36,37,40,48-51].
Некоторые авторы полагают, что хирургическую коронарную реваскуляризацию необходимо проводить лишь в случаях значительного стеноза ствола ЛКА [58]. В случае синдрома сдавления основного ствола ЛКА крайне важно восстановить беспрепятственный коронарный поток; это, по-видимому, снижает частоту внезапной сердечной смерти. Лечение показано при задокументированной ангиографической компрессии; неинвазивная оценка ишемии миокарда, по-видимому, не представляет интереса в такой ситуации [60].
В 2001 году Рич и соавт. [64] сообщили об успешном стентировании основного ствола ЛКА у двух пациентов с идиопатической ЛАГ с синдромом сдавления ствола ЛКА. Позже и другие авторы [26,29,65,66] также сообщили об успешных ангиографических и краткосрочных клинических исходах.
Ogiso и соавт. [44] под контролем УЗИ и МСКТ продемонстрировали успешное стентирование у пациентки 60 лет с депрессией сегмента ST с иЛАГ и синдромом сдавления ствола ЛКА расширенным стволом легочной артерии. Подкожное введение эпопростенола в нарастающих дозах было начато сразу после установки стента. В течение 1 года наблюдения была достигнута стабильная гемодинамика без эпизодов обострения синдрома сдавления ствола ЛКА.
Так Galie и соавт. [17] в исследовании, целью которого стало оценка частоты сдавления ствола ЛКА расширенной легочной артерией у пациентов с ЛАГ и стенокардией или симптомами схожими со стенокардией, определение необходимости скрининга КТ коронарной ангиографии и оценки эффективности и безопасности ЧКВ с последующим стентированием. Из 765 включенных в исследование пациентов с ЛАГ, 121 имели симптомы стенокардии. 94 пациента имели изменения в отношении ЛА и ЛКА по данным КТ коронарной ангиографии и были направлены на селективную коронарную ангиографию. Стеноз ствола ЛКА ≥ 50% был обнаружен у 48 пациентов из 94. Сорок пять пациентов были подвергнуты коронарному стентированию, из которых у 41 был отмечен регресс симптомов стенокардии. Трем другим пациентам была выполнена хирургическая пластика ЛА. Через девять месяцев после выполненного ЧКВ у 5 пациентов наблюдался рецидив стеноза ствола ЛКА (им была повторно проведена ЧКВ). Лучший предиктор стеноза ЛКА ≥ 50% – это диаметр ствола ЛА ≥ 40 мм. Авторы пришли к выводу, что распространенность стеноза ствола ЛКА у пациентов с ЛАГ и клиникой стенокардии высока. Эти результаты свидетельствуют о том, что пациентам с ЛАГ и стенокардией или симптомами, схожими с ней, показана КТ коронарная ангиография. ЧКВ пациентами переносилась хорошо, что способствовало регрессу симптоматики и благоприятному долгосрочному исходу.
Lee и соавт. по итогам своего исследования приходят к выводам: лечение пациентов с внешней компрессией ствола ЛКА расширенной ЛА методом ЧКВ является выполнимым, безопасным и эффективным способом лечения. Учитывая высокий риск послеоперационных осложнений (правожелудочковая недостаточность и смертность), наблюдаемые при хирургической реваскуляризации у таких пациентов, авторы рекомендуют врачам рассматривать чрескожное коронарное вмешательство с последующим стентированием как предпочтительную методику реваскуляризации для некоторых пациентов с синдромом сдавления ствола ЛКА при ЛГ [47].
Albadri K и соавт. [50] описали случай успешного лечения пациентки с ЛАГ с синдромом сдавления ствола ЛКА методом ЧКВ с имплантацией стента в ствол ЛКА.
КЛИНИЧЕСКИЙ СЛУЧАЙ
Клинический случай. В региональном центре ЛАГ Свердловской области на базе ГБУЗ СО «СОКБ №1» в настоящее время под наблюдением находятся 26 взрослых пациентов с диагнозом идиопатическая легочная артериальная гипертензия.
В период с 2015 по 2018 гг. все пациенты были обследованы на предмет наличия возможной ишемии миокарда. У 19 из 32 пациентов выявлены признаки ишемии миокарда (клинически, по данным ХМ ЭКГ).
Этим пациентам была проведена КТ коронарная ангиография (данных об атеросклеротических стенозах коронарных артерий получено не было) и коронарная ангиография (КАГ), по данным которых у 6 пациентов было выявлено сдавление ствола ЛКА расширенным стволом ЛА.
Описание кейса. Пациентке М. (38 лет), при комплексном обследовании в ГБУЗ Свердловской области «Свердловская областная клиническая больница № 1» г. Екатеринбурга в 2009 г. установлен диагноз идиопатической ЛАГ, III ФК по ВОЗ.
По данным КПОС (2009 г.): сердечный выброс 4,8 л/мин., Ср.ДЛА 92 мм рт. ст., ДЗЛА 5 мм рт. ст., ЛСС 1442 дин х сек/ см5, СИ 2,8 л/мин/м2. Данных за ВПС не было получено. Дан- ные острой фармакологической пробы отрицательные. Тест с Д6МХ 280 м.
Ранее проводимая терапия ЛАГ включала в себя лишь вар-фарин и диуретики. Участие в международном клиническом рандомизированном контролируемом исследовании (РКИ SERAPHIN NCT00660179) неселективного ЭРА позволило назначить ЛАГ-специфическую терапию в виде монотерапии мацитентаном с 2009 г.
Несмотря на положительную динамику проводимой ЛАГ-специфической терапии (2013 г.) по данным КПОС, когда наблюдалось улучшение по ряду показателей: снижение Ср.ДЛА до 72 мм рт. ст., ЛСС 998 дин х сек/см5, а также положительную динамику в тесте с Д6МХ (310 м), и общее улучшение состояния пациента, по данным ЭХО-КГ дилатация ствола ЛА прогрессировала. Почти за 4 года наблюдения с 2009 г. по 2013 г. диаметр увеличился с 38 до 42 мм.
Завершение участия пациентки в исследовании SERAPHIN и старт Орфанной программы в Свердловской области в 2013 г. радикально поменяли вектор ЛАГ-специфической терапии. Отменен мацитентан и последовательно назначена трехкомпонентная терапия в виде бозентана, силденафила и ингаляционного илопроста. В момент назначения тройной терапии пациент находился в III ФК по ВОЗ; признаков сдавления ЛКА не наблюдалось. На данном этапе не было клиники стенокардии.
В дальнейшем илопрост был отменен по причине плохой переносимости (выраженный кашель и гиперемия лица). На фоне двухкомпонентной терапии (бозентан+силденафил) по данным КПОС в 2015 г. было зафиксировано клиническое ухудшение состояния пациентки по ряду гемодинамических и функциональных показателей: увеличение ср. ДЛА 98 мм рт. ст. и ЛСС 1642 дин х сек/см5, уменьшение дистанции в тесте 6МХ 290 м и СВ до 4,2 л/мин. Субъективно у пациентки наблюдался III ФК по ВОЗ. Помимо ухудшения основных показателей обращает на себя внимание и увеличение диаметра ствола ЛА, который по данным ЭХО-КГ составляет 53 мм, и появление признаков ишемии миокарда клинически и по данным ХМ ЭКГ.
С 2015 года наблюдалась клиника ишемии миокарда в виде ангинозных приступов на высоте физической нагрузки, заставляющие останавливаться, периодически – загрудинная боль в момент положения пациентки лежа на спине.
При поступлении в отделение кардиологии СОКБ № 1 в мае 2015 г. имелись жалобы на выраженную нехватку воздуха при незначительной физической нагрузке, слабость, быструю утомляемость, учащенное сердцебиение, боль в грудной клетке на высоте физических нагрузок, головокружение. При осмотре: тахипноэ (ЧДД 22 в минуту), артериальная гипотензия (АД 90/55 мм рт. ст.), тахикардия (110 ударов в минуту), акроцианоз и набухание шейных вен, аускультативно – акцент 2 тона над легочной артерией, легочной артерии, шум Грехема-Стилла.
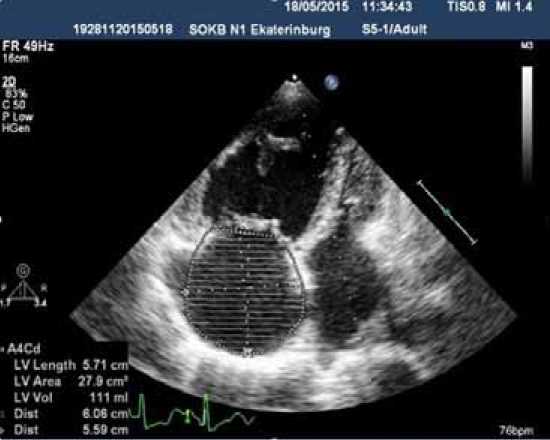
На момент поступления в стационар – III ФК (ВОЗ), дистанция Т6МХ 290 м. По данным ЭХО-КГ: полость левого желудочка резко уменьшена в размерах, значительное расширение правых отделов сердца. Расширение ствола ЛА до 59 мм. Среднее давление в ЛА – 98 мм рт. ст. (рис. 1 А, 1 Б).
По данным ХМ ЭКГ – признаки ишемии миокарда. При проведении коронарной ангиографии (КАГ) было выявлено гемодинамически значимое внешнее сужение ствола ЛКА по типу «Pencil-tip shaped stenosis», что было подтверждено данными МСКТ (рис. 2Б). Диаметр ствола ЛА по данным МСКТ — 59 мм.
Атеросклеротических или стенотических поражений бассейнов других коронарных артерий не было выявлено. В результате комплексного обследования в 2015 году диагноз был уточнен: Идиопатическая лёгочная артериальная гипертензия, III ФК по ВОЗ. ХСН II А, III ФК (ВОЗ). Критический стеноз (90%) ствола левой коронарной артерии, вызванный сдавлением расширенным стволом легочной артерии.
С целью хирургической коррекции стеноза ствола ЛКА, 15.05.2015 г. было проведено успешное стентирование ствола ЛКА стентом, выделяющим Эверолимус размером 4,0 мм (рис. 3 А). На контрольной ангиографии (рис. 3 Б) стеноз ствола ЛКА устранен.
После стентирования ствола ЛКА на рисунке 3Б видно, что компрессия ствола ЛКА устранена, коронарный кровоток восстановлен, отмечался регресс клиники стенокардии. По данным ХМ ЭКГ (май 2015 г.): синусовый ритм 47-107 в минуту, 559 ОНЖЭ, 3 ОЖЭ. Максимальная пауза 1460 мсек. Эпизодов депрессии ST не выявлено (табл. 1).
После успешного ЧКВ была скорректирована ЛАГ-специфическая терапия. С учетом плохой переносимости (тошнота, рвота, гипотензия) и уменьшающейся эффективности («ускользание» эффекта) силденафил был отменен. Пациентка была переведена с комбинации силденафил+бозентан на комбинированную двойную терапию бозентан 125 мг 2 раза в сутки и риоцигуат, доза которого была оттитрована согласно инструкции к препарату (пациентка остановилась на дозе 2 мг 3 раза в сутки). Систолическое артериальное давление на момент перевода с силденафила на риоцигуат со-
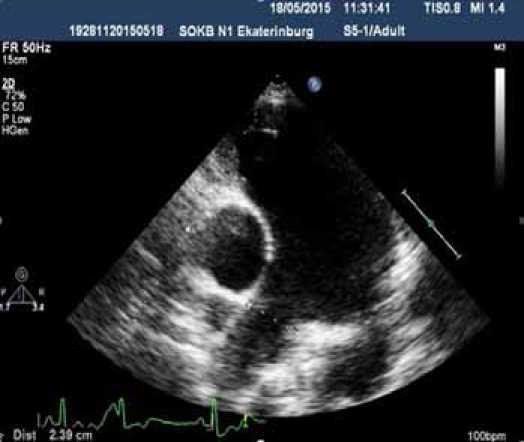
Рисунок 1. ЭХО-КГ исследование. Аневризма ствола ЛА (А) и дилатация правых отделов сердца (Б).
ставляло 100 мм рт. ст. На фоне лечения бозентан+риоцигуат наблюдалось улучшение целого ряда показателей, включая улучшение дистанции Т6МХ и улучшение ФК по ВОЗ.
При контрольном обследовании в декабре 2015 г.: Д6МХ – 420 метров (II ФК), при контрольной КАГ – без сужения ствола ЛКА. КПОС: ср.ДЛА 96 мм рт. ст., СИ 2,5 л/мин/м2, ЛСС 1632 дин х с/см5.
При последующих наблюдениях (2016, 2017 гг.) отмечалась также положительная динамика в виде отсутствия рецидива болевого синдрома в грудной клетке, при контрольной КАГ – без сужения ствола ЛКА (рис. 4). КПОС: ср. ДЛА 74 мм рт. ст. и ЛСС 1048 дин х сек/см5, Д6МХ 435 м, СВ 4,2 л/мин, II ФК (ВОЗ).
Также обращает внимание и тот факт, что с назначением новой двойной комбинированной терапии риоцигуат+бозентан, диаметр ствола ЛА без тенденции к увеличению, а основные гемодинамические параметры сопоставимы и мало чем отличаются за период наблюдения. Следует также отметить, что все ЛАГ-специфические препараты, которые использовались для лечения пациентки, включая бозентан и риоцигуат, использовались только с целью лечения иЛАГ, но не для лекарственной терапии стеноза ствола ЛКА.
ОБСУЖДЕНИЕ
Наиболее известная причина появления загрудинной боли при ЛГ – это гипертрофия ПЖ, что приводит к появлению ишемии миокарда при физической нагрузке. Однако не следует забывать о возможной компрессии ствола ЛКА аневриз-матически расширенным стволом ЛА.
Сдавление извне ствола ЛКА является жизнеугрожающим осложнением, о чем следует помнить при появлении болей в груди у пациента с ЛГ.
Сообщалось о случаях острого коронарного синдрома [26,56,57] или левожелудочковой недостаточности и кардиогенного шока [23,26,57] при синдроме ствола ЛКА. Желудочковые тахиаритмии из-за ишемии, вторичной по отношению к синдрому сдавления ствола ЛКА, могут способствовать увеличению риска внезапной сердечной смерти у этих пациентов. Таким образом, в случае стенокардии у пациента с легочной гипертензией, синдром сдавления ствола ЛКА следует рассматривать в дифференциальном диагнозе.
Важнейшим фактором риска развития синдрома сдавления ствола ЛКА, по-видимому, является тяжесть и продолжительность легочной гипертензии.
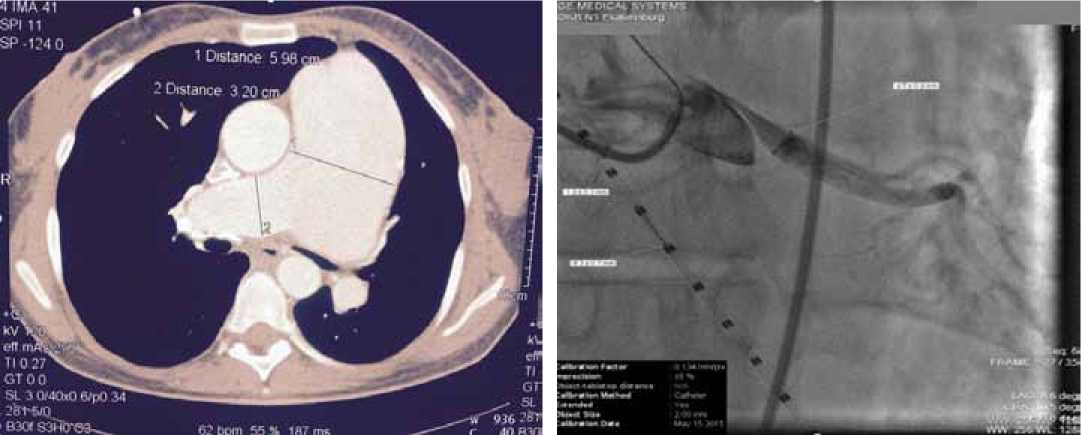
Рисунок 2. Аневризма ствола ЛА (А) и компрессия ствола ЛКА расширеным стволом ЛА по данным коронарной ангиографии (Б).
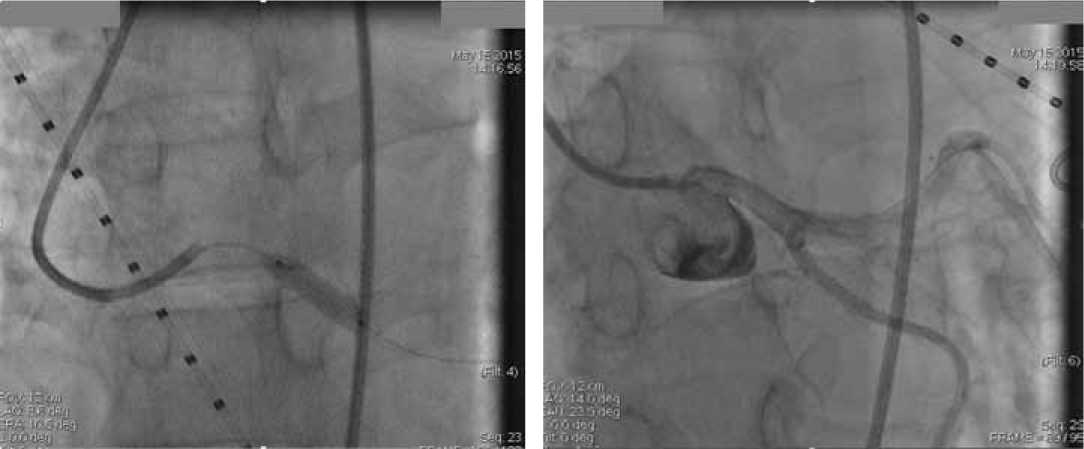
Рисунок 3. Коронарная ангиография. Установка стента в ствол ЛКА (А).
Контрольная ангиография после успешного стентирования ствола ЛКА (Б)
Таблица 1. Динамика изменения гемодинамических и функциональных показателей во время лечения и наблюдения за пациентом
|
2009 |
2013 |
05.2015 |
2016 2017* |
||
|
до стентирования ЛКА |
после стентирования ЛКА |
||||
|
ЛАГ-специфическая терапия и причины ее смены |
Мацитентан |
Силденафил Бозентан Илопрост |
Силденафил Бозентан |
Риоцигуат Бозентан |
|
|
Завершение участия в исследовании SERAPHIN и старт Орфанной программы в Свердловской области Выраженный кашель на илопрост. |
«Ускользание» эффекта и диспепсические проявления на силденафил. Синдром сдавления ствола ЛКА |
||||
|
СВ, л/мин |
4,8 |
5,8 |
4,2 |
4,4 |
4,2 |
|
ср. ДЛА, мм рт. ст. |
92 |
72 |
98 |
96 |
74 |
|
ДЗЛА, мм рт. ст. |
5 |
6 |
7 |
7 |
8 |
|
ЛСС, дин х сек/см5 |
1442 |
998 |
1642 |
1632 |
1048 |
|
СИ, л/мин/м2 |
2,8 |
3,5 |
2,5 |
2,5 |
2,4 |
|
ФК ВОЗ |
III |
III |
III |
II |
II |
|
Диаметр ЛА, мм |
38 |
42 |
59 |
59 |
57 |
|
Т6МХ, м |
280 |
310 |
290 |
420 |
435 |
|
Депрессия ST, ХМ ЭКГ |
- |
- |
+ |
- |
- |
* изучаемые параметры через 7 месяцев (декабрь 2015 г.) после стентирования, а также во время диспансерно-динамического наблюдения в 2016 и 2017 гг. были сопоставимы и мало чем отличались.
Продолжительность заболевания нашей пациентки и тяжесть течения иЛАГ вероятно стали пусковым механизмом к прогрессирующей дилатации ствола ЛА, а это в свою очередь, достигнув критических цифр, привело к синдрому сдавления ствола ЛКА.
Факторами риска возможного сдавления ствола ЛКА при ЛАГ являются: молодой возраст, значительное расширение ствола ЛА (более 40 мм) и соотношение ствол ЛА/диаметр аорты более 1,2 (норма 1,0) [25].
По данным разных авторов сдавление ствола ЛКА при ЛГ наблюдается от 5% до 44% случаев (19% в случае иЛАГ) и это сдавление примерно в 41% случае клинически проявляется болью в грудной клетке [38,51,52], с чем мы впервые столкнулись в нашем центре ЛГ, когда у молодой пациентки с иЛАГ и длительным анамнезом появилась клиника ишемии миокарда. Появление клиники стенокардии у пациентки заставляло нас вести диагностический поиск причины столь редкого для ЛАГ осложнения.
Расширение легочной артерии обычно наблюдается в эхокардиографических исследованиях, а также при компьютерной томографии [28]. Быстрая диагностика может быть выполнена с использованием неинвазивных методов, таких как КТ коронарной ангиографии и трансторакальной эхокардиографии.
КТ или магнитно-резонансная ангиография являются полезными инструментами для неинвазивного скрининга [47]; однако коронарная ангиография [57] считается «золотым стандартом» для окончательной диагностики синдрома сдавления ствола ЛКА [60]. Для оценки тяжести, степени сдавления ЛКА, а также исключения атеросклеротического поражения коронарных сосудов некоторые авторы используют внутрисосудистое ультразвуковое исследование [56,60,61], в нашей клинике такая возможность до 2018 года отсутствовала.
В нашем случае, для проведения дифференциальной диагностики мы ограничились рядом инструментальных неинва- зивных и инвазивных методов обследования. Так по данным ХМ ЭКГ у пациентки наблюдалась депрессия сегмента ST, что является вероятным признаком ишемии миокарда. По данным трансторакальной ЭХО-КГ были верифицированы дилатированные правые отделы сердца и аневризматически расширенный ствол ЛА (59.8 мм на момент возникновения клиники стенокардии). Следующим шагом в дифференциальном поиске стала МСКТ-коронарная ангиография, которая позволила неинвазивно определить взаимоотношение ЛА и коронарных артерий. Диагноз синдрома сдавления ствола ЛКА расширенным стволом ЛА был подтвержден выполнением «золотого стандарта» – коронарной ангиографией.
Если по данным международной литературы нет единого мнения в алгоритме диагностики синдрома сдавления ствола ЛКА, то позиция большинства авторов сходится в том, что лечение должно быть направлено на восстановление коронарного кровотока путем хирургической коронарной реваскуляризации [58]. В случае синдрома сдавления ствола ЛКА крайне важно восстановить коронарный кровоток. Это, по-видимому, снижает частоту внезапной сердечной смерти. Лечение показано при задокументированной ангиографической компрессии [60].
Несмотря на то, что большинство авторов говорят о том, что нет однозначного мнения, какой из способов лечения данной патологии является оптимальным, во многих публикациях описывается успешное применение метода чрескожной коронарной интервенции [44-47] с последующим стентированием [36,37,40,48-51].
По мнению Ay ^ enur Pa ^ и соавт., чрескожное коронарное вмешательство со стентированием должно рассматриваться в качестве наиболее оптимальной стратегии по реваскуляризации миокарда при сдавлении ствола ЛКА у пациентов с иЛАГ [34].
Существует и мнение, что возможно использование как инвазивных (ЧКВ), так и терапевтических методов лечения па-
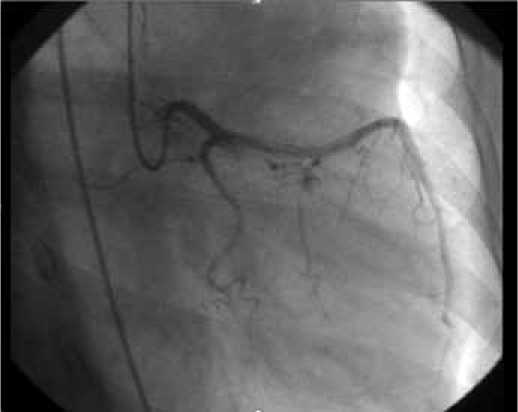
Рисунок 4. Контрольная коронарная ангиография, декабрь 2015 г. Данных за компрессию ствола ЛКА, наличие рестеноза в стенте нет.
циентов с ЛАГ с синдромом сдавления ствола ЛКА [51].
В нашем случае мы выбрали фармако-хирургическую стратегию лечения пациентки. К моменту прогрессирования иЛАГ и возникновению клиники стенокардии, пациентка находилась на комбинированной двухкомпонентной терапии ЛАГ-специфическими препаратами (силденафил, бозентан), однако вскоре после проведенного стентирования исследователи были вынуждены сменить терапию в связи с плохой переносимостью силденафила, а также с недостаточным терапевтическим ответом на данную комбинацию. Было принято решение сменить ЛАГ-специфическую терапию, а именно к бозентану добавить риоцигуат вместо силденафила.
К настоящему времени показано, что часть пациентов с ЛАГ (по некоторым данным до 60%) недостаточно отвечают на терапию иФДЭ5 [76,77,79]. Причина этого может крыться в недостаточной концентрации эндогенного оксида азота в стенке легочных сосудов больных ЛГ. Другой причиной неэффективности силденафила может быть разрушение цГМФ изоферментами ФДЭ, в отношении которых активность силденафила невелика или отсутствует [76,79,80]. В связи с этим высказано предположение, что хорошей альтернативой для больных с ЛАГ, не отвечающих на терапию иФДЭ5, могли бы стать стимуляторы рГЦ [79]. Способность риоцигуата стимулировать синтез цГМФ в условиях дефицита оксида азота, часто наблюдаемого у больных с ЛГ, – потенциальное преимущество риоцигуата перед иФДЭ5 [79].
Риоцигуат – представитель нового класса лекарственных препаратов, стимуляторов растворимой гуанилатциклазы (рГЦ). Препарат имеет двойной механизм действия, с одной стороны, он напрямую, независимо от уровня эндогенного NO, стимулирует рГЦ, а с другой – повышает чувствительность рГЦ к эндогенному NO [81,82]. За счет повышения уровня цГМФ риоцигуат приводит к вазорелаксации, подавлению пролиферации и оказывает антифиброзный эффект, что было показано на экспериментальных моделях ЛГ.
Одним из преимуществ риоцигуата является потенциально выгодные особенности механизма действия – независимость от эндогенного оксида азота при синтезе цГМФ [78, 83].
В нашем случае одновременное использование терапевтического и хирургического методов лечения дало достаточно хорошие отдаленные результаты.
Стентирование позволило восстановить коронарный кровоток и устранить клинику ишемии миокарда, после чего наблюдался полный регресс клиники стенокардии.
Улучшение гемодинамических показателей при иЛАГ, вероятно, отчасти обусловлено назначением комбинированной двойной терапии, в состав которой вошел второй ЛАГ-специфический препарат – риоцигуат.
ЗАКЛЮЧЕНИЕ
Сдавление ствола левой коронарной артерии увеличенным стволом легочной артерии ассоциируются с возможной клиникой стенокардии, но правильные диагностические и лечебные подходы остаются мало изученными.
Современных рекомендаций по диагностике синдрома сдавления ствола ЛКА при ЛГ нет.
В случае наличия стенокардии у пациента с легочной гипертензией, синдром сдавления ствола ЛКА следует рассматривать в дифференциальном диагнозе.
Неинвазивные методы измерения диаметра ствола легочной артерии у пациентов с ЛГ могут быть полезны для определения вероятности наличия компрессии ствола ЛКА, а также для выбора пациентов для дальнейшего дообследования в объеме коронарной ангиографии.
Коронарная ангиография является золотым стандартом для диагностики синдрома ствола ЛКА, напротив КТ коронарная ангиография и магнитно-резонансная ангиография являются неинвазивными инструментальными методами обследования для проведения скрининга таких пациентов.
Важнейшими факторами риска развития синдрома сдавления ствола ЛКА, по-видимому, является тяжесть и продолжительность легочной гипертензии, а также: молодой возраст, значительное расширение ствола ЛА (более 40 мм) и соотношение ствол ЛА/диаметр аорты более 1,2 (норма 1,0).
Раннее выявление стенозов коронарных артерий при иЛАГ и последующая хирургическая их коррекция может повлиять на прогноз и улучшить качество жизни пациента.
Наличие критического стеноза ствола ЛКА расширенным стволом ЛА, вероятно, должно быть достаточным для определения показаний к хирургическому лечению. Чрескожное коронарное вмешательство со стентированием может рассматриваться в качестве наиболее оптимальной стратегии по реваскуляризации миокарда при сдавлении ствола ЛКА у пациентов с иЛАГ, что должно проводиться параллельно с фармакотерапией ЛАГ. Необходимо проведение клинических исследований для выявления дополнительных предикторов стеноза ствола ЛКА при ЛАГ, а также для разработки оптимальных подходов в диагностике и лечении данного синдрома.
Список литературы Синдром сдавления ствола левой коронарной артерии при легочной артериальной гипертензии. Первый клинический опыт
- Galie et al. Guidelines for the diagnosis and treatment of pulmonary hypertension: the Task Force for the Diagnosis and Treatment of Pulmonary Hypertension of the European Society of Cardiology (ESC) and the European Respiratory Society (ERS). Eur Heart J 2009;30:2493-537.
- McLaughlin et al. ACCF/AHA 2009 expert consensus document on pulmonary hypertension a report of the American College of Cardiology Foundation Task Force on Expert Consensus Documents and the American Heart Association. J Am Coll Cardiol 2009; 53:1573-619.
- De Alonzo GE et al. Survival in patients with primary pulmonary hypertension. Results from a national prospective registry. Intern Med 1991;115:343-9.
- Humbert et al. Survival in patients with idiopathic, familial and anorexigen-associated pulmonary arterial hypertension in the modern management era. Circulation 2010;122:156-163.
- Montani et al. Pulmonary arterial hypertension. Orphanet Journal of Rare Diseases 2013; 8:97.
- Benza et al. An evaluation of long-term survival from time of diagnosis in pulmonary arterial hypertension from the REVEAL Registry. Chest 2012;142:448-56.
- И.Е. Чазова, С.Н. Авдеев, Н.А. Царева, А.В. Волков, Т.В. Мартынюк, С.Н. Наконечников. Клинические рекомендации по диагностике и лечению легочной гипертонии. Терапевтический архив 2014; 9:4-23.
- Galie N, Humbert M, Vachiery JL, et al. 2015 ESC/ERS Guidelines for the diagnosis and treatment of pulmonary hypertension. The Joint Task Force for the Diagnosis and Treatment of Pulmonary Hypertension of the European Society of Cardiology (ESC) and the European Respiratory Society (ERS). Eur Respir J. 2015; 46(4): 903-75.
- Gali N et al. Guidelines for the diagnosis and treatment of pulmonary hypertension. Eur Heart J 2009; 30:2493-537.
- Rosenblum WD. Pulmonary arterial hypertension: pathobiology, diagnosis, treatment, and emerging therapies. Cardiol Rev 2010; 18:58-63.
- Rosenkranz S. Pulmonary hypertension: current diagnosis and treatment Clin Res Cardiol 2007; 96:527-541.
- Humbert M. Pulmonary arterial hypertension and chronic thromboembolic pulmonary hypertension: pathophysiology. Eur Respir Rev 2010;19:115,59-63.
- Мартынюк Т.В. Легочная гипертензия: диагностика и лечение, Москва, 2018, 148./T.V. Martynyuk. Pulmonary hypertension: diagnostics and treatment, Moscow, 2018,148. .
- Hoeper M, Bogaard H, Condliffe R, et al. Definitions and Diagnosis of Pulmonary Hypertension. J Am Coll Cardiology 2013; Vol. 62, Suppl D: сЛ42-50.
- Беленков Ю.Н., Чазова И.Е. Первичная легочная гипертензия. М.: Нолидж, 1999 г. с. 141./Belenkov Yu.N., Chazova I.Ye. Primary pulmonary hypertension. Moscow: Nolidge, 1999. p. 141. .
- Galie N, Simonneau G. The Fifth World Symposium on Pulmonary Hypertension. J Am Coll Cardiol 2013; 62: D1-3.
- Galiè N, Saia F, et al. Left Main Coronary Artery Compression in Patients With Pulmonary Arterial Hypertension and Angina. JACC. Vol. 69, NO. 2 3, June 13,2017:2 808-17.
- Ling Y, Johnson M, Kiely D et al. Changing demographics, epidemiology, and survival of incident pulmonary arterial hypertension: results from the pulmonary hypertension registry of the United Kingdom and Ireland. Am J Respir Crit Care Med 2012; 186:790-6.
- Rich S, Dantzker D, Ayres S et al. Primary pulmonary hypertension. A national prospective study. Ann Intern Med 1987; 107:216-23.
- Brown L, Chen H et al. Delay in recognition of pulmonary arterial hypertension: factors identified from the REVEAL Registry. Chest 2011; 140:19-26.
- Jing Z, Xu X, Han Z et al. Registry and Survival Study in Chinese Patients With Idiopathic and Familial Pulmonary Arterial Hypertension. Chest 2007; 132:373-9.
- Gomez A., Bialostozky D., Zajarias A. et al. Right ventricular ischemia in patients with primary pulmonary hypertension. J Am Coll Cardiol 2001; 38:1137-42.
- de Jesus Perez V.A., Haddad F.et al. Angina associated with left main coronary artery compression in pulmonary hypertension. J Heart Lung Transplant 2009; 28: 527-30.
- Karrowni W., Sigurdsson G. et al. Left main coronary artery compression by an enlarged pulmonary artery. J Am Coll Cardiol Intv 2013; 6: e3-4.
- Mesquita S., Castro C. et al. Likelihood of left main coronary artery compression based on pulmonary trunk diameter in patients with pulmonary hypertension. Am J Med 2004; 116:369-374.
- Vaseghi M, Lee J et al. Acute myocardial infarction secondary to left main coronary artery compression by pulmonary artery aneurysm in pulmonary arterial hypertension. J Invasive Cardiol 2007; 19(12): 375-377.
- Skoularigis J, Sareli P. Submitral left ventricular aneurysm compressing the left main coronary artery. Cathet Cardiovasc Diagn 1997; 40:173-5.
- Demerouti E, Manginas A et al. Complications leading to sudden cardiac death in pulmonary arterial hypertension. Respir Care 2013; 58:1246-54.
- Dodd J, Maree A, Palacios I, et al. Images in cardiovascular medicine. Left main coronary artery compression syndrome: evaluation with 64-slice cardiac multidetector computed tomography. Circulation 2007; 115: e7-8.
- Kajita L, Martinez E, Ambrose J, et al. Extrinsic compression of the left main coronary artery by a dilated pulmonary artery: clinical, angiographic, and hemodynamic determinants. Catheter Cardiovasc Interv 2001; 52:49-54.
- D'Alonzo GE, Barst R, Ayres S et al. Survival in patients with primary pulmonary hypertension. Results from a national prospective registry. Ann Intern Med 1991; 115:343-9.
- Vaseghi M, Lee M et al. Percutaneous intervention of left main coronary artery compression by pulmonary artery aneurysm. Catheter Cardiovasc Interv 2010; 76:352-356.
- Corday E, Gold H, Kaplan L. Coronary artery compression: an explanation for the cause of coronary insufficiency in pulmonary hypertension. Trans Am Coll Cardiol 1957 Jan; 7:93-103.
- Ay§enurPaç, Deniz N. Çagda§ D, MahmutUlaç et al. Left main coronary artery and aortic root compression associated with atrial septal defect and pulmonary hypertension. International Journal of Cardiology 118,2007: e41-e43.
- Amaral F, Lafaiete Alves Jr. et al. Extrinsic Compression of Left Main Coronary Artery from Aneurysmal Dilation of Pulmonary Trunk in an Adolescent. Involution after Surgery Occlusion of Sinus Venosus Atrial Septal Defect and Pulmonary Trunk Plasty for Reduction Arq Bras Cardiol 2007; 88(2): e39-e41.
- Andjelkovic K, Kalimanovska-Ostric D et al. Two rare conditions in an Eisenmenger patient: Left main coronary artery compression and Ors syndrome due to pulmonary artery dilatation. Heart & Lung 42 (2013) 382e386.
- Kothandam Sivakumar K, Maruthanayagam Rajan et al. Extrinsic Compression of the Left Coronary Ostium by the Pulmonary Trunk: Management in a Case of Eisenmenger Syndrome. TexHeartInstJ 2010; 37(1): 95-8.
- Rich S, Dantzker DR, Ayres SM, et al. Primary pulmonary hypertension: a national prospective study. Ann Intern Med. 1987; 107:216-223.
- Galie N et al. 2015 ESC/ERS Guidelines for the diagnosis and treatment of pulmonary hypertension. The Joint Task Force for the Diagnosis and Treatment of Pulmonary Hypertension of the European Society of Cardiology (ESC) and the European Respiratory Society (ERS). European Heart Journal (2016) 37, 67-119).
- Luciana F. Seabra, Henrique B. Ribeiro et al. Left Main Ostial Compression in a Patient with Pulmonary Hypertension: Dynamic Findings by IVUS Am J Case Rep, 2015; 16:899-903.
- Sonia M. F. Mesquita, MD, Claudia R. P. Castro et al. Likelihood of Left Main Coronary Artery Compression Based on Pulmonary Trunk Diameter in Patients with Pulmonary Hypertension. March 15,2004 THE AMERICAN JOURNAL OF MEDICINE, Vol. 116
- D'Alonzo GE et al. Survival in Patients with Primary Pulmonary Hypertension Ann Intern Med 1991; 115:343-349.
- Thenappan T et al. Survival in pulmonary arterial hypertension: a reappraisal of the NIH risk stratification equation. Eur Respir J 2010; 35:1079-1087.
- Masataka Ogiso, Naoki Serizawa et al. Percutaneous Coronary Intervention for Left Main Compression Syndrome due to Severe Idiopathic Pulmonary Arterial Hypertension: One Year Follow-up Using Intravascular Imaging Intern Med 54:801-804,2015.
- Khaled F. Salhab, Adil H. Al Kindi et al. Percutaneous coronary intervention of the left main coronary artery in a patient with extrinsic compression caused by massive pulmonary artery enlargement. J ThoracCardiovascSurg 2012; 144:1517-1518.
- Vaseghi M, Lee M et al. Percutaneous Intervention of Left Main Coronary Artery Compression by Pulmonary Artery Aneurysm. Catheterization and Cardiovascular Interventions 76: 352-356 (2010)
- Lee M, Oyama J et al. Left Main Coronary Artery Compression from Pulmonary Artery Enlargement Due to Pulmonary Hypertension: A Contemporary Review and Argument for Percutaneous Revascularization Catheterization and Cardiovascular Interventions 76:543-550 (2010).
- Caldera A, Cruz-Gonzalez I et al. Endovascular Therapy for Left Main Compression Syndrome, Case Report and Literature Review CHEST 2009; 135:1648-1650.
- Godfrey A, Cajigas H et al. A 55-Year-Old Woman With Pulmonary Hypertension, Worsening Dyspnea, and Chest Pain CHEST2014; 145 (3): 642 -645.
- Albadri K, Jensen J et al. Left main coronary artery compression in pulmonary arterial hypertension. PulmCirc 2015; 5(4): 734736.
- DOI: 10.1086/683690
- Yoon-Jung Choi, Ung Kim et al. A Case of Extrinsic Compression of the Left Main Coronary Artery Secondary to Pulmonary Artery Dilatation. J Korean Med Sci 2013; 28:1543-1548.
- Kawut S, Frank E. Silvestry et al. Extrinsic Compression of the Left Main Coronary Artery by the Pulmonary Artery in Patients With Long-Standing Pulmonary Hypertension. THE AMERICAN JOURNAL OF CARDIOLOGYT, 1999. Vol. 83.
- Boerrigter B, Mauritz GJ, Marcus JT, Helderman F, Postmus PE, Westerhof N, Vonk-Noordegraaf A. Progressive dilatation of the main pulmonary artery is a characteristic of pulmonary arterial hypertension and is not related to changes in pressure. Chest 2010; 138(6): 1395-1401.
- Mitsudo K, Fujino T, Matsunaga K et al. Coronary angiographic findings in the patients with atrial septal defect and pulmonary hypertension-compression of left main coronary artery by pulmoanry trunk. Kokyu To Junkan 1989; 37(6): 649-655. Article in Japanese.
- Kothari S, Chatterjee S et al. Left main coronary artery compression by dilated main pulmonary artery in atrial septal defect. Indian Heart J 1994; 46(4): 165-167.
- Lindsey JB, Brilakis ES, Banerjee S. Acute coronary syndrome due to extrinsic compression of the left main coronary artery in a patient with severe pulmonary hypertension: successful treatment with percutaneous coronary intervention. Cardiovasc Revasc Med 2008; 9(1): 47-51.
- Tespili M, Saino A, Personeni D et al. Life-threatening left main stenosis induced by compression from a dilated pulmonary artery J Cardiovasc Med (Hagerstown) 2009; 10(2): 183-187.
- Fujiwara K, Naito Y et al. Left main coronary trunk compression by dilated main pulmonary artery in atrial septal defect. Report of three cases. J Thorac Cardiovasc Surg 1992; 104(2): 449-452.
- Ngaage D, Lapeyre A et al. Left main coronary artery compression in chronic thromboembolic pulmonary hypertension. Eur J Cardiothorac Surg 2005; 27(3): 512.
- Pin'a Y, Exaire J et al. Left main coronary artery extrinsic compression syndrome: a combined intravascular ultrasound and pressure wire. J Invasive Cardiol 2006; 18:102-104.
- Bonderman D, Fleischmann D et al. Images in cardiovascular medicine. Left main coronary artery compression by the pulmoarny trunk in pulmonary hypertension. Circulation 2002; 105(2): 265.
- Safi M, Eslami V, Shabestari A et al. Extrinsic compression of left main coronary artery by the pulmoarny trunk secondary to pulmonary hypertension documented using 64-slice multidetector computed tomography coronary angiography. Clin Cardiol 2009; 32(8): 426-428.
- Jodocy D, Friedrich G et al. Left main compression syndrome by idiopathic pulmonary artery aneurysm caused by medial necrosis Erdheim-Gsell combined with bicuspid pulmonary valve. J Thorac Cardiovasc Surg 2009; 138(1): 234-236.
- Rich S, McLaughlin V et al. Stenting to reverse left ventricular ischemia due to left main coronary artery compression in primary pulmonary hypertension. Chest 2001; 120(4): 1412-1415.
- Go 'mez Varela S, Montes Orbe P et al. Stenting in primary pulmonary hypertension with compression of the left main coronary artery. Rev Esp Cardiol 2004; 57(7): 695-698. Article in Spanish.
- Dubois CL, Dymarkowski S et al. Compression of the left main pulmaorny artery in a patient with the Eisenmenger syndrome. Eur Heart J 2007; 28(16): 1945.
- Badagliacca R, Poscia R et al. Pulmonary arterial dilatation in pulmonary hypertension: prevalence and prognostic relevance. Cardiology, 2012; 121(2): 76-82.
- Liu WH, Luo Q, Liu ZH et al. Pulmonary function differences in patients with chronic right heart failure secondary to pulmonary arterial hypertension and chronic left heart failure. Med Sci Monit, 2014; 20:960-66.
- Taylor A, Rogan K, Virmani R et al. Sudden cardiac death associated with isolated congenital coronary artery anomalies. J Am Coll Cardiol, 1992; 20:640-47.
- Hernândez V, Ruiz-Cano M et al. Complications of proximal pulmonary artery aneurysms in patients with severe pulmonary arterial hypertension. Rev Esp Cardiol, 2010; 63:612-620.
- Chaikriangkrai K, Polsani V, Wei L et al. Stenting of a left main coronary artery compressed by a dilated main pulmonary artery. Catheter Cardiovasc Interv, 2013; 82: E684-87.
- Humbert M et al. Pulmonary Arterial Hypertension in France. Results from a National Registry. Am J Respir Crit Care Med 2006;173:1023-1030.
- Escribano-Subias P et al. Survival in pulmonary hypertension in Spain: insights from the Spanish registry. Eur Respir J 2012; 40: 596-603.
- Peacock A et al. An epidemiological study of pulmonary arterial hypertension. Eur Respir J 2007; 30:104-109.
- Kirson N et al. Prevalence of pulmonary arterial hypertension and chronic thromboembolic pulmonary hypertension in the United States. Curr Med Res Opin 2011; 27:1763-1768.
- Ghofrani HA, Voswinckel R, Gall H et al. Riociguat for pulmonary hypertension. Future Cardiol 2010; 6:155-166.
- Stasch JP, Pacher P, Evgenov Ov. Soluble guanylate cyclase as an emerging therapeutic target in cardiopulmonary disease. Circulation 2011; 123:2263-73.
- А.А. Шмальц, С.В. Горбачевский. Риоцигуат и силденафил в лечении легочной гипертензии: сходства и различия. Пульмонология. 2016; 26 (1): 85-91./A.A. Shmalts, S.V. Gorbachevskiy. Riociguat and sildenafil in treatment of pulmonary hypertension: similarities and differences. Pulmonology. 2016; 26 (1): 85-91. .
- Guha M. First-in-class guanylate cyclase stimulator approved for PAH. Nat. Biotechnol. 2013; 31:1064.
- Hemnes AR, Champion hC. Sildenafil, a PDE5 inhibitor, in the treatment of pulmonary hypertension. Exp Rev Cardiovasc Ther 2006; 4:293-300.
- Ghofrani HA, Hoeper MM, Halank M, et al. Riociguat for chronic Thromboembolic pulmonary hypertension and pulmonary arterial hypertension: A phase II study. Eur Respir J. 2010; 36:792-799.
- Мершин К.В., Мартынюк Т.В. Место медикаментозной терапии в лечении хронической тромбоэмболической легочной гипертензии. Евразийский кардиологический журнал. 2014; 1:113-118.
- Gall H. et al. Real-World Switching to Riociguat: Management and Practicalities in Patients with PAH and CTEPH. Lung (2018) 196:305-312.
- Kawase T, Ueda H et al. A case of acute coronary syndrome caused by extrinsic compression of the left main coronary artery due to pulmonary hypertension. Journal of Cardiology Cases (2010) 2, e154-e158.
- Инструкция по медицинскому применению лекарственного препарата Адемпас (регистрационный номер лП-002639)


