Синергетический эффект противоопухолевой активности доксорубицина и бикомпонентных наноструктур на основе оксида алюминия
Автор: Бакина Ольга Владимировна, Сваровская Наталья Валентиновна, Миллер Андрей Александрович, Ложкомоев Александр Сергеевич, Августинович Александра Владимировна, Добродеев Алексей Юрьевич, Спирина Людмила Викторовна, Афанасьев Сергей Геннадьевич
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 2 т.19, 2020 года.
Бесплатный доступ
Введение. Высокотехнологичные методы синтеза наночастиц позволяют контролировать их морфологию и физико-химические свойства уже на этапе синтеза. Мезопористые наноструктуры на основе оксида алюминия обладают низкой токсичностью, биосовместимостью, они рекомендованы ассоциацией FDA для биомедицинских приложений. Благодаря положительному дзета-потенциалу и низкой растворимости в воде оксид алюминия способен вызывать ингибирование роста опухоли и апоптоз клеток вследствие ионного дисбаланса в микроокружении опухоли. При совместном применении нетоксичных наноструктур со стандартными химиотерапевтическими препаратами наблюдается синергетический эффект, что позволяет снизить концентрацию цитостатика и уменьшить побочные эффекты. Цель исследования - синтезировать наноструктуры с различным поверхностным потенциалом и провести исследование цитотоксичности синтезированных наноструктур в чистом виде и совместно с доксорубицином. Материал и методы. Наноструктуры на основе оксида алюминия были получены путем взаимодействия нанопорошков с водой. Морфология наноструктур была охарактеризована при помощи электронной микроскопии и энергодисперсионного анализа. Фазовый состав был исследован методом ренгенофазового анализа. Влияние на клетки синтезированных наноструктур было оценено при помощи МТТ-теста. Результаты. Сравнительный анализ показал, что полученные наноструктуры AIOOH обладают низкой токсичностью и могут быть использованы в качестве носителя для доксорубицина. Заключение. Совместное применение доксорубицина с наноструктурами AIOOH и ZnO-AlOOH приводит к повышению повреждающего действия цитостатика на опухолевые клетки линии Neuro-2a.
Наноструктуры, токсичность, противоопухолевая активность, химиотерапевтические препараты
Короткий адрес: https://sciup.org/140254340
IDR: 140254340 | УДК: 616-006:615.28:57.085.23 | DOI: 10.21294/1814-4861-2020-19-2-82-89
Текст научной статьи Синергетический эффект противоопухолевой активности доксорубицина и бикомпонентных наноструктур на основе оксида алюминия
Развитие современных методов синтеза позволяет получать наночастицы и наноструктуры с контролируемой морфологией и физико-химическими свойствами для биомедицины и биоинженерии. Многие биосовместимые наночастицы уже используются при проведении противоопухолевой лекарственной терапии. FDA одобрила несколько технологий получения лекарственных препаратов на основе наночастиц золота для диагностических и терапевтических целей [1]. Наночастицы серебра демонстрируют выраженный цитотоксический эффект, основанный на гибели клеток опухоли через апоптоз и активацию аутофагии [2]. Применение наночастиц платины, палладия, меди, селена, кремния, углерода в качестве противоопухолевых агентов также продемонстрировано в экспериментах in vivo [3]. Перспективным является подход, основанный на применении наночастиц и наноструктур с низкой токсичностью, которые усиливают канцероцидный эффект стандартных химиопрепаратов [4] с известными побочными эффектами в виде кардио- и нефротоксичности [5, 6]. Недавнее исследование [7] показало, что наночастицы хитозана, импрегнированные доксорубицином, заметно ингибировали рост опухоли у мышей по сравнению с воздействием свободного доксорубицина. Композитные наночастицы, со- стоящие из мезопористого оксида кремния, функционализированного доксорубицином, благодаря усиленному эндоцитозу, вызванному химической природой носителя, показали высокую противоопухолевую активность по сравнению с чистым доксорубицином [8]. При изучении совместного действия даунорубицина и нанопроволок ZnO [9] продемонстрирована лучшая дозозависимая токсичность в отношении опухолевых клеточных линий по сравнению с отдельными компонентами.
Мезопористые наноструктуры на основе оксида алюминия находят широкое применение в биомедицине благодаря термической и химической стабильности, развитой поверхности, биосовместимости и низкой токсичности [10]. Благодаря положительному дзета-потенциалу и низкой растворимости в воде оксид алюминия способен вызывать ингибирование роста опухоли и апоптоз клеток вследствие ионного дисбаланса в микроокружении опухоли [11]. Ожидается, что при совместном применении с химиотерапевтическим препаратом эти нетоксичные наноструктуры будут способны усиливать действие стандартных лекарственных средств на опухолевые клетки.
Цель исследования – синтезировать наноструктуры AlOOH и композитные бикомпонентные наноструктуры AlOOH-ZnO с различным поверхностным потенциалом и провести исследование
Таблица 1/Table 1


их цитотоксичности в чистом виде и совместно с доксорубицином.
Материал и методы
Синтез объектов исследования
Прекурсорами для получения наноструктур AlOOH и композитных бикомпонентных наноструктур AlOOH-ZnO служили нанопорошки, полученные методом электрического взрыва проводников (табл. 1). Морфологию и размер наночастиц и наноструктур определяли методом просвечивающей (JEOL 2000FX, Япония) и сканирующей (LEO EVO 50, Германия) электронной микроскопии. Фазовый состав наночастиц изучали методом рентгенофазового анализа на дифрактометре (Дрон-7, Россия) на CoKα-излучении. Удельную поверхность образцов определяли методом тепловой десорбции азота (SorbtometerM, Russia). Дзета-потенциал объектов выявляли методом микроэлектрофореза (ZetoSizer Nano ZSP, Великобритания).
Культуры клеток и цитотоксичность
Все клеточные культуры предоставлены ФБУН ГНЦ ВБ «Вектор». Клетки нейробластомы мыши Neuro 2a и фибробластоподобные клетки L929 культивировали в ростовой среде MEM (HyClone, США) с добавлением 10 % фетальной бычьей сыворотки, 2mM L-глутамина и 1 % пенициллин/ стрептомицина в CO2 инкубаторе (Sanyo, Япония) при температуре 37 ± 1 ºС в течение 24 ч в 96-луночных планшетах (ТРР, Швейцария). Конечная концентрация клеток составляла 1×104 клеток в 100 мкл среды в каждой лунке 96-луночного микропланшета.
Цитотоксичность синтезированных образцов оценивали по изменению жизнеспособности клеточных линий в контакте с образцами по сравнению с контрольной группой при помощи МТТ-теста. Метод основан на реакции восстановления МТТ-реагента редуктазами живых клеток до формазана, окрашенного в фиолетовый цвет, и его последующем определении при помощи спектрофотометрического метода анализа.
Образцы наноструктур предварительно стерилизовали методом паровой стерилизации в автоклаве (Panasonic, Япония) при 121 °C. Для проведения теста из лунок 96-луночного микропланшета, содержащих 1×104 клеток в 100 мкл, осторожно удаляли питательную среду и добавляли 100 мкл питательной среды, содержащей наноструктуры в концентрации от 0,01 до 1 мг/мл. Клетки инкубировали с наноструктурами в течение 24 ч. После этого среду повторно удаляли и клетки двукратно промывали раствором буфера Дульбекко (Sigma-Aldrich, США). В каждую лунку с клетками добавляли по 10 мкл раствора MTT (3-4,5-диметилтиазол-2,5 дифенил тетразо-лия бромида). Инкубирование с раствором MTT проводили в течение 2 ч при температуре 37 ± 1 ºС и 5 % CO2. По окончании инкубирования питательную среду осторожно удаляли и добавляли в каждую лунку по 100 мкл ДМСО (Биолот, Россия) для растворения кристаллов формазана. Через 15 минопределяли оптическую плотность суспензий при помощи планшетного спектрофотометра Multiscan FC (Termo Scientific, Германия). Длина волны составляла 570 нм. В качестве отрицательного контроля использовали клетки, инкубируемые в питательной среде без добавления нанострукур. В качестве положительного контроля использовали наночастицы ZnO со средним размером 62 нм, полученные электрическим взрывом цинковой проволоки в атмосфере кислорода. Для статистической обработки данных использовались параметрические методы с уровнем достоверности p≤0,05.
Результаты и обсуждение
Формирование наноструктур AlOOH и AlOOH-ZnO
На рис. 1 приведены электронно-микроскопические изображения нанопорошков прекурсоров. Частицы имеют сферическую форму и агломерированы, что характерно для нанопорошков, полученных электрическим взрывом проводников. Основные физико-химические характеристики нанопорошков и синтезированных из них наноструктур приведены в табл. 2.
При окислении деионизированной водой нанопорошков Al и Al-Zn наблюдалось увеличение рН

Рис. 1. ПЭМ-изображение наночастиц Al (а) и Al-Zn (б) Fig. 1. TEM image of Al (а) and Al-Zn (b) nanoparticles

Рис. 2. ПЭМ (а, б) и СЭМ (в, г) изображения наноструктур AlOOH (а, в) и AlOOH-ZnO (б, г) Fig. 2. TEM (a, b) and SEM (c, d) images of AlOOH (a, c) and AlOOH-ZnO (b, d) nanostructures
реакционной среды до 8,3 и до 7,5 соответственно. Реакцию проводили в течение 60 мин. После этого продукты реакции отфильтровывали и высушивали при 100 °C до постоянной массы (≈120 мин). В результате наблюдалось формирование мезопо-ристых наноструктур (рис. 2). Пористая структура образцов представлена мезопорами по классификации ИЮПАК со средним размером 4–9 нм.
Цитотоксичность образцов
Жизнеспособность клеточных линий при инкубации с синтезированными наноструктурами носит дозозависимый характер (рис. 3). Увеличение концентрации наноструктур AlOOH вплоть до 0,1 мг/мл снижает жизнеспособность не более чем на 10 % (легкая цитотоксичность по ГОСТ Р ИСО 10993.5). Наноструктуры AlOOH-ZnO проявляли легкую цитотоксичность при концентрации не выше 0,05 мг/мл.
Наночастицы ZnO были токсичны для всех исследуемых клеточных линий. Ранее было показано [12], что наночастицы ZnO проявляют цитотоксичность по отношению к нормальным и опухолевым клеткам. Механизм действия наночастиц ZnO сложен и определяется комплексом нескольких видов воздействия, основным из которых является генерация реактивных форм кислорода [13]. Это воздействие протекает через ряд механизмов, включающих генерацию АФК на поверхности частиц [14], растворение и выделение ионов Zn2+ в клеточную среду [15] и механическое взаимодействие наночастиц с клеточной мембраной [16]. Наноструткуры AlOOH способны проникать в клетки благодаря эндоцитозу (рис. 4).
Ожидается, что при совместном воздействии наноструктур и доксорубицина синтезированные
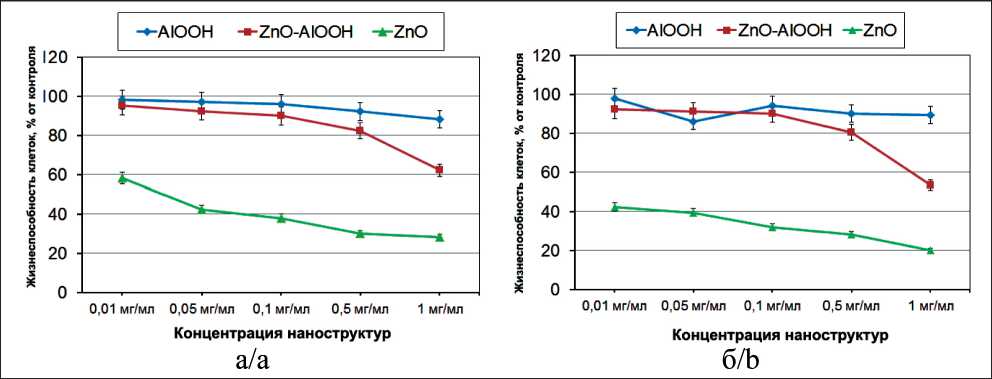
Рис. 3. Жизнеспособность клеточных линий L929 (а) и Neuro-2a (б) в зависимости от концентрации Fig. 3. Cell viability of L929 (а) and Neuro-2a (b) cell lines
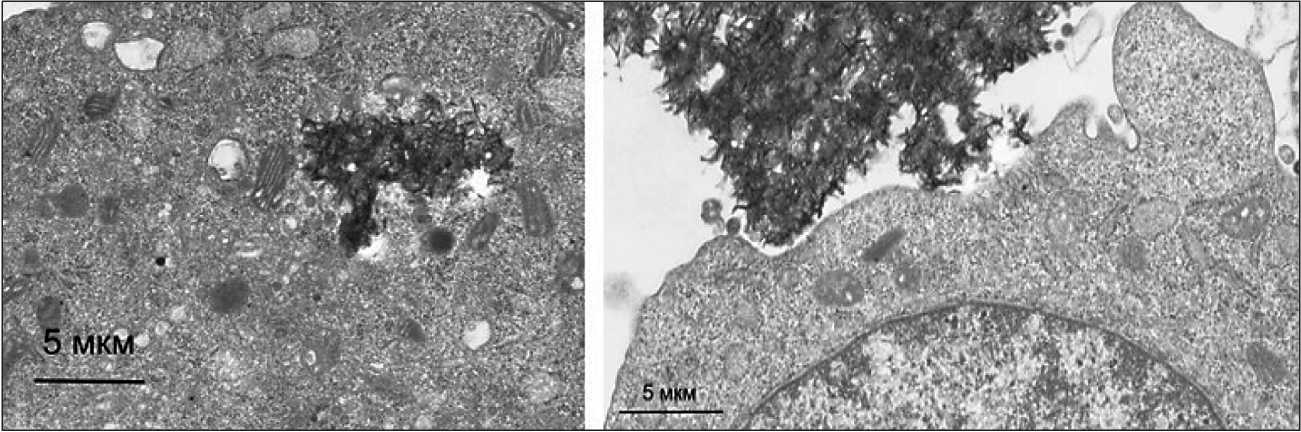
Рис. 4. Электронно-микроскопическое изображение клеток Neuro-2a после инкубирования с образцами наноструктур AlOOH Fig. 4. TEM-image of Neuro-2a cell line after incubation with AlOOH nanostructures
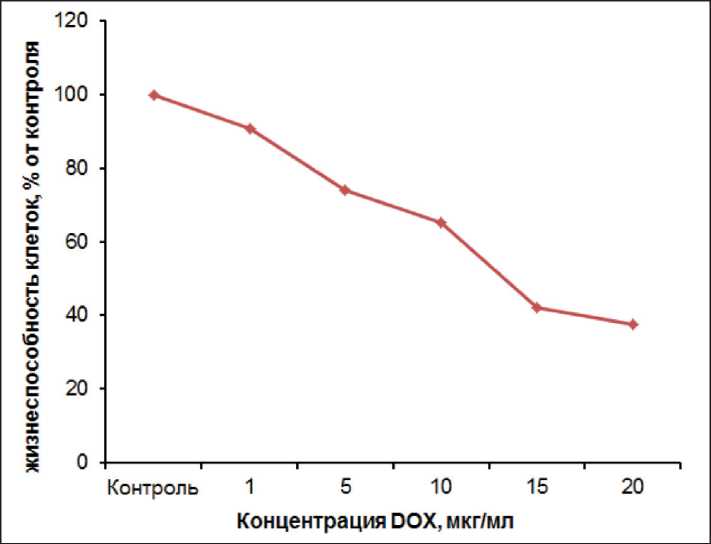
Рис. 5. Жизнеспособность клеток Neuro-2a при воздействии доксорубицина гидрохлорида
Fig. 5. Cell viability of Neuro-2a cell after incubation with doxorubicin
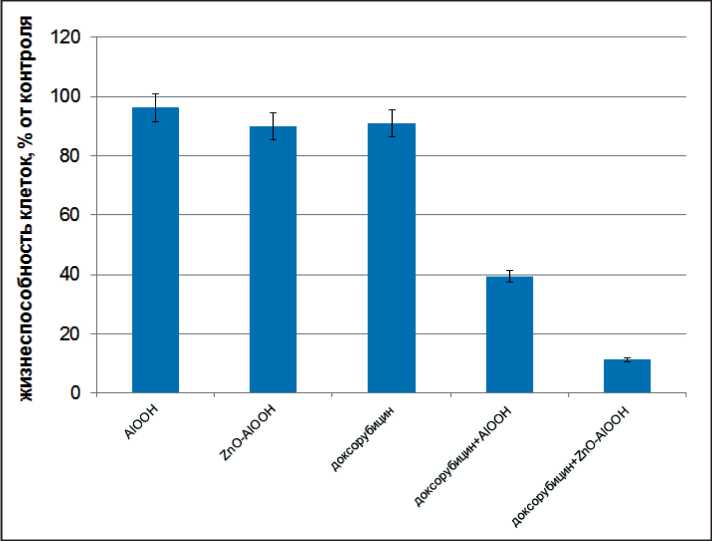
Рис. 6. Жизнеспособность клеток Neuro-2 при совместном воздействии доксорубицина и наноструктур
Fig. 6. Cell viability of Neuro-2 cell line by joint application of doxorubicin and nanostructures
образцы смогут усилить действие химиопрепарата, что позволит снизить его дозировку, а, следовательно, и токсичность. Механизм действия доксорубицина основан на внедрении его в двойную спираль ДНК, вызывающем ее повреждение [17]. Для определения концентрации доксорубицина, не оказывающей токсического действия на исследуемые клеточные линии, предварительно исследовали влияние различных концентраций препарата (рис. 5).
Доксорубицин в концентрации 5 мкг/мл уже оказывает цитотоксическое действие на линию клеток Neuro2a. Для проведения дальнейших исследований совместного действия препарата с наноструктурами была выбрана концентрация 1 мкг/мл.
Для проведения исследования опухолевые клетки инкубировали с наноструктурами и доксорубицином совместно. Предварительно доксорубицин адсорбировали на наноструктурах, адсорбционная емкость составила 10 мкг/г наноструктур. Концентрация наноструктур составила 0,1 мг/мл. Таким образом, при инкубации в каждой ячейке планшета находился 1 мкг/мл DOX. Данные по жизнеспособности клеток (рис. 6) показывают, что синтезированные наноструктуры усиливают действие доксорубицина за счет синергетического эффекта, особенно выраженного при использовании бикомпонентных наноструктур AlOOH-ZnO. Такое действие можно объяснить высокой адгезией клеточной линии к наноструктурам, эндоцитозу и действию химиопрепарата внутри клетки.
Заключение
Наноструктуры, синтезированные взаимодействием с водой электровзрывных порошков Al и Al-Zn, обладают низкой токсичностью и могут быть использованы в качестве носителя для доксорубицина. Совместное применение химиопрепарата с наноструктурами AlOOH и ZnO-AlOOH приводит к усилению клеточного поглощения DOX и, следовательно, повышению повреждающего действия в отношении клеток Neuro-2a. Синергетический эффект синтезированных наноструктур и противоопухолевого препарата доксорубицин в нашей работе продемонстрирован впервые.
Список литературы Синергетический эффект противоопухолевой активности доксорубицина и бикомпонентных наноструктур на основе оксида алюминия
- Singh A.P., Biswas A., Shukla A., Maiti P. Targeted therapy in chronic diseases using nanomaterial-based drug delivery vehicles. Signal Transduct Target Ther. 2019 Aug 30; 4: 33. DOI: 10.1038/s41392-019-0068-3
- Buttacavoli M., Albanese N.N., Di Cara G., Alduina R., Faleri C., Gallo M., Pizzolanti G., Gallo G., Feo S., Baldi F., Cancemi P. Anticancer activity of biogenerated silver nanoparticles: an integrated proteomic investigation. Oncotarget. 2017 Dec 23; 9(11): 9685-9705. 10.18632/ Oncotarget.23859. DOI: 10.18632/oncotarget.23859
- Li Z., Tan S., Li S., Shen Q., Wang K. Cancer drug delivery in the nano era: An overview and perspectives (Review). Oncol Rep. 2017 Aug; 38(2): 611-624. DOI: 10.3892/or.2017.5718
- Zhao N., Woodle M.C., Mixson A.J. Advances in delivery systems for doxorubicin. J Nanomed Nanotechnol. 2018; 9(5). pii: 519. DOI: 10.4172/2157-7439.1000519
- Chatterjee K., Zhang J., Honbo N., Karlinerb J.S. Doxorubicin Cardiomyopathy. Cardiology. 2010; 115(2): 155-62. DOI: 10.1159/000265166


