Синтез 2-арилоксиэтильных производных хиназолин-4 (3 Н)-она
Автор: Озеров А.А., Новиков М.С., Солодунова Е.А., Глухова Е.Г., Романова А.Д.
Журнал: Волгоградский научно-медицинский журнал @bulletin-volgmed
Рубрика: Фармакология токсикология
Статья в выпуске: 2 (22), 2009 года.
Бесплатный доступ
Алкилированием ханазолин-4(3Н)-она и его 5-замещенных производных различными 2-феноксиэтилбромидами получены новые 3-(2-феноксиэтил)хиназолин-4(3Н)-оны.
Хиназолин, алкилирование
Короткий адрес: https://sciup.org/142148758
IDR: 142148758 | УДК: 615.1:54
Текст научной статьи Синтез 2-арилоксиэтильных производных хиназолин-4 (3 Н)-она
Перспективный класс фармакологически активных веществ представляют собой 2-арилоксиэтиль-ные производные различных азотсодержащих гетероциклических соединений. Соответствующие пуриновые производные продемонстрировали мощную противовирусную [5, 6] и высокую антидепрессант-ную [7] активность. Пиримидиновые аналоги этих соединений также обладают выраженными противовирусными свойствами [1, 2]. В то же время фармакологические свойства 2-арилоксиэтильных производных других азотсодержащих соединений, в частности хиназолинов, остаются практически не исследованными. В этой связи синтез таких производных представляет значительный интерес в плане поиска новых потенциальных лекарственных веществ.
ЦЕЛЬ РАБОТЫ
Разработать методы синтеза, исследовать физико-химические и спектральные свойства 3-(2-фе-ноксиэтил)хиназолин-4(3 Н )онов общей формулы:
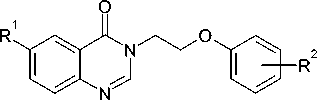
где R1 = H, Br, NO2;
R2 = H, о -, м -, п -CH3, C2H5, CH(CH3)2, Cl, Br, OCH3, фенилен.
МЕТОДИКА ИССЛЕДОВАНИЯ
Исходный хиназолин-4(3Н)-он, а также его 5-бром- и 5-нитропроизводные были получены путем конденсации антраниловой кислоты с формамидом с последующим электрофильным бромированием или нитрованием, как это было описано нами ранее [3, 4]. Алкилирование производных хиназолина 2-феноксиэтилбромидами осуществляли в среде безводного диметилформамида в присутствии карбоната калия в интервале температур 100—120 оС согласно методике, использованной нами ранее для алкилирования пиримидиновых и пуриновых оснований [6]. Спектры ПМР регистрировали на спектрометре «Bruker DRX-300» (300 МГц) в ДМСО-D6 (для соединения 5 — в CDCl3), внутренний стандарт — ГМДС. Интерпретацию спектров осуществляли с помощью лицензионной программы ACD/HNMR Predictor Pro 3.0 фирмы Advanced Chemistry Development (Канада). Тонкослойную хроматографию выполняли на пла- стинах Sorbfil в этилацетате, проявление в парах иода. Температуры плавления измерены в стеклянных капиллярах на приборе «Mel-Temp 3.0» (Laboratory Devices Inc., США).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
Взаимодействие калиевой соли незамещенного хиназолин-4(3 Н )-она, получаемой in situ из карбоната калия в среде безводного диметилфор-мамида, с различными 2-феноксиэтилбромидами в интервале температур 100—120 оС селективно протекает как N3-алкилирование и не затрагивает другие атомы хиназолиновой системы. Выход целевых продуктов алкилирования составляет от 45 до 72 % и в значительной степени зависит от природы алкилирующего агента: увеличение липофильности и размеров заместителя в ароматическом ядре приводит в целом к понижению выхода целевых продуктов, который является минимальным (45—52 %) для бромэтиловых эфиров п -изоп-ропилфенола, α- и β-нафтола (соединения 9 , 14 и 15 ). Использование в качестве субстратов 5-бром-и 5-нитрохиназолин-4(3 Н )-онов также приводит к понижению выхода целевых продуктов в среднем на 14 % по сравнению с незамещенным хиназо-лин-4(3 Н )-оном, что может быть объяснено более низкой растворимостью их солей в ДМФА (табл. 1). Полученные соединения представляют собой белые или светло-желтые кристаллические вещества, хорошо растворимые при нагревании в спирте и этилацетате, легко — в ДМФА и ДМСО, практически нерастворимые в воде и трудно — в водных растворах минеральных кислот.
ТАБЛИЦА 1
Свойства синтезированных соединений
|
Соеди нение |
R1 |
R2 |
Брутто-формула |
Выход, % |
Т. пл., оС |
R f |
|
1 |
H |
H |
C 16 H 14 N 2 O 2 |
71 |
158-160 |
0,67 |
|
2 |
Br |
H |
C16H13BrN2O2 |
62 |
190-192 |
0,79 |
|
3 |
Br |
п -CH 3 |
C 17 H 15 BrN 2 O 2 |
45 |
205-207 |
0,75 |
|
4 |
NO 2 |
H |
C 16 H 13 N 3 O 4 |
48 |
162-165 |
0,66 |
|
5 |
H |
о -CH 3 |
C 17 H 16 N 2 O 2 |
58 |
140-141 |
0,67 |
|
6 |
H |
м -CH3 |
C 17 H 16 N 2 O 2 |
57 |
142-144 |
0,61 |
|
7 |
H |
п -CH 3 |
C 17 H 16 N 2 O 2 |
56 |
158-160 |
0,67 |
|
8 |
H |
п -C2H5 |
C 18 H 18 N 2 O 2 |
72 |
141-142 |
0,69 |
|
9 |
H |
п -CH(CH 3 ) 2 |
C 19 H 20 N 2 O 2 |
50 |
143-145 |
0,69 |
|
10 |
H |
м -Cl |
C 16 H 13 ClN 2 O 2 |
62 |
189-191 |
0,58 |
|
11 |
H |
п -Cl |
C 16 H 13 ClN 2 O 2 |
63 |
166-168 |
0,54 |
|
12 |
H |
п -Br |
C 16 H 13 BrN 2 O 2 |
68 |
175-177 |
0,54 |
|
13 |
H |
п -OCH 3 |
C 17 H 16 N 2 O 3 |
70 |
127-130 |
0,63 |
|
14 |
H |
2,3-фенилен |
C 20 H 16 N 2 O 2 |
45 |
179-181 |
0,63 |
|
15 |
H |
3,4-фенилен |
C 20 H 16 N 2 O 2 |
52 |
205-208 |
0,62 |
В спектрах ПМР синтезированных соединений наблюдаются отчетливые сигналы всех протонов хиназолиновой системы как при наличии, так и при отсутствии заместителя в положении 5 (табл. 2). Химические сдвиги, мультиплетность и интегральная интенсивность сигналов протонов 2- феноксиэтильных заместителей также соответствуют ожидаемым. Интересно отметить то обстоятельство, что химический сдвиг протона при С2 в хина-золиновом ядре сильно зависит от растворителя: в высокополярном ДМСО-D6 он проявляется в слабом поле в среднем при 8,30—8,40 м.д., а в малополярном хлороформе-D он смещается в сильное поле на величину 0,15—0,25 м.д. относительно других сигналов протонов хиназолиновой гетероциклической системы.
ТАБЛИЦА 2
Параметры спектров ПМР синтезированных соединений
|
Со-единение |
Химический сдвиг, δ , м.д. |
|
1 |
4,24 т (5 Гц, 2 Н, NCH 2 ); 4,33 т (5 Гц, 2 Н, CH 2 O); 6,80-6,91 м (3 Н, фенил); 7,17-7,22 м (2 Н, фенил); 7,49 т (7,5 Гц, 1 Н, Н6); 7,62 д (8 Гц, 1 Н, Н8); 7,77 т (7,5 Гц, 1 Н, Н7); 8,11 д (8 Гц, 1 Н, Н5); 8,35 с (1 Н, Н2) |
|
2 |
4,22 т (5 Гц, 2 Н, NCH 2 ); 4,34 т (5 Гц, 2 Н, CH 2 O); 6,85-6,88 м (3 Н, фенил); 7,18-7,23 м (2 Н, фенил); 7,59 д (8,5 Гц, 1 Н, Н8); 7,93 д (8,5 Гц, 1 Н, Н7); 8,19 с (1 Н, Н5); 8,41 с (1 Н, Н2) |
|
3 |
2,16 с (3Н, СН 3 ); 4,19 т (5 Гц, 2 Н, NCH 2 ); 4,33 т (5 Гц, 2 Н, CH 2 O); 6,75-7,03 м (4 Н, фенил); 7,61 д (8,5 Гц, 1 Н, Н8); 7,95 д (8,5 Гц, 1 Н, Н7); 8,20 с (1 Н, Н5); 8,40 с (1 Н, Н2) |
|
4 |
4,24 т (5 Гц, 2 Н, NCH 2 ); 4,34 т (5 Гц, 2 Н, CH 2 O); 6,80-6,88 м (3 Н, фенил); 7,15-7,20 м (2 Н, фенил); 7,79 д (9 Гц, 1 Н, Н8); 8,44 д (9 Гц, 1 Н, Н7); 8,55 с (1 Н, Н5); 8,74 с (1 Н, Н2) |
|
5 |
2,13 с (3 Н, СН 3 ); 4,20 т (5 Гц, 2 Н, NCH 2 ); 4,36 т (5 Гц, 2 Н, CH 2 O); 6,66-7,06 м (4 Н, фенил); 7,40 т (7,5 Гц, 1 Н, Н6); 7,60-7,70 м (2 Н, Н7, Н8); 8,15 с (1 Н, Н2); 8,22 д (8 Гц, 1 Н, Н5) |
|
6 |
2,17 с (3 Н, СН 3 ); 4,19 т (5 Гц, 2 Н, NCH 2 ); 4,31 т (5 Гц, 2 Н, CH 2 O); 6,60-6,70 м (3 Н, фенил); 7,06 т (7,5 Гц, 1 Н, фенил); 7,49 т (7,5 Гц, 1 Н, Н6); 7,62 д (8 Гц, 1 Н, Н8); 7,77 т (7,5 Гц, 1 Н, Н7); 8,10 д (8 Гц, 1 Н, Н5); 8,33 с (1 Н, Н2) |
|
7 |
2,26 с (3 Н, СН 3 ); 4,30 т (5 Гц, 2 Н, NCH 2 ); 4,42 т (5 Гц, 2 Н, CH 2 O); 6,86-7,13 м (4 Н, фенил); 7,62 т (7,5 Гц, 1 Н, Н6); 7,75 д (8 Гц, 1 Н, Н8); 7,90 т (7,5 Гц, 1 Н, Н7); 8,23 д (8 Гц, 1 Н, Н5); 8,46 с (1 Н, Н2) |
|
8 |
1,03 т (7,5 Гц, 3 Н, СН 3 ); 2,41 кв (2Н, СН 2 ); 4,18 т (5 Гц, 2 Н, NCH 2 ); 4,31 т (5 Гц, 2 Н, CH 2 O); 6,75-7,02 м (4 Н, фенил); 7,48 т (7,5 Гц, 1 Н, Н6); 7,61 д (8 Гц, 1 Н, Н8); 7,76 т (7,5 Гц, 1 Н, Н7); 8,09 д (8 Гц, 1 Н, Н5); 8,33 с (1 Н, Н2) |
|
9 |
1,05 д (7 Гц, 6 Н, СН 3 ); 2,72 м (7 Гц, 1Н, СН); 4,18 т (5 Гц, 2 Н, NCH 2 ); 4,31 т (5 Гц, 2 Н, CH 2 O); 6,76-7,05 м (4 Н, фенил); 7,48 т (7,5 Гц, 1 Н, Н6); 7,61 д (8 Гц, 1 Н, Н8); 7,77 т (7,5 Гц, 1 Н, Н7); 8,10 д (8 Гц, 1 Н, Н5); 8,33 с (1 Н, Н2) |
|
10 |
4,27 т (5 Гц, 2 Н, NCH 2 ); 4,32 т (5 Гц, 2 Н, CH 2 O); 6,86-6,99 м (3 Н, фенил); 7,23 т (7,5 Гц, 1 Н, фенил) 7,51 т (7,5 Гц, 1 Н, Н6); 7,63 д (8 Гц, 1 Н, Н8); 7,79 т (7,5 Гц, 1 Н, Н7); 8,12 д (8 Гц, 1 Н, Н5); 8,35 с (1 Н, Н2) |
|
11 |
4,25 т (5 Гц, 2 Н, NCH 2 ); 4,33 т (5 Гц, 2 Н, CH 2 O); 6,90-7,26 м (4 Н, фенил); 7,50 т (7,5 Гц, 1 Н, Н6); 7,63 д (8 Гц, 1 Н, Н8); 7,78 т (7,5 Гц, 1 Н, Н7); 8,11 д (8 Гц, 1 Н, Н5); 8,35 с (1 Н, Н2) |
|
12 |
4,21 т (5 Гц, 2 Н, NCH 2 ); 4,31 т (5 Гц, 2 Н, CH 2 O); 6,82-7,36 м (4 Н, фенил); 7,48 т (7,5 Гц, 1 Н, Н6); 7,61 д (8 Гц, 1 Н, Н8); 7,76 т (7,5 Гц, 1 Н, Н7); 8,09 д (8 Гц, 1 Н, Н5); 8,33 с (1 Н, Н2) |
|
13 |
3,59 с (3 Н, ОСН 3 ); 4,15 т (5 Гц, 2 Н, NCH 2 ); 4,29 т (5 Гц, 2 Н, CH 2 O); 6,70-6,81 м (4 Н, фенил); 7,48 т (7,5 Гц, 1 Н, Н6); 7,61 д (8 Гц, 1 Н, Н8); 7,74 т (7,5 Гц, 1 Н, Н7); 8,09 д (8 Гц, 1 Н, Н5); 8,32 с (1 Н, Н2) |
|
14 |
4,38 т (5 Гц, 2 Н, NCH 2 ); 4,48 т (5 Гц, 2 Н, CH 2 O); 6,86 д (7 Гц, 1 Н, нафтил); 7,28 т (7,5 Гц, 1 Н, Н6); 7,34-7,47 м (4 Н, нафтил); 8,02-8,07 м (1 Н, нафтил); 7,59 д (8 Гц, 1 Н, Н8); 7,65-7,70 м (1 Н, нафтил); 7,72 т (7,5 Гц, 1 Н, Н7); 8,09 д (8 Гц, 1 Н, Н5); 8,57 с (1 Н, Н2) |
ЗАКЛЮЧЕНИЕ
Таким образом, нами установлено, что алкилирование хиназолин-4(3 Н )-она разнообразными 2-фе-ноксиэтилбромидами в среде безводного диметил-формамида в присутствии карбоната калия с хорошим выходом приводит к соответствующим 3-(2-фе-ноксиэтил)хиназолин-4(3 Н )-онам — новым потенциальным фармакологически активным соединениям.


