Синтез 2-бензилтио-5-бензил-6-метил-пиримидин-4 (зн)-онов как потенциальных противовирусных агентов
Автор: Новиков М.С., Бараташвили М.Б., Варавкина Е.В., Озеров А.А.
Журнал: Волгоградский научно-медицинский журнал @bulletin-volgmed
Рубрика: Токсикология
Статья в выпуске: 4 (20), 2008 года.
Бесплатный доступ
Обработкой исходных 2-тио-5-бензил-6-метилурацилов бензилбромидами осуществлен синтез новых 2-5ензил- тио-5-бензил-6-метилпиримидин-4(ЗН)-онов, которые представляют интерес в качестве потенциальных противовирусных агентов.
Синтез, 2-тио-5-бензил-6-метилурацилы, 2-бензилтио-5-бензил-6-метилпиримидин-4(зн)-оны, потенциальные противовирусные агенты
Короткий адрес: https://sciup.org/142148735
IDR: 142148735 | УДК: 615.3:547.854.4
Текст научной статьи Синтез 2-бензилтио-5-бензил-6-метил-пиримидин-4 (зн)-онов как потенциальных противовирусных агентов
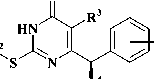
Производные 2-тиоурацила проявляют широкий спектр биологической активности, среди которых наибольший интерес в последнее десятилетие представляют потенциальные ингибиторы вирусной репродукции. В частности, 2-алкил-и 2-циклоалкилтио-6-бензилпиримидин-4(3Н)-оны (рис. 1 [I]) обладают мощной активностью в отношении вируса иммунодефицита человека типа 1 [4, 7, 8], 2-бензилтио-5-циано-6-фенилпирими-дин-4(3Н)-оны (рис. 1 [II]) проявляют выраженный ингибиторный эффект в отношении вируса гепатита С [3]. По этой причине поиск новых высокоэффективных противовирусных агентов в ряду производных 2-тиоурацила представляется актуальным и перспективным.
O
R
R
I
R
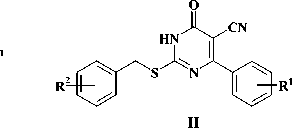
Рис. 1. (I) 2-алкил- и 2-циклоалкилтио-6-бензилпи-римидин-4(3Н)-оны, (II) 2-бензилтио-5-циано-6-фенилпиримидин-4(3Н)-оны
Особый интерес для нас представляли пири-мидин-4(3Н)-оны, содержащие ароматический заместитель в положении 5 и являющиеся структурными аналогами соединений (I) и (II).
ЦЕЛЬ РАБОТЫ
Синтез новых производных 2-тио-5-бензил-6-метилурацила, представленный на рис. 2.
МЕТОДИКА ИССЛЕДОВАНИЯ
Спектры ЯМР 1Н регистрировали на спектрометре «Bruker DRX-500» (500 МГц) в ДМСО-D6, внутренний стандарт ТМС. Интерпретацию спектров осуществляли с помощью лицензионной программы ACD/HNMR Predictor Pro 3.0 фирмы Advanced Chemistry Development (Канада). Тонкослойную хроматографию выполняли на пластинах
Silufol UV-254, проявление — в парах йода. В качестве элюента использовали этилацетат. Темпе- ратуры плавления измерены в стеклянных капиллярах на приборе «Mel-Temp 3.0» (Laboratory Devices Inc., США).
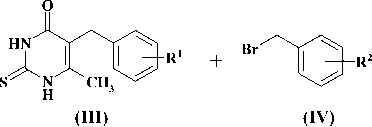
ДМФА
K2CO3
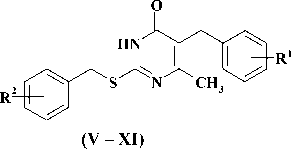
Рис. 2. R1 = H, Me, OMe; R2 = H, Me, Cl, OPh
2-бензилтио-5-бензил-6-метилпирими-дин-4(3Н)-он (V) . Смесь 1 г (4,30 ммоль) 2-тио-5-бензил-6-метилурацила ( III ) и 0,75 г (5,43 ммоль) карбоната калия в 10 мл ДМФА перемешивают при 70—80 °С в течение 1 ч, охлаждают до комнатной температуры, добавляют раствор 0,8 г (4,68 ммоль) бензилбромида ( IV ) в 10 мл ДМФА, перемешивают при той же температуре еще 4 ч и оставляют на ночь. Охлаждают до комнатной температуры, фильтруют, фильтрат упаривают в вакууме, остаток промывают 100 мл холодной воды, не растворившийся твёрдый остаток отфильтровывают, сушат на воздухе и перекристаллизовывают из 40 мл ацетона. Получают 0,95 г (69 %) продукта V в виде белого кристаллического вещества, тем-ра плавления 196—197 °С. 1H ЯMР (DMSO-D6), d, м.д., J (Гц): 2,17 с (3H, CH3); 3,68 с (2H, SCH2); 4,31 с (2H, CH2), 7,08—7,41 м (10H, ароматические Н); 12,60 с (1H, NH).
Соединения VI—XI были получены аналогично.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
Исходные 2-тиоурацилы ( III ), полученные в соответствии с известными методами [1, 5, 6] путем конденсации избытка тиомочевины с соответствующим бензилацетоуксусным эфиром в присутствии этилата натрия алкилировали эквимолярным количеством бензилбромида ( IV ), содержащего различные заместители в ароматическом кольце. Реакция протекала в растворе ДМФА в присутствии 1,25—1,3-кратного мольного избытка карбоната калия и вела исключительно к образованию 2-бензилтио-5-бензил-6-метилпи-римидин-4(3Н)-онов ( V—XI ), выход которых составил 69—87 %. В литературе описано, что использование в качестве алкилирующих агентов первичных алкилгалогенидов ведет к образованию сложной смеси, состоящей из S-моно-, S,N1-и S,N3-дизамещенных продуктов алкилирования с преобладанием первого [2]. В случае алкилирования вторичными алкилгалогенидами наблюдается неполная конверсия исходного 2-тио-6-бен-зилурацила и образуется смесь, состоящая из S-монозамещенного продукта и не прореагировавшего пиримидинового основания, которые разделяют хроматографически [6]. В случае использования бензилбромидов, имеющих больший объем, в результате реакции образуется S-монозамещенные продукты ( V—XI ), бензилтиогруппа которого, по всей вероятности, экранирует атомы азота и препятствует процессу дальнейшего N-алкилирования.
Чистота полученных соединений ( V—XI ) определялась методом тонкослойной хроматографии, строение — ПМР-спектроскопией. Физико-химические свойства соединений ( V—XI ) представлены в таблице.
ТАБЛИЦА
Свойства синтезированных соединений
ЗАКЛЮЧЕНИЕ
Таким образом, нами синтезированы 7 новых ранее не описанных в литературе 2-бензилтио-5-бен-зил-6-метилпиримидин-4(3Н)-онов, изучены их спектральные и физико-химические свойства. Соединения этого ряда представляют интерес в плане поиска новых высокоэффективных противовирусных агентов.


