Синтез 4,4’-окса-бис-(цианобензола) дегидратацией 4,4’-дикарбоксамидодифенилоксида хлористым тионилом
Автор: Луцкая Марина Руслановна, Холхоев Бато Чингисович, Бурдуковский Виталий Федорович
Журнал: Вестник Бурятского государственного университета. Философия @vestnik-bsu
Рубрика: Химия
Статья в выпуске: 3, 2012 года.
Бесплатный доступ
4,4’-окса-бис-(цианобензол) синтезирован дегидратацией 4,4’-дикарбоксамидодифенилоксида хлористым тионилом в растворе ДМФА при 40°С в течение 4 ч. Последний получен низкотемпературной конденсацией дихлорангидрида 4,4’-дикарбоксидифенилоксида с 28% водным раствором аммиака.
4'-окси-бис-(цианобензол), хлористый тионил, 4'-дикарбоксамидодифенилоксид
Короткий адрес: https://sciup.org/148180978
IDR: 148180978 | УДК: 547.592
Текст научной статьи Синтез 4,4’-окса-бис-(цианобензола) дегидратацией 4,4’-дикарбоксамидодифенилоксида хлористым тионилом
В основе структуры нитрилов лежит тройная связь C≡N, относящаяся к числу классических функциональных групп в органической химии. Большое значение тройной связи связано с легкостью ее введения в молекулу и с ее исключительно высокой реакционной способностью, обусловленной уникальным сочетанием ненасыщенности, поляризуемости и невысокой чувствительности к стерическим факторам. Высокая реакционная способность нитрилов и большой ассортимент возможных продуктов их взаимодействия с нуклеофильными реагентами предопределили использование их бифункциональных производных в синтезе различных полигетероариленов [1-5].
Классическими методами синтеза алифатических и ароматических нитрилов являются реакции нуклеофильного замещения алкил- или арилгалогенидов цианид-ионом [6]. В случае алкилгалогени-дов обычно используют цианиды щелочных металлов, а реакцию проводят в водно-спиртовой среде при комнатной или повышенной температуре часто с использование катализаторов межфазного переноса или цианид-ион в виде комплекса с 18-краун-6. Неактивированные арилгалогениды в обычных условиях не реагируют с цианидами металлов, однако замещение удается осуществить при нагревании галогенида с цианидом меди при высокой температуре (>200 ° С) в присутствии пиридина [7]. Применение этих методов ограничено из-за использования весьма жестких условий. Кроме того, к недостаткам указанных методов можно отнести и то, что вследствие амбидентного характера циа-нид-иона часто в небольшом количестве образуется и соответствующий изоцианид, который может стать при определенных условиях основным продуктом реакции.
Другой распространенный метод синтеза ароматических нитрилов состоит в отщеплении воды от первичных карбоксамидов [7]. Классический вариант этого метода заключается в нагревании амида с такими реагентами, как пентаоксид фосфора или хлорангидриды кислот (например, пентахлорид фосфора, фосфорилхлорид, фосген и др.). Выходы продуктов таких реакций, как правило, достаточно высоки, однако они могут быть загрязнены побочными продуктами или исходными водоотнимающими реагентами. На наш взгляд, наиболее сбалансированным подходом является использование в
М.Р. Луцкая, Б.Ч. Холхоев, В.Ф. Бурдуковский. Синтез 4,4’-окса-бис-(цианобензола) дегидратацией 4,4’-дикарбоксамидодифенилоксида хлористым тионилом качестве дегидратирующего агента тионил хлорида, поскольку побочными продуктами такой реакции будут легко удаляемые летучие вещества (SO2, HCl). Кроме того использование амидного растворителя (например, ДМФА) позволит увеличить выход целевого продукта, поскольку указанный растворитель является акцептором хлороводорода, тем самым равновесие реакции будет смещаться в сторону продуктов.
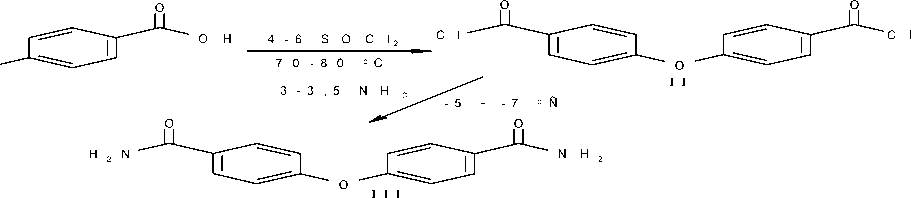
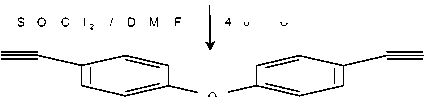
В работе определены условия реакции дегидратации 4,4’-дикарбоксамидодифенилоксида хлористым тионилом в растворе ДМФА, позволяющие с высоким выходом получить 4,4’-окса-бис-(цианобензол). Синтез указанного динитрила осуществлен в соответствии со схемой:
HO
I
N
N
SO
40 oC
IV
Дихлорангидрид 4,4’-дикарбоксидифенилоксида (II) получали по известным методикам, действием 2-3 кратного избытка хлористого тионила в присутствии нескольких капель ДМФА как катализатора. Смесь нагревали при 70-80 ° С до полной гомогенизации и выдерживали дополнительно 2 ч. Затем избыток хлористого тионила отгоняли. После перекристаллизации из октана выход светложелтого продукта II, с Тпл = 85.0-86.3 ° С (лит. Тпл = 83-85 ° С), составил 76.2%.
Диамид (III), как промежуточное соединение в синтезе динитрила, получали низкотемпературной конденсацией дихлорангидрида с концентрированным водным раствором аммиака. При этом в предварительно охлажденный до -5 ^ -7 ° С раствор аммиака небольшими порциями при тщательном перемешивании добавляли твердый дихлорангидрид, так чтобы температура не поднималась выше -5 ° С. Полученное в результате вещество III представляло собой белый порошок с температурой плавления 278.8-280.1 ° С (выход 98.9%).
Отсутствие в литературе конкретных методик синтеза ароматических динитрилов дегидратацией дикарбоксамидов предопределило поиск наиболее оптимальных условий синтеза указанных соединений. Проведенные нами исследования подтвердили предположение о высокой эффективности сочетания хлористого тионила с ДМФА. Влияние различных параметров на выход целевого продукта IV показано на рис. 1-3. Влияние температуры синтеза на выход динитрила исследовали в диапазоне 20-60 ° С, при этом оказалось, что наибольший выход достигается при 40 ° С (рис. 1).
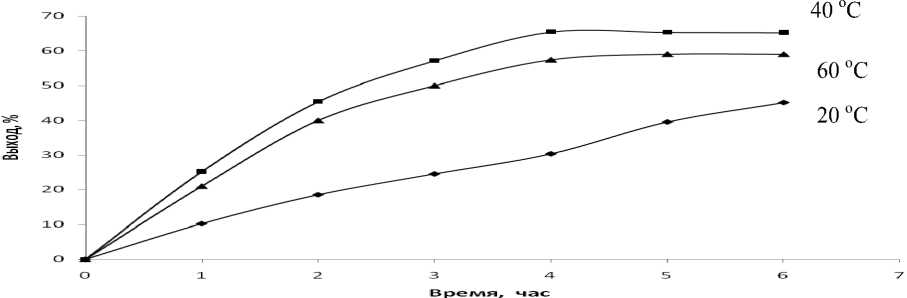
Рис. 1. Влияние температуры и продолжительности реакции на выход динитрила
На выход целевого продукта большое влияние оказывает мольное соотношение исходных реагентов, как видно из рис. 2 использование, как недостатка, так и эквивалентного количества хлористого тионила приводит лишь к небольшим выходам динитрила, тогда как небольшой избыток дегидратирующего агента приводит к значительному увеличению выхода продукта реакции.
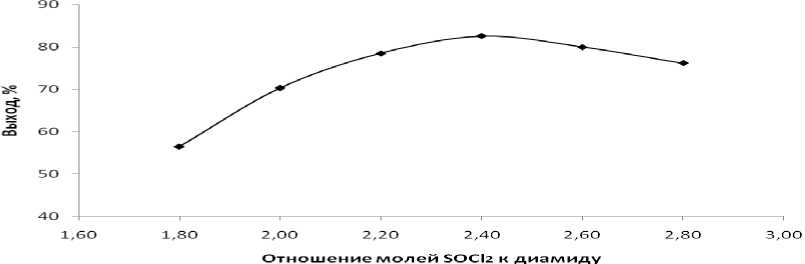
Рис. 2. Влияние отношения молей SOCl 2 к диамиду на выход динитрила
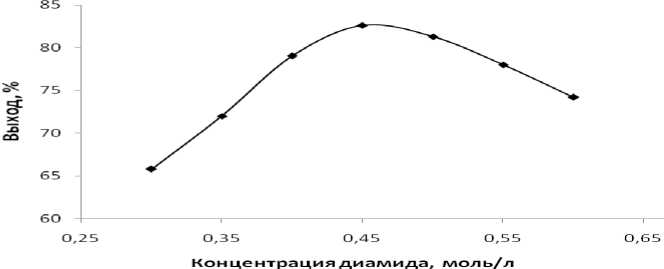
Рис. 3. Влияние концентрации диамида в ДМФА на выход динитрила
Дальнейшие исследования показали, что для получения динитрила с наибольшим выходом необходима концентрация исходных веществ равная 0.45-0.47 моль/л в ДМФА (рис. 3).
Таким образом, в ходе данной работы осуществлен трехступенчатый синтез ароматического динитрила 4,4’-окса-бис-(цианобензола) с выходом 82.6%. Установлено, что дегидратация диамидов значительно эффективней осуществляется в ДМФА, который выступает одновременно реакционной средой и акцептором выделяющегося хлороводорода. В качестве хлорирующего агента удобно использовать незначительный избыток хлористого тионила при 40 ° С в течение 4 ч.


