Синтез алифитических и ароматических кетонов хиназолинового ряда
Автор: Глухова Е.Г., Озерова Т.П., Солодунова Г.Н., Озеров А.А.
Журнал: Волгоградский научно-медицинский журнал @bulletin-volgmed
Рубрика: Фармакология токсикология
Статья в выпуске: 1 (41), 2014 года.
Бесплатный доступ
Алкилированием хиназолин-4(3Н)-она, 2-метил-, 6-бром- и 6-нитрохиназолин-4(3Н)-она алифатическими и ароматическими галоидметилкетонами получен ряд карбонильных производных хиназолин-4(3Н)-она - ценных полупродуктов для синтеза фармакологически активных веществ.
Хиназолин, галоидметилкетон, алкилирование
Короткий адрес: https://sciup.org/142149080
IDR: 142149080 | УДК: 547.856.1
Текст научной статьи Синтез алифитических и ароматических кетонов хиназолинового ряда
Интерес к азотсодержащим гетероциклическим соединениям хиназолиновой природы определяется широким спектром биологической активности этих веществ, имеющих как природное [3], так и синтетическое [4] происхождение. В последние годы среди производных хиназо-лина были выявлены новые соединения, обладающие выраженной противосудорожной [5] и антидепрессантной [6] активностью, а также ряд веществ с иммунотропными свойствами [2]. Функциональные производные хиназолина, имеющие карбонильную группу в составе заместителя при атоме азота, открывают широкие синтетические возможности для получения новых веществ хиназолинового ряда на основе реакций нуклеофильного присоединения по двойной углерод-кислородной связи. Синтезу таких ценных промежуточных продуктов посвящена настоящая статья.
ЦЕЛЬ РАБОТЫ
Синтез, исследование физико-химических свойств и спектральных характеристик новых производных хиназолин-4(3Н)-она, содержащих фрагменты алифатических и ароматических метилкетонов в положении 3 гетероциклической системы.
МЕТОДИКА ИССЛЕДОВАНИЯ
Синтез новых и описанных нами ранее [1] кетонов хиназолинового ряда был осуществлен путем N-алкилирования хиназолин-4(3Н)-она, а также его 2-метил-, 6-бром- и 6-нитропроизводных соответствующими галоидметил-кетонами в среде безводного диметилформа-мида в присутствии карбоната калия в интервале температур 70-120 °С. Спектры ЯМР 1Н и 13С регистрировали на спектрометре Bruker AMXIII-400 в растворе диметилсульфоксида-D6, внутренний стандарт – тетраметилсилан. Интерпретацию спектров осуществляли с помощью лицензионной программы ACD/HNMR Predictor Pro 3.0 фирмы Advanced Chemistry Development (Канада). ТСХ выполняли на пластинах Sorbfil, элюент – изопропиловый спирт, проявление в парах иода. Температуры плавления измерены в стеклянных капиллярах на приборе Mel-Temp 3.0 (Laboratory Devices Inc., США).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯИ ИХ ОБСУЖДЕНИЕ
Нами обнаружено, что алкилирование калиевых солей ханазолин-4(3 Н )-она и его
2-метил-, 6-бром- и 6-нитропроизводных, образующихся in situ в среде диметилформамида из карбоната калия, легко реагируют с алифатическими и ароматическими хлорметил-и бромметилкетонами и приводят к целевым соединениям с выходом 51–83 % в соответствии со схемой:
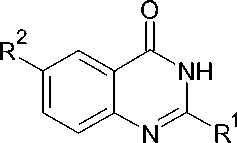
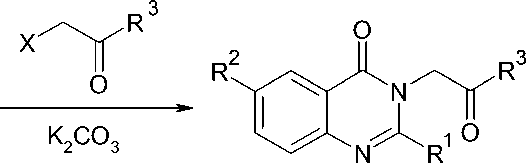
где X = Cl или Br; R1 = H или CH 3 ; R2 = H, Br или NO 2 ;
R3 = CH 3 , C(CH 3 ) 3 , C 6 H 5 , 1-C 10 H 7 или 2-C 10 H 7
Наличие дополнительного метильного заместителя в положении 2 хиназолинового ядра практически не оказывает отрицательного влияния на выход продуктов N-алкилирования по атому азота в положении 3, однако понижает температуру плавления веществ. Выход и физико-химические свойства синтезированных соединений представлены в таблице.
|
Соединение |
R1 |
R2 |
R3 |
Брутто-формула |
Выход, % |
Т. пл., ° С |
|
I |
H |
H |
CH 3 |
С 11 H 10 N 2 O 2 |
62 |
166–168 |
|
II |
H |
H |
C(CH 3 ) 3 |
С 14 H 16 N 2 O 2 |
69 |
128,5–130 |
|
III |
H |
H |
C 6 H 5 |
С 16 H 12 N 2 O 2 |
83 |
156–158 |
|
IV |
H |
H |
1-C 10 H 7 |
С 20 H 14 N 2 O 2 |
58 |
174–174,5 |
|
V |
H |
H |
2-C 10 H 7 |
С 20 H 14 N 2 O 2 |
56 |
199–201 |
|
VI |
H |
Br |
1-C 10 H 7 |
С 20 H 13 BrN 2 O 2 |
63 |
217,5–220 |
|
VII |
H |
Br |
2-C 10 H 7 |
С 20 H 13 BrN 2 O 2 |
51 |
239–241,5 |
|
VIII |
H |
NO 2 |
C(CH 3 ) 3 |
С 14 H 15 N 3 O 4 |
56 |
200–203 |
|
IX |
CH 3 |
H |
C(CH 3 ) 3 |
С 15 H 18 N 2 O 2 |
72 |
110,5–112,5 |
|
X |
CH 3 |
H |
C 6 H 5 |
С 17 H 14 N 2 O 2 |
79 |
161,5–163 |
Все синтезированные соединения представляют собой белые или светло-желтые кристаллические вещества, мало (за исключением соединения I ) растворимые в воде, растворимые в 95%-м этиловом спирте и диметилсульфоксиде. Все соединения легко образуют в спиртовой среде стабильные соли с минеральными кислотами. Предварительное исследование фармакологических свойств новых карбонильных производных хиназолин-4(3 Н )-она на модели циклофосфановой иммунодепрессии выявило возможность использования этих веществ для коррекции иммунодефицитных состояний.
ЗАКЛЮЧЕНИЕ
Осуществлен синтез ряда новых алифатических и ароматических кетонов хиназолиново-го ряда, представляющих интерес в качестве интермедиатов для дальнейшей химической 24
модификации с целью синтеза фармакологически активных веществ, а также обладающих самостоятельной иммунотропной активностью.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
3-(2-Оксопропил)-4(3Н)-хиназолинон (I). 10,0 г (68,4 моль) хиназолин-4(3Н)-она, 12,5 г (90,4 ммоль) безводного карбоната калия и 100 мл безводного диметилформамида (Pan-reac) перемешивают 30 мин при комнатной температуре, добавляют 6,0 мл (75,3 ммоль) све-жеперегнанного хлорацетона, перемешивают сначала 15 мин без нагревания, а затем 1 ч при температуре 70-80 °С. Фильтруют, фильтрат упаривают в вакууме досуха, остаток экстрагируют 100 мл кипящего изопропилового спирта, горячий экстракт фильтруют и выдерживают в течение суток при температуре 0-5 °С. Выделившийся продукт отфильтровывают, промывают холодным изопропиловым спиртом, сушат на воздухе и получают 8,65 г светло-желтого кристаллического вещества, выход 62 %, Т.пл.166-168°С.
Спектр ЯМР 1Н, δ, м.д.: 2,25 с (3Н, СН 3 ); 4,96 c (2H, CH 2 ); 7,55 т (1Н, 8 Гц, Н6); 7,70 д (1Н, 8 Гц, Н8); 7,84 т (1Н, 8 Гц, Н7); 8,14 д (1Н, 8 Гц, Н5); 8,22 с (1Н, Н2).
Спектр ЯМР 13С, δ, м.д.: 27,47; 55,01; 121,70; 126,36; 127,50; 127,57; 134,84; 148,31; 148,37; 160,32; 202,01.
Остальные соединения получают аналогично.
3-(2-трет.-Бутил-2-оксоэтил)-4(3 Н )-хиназолинон (II).
Спектр ЯМР 1Н, δ, м.д.: 1,19 с (9Н, СН 3 ); 5,10 c (2H, CH 2 ); 7,52 т (1Н, 8 Гц, Н6); 7,69 д (1Н, 8 Гц, Н8); 7,81 т (1Н, 8 Гц, Н7); 8,12 д (1Н, 8 Гц, Н5); 8,23 с (1Н, Н2).
Спектр ЯМР 13С, δ, м.д.: 26,09; 43,09; 50,91; 121,70; 126,27; 127,40; 127,50; 134,72; 148,33; 148,58; 160,27; 208,68.
3-(2-Фенил-2-оксоэтил)-4(3 Н )-хиназолинон (III).
Спектр ЯМР 1Н, δ, м.д.: 5,67 с (2H, CH 2 ); 7,54–7,77 м (5Н, Н6, Н8, фенил); 7,87 т (1Н, 8 Гц, Н7); 8,07–8,19 м (3Н, Н5, фенил); 8,39 с (1Н, Н2).
Спектр ЯМР 13С, δ, м.д.: 52,48; 121,77; 126,40; 127,53; 127,64; 128,40; 129,34; 134,51; 134,65; 134,86; 148,43; 148,61; 160,52; 193,14.
3-[2-(1-Нафтил)-2-оксоэтил]-4(3 Н )-хиназолинон (IV).
Спектр ЯМР 1Н, δ, м.д.: 5,68 с (2Н, СН 2 ); 7,56–8,63 м (11Н, Н5,Н6, Н7, Н8, нафтил); 8,48 с (1Н, Н2).
Спектр ЯМР 13С, δ, м.д.: 54,56; 121,83; 125,18; 125,49; 126,44; 127,02; 127,56; 127,68; 128,56; 128,98; 129,19; 129,87; 132,60; 133,83; 133,94; 134,91; 148,49; 148,67; 160,62; 196,62.
3-[2-(2-Нафтил)-2-оксоэтил]-4(3 Н )-хиназолинон (V).
Спектр ЯМР 1Н, δ, м.д.: 5,81 с (2Н, СН 2 ); 7,55-8,89 м (11Н, Н5, Н6, Н7, Н8, нафтил); 8,42 с (1Н, Н2).
Спектр ЯМР 13С, δ, м.д.: 52,49; 121,80; 123,59; 126,42; 127,56; 127,66; 128,14; 129;02; 129,45; 130,02; 130,66; 131,97; 132,46; 134,89; 135,78; 148,45; 148,76; 160,56; 193,09.
3-[2-(1-Нафтил)-2-оксоэтил]-6-бром-4(3 Н )-хиназолинон (VI).
Спектр ЯМР 1Н, δ, м.д.: 5,65 с (2Н, СН 2 ); 7,57–8,62 м (10Н, Н5, Н7, Н8, нафтил); 8,46 с (1Н, Н2).
Спектр ЯМР 13С, δ, м.д.: 54,61; 120,01; 123,49; 125,03; 125,49; 126,92; 128,39; 128,61;
128,88; 130,02; 132,93; 133,75; 133,86; 133,95; 137,64; 147,56; 149,10; 159,57; 196,28.
3-[2-(2-Нафтил)-2-оксоэтил]-6-бром-4(3 Н )-хиназолинон (VII).
Спектр ЯМР 1Н, δ, м.д.: 5,76 с (2H, CH 2 ); 7,60– 8,81 м (10Н, Н5, Н7, Н8, нафтил); 8,39 с (1Н, Н2).
Спектр ЯМР 13С, δ, м.д.: 52,48; 119,95; 123,61; 124,22; 127,42; 128,05; 128,59; 128,95; 129,26; 129,93; 130,03; 130,33; 132,60; 135,87; 137,60; 149,11; 159,49; 162,77; 192,84; 211,30.
6-Нитро-3-(2-трет.-бутил-2-оксоэтил)-4(3 Н )-хиназолинон (VIII).
Спектр ЯМР 1Н, δ, м.д.: 1,24 с (9Н, СН 3 ); 5,16 c (2H, CH 2 ); 7,86 д (1Н, 8 Гц, Н8); 8,36 с (1Н, Н2); 8,51 д (1Н, 8 Гц, Н7); 8,80 с (1Н, Н5).
Спектр ЯМР 13С, δ, м.д.: 26,13; 43,15; 51,04; 121,77; 122,38; 128,53; 129,47; 145,85; 151,67; 152,42; 159,54; 207,97.
2-Метил-3-(2-трет.-бутил-2-оксоэтил)-4(3 Н )-хиназолинон (IX).
Спектр ЯМР 1Н, δ, м.д.: 1,25 с (9Н, СН 3 ); 2,40 с (3Н, СН 3 ); 5,23 c (2H, CH 2 ); 7,47 т (1Н, 8 Гц, Н6); 7,61 д (1Н, 8 Гц, Н8); 7,79 т (1Н, 8 Гц, Н7); 8,07 д (1Н, 8 Гц, Н5).
Спектр ЯМР 13С, δ, м.д.: 22,89; 26,21; 43,31; 49,33; 119,86; 126,44; 126,60; 126,92; 134,72; 147,48; 155,22; 161,19; 209,05.
2-Метил-3-(2-фенил-2-оксоэтил)-4(3 Н )-хиназолинон (X).
Спектр ЯМР 1Н, δ, м.д.: 2,49 с (3Н, СН 3 ); 5,76 c (2H, CH 2 ); 7,49 т (1Н, 8 Гц, Н6); 7,58–7,76 м (5 Н, Н5, Н8, фенил); 7,82 т (1Н, 8 Гц, Н7); 8,08– 8,15 м (2Н, фенил).
Спектр ЯМР 13С, δ, м.д.: 23,16; 50,95; 119,91; 126,51; 126,72; 126,99; 128,51; 129,28; 134,53; 134,77; 134,86; 147,55; 155,40; 161,41; 193,59.
Список литературы Синтез алифитических и ароматических кетонов хиназолинового ряда
- Озерова Т.П., Гпухова Е.Г., Ситникова Е.В. и др.//Совр. пробл. науки и образов. -2010. -№ 6. -C. 3.
- Цибизова А.А., Тюренков И.Н., Самотруева М.А. и др.//Межд. журн. прикл. и фундам. исслед. -2013. -№ 11. -С. 71-72.
- Arora R., Kapoor A., Gill N.S., et al.//Int. Res. J. Pharmacy. -2011. -Vol. 2, № 12. -P. 22-28.
- Jatav V., Mishra P., Kashaw S., et al.//Eur. J. Med. Chem. -2008. -Vol. 43. -P. 135-141.
- Nerkar A.G., Joshi P.P., Mohite S., et al.//Int. J. Pharmacy Pharm. Sci. -2013. -Vol. 5, № 1. -P. 331-335.
- Tyurenkov I.N., Ozerov A.A., Solodunova E.A., et al.//Pharm. Chem. J. -2013. -Vol. 47, № 5. -P. 239-242.


