Синтез ангиотензиногена в тканях печени при длительном течении артериальной гипертензии
Автор: Железнякова О.Е., Слесарева Е.В., Кузнецова Т.И., Слесарева Ю.С., Денисова О.Ф.
Журнал: Ульяновский медико-биологический журнал @medbio-ulsu
Рубрика: Биологические науки
Статья в выпуске: 2, 2025 года.
Бесплатный доступ
Артериальная гипертензия остается одним из самых распространенных заболеваний, оказывающим влияние на разные органы, в т.ч. на печень, которая является частью ренин-ангиотензинальдостероновой системы и вырабатывает ангиотензиноген. Большинство исследований уделяют внимание гепатоцитам – основным клеткам, вырабатывающим ангиотензиноген, тогда как работ, посвященных выработке ангиотензиногена стромой, крайне мало. Цель. Определить интенсивность синтеза ангиотензиногена стромальными элементами печени в зависимости от длительности течения артериальной гипертензии. Материалы и методы. Исследование проводилось на аутопсийном материале 37 чел., которые были разделены на 4 группы. Первая группа включала участников со стажем артериальной гипертензии не более 5 лет, вторая группа – со стажем 10–15 лет, третья – со стажем более 15 лет. Четвертая группа (группа сравнения) объединяла исследуемых без артериальной гипертензии. Аутоптаты печени были приготовлены по стандартной гистологической методике, окрашены гематоксилин-эозином. Экспрессия ангиотензиногена печенью определялась при помощи ИГХокрашивания парафиновых микропрепаратов. Результаты. Полученные данные свидетельствуют, что артериальная гипертензия длительностью более 15 лет вызывает патологические изменения в паренхиме и строме печени. Площадь стромы увеличивается, наблюдаются фиброз и воспаление. Степень экспрессии ангиотензиногена в строме не изменяется в течение всего срока заболевания. Стромальные клетки экспрессируют больше ангиотензиногена, чем гепатоциты.
Артериальная гипертензия, строма печени, жировая дистрофия, ангиотензиноген, морфометрия
Короткий адрес: https://sciup.org/14132991
IDR: 14132991 | УДК: 616.12- 008.331.1:616.36 | DOI: 10.34014/2227-1848-2025-2-110-120
Текст научной статьи Синтез ангиотензиногена в тканях печени при длительном течении артериальной гипертензии
Введение. Несмотря на значительное количество исследований, посвященных изучению регуляции артериального давления, артериальная гипертензия (АГ) остается актуальной проблемой современного здравоохранения. Повышенное артериальной давление наблюдается более чем у 80 % пожилого населения и оказывает непосредственное влияние на многие системы органов. Печень, как многофункциональный орган, при артериальной гипертензии претерпевает изменения гемодинамики, что не может не сказываться на ее функциях и строении. Клетки печени вырабатывают ангиотензиноген (AGT), т.е. являются частью ренин-ангиотен-зин-альдостероновой системы (РААС).
Звенья цепи РААС и тонкие механизмы ее работы исследуются до сих пор. Значительное внимание уделяется ангиотензину I, ангиотензину II, ангиотензинпревращающему ферменту, их антагонистам и ингибиторам [1]. Ангиотензиноген же изучается с точки зрения разнообразия аллелей генов, его кодирующих. Так, доказано, что уровень артериального давления зависит от степени экспрессии гена AGT и количества его аллелей [2–5]. На синтез ангиотензиногена влияет множество физиологических медиаторов, например циркулирующие стероидные гормоны (глюкокортикоиды и эстрогены), цитокин, интерлейкин-1, фактор некроза опухоли [6–9].
Цель исследования. Определить интенсивность синтеза ангиотензиногена стромальными элементами печени в зависимости от длительности течения артериальной гипертензии.
Материалы и методы. Исследование было выполнено на аутопсийном материале 37 умерших мужского пола, из которых 30 чел. страдали артериальной гипертензией, 7 чел. умерли от хирургической патологии, не имея хронических заболеваний сердечно-сосудистой системы, эндокринной патологии и онкологических заболеваний (группа сравнения). План исследования был одобрен локальным этическим комитетом и научно-координационным советом ИМЭиФК Ульяновского государственного университета (протокол заседания № 3/21 от 13.12.2021) и соответствовал принципам Хельсинкской декларации (WMA Declaration of Helsinki – Ethical Principles for Medical Research Involving Human Subjects).
Участники были разделены на 4 группы в зависимости от длительности течения заболевания и уровня артериального давления:
-
- 1-я группа: длительность течения АГ – не более 5 лет, уровень систолического артериального давления – 140–159 мм рт. ст., уровень диастолического артериального давления – 90–99 мм рт. ст. – 1-я степень АГ (10 умерших, средний возраст – 52,3±3,3 года);
-
- 2-я группа: длительность течения АГ – 10–15 лет, уровень систолического артериального давления – 160–179 мм рт. ст., уровень диастолического артериального давления – 100–109 мм рт. ст. – 2-я степень АГ (10 умерших, средний возраст – 59,5±4,9 года);
-
- 3-я группа: длительность течения АГ – более 15 лет, уровень систолического артериального давления – выше 180 мм рт. ст., уро-
- вень диастолического артериального давления – выше 110 мм рт. ст. – 3-я степень АГ (10 умерших, средний возраст – 74,7±6,3 года);
-
- 4-я группа (группа сравнения): отсутствие патологии сердечно-сосудистой системы (7 умерших, средний возраст 48,5±4,3 года).
Непосредственным объектом исследования послужили фрагменты печени, которые фиксировались в 10 % забуференном нейтральном формалине. Проводку осуществляли по стандартной гистологической методике с заливкой в парафин, после чего изготавливали срезы толщиной 6 мкм. Для визуализации ангиотензиногеновых гранул в паренхиме печени использовалась иммуногистохимическая методика окрашивания с применением поликлональных первичных антител к ангиотензиногену Angiotenzinogen-antibody (CloudClone, Китай). Разведение осуществлялось на основе рекомендаций производителя (1:100); использовался набор для детекции ultraView Universal DAB detection Kit (США). Окрашивание производилось с помощью автоматического иммуностейнера BenchMark XT Ventana, Roshe (США).
На ИГХ-окрашенных препаратах оценивалась степень экспрессии ангиотензиногена в баллах: 1 – слабая экспрессия, 2 – средняя экспрессия, 3 – сильная экспрессия. В каждом образце оценивали не менее 10 полей зрения, в каждой группе суммарно не менее 100 участков.
Для морфометрии использовался бинокулярный микроскоп Levenhook, морфометрическая программа Levenhook Lite и микрофотокамера Levenhook M800. При помощи системы видеоморфометрии на микрофотографиях гистопрепаратов печени проводили измерения при увеличении ×10. На стандартной единице площади (270×103 мкм2) среза измеряли общую площадь стромы, а также площадь стромы, экспрессирующей ангиотензи-ноген. В каждой группе проведено не менее 100 измерений.
Полученные данные обрабатывали статистически в программе Statistica 10.0. (США). Полученные морфометрические параметры были проверены на соответствие закону нормального распределения (критерий Шапиро –
Уилкса). Для всех групп обнаружено логнормальное и экспоненциальное распределение. Далее для попарного сравнения значимости различий использовали U-критерий Манна – Уитни, а также дисперсионный анализ Крас-келла – Уоллиса. Данные представлены как среднее арифметическое и стандартная ошибка среднего (М±m). Значимыми читали отличия при р<0,05.
Результаты и обсуждение. В печени больных артериальной гипертензией микроскопически выявлялись признаки жировой дистрофии. Оптически прозрачные округлые полости в цитоплазме гепатоцитов различного диаметра имели разную степень выраженности – от очаговых изменений в группе больных, страдающих артериальной гипертензией около 5 лет, до крупных оптически прозрачных капель, местами сливающихся друг с другом, в группе больных, страдающих гипертензией более 15 лет. Кроме того, выявлялась очаговая лимфогистиоцитарная инфильтрация, преимущественно портальных трактов, без разрушения пограничной пластинки (рис. 1).
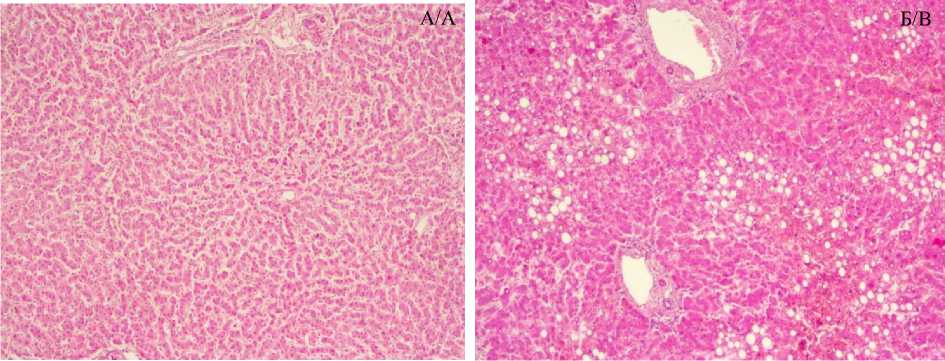
Рис. 1. Жировая дистрофия в паренхиме печени: а) группа сравнения (без АГ); б) группа 3 (стаж АГ более 15 лет). Определяются оптически прозрачные вакуоли различного диаметра, очаги диапедеза эритроцитов и лимфогистиоцитарной инфильтрации (б). Окраска гематоксилин-эозином, ×15×4
Fig. 1. Fatty degeneration in the liver parenchyma in long-term arterial hypertension: a) comparison group, without hypertension; b) group 3, hypertension history more than 15 years. Optically transparent vacuoles of different diameters, foci of erythrocyte diapedesis and lymphohistiocytic infiltration are determined (b). Hematoxylin and eosin staining, magnification 15×4
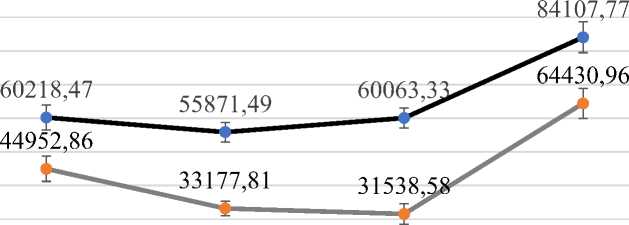
Согласно полученным морфометрическим данным общая площадь стромы печени в первых двух исследуемых группах изменялась незначительно и возрастала только в 3-й группе. Так, в первые 5 и 10–15 лет развития АГ (группа 1 и группа 2) площадь общей стромы составляла 55871,49±2919,20 мкм2 и 60063,00±2955,74 мкм2 соответственно, в контрольной группе – 60218,47±3691,08 мкм2. В группе больных со стажем АГ более 15 лет данный показатель возрастал до 84107,77±4575,37 мкм2 (р≤0,05) (рис. 2).
Изменения общей площади стромы печени, происходящие по мере увеличения стажа артериальной гипертензии, согласуются с морфологическими изменениями ее паренхимы.
В первые 5 и 10–15 лет протекания артериальной гипертензии (группы 1 и 2) в паренхиме не наблюдается значительных количественных сдвигов, размеры гепатоцитов не имеют значимых различий, разрастания стромы не отмечается. При стаже АГ около 10–15 лет (группа 2) начинают появляться очаги мелкокапельной жировой дистрофии гепатоцитов, а при стаже более 15 лет (группа 3) эти очаги заметно разрастаются, клетки в них демонстрируют уже крупнокапельную жировую дистрофию, тогда как остальные клетки подвергаются процессу гипотрофии. Площадь стромы при этом также увеличивается, наблюдается фибротическая активность и воспаление.
мкм2 / μm2
Группа сравнения /
Comparison group
—•— Общая площадь стромы / Total area of the stroma
Группа 1 / Группа 2 / Группа 3 /
Group 1 Group 2 Group 3
—Площадь экспрессирующей тромы / The area of the expressing stroma
Рис. 2. Общая площадь стромы печени и площадь стромы, экспрессирующей ангиотензиноген, мкм2 (* – различия достоверны по сравнению с контрольной группой, р≤0,05)
Fig. 2. Total area of the liver stroma and the area of the stroma expressing angiotensinogen, μm2 (* – the differences are significant compared with the control group, p≤0.05)
При иммуногистохимическом окрашивании в целях выявления AGT в образцах исследуемых групп, в т.ч. в группе сравнения, гепато- циты демонстрировали слабую реакцию, основная же экспрессия ангиотензиногена наблюдалась в стромальном компоненте печени (рис. 3).
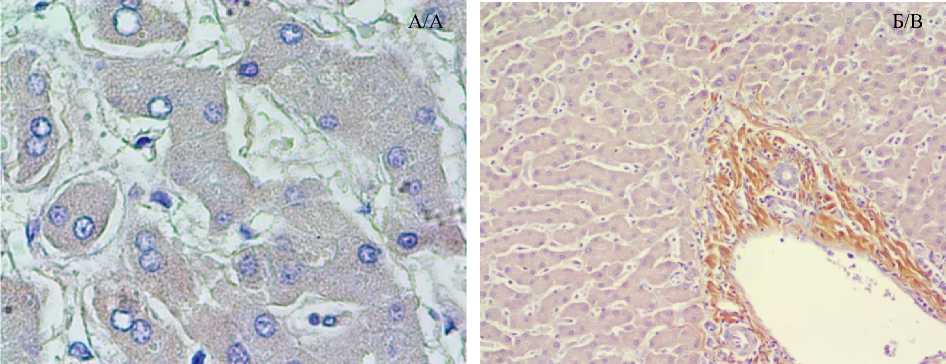
Рис. 3. ИГХ-окрашивание в целях выявления ангиотензиногена. Микрофотография печени пациентов группы сравнения: а) гепатоциты печени, экспрессирующие ангиотензиноген, ×15×40; б) ткань печени: гепатоциты демонстрируют слабый уровень экспрессии маркера, тогда как строма окрашена ярче, ×15×10
Fig. 3. IHC staining for angiotensinogen (AGT). Micrograph of the liver of patients in the comparison group: a) liver hepatocytes expressing angiotensinogen, magnification 15×40; b) liver tissue: hepatocytes demonstrate a weak level of marker expression, while the stroma is brighter, magnification 15×10.
При сравнении ИГХ-окрашенных препа- групп демонстрировала небольшие различия. ратов строма образцов разных исследуемых Наиболее ярко и четко была окрашена строма группы сравнения, тогда как по мере прогрессирования АГ степень экспрессии уменьшалась (строма образцов печени пациентов со стажем АГ более 15 лет демонстрировала наименьшую яркость) (рис. 4).
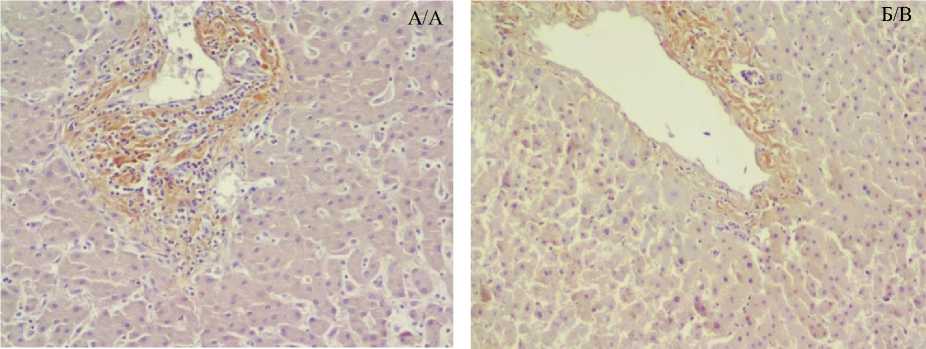
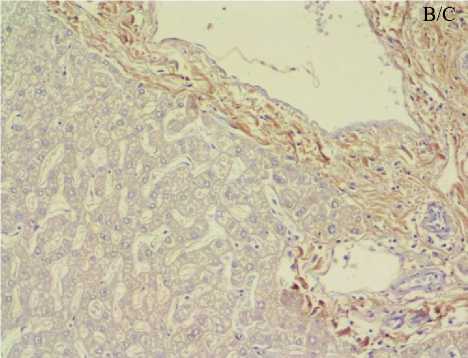
Рис. 4. Микрофотография печени пациентов исследуемых групп: а) группа сравнения (без АГ), б) группа 2 (длительность АГ 10–15 лет), в) группа 3 (длительность АГ более 15 лет). ИГХ-окрашивание в целях выявления ангиотензиногена, ×15×10
Fig. 4. Micrograph of the liver parenchyma in the study groups: a) comparison group, without hypertension, b) group 2, hypertension history 10-15 years, c) group 3, hypertension history more than 15 years. IHC staining for angiotensinogen (AGT), magnification 15x10.
Площадь стромы, экспрессирующей ан-гиотензиноген, демонстрировала сходную динамику. Наблюдались незначительное недостоверное снижение значений данного показателя в первых двух экспериментальных группах, продолжительность АГ в которых составляла до 15 лет, и резкий рост (р≤0,05) в 3-й группе с продолжительностью АГ более
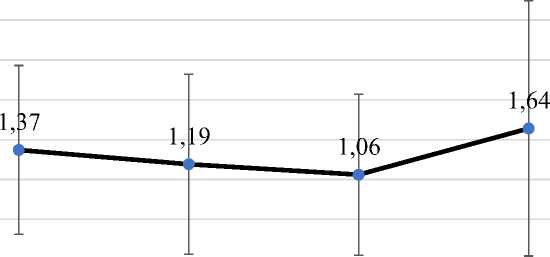
15 лет. Так, площадь стромы, экспрессирующей ангиотензиноген, в группе сравнения составляла 44952,86±3736,93 мкм2, в группе 2 – 31538,58±3073,10 мкм2 (р≤0,05), а в группе 3 – 64430,96±4462,30 мкм2 (рис. 2). Степень экспрессии AGT клетками стромы не обнаруживала статистически значимых отличий (р≥0,05), демонстрируя лишь небольшие колебания (рис. 5).
Баллы / points
3,5
2,5
1,5
0,5
Группа сравнения / Comparison group
Группа 1 /
Group 1
Группа 2 /
Group 2
_ Степень экспрессии маркера / Degree of marker expression
Группа 3 /
Group 3
Рис. 5. Степень экспрессии AGT стромой печени в исследуемых группах
Fig. 5. The degree of AGT expression by liver stroma in the studied groups
Наблюдаемое увеличение размера экспрессирующей стромы в группе 3 соответствует росту площади стромы в целом. Несмотря на то что визуально строма в третьей группе демонстрировала более слабую экспрессию, статистически это не подтверждалось. Таким образом, можно заключить, что при длительно протекающей АГ (более 15 лет) строма печени разрастается, а степень экспрессии в ней AGT остается на стабильном уровне. В таком случае суммарно количество AGT, синтезированного печенью, возрастет на поздних этапах развития АГ.
Несмотря на полигенный характер наследования артериальной гипертензии и различные варианты ее дебюта по мере прогрессирования АГ в патогенез включаются компоненты РААС [12–14], где ангиотензиноген является одним из ключевых факторов. Исследования уровня AGT в плазме крови показало его положительную связь с ростом уровня артериального давления как у мужчин, так и у женщин в разных расовых группах [15]. Принято считать, что в нормальных условиях основной вклад в синтез этого прогормона вносят паренхиматозные элементы печени, в частности гепатоциты [16]. В рамках патологических процессов активируются печеночные звездчатые клетки (клетки Ито, липо-циты), которые, будучи мезенхимальными по происхождению, трансформируются в миофибробласты и начинают синтезировать не только коллаген и аморфное вещество соединительной ткани, но и AGT [17]. Таким образом эти клетки участвуют в образовании фиброзной ткани в печени [18–20]. В проведенном исследовании было показано, что на поздних этапах течения артериальной гипертензии строма печени активно экспрессирует ангиотензиноген, тогда как паренхима в значительной мере подвергается жировой трансформации.
Заключение. Таким образом, на поздних этапах развития артериальной гипертензии (более 15 лет) структура печени подвергается ремоделированию с увеличением доли стромального компонента. Однако несмотря на жировую дегенерацию паренхимы стромальные элементы печени увеличивают экспрессию ангиотензиногена, поставляя субстрат для ренина и образования активных форм ангиотензинов, потенциирующих гипертензию.


