Синтез четвертичных аммониевых солей на основе триэтаноламина
Автор: Дурполадова Дурсундаш, Савин Геннадий Анатольевич
Журнал: Грани познания @grani-vspu
Рубрика: Химия
Статья в выпуске: 3 (74), 2021 года.
Бесплатный доступ
Реакцией кватернизации получены представители четвертичных аммониевых солей на основе легкодоступного триэтаноламина. Изучены их физические и физико-химические свойства.
Амины, третичные амины, триэтаноламин, соли аммония, бензилхлорид, кватернизация
Короткий адрес: https://sciup.org/148322076
IDR: 148322076 | УДК: 547-38
Текст научной статьи Синтез четвертичных аммониевых солей на основе триэтаноламина
Соли аммония – важные соединения, широко применяемые на практике. По своей химической природе они делятся на 2 класса: неорганические (минеральные) соли и соли органического происхождения. Примерами неорганических солей аммония являются нитрат аммония NH4NO3, сульфат аммония (NH4)2SO4, фосфат аммония (NH4)3PO4 и др. Органические соли аммония содержат углеводородные радикалы, например, CH3-CH2-COONH4, [C2H5NH3]Br.
По составу органические соли аммония можно разделить на 2 типа. Первый тип составляют аммонийные соли карбоновых кислот: ацетат аммония CH3-COONH4, оксалат аммония (NH4)2C2O4 и др. Их получают в реакциях карбоновых кислот с растворами аммиака:
CH 3 -COOH + NH 4 OH ^ H 2 O + CH 3 -COONH 4 ;
HOOC-COOH + 2 NH4OH → 2 H2O + (NH4)2C2O4.
Второй тип составляют соли замещенного аммония. Таких солей различают 4 группы. Первая группа – это органические соли первичного замещенного аммония, например, хлорид метиламмо-ния [CH3NH3]Cl. Они образуются при взаимодействии первичных аминов с кислотами:
CH3NH2 + HCl → [CH3NH3]Cl.
Вторую группу образуют соли вторичного аммония, например, бромид дипропиламмо-ния [(CH3-CH2-CH2)2NH2]Br. Их легко получить из вторичных аминов и кислот:
(CH3-CH2-CH2)2NH + HBr → [(CH3-CH2-CH2)2NH2]Br.
Органические соли третичного аммония составляют третью группу солей замещенного аммония, например, йодид триэтиламмония
[(CH3-CH2)3NH]I. Они – продукты взаимодействия третичных аминов с кислотами:
(CH3-CH2)3N + HI → [(CH3-CH2)3NH]I.
Наконец, в четвертую группу входят органические соли замещенного четвертичного аммония, например, хлорид тетраметиламмония [(CH3)4N]Cl. Их синтезируют из третичных аминов и галогенопроизводных углеводородов:
(CH3)3N + CH3-Cl → [(CH3)4N]Cl.
Безусловно, существуют и органические соли аммония смешанного типа, например, ацетат диэти-ламмония CH3-COO- +NH2(CH2-CH3)2: они содержат углеводородные радикалы и в катионной, и в анионной части соединений.
Соли аммония – это производные аммиака и аминов. Амины и соли аммония широко распространены в природе, прежде всего, в составе живых организмов. Важнейшими из них являются вещества гормональной природы – адреналин, норадреналин, дофамин:
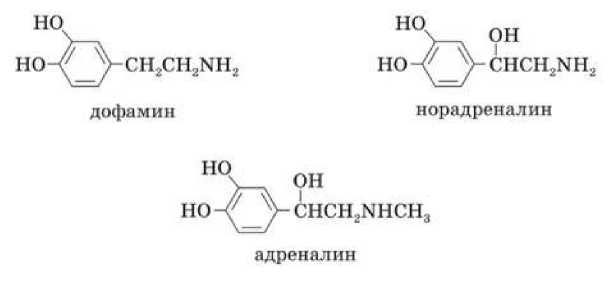
Рис. 1. Амины гормональной природы
К аминам также принадлежат и такие биологически активные катехоламины, как гистамин, серотонин, тирамин:
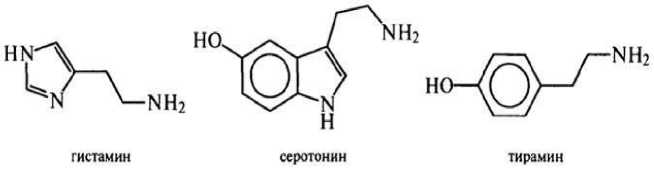
Рис. 2. Биологически активные катехоламины
Следует отметить, что и четвертичные аммониевые соли служат компонентами живых организмов. Среди них первостепенное значение имеет ацетилхолин – основной нейромедиатор в парасимпатической нервной системе:
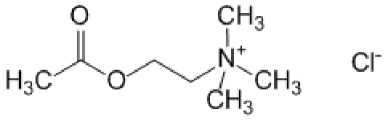
Рис. 3. Ацетилхолин
К группе четвертичных аммониевых солей природного происхождения принадлежит также производное тиамина (аневрина, витамина В1) – тиаминхлорид:
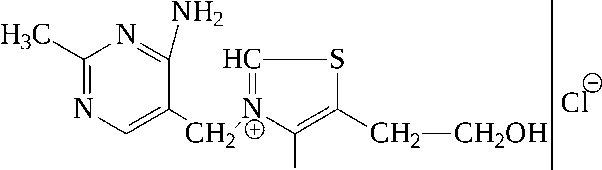
СН3
Хлорид тиамина
Рис. 4. Тиаминхлорид
Еще один пример соли четвертичного аммония природного происхождения – мускарин – алкалоид, содержащийся в грибах (сильнейший яд в составе мухомора):
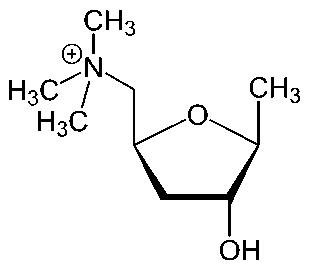
Рис. 5. Мускарин
Таким образом, амины и их соли – важнейшие природные соединения, выполняющие самые разнообразные функции. Многие из природных аминов и их солей еще недостаточно хорошо изучены. Таким образом, исследования этой группы соединений с целью выяснения их физиологической роли в живых системах в настоящее время является весьма актуальной задачей органической химии, биохимии и смежных с ними наук.
Заслуживает внимания и тот факт, что четвертичные аммониевые соли в последние десятилетия широко используются в качестве весьма эффективных катализаторов в реакциях межфазного катализа. Это процессы, протекающие на границе раздела двух фаз, например, водной фазы (водный раствор) и несмешивающейся с водой неводной фазы (например, эфирный раствор).
Простейшим представителем катализаторов межфазного катализа является дидецилдиметилам-мония хлорид:
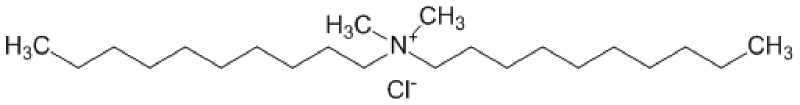
Рис. 6. Дидецилдиметиламмония хлорид
Дальнейшие исследования в этой области – актуальная задача химии и химической технологии [1].
Спектр практического использования четвертичных аммониевых солей не исчерпывается описанными примерами. Он довольно широк, о чем могут свидетельствовать также следующие факты. Бензалкония хлорид – антисептическое лекарственное средство, оказывает также противогрибковое, виру-лицидное, антипротозойное, местное контрацептивное действие:
cr
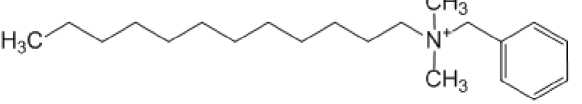
Рис. 7. Бензалкония хлорид
Цетримониум хлорид широко используется в косметике в качестве эмульгатора-кондиционера:
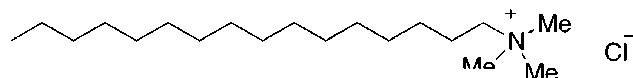
Рис. 8. Цетримониум хлорид
Нами осуществлен синтез новых представителей четвертичных аммониевых солей – потенциальных катализаторов межфазного катализа на основе триэтаноламина (НО-СН2-СН2)3N. Этот третичный амин – легкодоступное органическое соединение, представляет собой бесцветную жидкость, хорошо растворимую в воде: триэтаноламин смешивается с водой во всех отношениях, является слабым основанием.
Его систематическое название – N,N-(2-гидроксиэтил)-2-аминоэтанол; рациональное название – трис(2-гидроксиэтил)амин; аббревиатура – ТЭА.
В промышленности триэтаноламин получают алкилированием аммиака этиленоксидом:
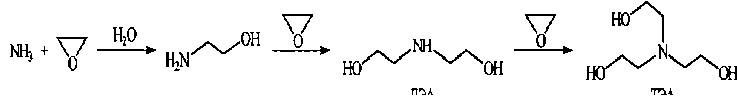
Рис. 9. Синтез триэтаноламина
Промежуточными продуктами синтеза являются моноэтаноламин (МЭА), диэтаноламин (ДЭА).
В основе синтеза лежит реакция кватернизации – алкилирования третичного амина различными реагентами. В качестве таких реагентов нами использованы этиленхлоргидрин (2-хлорэтанол) и бен-зилхлорид (фенилхлорметан).
В качестве растворителя использовали ацетонитрил.
Синтез тетраэтаноламмония хлорида.
Готовят растворы исходных веществ в ацетонитриле. Для этого 3,3 мл (3,73 г; 0,025 моль) триэтаноламина растворяют в 7 мл ацетонитрила; 1,7 мл (2,0 г; 0,025 моль) этиленхлоргидрина растворяют в 3 мл ацетонитрила.
В небольшом химическом стакане объемом 50 мл смешивают приготовленные растворы. Смесь выдерживают 1 час при комнатной температуре, затем охлаждают льдом. Выпавший осадок хлорида тетраэтаноламмония отфильтровывают, сушат на воздухе. Соль представляет собой кристаллы белого цвета, хорошо растворимые в воде и довольно устойчивые при хранении.
Выход 4,7 г (82,5%); т. пл. 163–1650С.
Синтез бензилтриэтаноламмония хлорида.
Готовят растворы исходных веществ в ацетонитриле. Для этого 3,3 мл (3,73 г; 0,025 моль) триэтаноламина растворяют в 7 мл ацетонитрила; 2,9 мл (3,2 г; 0,025 моль) бензилхлорида растворяют в 5 мл ацетонитрила.
В небольшом химическом стакане объемом 50 мл смешивают приготовленные растворы. Смесь выдерживают 1 час при комнатной температуре, затем охлаждают льдом. Выпавший осадок хлорида бензилтриэтаноламмония отфильтровывают, сушат на воздухе. Вещество представляет собой белые кристаллы, хорошо растворимые в воде. Соль довольно устойчива при хранении.
Выход 5,9 г (85%); т. пл. 182–1840С.
Описанный химический эксперимент прост в исполнении и может быть рекомендован к практическому применению во внеклассной работе с учащимися [2], а также на лабораторных занятиях по химическому синтезу со студентами вузов.
Список литературы Синтез четвертичных аммониевых солей на основе триэтаноламина
- Грандберг И.И., Нам Н.Л. Органическая химия. СПб.: Лань, 2019.
- Ермакова Ю.А., Ахметов М.А. Химический эксперимент при изучении нового материала // Химия в школе. 2018. № 5. С. 45-49.


